不同干燥方法对星油藤分离蛋白结构和功能性质的影响
2017-08-07田少君夏克东刘斯博李林芽
田少君 夏克东 刘斯博 李林芽
(河南工业大学粮油食品学院,郑州 450001)
不同干燥方法对星油藤分离蛋白结构和功能性质的影响
田少君 夏克东 刘斯博 李林芽
(河南工业大学粮油食品学院,郑州 450001)
通过喷雾干燥和真空冷冻干燥的方法得到星油藤分离蛋白。对它们的结构和功能性质进行分析比较,结果表明,2种干燥方法对蛋白分子量分布没有影响,但二级结构、表面疏水性、二硫键含量均有改变。与原蛋白相比喷雾干燥蛋白β-转角含量增大30.0%,无序结构基本消失;二硫键含量从6.79 μmol/g增加到12.18 μmol/g。真空冷冻干燥蛋白变性程度小,溶解性质和起泡能力也好于喷雾干燥的样品。
喷雾干燥 真空冷冻干燥 疏水性 SDS-PAGE
星油藤又称为南美油藤、印加果、印奇果,大戟科,木质藤本作物,是一种新型特种油料作物,星油藤果油不饱和脂肪酸含量很高,是一种营养保健型食用油[1-2]。星油藤榨油后的饼中蛋白含量很高,但是目前国内外对星油藤蛋白的研究还较少,了解的不深入,导致无法对其进行有效的利用,造成了星油藤蛋白资源的浪费。
蛋白质功能性质对其在食品行业的应用有着重要的影响,然而蛋白的结构又决定着功能性质。蛋白质结构与功能特性之间的关系主要体现在其亚基组成、亲/疏水性、分子积聚状态、亚基缔合/解离形式、热变性和热聚集、功能基团修饰或分解、蛋白质/多糖相互作用、蛋白质/脂肪相互作用等方面。溶解性、起泡性与食品蛋白分子质量分布、亚基大小/组成、二硫键多寡、亲水/疏水性有密切联系[3-5]。本试验主要采用了傅里叶红外光谱法、SDS-PAGE、分光光度法、ANS荧光探针等方法测定分析2种干燥方法对星油藤蛋白质结构的影响并浅析结构与功能性质的关系。
1 材料与方法
1.1 材料与仪器
星油藤饼:印奇生物资源开发有限公司;凝胶制备试剂盒:武汉博士德生物工程有限公司;ANS(色谱纯):Sigma-Aldrich 公司;低分子量标准蛋白(分装进口):上海纪宁实业有限公司;DTNB(分析纯):洛阳试剂厂。
LGJ-10C 真空冷冻干燥机:北京四环科学仪器厂有限公司;小型台式喷雾干燥机:瑞士Buchi实验仪器公司;计算机三恒电泳仪DYY-6D:北京六一仪器厂;Biorad GelDoc XR伯乐凝胶成像系统:伯乐生命医学产品(上海)有限公司;傅里叶红外(FT-IR)光谱仪:日本岛津公司。
1.2 试验方法
1.2.1 原料预处理
将星油藤饼粉碎,过100目筛,45 ℃下用石油醚脱脂5 h以上,置通风橱中12 h进行溶剂挥发,得星油藤脱脂粉,冰箱4 ℃保存备用。
1.2.2 星油藤分离蛋白的制备[5]
每次取50.0 g脱脂粉与双蒸水按料液比1∶20混合,1 mol/L NaOH调pH至11.0,45 ℃磁力搅拌浸提30 min,然后在4 ℃下4 000 r/min离心20 min。沉淀物再重复提取2次,合并3次上清液,用1 mol/L HCl调pH至等电点沉淀蛋白质,静置沉淀后,双蒸水洗涤沉淀3次,1 mol/L NaOH回调pH至7.0,搅拌使其复溶后干燥。喷雾干燥:进风温度170 ℃,出风温度55~75 ℃,进样浓度20%~22%。真空冷冻干燥:温度-52 ℃,真空度 0.1 MPa,时间36 h。
1.2.3 傅里叶红外光谱分析
采用傅里叶红外光谱仪在20 ℃下扫描,测定波段为4 000~400 cm-1,扫描次数为32次。选取红外光谱的酰胺Ⅰ带分析经过不同干燥方式处理后的星油藤蛋白二级结构组成;用Peak Fit v4.12软件分析,先对红外光谱的酰胺Ⅰ带进行去卷积处理,再进行二阶导数拟合。酰胺Ⅰ带各峰位的指认依据:β-折叠结构,1 637、1 615、1 695 cm-1;β-折叠或β-转角结构,1 684 cm-1;β-转角结构,1 670 cm-1;α-螺旋结构,1 640 cm-1;无规卷曲结构,1 649 cm-1[6]。
1.2.4 表面疏水性的测定
参照文献[7]的方法并改进:配制0.1 mol/L的磷酸盐缓冲液(pH 7.0)溶解蛋白样品;室温下磁力搅拌2 h,低温离心15 min(10 000 r/min),Lowry法测定上清液中蛋白含量。用磷酸盐缓冲液稀释上述溶液至蛋白浓度在0.5~0.005 mg/mL范围内,加20 μLANS(8 mmol/L)到4 mL蛋白溶液中,暗处反应15 min,测荧光强度(激发波长365 nm,发射波长484 nm,狭缝5 nm)。以蛋白浓度为横坐标,荧光强度为纵坐标所得线性回归方程的斜率即为表面疏水性。
1.2.5 二硫键、巯基含量测定
参照文献[8]的方法配制缓冲液:A:Tris-Gly(pH 8.0);B:Tris-Gly-Urea溶液;C:DTNB(4 mg/mL),各取20 mL 的A、B缓冲液分别溶解0.1 g的蛋白粉;振荡离心取上清液0.25、0.5、0.75、1.0、1.25、1.5 mL;分别加0.1 mL C振荡30 min,稀释至3 mL于412 nm下测吸光度值。
巯基含量/μmol/g=73.53×A412×D/C
游离巯基含量=B溶液测的巯基含量-A溶液测的巯基含量
二硫键含量/μmol/g=A溶液测的巯基含量/2
式中:73.53为摩尔消光系数;A412为除去试剂空白后样品的吸光光度值;D为稀释倍数;C为蛋白含量。
1.2.6 SDS-PAGE
样品预处理:提取星油藤分离蛋白(在0.05 mol/L pH 7.0的磷酸钠盐缓冲环境下用0.01 mol /L 的硫酸铵提取36 h),经透析得到蛋白质提取液[3-4],4 ℃存放备用,电泳上样之前,蛋白质样品以6 500 r/min高速离心15 min,取上清液加样。
分离胶浓度12%(m/V),浓缩胶5%(m/V);上样量为15 μL,恒流电泳,浓缩胶电流28 mA,分离胶电流45 mA,溴酚蓝前沿至硅橡胶框底边1.5 cm关闭电源。后用考马斯亮蓝R-250染色120 min,脱色液(甲醇/冰乙酸,体积比为3∶1)脱色至透明[3-4],脱色后使用凝胶成像系统分析特征条带。
1.3 功能性质
1.3.1 溶解度测定
配制1% (m/V)蛋白溶液,0.1 mol/L的HCl或0.1 mol/L的NaOH调节pH 2、3、4、5、6、7、8、9、10、11,于室温下搅拌20 min 后以4 000 r/min的速度离心分离30 min,考马斯亮蓝法测定上清液中可溶性蛋白质的含量,以上清液中的可溶性蛋白含量占样品中总蛋白含量的百分比表示蛋白质的溶解度。
1.3.2 起泡性及泡沫稳定性测定
配制100 mL一定浓度样品溶液,搅拌20 min后调节pH至7.0,匀浆机10 000 r/min搅打1 min后,迅速转入250 mL量筒,同时用少量蒸馏水冲洗匀浆机内壁,测泡沫体积。
分别测定t(t=0、15、30、45、60) min后泡沫剩余的体积,剩余泡沫体积越小泡沫稳定性越差,t=0时为发泡能力。
2 结果与分析
2.1 傅里叶红外光谱分析
图1为星油藤原蛋白、喷雾干燥方法和真空冷冻干燥方法得到的蛋白样品的傅里叶红外光谱原始图。表1可以看出,与原蛋白相比,2种干燥方法对星油藤分离蛋白二级结构含量均有影响。可能因为真空冷冻干燥在低温条件下,水结冰从溶液中分离,各溶质组分都得到了浓缩,体系中的盐饱和沉淀,溶液 pH改变, 使蛋白质分子发生变性, 某些维持β-折叠或无规则卷曲的多肽链发生了180度的反转, 形成了β-转角结构[9-11]。喷雾干燥增加β-转角含量至48.3%,无序结构几乎消失,原因可能是喷雾干燥温度过高导致氢键断裂,折叠结构伸展转变为β-转角,蛋白质分子的空间构象发生了改变。
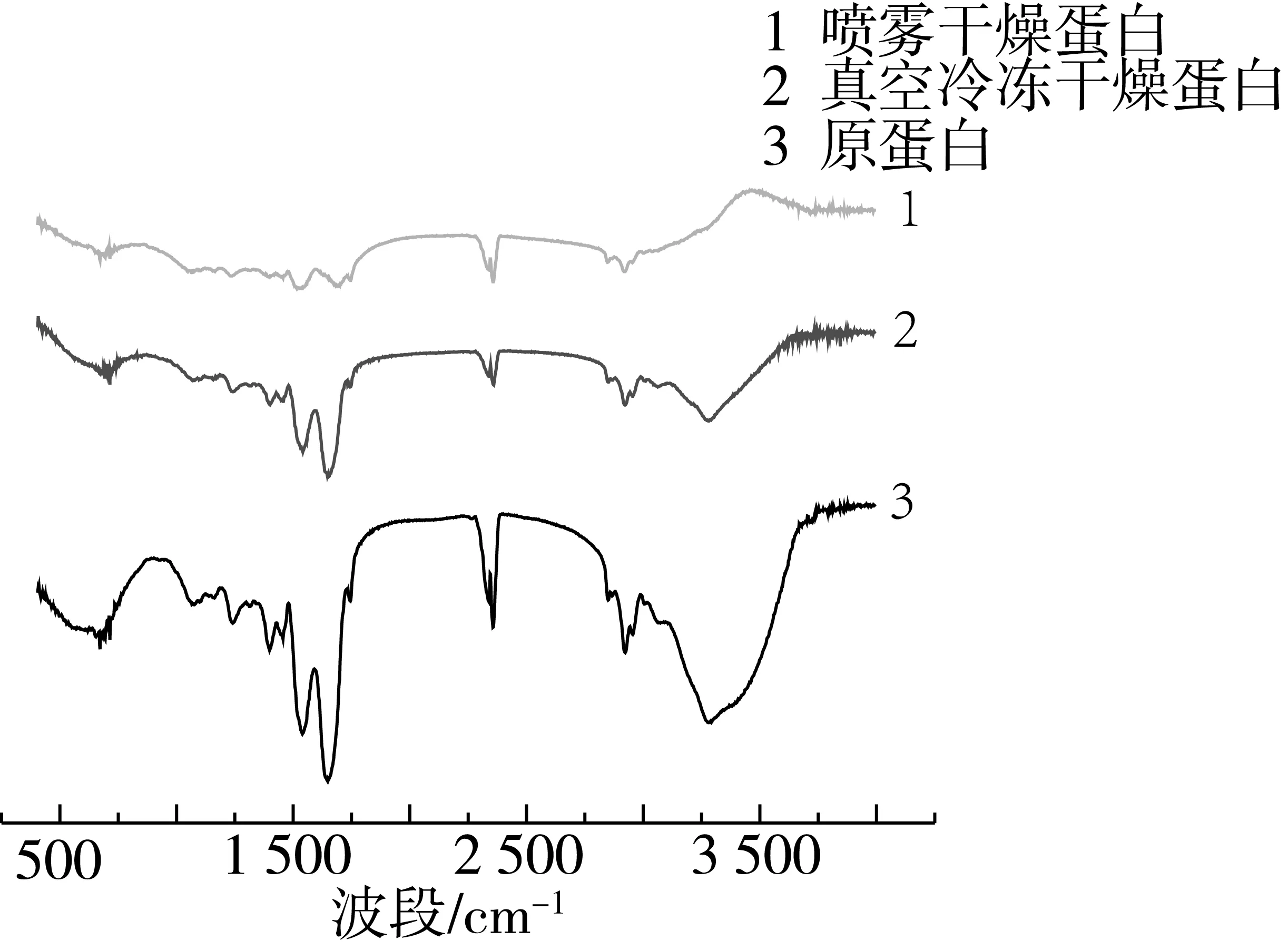
图1 不同干燥方式得到的星油藤蛋白红外光谱图
表1 酰胺Ⅰ带拟合不同干燥方式得到的星油藤蛋白二级结构组成比例/%

蛋白类型α-螺旋β-折叠β-转角无序结构原蛋白19.848.713.818.7喷雾干燥蛋白11.836.748.31.89冷冻干燥蛋白15.434.937.812.9
2.2 巯基、二硫键含量及表面疏水性分析
蛋白质是一种良好的天然表面活性剂,蛋白质中二硫键含量对结构有着重要的影响;然而蛋白质的结构与其表面活性关系密切。蛋白质二硫键及其巯基含量的测定对结构与功能性质的分析有着重要的意义。表面疏水性对蛋白质与蛋白质、蛋白质与其他分子间的相互作用有着很大的影响[10-13]。疏水性是指非极性物质与极性环境(如水溶液)间的排斥力,热力学上,代表非极性物质溶解在水中所需的能量高低,或者该物质在水相中自聚集的趋势大小。在水中加入蛋白质,单个蛋白质分子表面疏水基团周围的水分子被排斥,这一部分水分子会进行重排,以减少氢键的损失[12-14]。
从图2可以看出,2种干燥方式对星油藤分离蛋白的游离巯基、二硫键含量及表面疏水性均有不同程度的影响。干燥后的样品与原蛋白相比游离巯基含量有所降低;二硫键含量和表面疏水性均有升高;喷雾干燥的产品这种趋势更明显,二硫键含量从6.79 μmol/g增至12.18 μmol/g。干燥过程中的冷冻或高温可能使蛋白去折叠造成分子伸展、氢键被破坏、空间构象变化,进而促进巯基和二硫键的暴露引起巯基氧化和二硫键交换反应的发生[8,10]。同时紧密的三级结构的改变使蛋白质分子内部被隐藏的疏水基团更多的暴露出来。喷雾干燥蛋白的表面疏水性大于真空冷冻干燥,是因为喷雾干燥的瞬时高温,导致蛋白质变性程度大[11-12],而真空冷冻干燥由于条件温和对蛋白结构破坏较小,变性程度较小。

图2 不同干燥方式得到星油藤蛋白的游离巯基、二硫键含量及表面疏水性
2.3 SDS-PAGE分析
Shridhar[4]等通过SDS-PAGE方法得到星油藤种仁蛋白的相对分子量分布在6~70 ku之间,其中主要集中在20~40 ku间。由图3可看出干燥方法对蛋白质分子量分布没有产生影响。通过凝胶成像系统对图3的特征条带进行分析得出星油藤分离蛋白6种亚基分离组分的相对分子质量分别是21.18、23.97、35.71、37.89、40.82、75.72 ku;所占比例依次是13.33%、10.46%、24.53%、14.77%、14.22%、22.72%;与Shridhar等[4]的研究结果基本一致。

注:泳道S-低分子量标准蛋白;泳道A-喷雾干燥制备的星油藤分离蛋白;泳道B-真空冷冻干燥制备的星油藤蛋白;泳道C-原蛋白。图3 星油藤蛋白的凝胶电泳图
2.4 功能性质
2.4.1 溶解度
蛋白质-蛋白质和蛋白质-水相互作用间平衡的热力学表现形式为蛋白质的溶解度,疏水作用和离子相互作用是影响蛋白质溶解度的两个主要相互作用。溶解度是蛋白质最为基本的功能性质,它对蛋白质的乳化性、起泡性质、吸水性以及胶凝作用等性质都有影响。
图4中2种方法干燥的蛋白质在pH 2.0到11.0条件下溶解度随pH的增大呈现先下降后升高的趋势,在等电点pH 4.0时溶解度最低。因为在等电点附近缺乏静电推斥作用,疏水作用导致蛋白质聚集沉淀[8,10]。喷雾干燥的蛋白溶解度低于真空冷冻干燥,也可能是喷雾过程中瞬时高温导致二级结构的变化进而使卷曲的三级结构展开,隐藏在分子内部的疏水基团暴露、表面疏水性提高、蛋白质-蛋白质和蛋白质-溶剂相互作用的平衡向前者移动。

图4 pH对不同干燥方式得到星油藤分离蛋白溶解度的影响
2.4.2 起泡性和泡沫稳定性
起泡性指蛋白质搅打生成泡沫的能力,泡沫的稳定性是指蛋白质处在重力和机械力下泡沫稳定的能力。起泡性在面包、蛋糕等食品加工过程中起重要作用。图5中显示相同条件下真空冷冻干燥蛋白的起泡性和泡沫稳定性均大于喷雾干燥。主要因为喷雾干燥蛋白样品中折叠结构伸展,蛋白质分子柔性降低,分子在界面上快速展开、重排和暴露疏水基团的能力受到影响;巯基和二硫键交换反应发生了广泛的聚合作用,所形成的相对分子质量很高的聚合物不能在起泡过程中吸附在气水界面,气水界面膜上的蛋白质数量减少,不能够支持起泡导致泡沫破裂,泡沫稳定性下降[3]。二硫键含量的增加对于增强蛋白质分子的柔性、提高起泡能力、增强气泡稳定性有一定的负面影响[15]。真空冷冻干燥样品蛋白的二硫键含量少于喷雾干燥,因此得到的蛋白样品起泡性和泡沫稳定性较好。
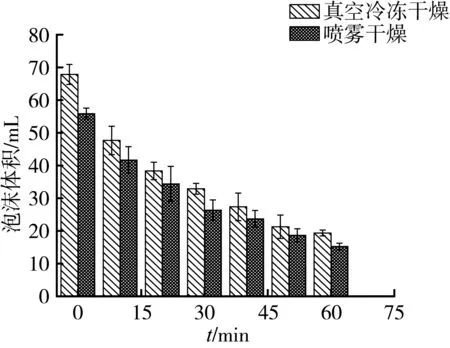
图5 不同干燥样品泡沫稳定性的比较
3 结论
3.1 干燥方法并没有改变蛋白质的分子质量分布;喷雾干燥蛋白β-转角含量比原蛋白高出30%,二硫键含量为12.18 μmol/g,大于原蛋白的二硫键含量。
3.2 喷雾干燥的样品变性程度较大;真空冷冻干燥条件温和、变性程度小,所得样品表现出的溶解性质和泡沫稳定性均比喷雾干燥的好。
[1]Semino C A, Rojas F C, Zapata E S. Protocolo del cultivo de Sacha Inchi (PlukenetiavolubilisL.) [M]. Peru: Lima Merced, 2008: 1-87
[2]Cai Z Q. Shade delayed flowering and decreased photosyn-thesis,growth and yield of Sacha Inchi (Plukenetiavolubi-lis) plants[J]. Industrial Crops and Products, 2011, 34: 1235-1237
[3]王金水. 酶解-膜超滤改性小麦面筋蛋白功能特性研究[D]. 广州:华南理工大学, 2007 Wang J S. Functional Properties of Modified Wheat Gluten by Enzymatic Hydrolysis-Membrane Ultrafiltration[D].Guangzhou: South China University of Technology,2007
[4]Shridhar K, Sathe H H, Kshirsagar G M,et al. Solubilization, fractionation, and electrophoretic characterizationof Inca Peanut (PlukenetiavolubilisL.) proteins[J]. Plant Foods for Human Nutrition, 2012, 67:247-255
[5]赵旻, 张萍, 李秀芬, 等. 星油藤种仁碱提蛋白和浓缩蛋白功能性质的比较研究[J]. 食品工业科技, 2011, 35(11):103-106 Zhao M, Zhang P, Li X F, et al.Comparisons of functional properties of protein isolate and protein concentrate in Plukenetia volubilis L. seeds[J]. Science and Technology of Food Industry, 2011, 35(11):103-106
[6]Zhao X Y, Chen F S, Xue W T, et al. FTIR spectra studies on the secondary structures of 7S and 11S globulins from soybean proteins using AOT reverse micellar extraction[J]. Food Hydrocolloids, 2008(1): 568-575
[7]Wagner J R, Sorgentini D A. Relation between solubility and surface hydrophobicity as an indicator of modifications during preparation processes of commercial and laboratory-prepares soy protein isolates[J]. Journal of Agricultural and Food Chemistry, 2000, 48: 3159-3165
[8]袁德宝. 大豆蛋白热聚集行为及其机理研究[D]. 广州:华南理工大学, 2010 Yuan D B. Heat-induced Aggregation of Soy Proteins and Its Mechaism[D]. Guangzhou: South China University of Technology, 2010
[9]Cheison S C, Wang Z, Xu S Y. Multivariate strategy in screening of enzymes to be used for whey protein hydrolysis in an enzymatic membranereactor[J]. International Dairy Journal, 2007, 5(6):393-402
[10]阮奇君. 大豆蛋白热诱导二硫键连接物的形成[D]. 无锡:江南大学, 2015 Ruan Q J. Subunit Level Study on Heat Induced Disulfide Linked Products and Sulfhydryl Change of Soy Protein[D].Wuxi: Jiangnan University, 2015
[11]Morel M H, Redl A, Guilbert S. Mechanism of heat and shear mediated aggregation of wheat gluten protein upon mixing [J]. Biomacromolecules, 2002, 3 (3): 488-497
[12]Lagrain B,Brijs K,Delcour J A. Reaction kinetics of gliadin-glutenin cross-linking in model systems and in bread making[J]. Journal of Agricultural and Food Chemistry, 2008, 56 (22): 10660-10666
[13]Kudryashova E V, Meinders m B J, Visseraj W G, et al. Structure and dynamics of egg white ovalbumin adsorbed at the air/water interface[J]. European Biophysics Journal, 2003, 32: 553-562
[14]Potani S, Doxastakis G, Kiosseoglou V. Functionality of lupin seed protein isolate in relation to its interfacial behavior[J]. Food Hydrocolloids, 2002, 16: 241-247
[15]Quinn G, Monahan F J, O′riordan E D, et al. Role of covalent and noncovalent interactions in the formation of films from unheated whey protein solutions following pH adjustment[J]. Journal of Food Science, 2003, 68(7):2284-2288.
Effect of Different Desiccant Methods on the Structure and Functional Properties of Sacha Inchi Proteins
Tian Shaojun Xia Kedong Liu Sibo Li Linya
(College of Food Science and Technology, Henan University of Technology, Zhengzhou 450001)
Sacha Inchi (PlukenetiavolubilisL.) proteins were prepared and dried through vacuum freeze-drying and spray drying, separately. Their structures and functional properties were analyzed and compared. The experimental results showed two methods had no influence on protein molecular weight distribution, but the secondary structure and hydrophobicity as well as disulfide bond content were changed. The content of β-corner wes increased by 30.0% and the disordered structure wes nearly disappeared through spray drying, while the disulfide bond wes increased from 6.79 μmol/g to 12.18 μmol/g compared with original protein. The proteins obtained from vacuum freeze-drying presented less degeneration degree, and better solubility and foaming ability than those via spray drying.
spray drying, vacuum freeze-drying, hydrophobicity, SDS-PAGE.
河南省高校科技创新团队支持计划(13IRTSTHN028)
2015-07-03
田少君,女,1964年出生,教授,蛋白质科学与工程
TS 210.1
A
1003-0174(2017)02-0057-05
