牛磺酸上调基因1对肿瘤发生发展的调控作用*
2017-08-07姜兴明王志东李景林郑汪洋李正龙李鑫恒崔云甫
姜兴明, 王志东, 李景林, 郑汪洋, 李正龙, 李鑫恒, 崔云甫
(哈尔滨医科大学附属第二医院胆胰外科,黑龙江 哈尔滨 150086)
·综 述·
牛磺酸上调基因1对肿瘤发生发展的调控作用*
姜兴明, 王志东, 李景林, 郑汪洋, 李正龙, 李鑫恒, 崔云甫△
(哈尔滨医科大学附属第二医院胆胰外科,黑龙江 哈尔滨 150086)
基因的失调控(异常表达)是肿瘤发生发展的重要原因(诱因)业已被学术界所公认,而在这一过程中非编码RNA(non-coding RNA,ncRNA)起到了极为重要的调控作用[1-2]。小RNA(small RNA;包括微小RNA,microRNA,miRNA,miR)和长链非编码RNA(long non-coding RNA,lncRNA)均属于ncRNA[3-4]。大量研究已证实miRNA对基因表达的调控与诸多生理病理过程有着密切的联系,并且miRNA的异常表达参与了肿瘤的发生发展[5-7]。而对于另一重要分支lncRNA的研究目前尚处于萌芽阶段。
既往lncRNA被视为基因转录过程中的“噪音”;而随着研究的不断深入,科学家发现其可在表观遗传、转录和转录后多个水平调控基因的表达,广泛参与机体的各种生理病理过程[8-12]。研究发现lncRNA牛磺酸上调基因1(taurine up-regulated gene 1,TUG1)对多种人体恶性肿瘤的发生发展起到了重要的调控作用,本文将就lncRNA TUG1在肿瘤中的研究进展进行综述。
1 TUG1的发现
早在2005年,Young等[13]对胚胎发育期小鼠的视网膜细胞予以牛磺酸处理,在检测表达发生改变的基因时发现了lncRNA TUG1,并为其命名。TUG1基因定位于人体22号染色体长臂12区2带(22q12.2),全长7 598 nt,具有3个转录本。研究证实TUG1是视网膜和神经系统正常发育的必需基因,调控视网膜细胞的分化过程,敲除TUG1后将导致小鼠视网膜无法正常发育。后续研究进一步发现TUG1参与调控了动脉硬化过程中内皮细胞的凋亡、慢性肾脏疾病中足细胞的线粒体功能、胰腺B细胞的胰岛素分泌与凋亡过程、低温诱导下肝脏损伤的炎症反应等病理生理过程[14-17]。此外,TUG1在诸多人体恶性肿瘤中呈现异常表达并参与调控了肿瘤的增殖、侵袭转移、抗凋亡、上皮间质化等恶性生物学行为。
2 消化系统肿瘤
2.1 食管癌 Jiang等[18]对62例食管鳞状细胞癌(esophageal squamous cell carcinoma,ESCC)的RT-qPCR定量检测显示,肿瘤组织内TUG1的表达水平明显高于对应癌旁正常组织,并且高表达的TUG1与患者家族史及上段食管癌密切相关。利用siRNA外源性沉默TUG1后能够抑制ESCC肿瘤细胞的增殖与侵袭转移。在此研究基础上,Xu等[19]发现TUG1的高表达与ESCC的化疗耐药呈正相关,TUG1低表达组患者对化疗药物具有更高的敏感性,进一步分析显示高表达TUG1组患者整体生存时间更短并且TUG1可以作为ESCC患者生存时间的独立判断因素。
2.2 胃癌 Ji等[20]研究指出TUG1在胃癌中呈上调表达并与肿瘤的淋巴侵袭和晚期TNM分期显著相关;胃癌中高表达的TUG1通过调控miR-144来促进c-Met的表达,进而增强肿瘤细胞的侵袭转移能力。Zhang等[21]的研究也证实胃癌中TUG1的高表达与癌肿浸润深度及晚期TNM分期呈正相关并可作为评估整体生存的独立判断因素。此外,细胞学及裸鼠成瘤实验显示沉默TUG1能够抑制肿瘤增殖并阻滞细胞周期,进一步的研究发现TUG1通过招募多梳抑制复合体2(Polycomb repressive complex 2,PRC2)来抑制p57基因的转录,从而实现对细胞周期的调控作用。
2.3 肝癌 Huang等[22]对77例肝细胞肝癌的肿瘤组织和对应癌旁正常组织的RT-qPCR定量检测结果显示TUG1呈上调表达并且其表达水平与肿瘤体积和Barcelona Clinic Liver Cancer (BCLC)临床分期显著相关。沉默TUG1后能够抑制肿瘤细胞增殖和克隆形成并诱导凋亡发生,同时低表达TUG1的裸鼠移植瘤的生长速度更慢。进一步研究发现TUG1启动子内存在5个转录因子SP1的结合位点,SP1能够与TUG1启动子结合促进其基因转录;上调表达的TUG1通过招募PRC2至下游基因Kruppel样因子2(Kruppel-like factor 2,KLF2)的启动子区来抑制其转录进而负向调控KLF2的表达,而低表达的KLF2能够促进肿瘤细胞增殖并抑制凋亡发生。此外,组织定量结果也显示TUG1与KLF2两者的表达水平间呈明显负相关。Dong等[23]的研究发现:在肝母细胞癌肿瘤组织和转移性肿瘤细胞系中TUG1呈现上调表达;沉默TUG1后能够抑制由HuH-6细胞构建的体内裸鼠移植瘤的生长与肿瘤血管生成;细胞学实验显示转染siRNA-TUG1后肿瘤细胞的增殖与侵袭转移能力明显下降。此外,该研究还指出:肝母细胞癌中由于TUG1可以通过内源性海绵(sponge)的作用方式结合miR-34a-5p,被结合的miR-34a-5p失去对其下游靶基因血管内皮生长因子A (vascular endothelial growth factor A,VEGFA)的抑制作用,从而导致了VEGFA表达的升高,而高表达的VEGFA能够促进肿瘤细胞的增殖并激活更多的内皮细胞形成新生血管。
2.4 结肠癌 组织定量结果显示结肠癌中TUG1为高表达状态,转染siRNA-p63后能够上调肿瘤细胞内TUG1的表达,而结肠癌中p63呈异常低表达,该结果提示TUG1的表达可能受到p63的调控;沉默TUG1能够明显抑制结肠癌肿瘤细胞的增殖与侵袭转移能力并促进细胞发生凋亡[24]。Sun等[25]的研究结果也证实TUG1在结肠癌中呈高表达且其表达水平与组织分化程度、癌肿浸润深度、淋巴侵袭及结肠癌肝转移呈正相关。利用组蛋白去乙酰化抑制剂曲古抑菌素A (trichostatin A,TSA)处理后检测发现TUG1的表达显著上升而肿瘤细胞内组蛋白去乙酰化酶1(histone deacetylase 1, HDAC1)的表达下调,并且转染siRNA-HDAC1后能够上调TUG1的表达,该结果提示结肠癌中TUG1的高表达可能源于HDAC1的异常沉默。进一步的研究结果显示过表达TUG1可以促进结肠癌肿瘤细胞的增殖与侵袭转移并促上皮-间充质转化(epithelial-mesenchymal transition,EMT)发生,利用SW480-pcDNA-TUG1细胞构建的裸鼠体内转移瘤模型显示过表达TUG1能够促进结肠癌的肝转移发生。Wang等[26]的研究除证实沉默TUG1后结肠癌肿瘤细胞的增殖与侵袭转移能力下降外,还发现肿瘤中高表达的TUG1通过上调vimentin、N-cadherin和下调E-cadherin的表达来促进肿瘤细胞发生侵袭转移与EMT。
3 泌尿系统肿瘤
3.1 膀胱癌 Han等[27]对44例膀胱上皮细胞癌患者组织的RT-qPCR定量检测显示肿瘤组织中TUG1的表达水平是癌旁正常组织的1.74倍,高分级和伴转移的肿瘤组织内TUG1的表达分别是低分级和无转移肿瘤组织的1.36倍和1.40倍。对肿瘤细胞转染siRNA-TUG1后,细胞增殖受到抑制且发生凋亡的细胞比占上升。Iliev等[28]研究发现:对比正常组织,肌层浸润性膀胱癌(muscle-invasive bladder can-cer,MIBC)及转移性膀胱癌肿瘤组织内TUG1的表达显著上调,MIBC患者中TUG1高表达组的整体生存时间更短。外源性沉默T-24细胞内TUG1的表达后,肿瘤细胞的增殖与侵袭转移能力下降,而对细胞周期及细胞凋亡无明显影响。Tan等[29]在上述研究的基础上通过体外体内实验证实:异常高表达的TUG1借助TUG1/miR-145/ZEB1调控轴通过促进肿瘤细胞发生EMT来增强膀胱癌的侵袭转移能力和抑制其对放疗的敏感性,并指出膀胱癌中TUG1与miR-145间存在双重负反馈调控环路。
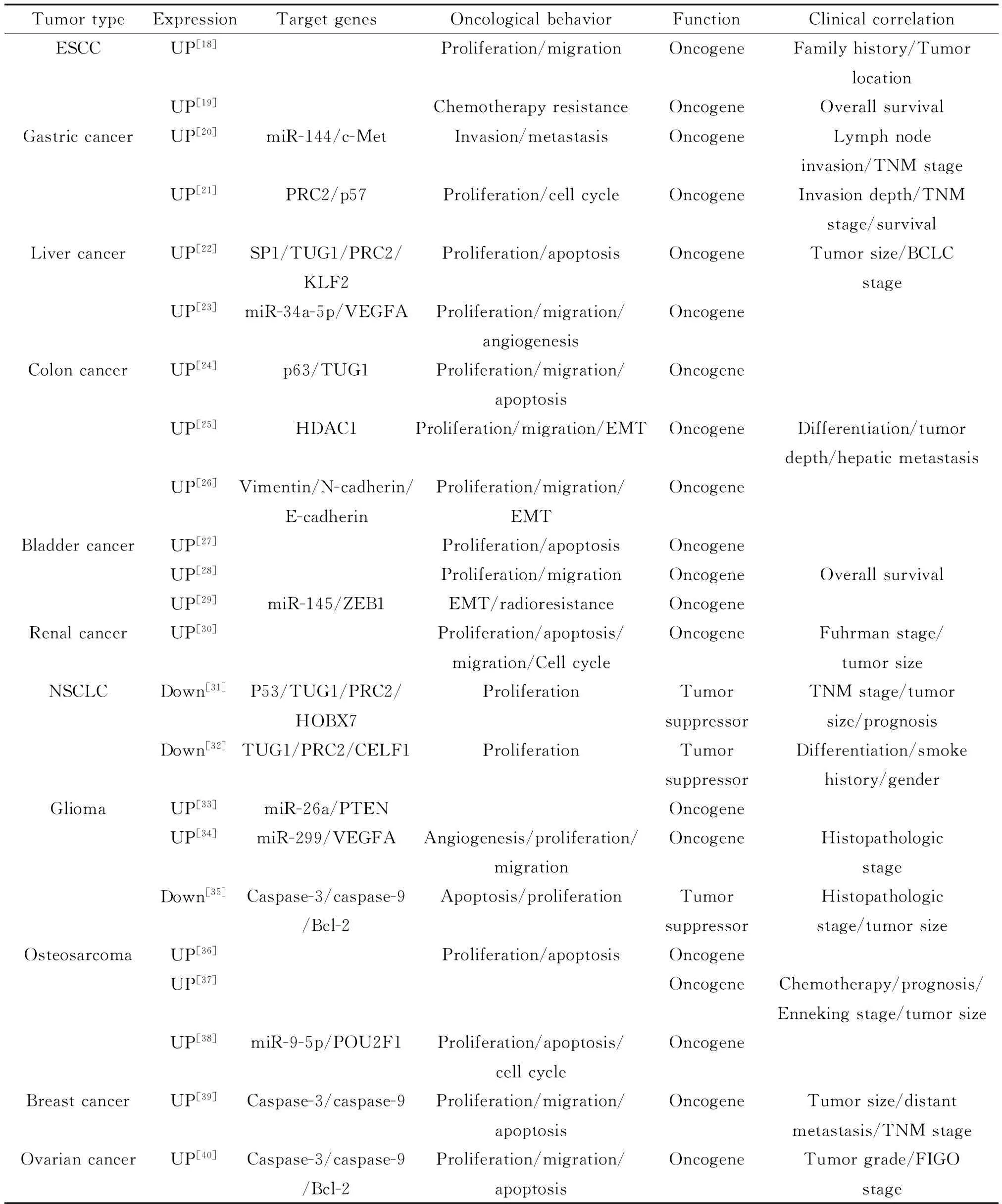
表1 肿瘤中TUG1的表达情况及其调控作用
3.2 肾细胞癌 Zhang等[30]研究发现在肾细胞癌组织及肿瘤细胞系内TUG1呈现异常高表达,并且TUG1的高表达与Fuhrman分期及更大的癌肿体积呈正相关。外源性沉默TUG1能够抑制肿瘤细胞的增殖、阻滞细胞周期并诱导凋亡发生,同时细胞的侵袭转移能力也出现下降。
4 非小细胞肺癌
Zhang等[31]研究发现非小细胞肺癌中TUG1的低表达与TNM分期、瘤体大小、预后不良呈负相关,并且单变量与多变量分析显示TUG1的表达水平可以作为患者生存时间的独立判断因素。通过luci-ferase与ChIP实验证实TUG1的表达受p53的直接转录调控,沉默TUG1能够促进肿瘤细胞增殖并上调同源异形盒B7(homeobox B7,HOXB7)的表达。进一步研究发现TUG1通过与PRC2结合促进HOXB7启动子组蛋白H3K27的甲基化修饰进而下调HOXB7的表达,而低表达的TUG1失去了对HOXB7表达的负向调控进而促进了肿瘤细胞的增殖。Lin等[32]对89例非小细胞肺癌患者组织的定量检测结果显示TUG1呈异常低表达,并且其表达水平与患者性别、吸烟史、组织分化程度密切相关。此外,该研究团队利用生物信息学分析筛选出TUG1所调控的下游基因CUGBP and Elav-like family member 1 (CELF1),并通过细胞学实验证实外源性沉默TUG1后能够促进肿瘤细胞的增殖并上调CELF1的表达;RNA免疫沉淀实验结果显示TUG1可以结合PRC2,而PRC2在CELF1转录起始位点上游992 bp处与CELF1启动子结合来抑制其基因转录。
5 神经胶质瘤
Li等[33]对26例肿瘤组织的定量检测结果显示脑胶质瘤中TUG1和miR-26a分别呈现上调与下调表达,并且两者的表达水平呈负相关。TUG1可以通过海绵吸附负向调控胶质瘤细胞内miR-26a的表达来阻断miR-26a与其下游靶基因PTEN 3’-UTR的结合,从而导致肿瘤内磷酸酶和张力蛋白同源物(phosphatase and tensin homolog,PTEN)的上调表达。此外,胶质瘤组织内上调表达的PTEN与TUG1的表达呈正相关,而与miR-26a的表达呈负相关。Cai等[34]也得到了相似的研究结果:肿瘤组织与肿瘤细胞内TUG1为上调表达并且TUG1的高表达与胶质瘤的病理学分期密切相关,外源性沉默TUG1能够显著抑制肿瘤的血管生成并下调VEGFA的表达。进一步的研究证实,TUG1的促血管生成作用依赖于其作为内源性海绵对miR-299的调控,而VEGFA是miR-299所调控的下游靶基因,在体内及体外过表达miR-299均能在一定程度上逆转TUG1的促肿瘤血管生成作用。此外,该研究还指出TUG1与miR-299能够调控彼此的表达水平。与上述研究结果不同,Li等[35]的研究结果显示在胶质瘤组织中TUG1呈下调表达且TUG1的低表达与病理分期和癌肿体积密切相关。过表达TUG1能够促进胶质瘤细胞的凋亡发生,同时激活caspase-3/-9并下调抗凋亡基因bcl-2的表达,而转染siRNA-TUG1后肿瘤细胞的增殖能力上升。
6 骨肉瘤
Zhang等[36]在2013年首次发现在骨肉瘤组织和肿瘤细胞内TUG1呈异常高表达,并通过细胞学水平实验证实外源性沉默TUG1能够抑制骨肉瘤细胞的增殖并诱导凋亡发生。Ma等[37]在上述研究的基础上,通过对76例骨肉瘤患者肿瘤组织及血浆中TUG1的表达进行定量检测并综合临床数据分析发现,TUG1的表达水平与肿瘤大小、术后化疗、Enneking手术分期及患者预后显著相关,高表达的TUG1可以作为独立预后判断因素来对患者的整体生存与无恶化存活期(progression-free survival)进行评估。此外,该研究团队还发现术后患者血清中TUG1的表达显著下降且其在血清中的表达与疾病状况紧密相关,ROC分析显示TUG1可用来对健康人群中骨肉瘤患者进行初筛。Xie等[38]的研究进一步指出骨肉瘤中高表达的TUG1可以通过内源性海绵吸附机制下调miR-9-5p的表达,低表达的miR-9-5p失去了对其下游靶基因POU class 2 homeobox 1 (POU2F1)的负向调控,而上调表达的POU2F1能够促进肿瘤细胞增殖、推进周期并促抗凋亡发生。
7 乳腺癌
Li等[39]对乳腺癌组织及肿瘤细胞中TUG1表达的检测结果为异常上调表达,并且其表达水平与肿瘤大小、远处转移及TNM分期呈正相关。外源性沉默TUG1能够显著抑制乳腺癌肿瘤细胞的增殖与侵袭转移,同时促进凋亡发生并增加caspase-3/-9的活性。
8 卵巢癌
利用RT-qPCR对卵巢癌肿瘤组织和肿瘤细胞中TUG1的表达进行检测,结果显示TUG1在卵巢癌中呈异常上调表达并且与肿瘤分级和International Fe-deration of Gynecology and Obstetrics (FIGO)分期呈正相关。同样通过siRNA干扰来沉默卵巢癌肿瘤细胞内TUG1的表达后进行检测:细胞增殖与转移能力均下降并且凋亡细胞的比占增加,同时caspase-3和caspase-9蛋白表达水平上升而抗凋亡基因bcl-2的表达下降。此外,肿瘤细胞内的EMT 标志基因的表达也呈现趋势性变化[40]。
9 总结与展望
LncRNA在肿瘤发生发展过程中的重要调控作用正日渐凸显;TUG1是定位于22q12.2、全长7 598 nt、最初于胚胎发育期小鼠视网膜细胞分化研究中发现的lncRNA。随着研究的不断深入,发现TUG1在绝大部分人体恶性肿瘤中呈异常上调表达,并且高表达的TUG1能够促进包括增殖、细胞周期、侵袭转移、耐药、抗凋亡等多种肿瘤恶性生物学行为,发挥促癌因子的作用。此外,现有研究显示:TUG1的促癌作用依赖其通过多重机制(如招募PRC2/内源性海绵吸附等)在表观遗传、转录及转录后等不同水平对下游基因表达的调控。然而,肿瘤中TUG1的调控作用研究目前尚处于萌芽阶段,对于TUG1在肿瘤中所呈现的不同表达状态、详细的下游基因表达的分子调控机制以及肿瘤内TUG1失调控的上游分子事件等问题均有待后续的进一步深入性研究。LncRNA TUG1作为潜在的预后判断标记分子,对组织及血清内TUG1表达的检测将有助于术前诊断、癌肿浸润程度、肿瘤分期及患者术后生存的评估与预测,并且TUG1极有可能成为逆转化疗耐药与抗肿瘤分子精准治疗的干预靶点,为肿瘤患者未来可能的治愈带来希望。
[1] Hacisuleyman E, Cabili MN, Rinn JL. A keystone for ncRNA[J]. Genome Biol, 2012, 13(5):315-319.
[2] 荣 灿, 胡 云. 长链非编码RNA对能量代谢和相关疾病发生发展的作用[J]. 中国病理生理杂志, 2015, 31(5):956-960.
[3] Ling H, Fabbri M, Calin GA. MicroRNAs and other non-coding RNAs as targets for anticancer drug development[J]. Nat Rev Drug Discov, 2013, 12(11):847-865.
[4] Fu XD. Non-coding RNA: a new frontier in regulatory biology[J]. Natl Sci Rev, 2014, 1(2):190-204.
[5] Bracken CP, Scott HS, Goodall GJ. A network-biology perspective of microRNA function and dysfunction in can-cer[J]. Nat Rev Genet, 2016, 17(12):719-732.
[6] Giordano S, Columbano A. MicroRNAs: new tools for diagnosis, prognosis, and therapy in hepatocellular carcinoma?[J]. Hepatology, 2013, 57(2):840-847.
[7] 郑海伦, 赵 睿, 李大鹏, 等. miR-625-3p在结肠癌组织和细胞中的表达[J]. 中国病理生理杂志, 2016, 32(8):1376-1382.
[8] Lau E. Non-coding RNA: zooming in on lncRNA functions[J]. Nat Rev Genet, 2014, 15(9):574-575.
[9] Quinn JJ, Chang HY. Unique features of long non-coding RNA biogenesis and function[J]. Nat Rev Genet, 2016, 17(1):47-62.
[10]Engreitz JM, Pandya-Jones A, Mcdonel P, et al. The Xist lncRNA exploits three-dimensional genome architecture to spread across the X chromosome[J]. Science, 2013, 341(6147):1237973.
[11]Batista PJ, Chang HY. Long noncoding RNAs: cellular address codes in development and disease[J]. Cell, 2013, 152(6):1298-1307.
[12]张明娇, 吴 勇, 李珉珉. 长链非编码RNAs的生物功能及其与器官发育和恶性肿瘤的关系[J]. 中国病理生理杂志, 2015, 31(11):2107-2112.
[13]Young TL, Matsuda T, Cepko CL. The noncoding RNA taurine upregulated gene 1 is required for differentiation of the murine retina[J]. Curr Biol, 2005, 15(6):501-512.
[14]Chen C, Cheng G, Yang X, et al. Tanshinol suppresses endothelial cells apoptosis in mice with atherosclerosis via lncRNA TUG1 up-regulating the expression of miR-26a[J]. Am J Transl Res, 2016, 8(7):2981-2991.
[15]Li SY, Susztak K. The long noncoding RNATug1 connects metabolic changes with kidney disease in podocytes[J]. J Clin Invest, 2016, 126(11):4072-4075.
[16]Yin DD, Zhang EB, You LH, et al. Downregulation of lncRNA TUG1 affects apoptosis and insulin secretion in mouse pancreatic β cells[J]. Cell Physiol Biochem, 2015, 35(5):1892-1904.
[17]Su S, Liu J, He K, et al. Overexpression of the long noncoding RNA TUG1 protects against cold-induced injury of mouse livers by inhibiting apoptosis and inflammation[J]. FEBS J, 2016, 283(7):1261-1274.
[18]Jiang L, Wang W, Li G, et al. High TUG1 expression is associated with chemotherapy resistance and poor prognosis in esophageal squamous cell carcinoma[J]. Cancer Chemother Pharmacol, 2016, 78(2):333-339.
[19]Xu Y, Wang J, Qiu M, et al. Upregulation of the long noncoding RNA TUG1 promotes proliferation and migration of esophageal squamous cell carcinoma[J]. Tumour Biol, 2015, 36(3):1643-1651.
[20]Ji TT, Huang X, Jin J, et al. Inhibition of long non-co-ding RNA TUG1 on gastric cancer cell transference and invasion through regulating and controlling the expression of miR-144/c-Met axis[J]. Asian Pac J Trop Med, 2016, 9(5):508-512.
[21]Zhang E, He X, Yin D, et al. Increased expression of long noncoding RNA TUG1 predicts a poor prognosis of gastric cancer and regulates cell proliferation by epigenetically silencing of p57[J]. Cell Death Dis, 2016, 7:e2109.
[22]Huang MD, Chen WM, Qi FZ, et al. Long non-coding RNA TUG1 is up-regulated in hepatocellular carcinoma and promotes cell growth and apoptosis by epigenetically silencing of KLF2[J]. Mol Cancer, 2015, 14:165.
[23]Dong R, Liu GB, Liu BH, et al. Targeting long non-co-ding RNA-TUG1 inhibits tumor growth and angiogenesis in hepatoblastoma[J]. Cell Death Dis, 2016, 7:e2278.
[24]Zhai HY, Sui MH, Yu X, et al. Overexpression of long non-coding RNA TUG1 promotes colon cancer progression[J]. Med Sci Monit, 2016, 22:3281-3287.
[25]Sun J, Ding C, Yang Z, et al. The long non-coding RNA TUG1 indicates a poor prognosis for colorectal cancer and promotes metastasis by affecting epithelial-mesenchymal transition[J]. J Transl Med, 2016, 14:42.
[26]Wang L, Zhao Z, Feng W, et al. Long non-coding RNA TUG1 promotes colorectal cancer metastasis via EMT pathway[J]. Oncotarget, 2016, 7(32):51713-51719.
[27]Han Y, Liu Y, Gui Y. Long intergenic non-coding RNA TUG1 is overexpressed in urothelial carcinoma of the bladder[J]. J Surg Oncol, 2013, 107(5):555-559.
[28]Iliev R, Kleinova R, Juracek J, et al. Overexpression of long non-coding RNA TUG1 predicts poor prognosis and promotes cancer cell proliferation and migration in high-grade muscle-invasive bladder cancer[J]. Tumour Biol, 2016, 37(10):13385-13390.
[29]Tan J, Qiu K, Li M. Double-negative feedback loop between long non-coding RNA TUG1 and miR-145 promotes epithelial to mesenchymal transition and radioresistance in human bladder cancer cells[J]. FEBS Lett, 2015, 589(2):3175-3181.
[30]Zhang M, Lu W, Huang Y, et al. Downregulation of the long noncoding RNA TUG1 inhibits the proliferation, migration, invasion and promotes apoptosis of renal cell carcinoma[J]. J Mol Histol, 2016, 47(4):421-428.
[31]Zhang EB, Yin DD, Sun M, et al. P53-regulated long non-coding RNA TUG1 affects cell proliferation in human non-small cell lung cancer, partly through epigenetically regulating HOXB7 expression[J]. Cell Death Dis, 2014, 5:e1243.
[32]Lin PC, Huang HD, Chang CC, et al. Long noncoding RNA TUG1 is downregulated in non-small cell lung cancer and can regulate CELF1 on binding to PRC2[J]. BMC Cancer, 2016, 16:583.
[33]Li J, An G, Zhang M, et al. Long non-coding RNA TUG1 acts as a miR-26a sponge in human glioma cells[J]. Biochem Biophys Res Commun, 2016, 477(4):743-748.
[34]Cai H, Liu X, Zheng J, et al. Long non-coding RNA taurine upregulated 1 enhances tumor-induced angiogenesis through inhibiting microRNA-299 in human glioblastoma[J]. Oncogene, 2017, 36(3):318-331.
[35]Li J, Zhang M, An G, et al. LncRNA TUG1 acts as a tumor suppressor in human glioma by promoting cell apoptosis[J]. Exp Biol Med (Maywood), 2016, 241(6):644-649.
[36]Zhang Q, Geng PL, Yin P, et al. Down-regulation of long non-coding RNA TUG1 inhibits osteosarcoma cell proliferation and promotes apoptosis[J]. Asian Pac J Cancer Prev, 2013, 14(4):2311-2315.
[37]Ma B, Li M, Zhang L, et al. Upregulation of long non-coding RNA TUG1 correlates with poor prognosis and di-sease status in osteosarcoma[J]. Tumour Biol, 2016, 37(4):4445-4455.
[38]Xie CH, Cao YM, Huang Y, et al. Long non-coding RNA TUG1 contributes to tumorigenesis of human osteosarcoma by sponging miR-9-5p and regulating POU2F1 expression[J]. Tumour Biol, 2016, 37(11):15031-15041.
[39]Li T, Liu Y, Xiao H, et al. Long non-coding RNA TUG1 promotes cell proliferation and metastasis in human breast cancer[J]. Breast Cancer, 2016 Nov 15. [Epub ahead of print]
[40]Kuang D, Zhang X, Hua S, et al. Long non-coding RNA TUG1 regulates ovarian cancer proliferation and metastasis via affecting epithelial-mesenchymal transition[J]. Exp Mol Pathol, 2016, 101(2):267-273.
(责任编辑: 卢 萍, 罗 森)
Regulatory effects of taurine up-regulated gene 1 on tumorigenesis
JIANG Xing-ming, WANG Zhi-dong, LI Jing-lin, ZHENG Wang-yang,LI Zheng-long, LI Xin-heng, CUI Yun-fu
(DepartmentofBiliary-pancreaticSurgery,SecondAffiliatedHospitalofHarbinMedicalUniversity,Harbin150086,China.E-mail:yfcui777@hotmail.com)
It has been estimated that approximately 75% of the human genome is transcribed into RNA, 74% of which would be transcribed into non-coding RNA (ncRNA). The ncRNA can be divided into 2 major groups including small RNA and long non-coding RNA (lncRNA). There is increasing evidence that the dysregulation of lncRNA is closely associated with the occurrence and progression of many tumors. The lncRNA taurine up-regulated gene 1 (TUG1) is originally detected in a genomic screen for genes in response to taurine treatment of developing mouse retinal cells. According to research reports, dysregulation of TUG1 participates in the progression of a variety of tumors. Therefore, the regulatory effects of lncRNA TUG1 on tumorigenesis are summarized in this article.
长链非编码RNA; 牛磺酸上调基因1; 肿瘤发生
Long non-coding RNA; Taurine up-regulated gene 1; Tumorigenesis
1000- 4718(2017)07- 1332- 06
2017- 01- 09
2017- 04- 17
国家自然科学基金资助项目(No. 81602088);黑龙江省卫生计生委科研课题资助项目(No. 2016049);黑龙江省博士后资助课题(No. LBH-Z16096);哈尔滨医科大学创新科学研究基金资助项目(No. 2016LCZX09)
R730.23
A
10.3969/j.issn.1000- 4718.2017.07.030
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0451-86605113; E-mail: yfcui777@hotmail.com
