穿心莲内酯对卵巢癌细胞株SKOV-3侵袭与凋亡的影响*
2017-08-07苏芳静田林燕
苏芳静, 张 斌, 田林燕
(南阳医学高等专科学校护理系, 河南 南阳 473001)
穿心莲内酯对卵巢癌细胞株SKOV-3侵袭与凋亡的影响*
苏芳静△, 张 斌, 田林燕
(南阳医学高等专科学校护理系, 河南 南阳 473001)
目的: 观察穿心莲内酯对卵巢癌细胞株SKOV-3侵袭与凋亡的影响并探讨初步的作用机制。方法: CCK-8法检测不同浓度(0、5、10、20和40 μmol/L)的穿心莲内酯对SKOV-3细胞作用不同时间(12、24、36和48 h)后,SKOV-3细胞存活率的变化;Transwell法与TUNEL法分别检测SKOV-3细胞侵袭能力与凋亡能力的变化;Western blot法检测p-PI3K、p-Akt与p-mTOR蛋白水平的变化。结果: CCK-8法检测结果显示,随着浓度增加与培养时间延长,穿心莲内酯对SKOV-3细胞存活率的抑制程度增强;采用20 μmol/L穿心莲内酯培养SKOV-3细胞36 h后,SKOV-3细胞的侵袭数明显降低,凋亡数明显增加(P<0.05),p-PI3K、p-Akt与p-mTOR的蛋白水平明显降低(P<0.05)。结论: 穿心莲内酯能够抑制卵巢癌细胞SKOV-3的活力与侵袭能力,增强凋亡能力,这可能与抑制PI3K/Akt/mTOR信号通路有关。
穿心莲内酯; 卵巢癌细胞; PI3K/Akt/mTOR信号通路
卵巢恶性肿瘤是妇科肿瘤中最常见的恶性肿瘤之一,其发病率约占妇科恶性肿瘤的15%,可发生于任何年龄段的女性,常见于更年期与绝经期的妇女,发病年龄高峰为50~60岁[1-2]。由于发病部位隐匿,容易扩散转移,超过50%以上的卵巢癌患者在治疗完毕后再次复发,5年生存率较低,约为25%~30%[3]。临床上卵巢癌的治疗主要以手术为主,放化疗为辅的综合治疗手段,但由于化疗药物容易产生耐药性以及毒副作用,卵巢癌细胞对放疗射线的敏感性较低,导致临床的治疗效果并不理想。近年来,从中草药与天然植物中提取安全有效低毒的单体成分用于治疗癌症是肿瘤研究的热点。
穿心莲内酯(andrographolide,Ang)是爵床科植物穿心莲中所含的二萜内酯类化合物,具有祛热解毒、消炎止痛的功效,对细菌性与病毒性上呼吸道感染具有特殊的疗效,具有天然抗生素的美誉[4]。国内学者研究发现穿心莲内酯衍生物通过阻滞细胞于G0/G1期、下调Bcl-2蛋白表达、激活caspase-9和caspase-3蛋白表达诱导人食管癌Ec9706细胞凋亡,从而抑制Ec9706细胞增殖与克隆形成[5]。本实验观察了穿心莲内酯对卵巢癌细胞株SKOV-3生长与侵袭能力的影响,并探讨其具体的作用机制。
材 料 和 方 法
1 细胞来源与试剂
人卵巢癌浆液性乳头状囊腺癌细胞株SKOV-3购自中国科学院上海细胞所;穿心莲内酯购自中国食品药品检定研究院,溶解于HBSS缓冲液中备用[6];RPMI-1640培养基购自Gibco;10%胎牛血清购自杭州四季青生物工程材料有限公司;CCK-8试剂盒购自碧云天生物技术有限公司;Transwell小室购自Corning;抗磷脂酰肌醇3-激酶(phosphatidylino-sitol 3-kinase,PI3K)、p-PI3K、Akt、p-Akt、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、p-mTOR和β-actin抗体购自Santa Cruz。
2 方法
2.1 细胞培养与传代 将SKOV-3细胞株至于含10%胎牛血清的RPMI-1640培养基中,置于37 ℃、5% CO2的恒温培养箱中孵育,待细胞融合至80%~90%时,用0.25%胰酶消化3 min,进行传代。
2.2 CCK-8法检测细胞活力 将处于对数生长期的SKOV-3细胞接种于96孔板,每孔1×105个细胞,置于37 ℃、5% CO2的恒温培养箱中孵育,当细胞贴壁后,更换培养基,分别加入穿心莲内酯使最终浓度分别为0、5、10、20和40 μmol/L,每组设6个复孔,每组细胞分别培养12 h、24 h、36 h和48 h后,更换培养基,加入10 μL CCK-8检测液,继续孵育1 h,采用酶标仪检测波长为450 nm各孔的吸光度。
2.3 实验分组 实验共分为3组:正常对照(control)组采用正常培养基培养;溶剂(solvent)组加入等剂量溶剂HBSS缓冲液;Ang加药组(Ang组)给予20 μmol/L穿心莲内酯培养36 h。
2.4 Transwell小室检测细胞侵袭能力 将处于对数生长期的SKOV-3细胞接种于预铺Matrigel、含1%血清的Transwell上室中,每孔5×105个细胞;下室加入含10%血清的培养基,孵育24 h后,弃去培养基,用棉签轻轻擦拭,将上室至于结晶紫染液中3 min,PBS洗涤,置于显微镜下观察细胞计数,并拍照。
2.5 TUNEL法检测细胞凋亡 将细胞接种于已灭菌的培养皿中,每孔1×105个,待细胞贴壁后,加入穿心莲内酯使最终浓度为20 μmol/L,培养36 h。用4%多聚甲醛 4 ℃固定 30 min,0.1% Triton X-100冰浴2 min,分别加入50 μL TUNEL检测液,继续置于37 ℃避光孵育 60 min,PBS洗涤,加入DAPI染液(10 mg/L)孵育15 min,抗荧光淬灭剂封片,采用共聚焦激光扫描显微镜观察各组细胞的凋亡情况,统计细胞凋亡率。
2.6 Western blot检测蛋白表达水平 收集各组细胞,加入细胞裂解缓冲液,提取蛋白,通过分光光度测定仪进行蛋白定量,各组取50 μg蛋白进行凝胶电泳分离,完成后电转至硝酸纤维素膜,加入含封闭液的器皿中,室温封闭2 h,加入相应 I抗,4 ℃孵育过夜,PBS洗涤3次,加入对应 II 抗,37 ℃孵育1 h,PBS洗膜3次,避光加入按照说明书比例新鲜配置的ECL发光液,曝光,采用Quantity One图像分析软件对实验结果进行分析。
3 统计学处理
采用SPSS 16.0统计软件对实验数据进行分析,实验数据采用均数±标准差(mean±SD)表示,满足方差齐性的多组数据采用单因素方差分析,2组数据间的比较采用独立样本的t检验,以P<0.05为差异有统计意义。
结 果
1 不同浓度穿心莲内酯对SKOV-3细胞存活率的影响
在同一时点,随着穿心莲内酯浓度的增加,SKOV-3细胞的存活率逐渐下降,20 μmol/L与40 μmol/L穿心莲内酯对细胞存活率的影响与对照组比较差异无统计学意义;同一浓度药物,随着孵育时间的延长,SKOV-3细胞的存活率逐渐下降,48 h与36 h相比,存活率的差异无统计学显著性,见图1。因此,采用20 μmol/L穿心莲内酯培养细胞36 h的条件进行后续实验。

Figure 1.The viability of the SKOV-3 cells after treated with andrographolide. Mean±SD.n=6.
图1 穿心莲内酯对SKOV-3细胞存活率的影响
2 穿心莲内酯对SKOV-3细胞侵袭能力的影响
Transwell侵袭实验结果如图2所示。采用20 μmol/L穿心莲内酯培养SKOV-3细胞36 h后,细胞侵袭数显著低于正常对照组与溶剂对照组(P<0.05),其中正常对照组和溶剂对照组细胞侵袭数之间的差异无统计学显著性。
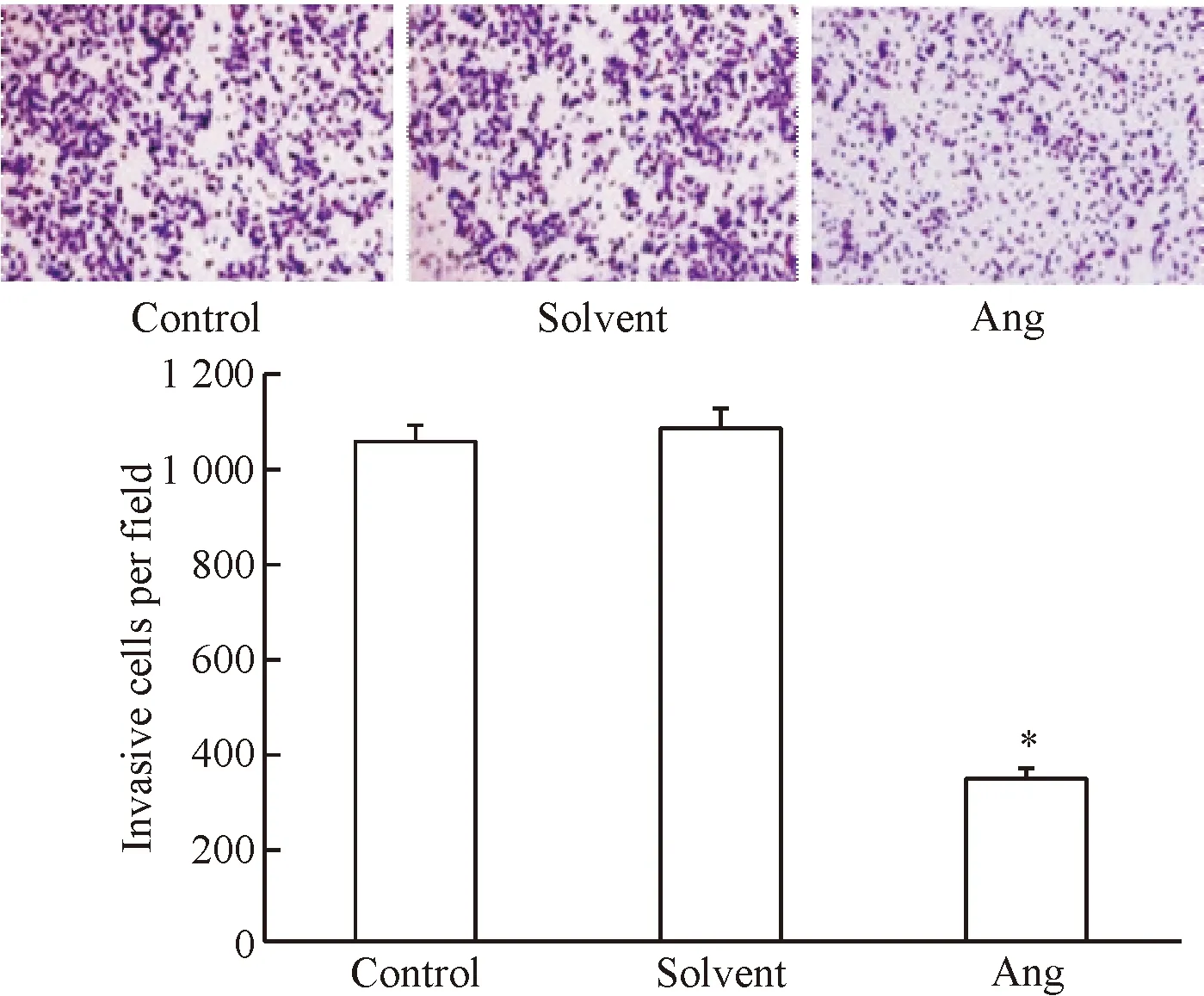
Figure 2.The invasion of SKOV-3 cells after 20 μmol/L andrographolide (Ang) treatment (×200).Mean±SD.n=3.*P<0.05vscontrol group.
图2 穿心莲内酯对SKOV-3细胞侵袭能力的影响
3 穿心莲内酯对SKOV-3细胞凋亡的影响
TUNEL实验结果如图3所示。采用20 μmol/L穿心莲内酯培养SKOV-3细胞36 h后,细胞凋亡数显著高于正常对照组与溶剂对照组(P<0.05),其中正常对照组和溶剂对照组的细胞凋亡之间的差异无统计学显著性。
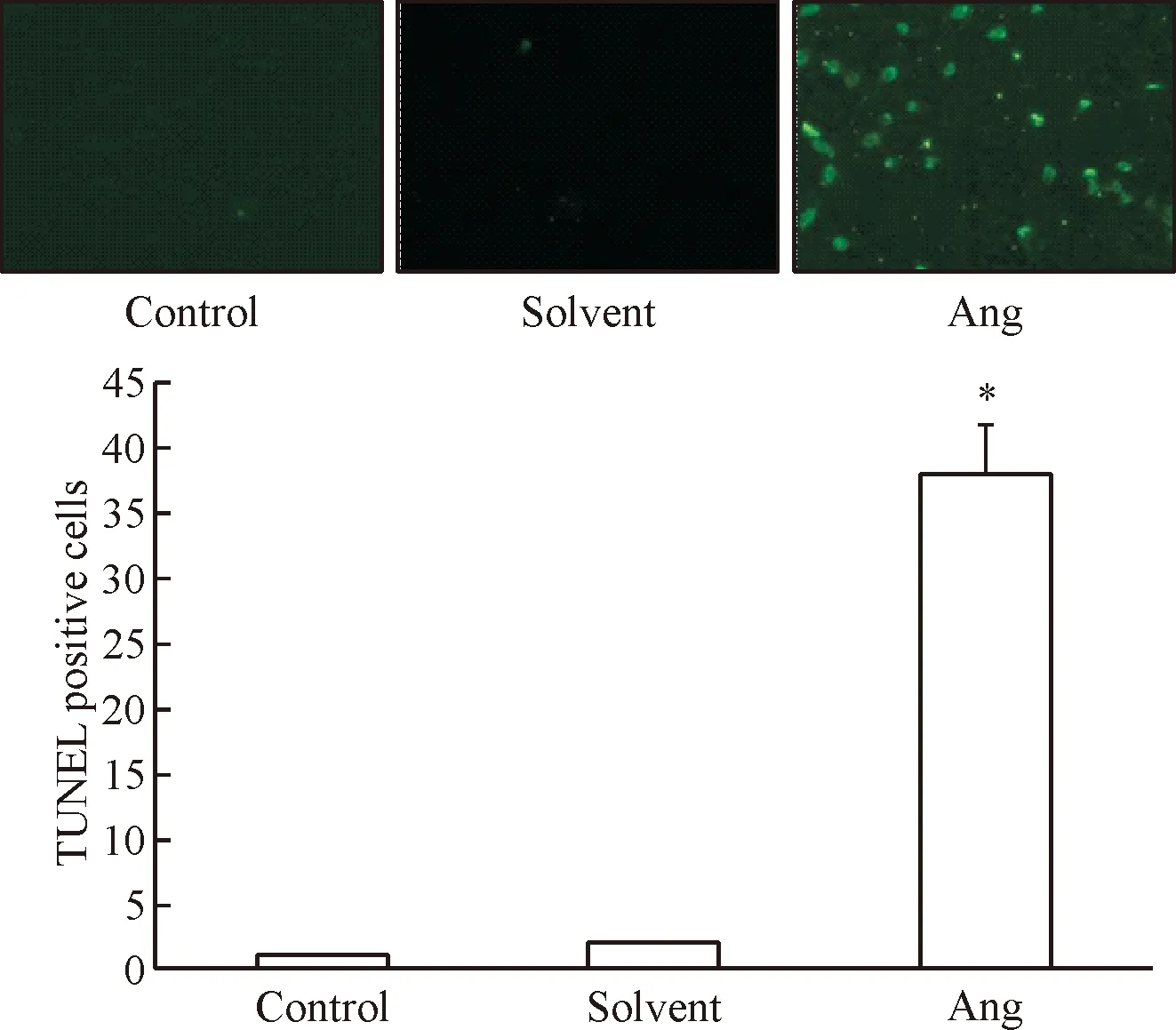
Figure 3.The effect of 20 μmol/L andrographolide (Ang) on the apoptosis of SKOV-3 cells (TUNEL staining, ×200). Mean±SD.n=3.*P<0.05vscontrol group.
图3 穿心莲内酯对SKOV-3细胞凋亡的影响
4 p-PI3K、p-Akt与p-mTOR蛋白水平的变化
Western blot实验结果如图4所示。采用20 μmol/L穿心莲内酯培养SKOV-3细胞36 h后,细胞中p-PI3K、p-Akt与p-mTOR的蛋白水平较对照组明显降低(P<0.05),而正常对照组和溶剂对照组之间蛋白表达水平的差异无统计学显著性。
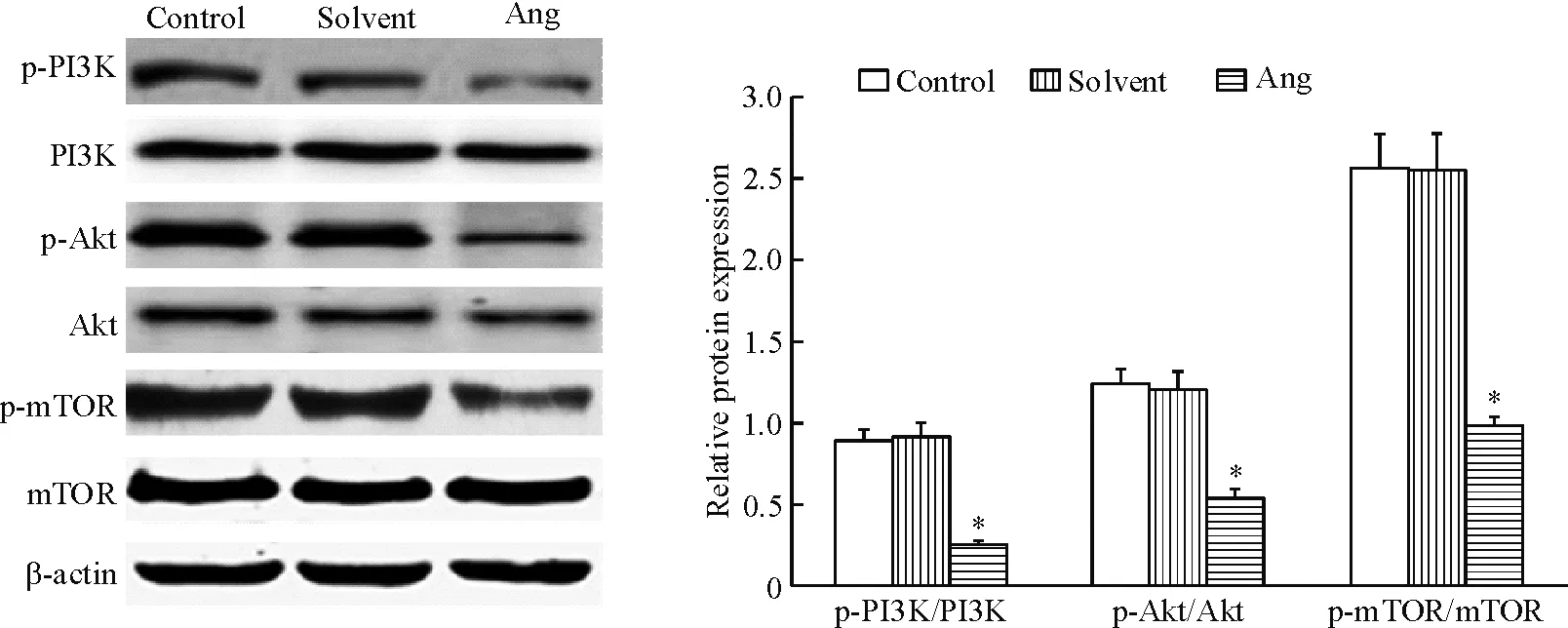
Figure 4.The effect of 20 μmol/L andrographolide (Ang) on the protein levels of p-PI3K, p-Akt and p-mTOR in the SKOV-3 cells. Mean±SD.n=3.*P<0.05vscontrol group.
图4 SKOV-3细胞中p-PI3K、p-Akt与p-mTOR蛋白水平的变化
讨 论
PI3Ks信号通路主要参与细胞增殖,分化与凋亡等多种细胞功能调节的过程,PI3K/Akt/mTOR信号通路被认为是肿瘤细胞存活的重要通路,对肿瘤细胞的生存、凋亡和细胞周期,以及肿瘤细胞新生血管的形成、转移与侵袭等具有重要的意义[7-8]。近年来研究发现在多种恶性肿瘤细胞中,如乳腺癌和子宫内膜癌等恶性上皮性肿瘤中发现PI3K/Akt信号通路过度激活,并在肿瘤细胞的增殖,迁移与侵袭过程中发挥重要作用[9-10]。国内学者研究发现,PI3K/Akt信号通路抑制剂LY294002对卵巢癌细胞SKOV3和CAOV3的增殖与侵袭能力具有明显的抑制作用,表明卵巢癌细胞的增殖与侵袭能力与PI3K/Akt信号通路的激活具有非常紧密的联系[11]。我们研究发现,穿心莲内酯对卵巢癌细胞的活力与侵袭能力具有明显的抑制作用,而PI3K、Akt与mTOR的磷酸化水平下降,推测穿心莲内酯对卵巢癌细胞SKOV3增殖与侵袭能力的抑制作用,以及凋亡的促进作用是通过抑制PI3K/Akt/mTOR信号通路的激活而实现的。
在卵巢恶性肿瘤中,肿瘤细胞的侵袭或转移是导致卵巢肿瘤患者治疗效果欠佳,预后不良与复发率高的主要原因,因此深入研究卵巢恶性肿瘤细胞侵袭或转移的主要分子作用机制,对于寻找卵巢肿瘤的治疗分子作用靶点,对卵巢恶性肿瘤进行早期的诊断与治疗提供确切的依据。本实验发现抑制PI3K/Akt/mTOR信号通路是穿心莲内酯对卵巢肿瘤细胞的主要作用方式,PI3K/Akt/mTOR信号通路可以作为治疗卵巢肿瘤作用靶点,对于指导卵巢肿瘤采用穿心莲内酯辅助治疗具有重要的意义。
[1] Sankaranarayanan R, Ferlay J. Worldwide burden of gynaecological cancer: the size of the problem[J]. Best Pract Res Clin Obstet Gynaecol, 2006, 20(2): 207-225.
[2] Liu CG, Calin GA, Meloon B, et al. An oligonucleotide microchip for genome-wide microRNA profiling in human and mouse tissues[J]. Proc Natl Acad Sci U S A, 2004, 101(26):9740-9744.
[3] 李 枫, 姚 丽, 张喜红, 等. miRNA-22在卵巢癌组织的表达及其对卵巢癌细胞增殖、迁移与侵袭的影响[J].中国病理生理杂志, 2016, 32(12):2251-2255.
[4] 吕巧莉, 涂国刚, 王嘉琦, 等. 穿心莲内酯的研究进展及临床应用[J].南昌大学学报: 医学版, 2013, 53(1):83-86.
[5] 戴桂馥, 赵 进, 王庆瑞, 等. 穿心莲内酯诱导人食管癌Ec9706细胞凋亡机制研究[J]. 中国药理学通报, 2009, 25(2):173-176.
[6] 彭伟文, 刘中秋, 叶 玲, 等. 穿心莲内酯的溶解度和稳定性实验研究[J]. 中国医药指南, 2008, 6(24):76-77.
[7] Liu Y, Cui B, Qiao Y, et al. Phosphoinositide-3-kinase inhibition enhances radiosensitization of cervical cancerinvivo[J]. Int J Gynecol Cancer, 2011, 21(1):100-105.
[8] Gao Y, Ishiyama H, Sun M, et al. The alkylphospholi-pid, perifosine, radiosensitizes prostate cancer cells bothinvitroandinvivo[J]. Radiat Oncol, 2011, 6:39.
[9] 郭瑞霞, 魏丽惠, 王建六, 等. 17β-雌二醇对子宫内膜癌细胞磷脂酰肌醇3激酶/蛋白激酶B信号传导通路的激活作用[J]. 中华妇产科杂志, 2004, 39(7):469-473.
[10]Zhao M, Mueller BM, DiScipio RG, et al. Akt plays an important role in breast cancer cell chemotaxis to CXCL12[J]. Breast Canner Res Treat, 2008, 110(2):211-222.
[11]雷 婧. SDF-1激活PI3K/Akt通路在卵巢癌细胞增殖和侵袭中的作用[D]. 郑州: 郑州大学, 2015.
(责任编辑: 林白霜, 罗 森)
Effects of andrographolide on invasion and apoptosis of ovarian cancer SKOV-3 cells
SU Fang-jing, ZHANG Bin, TIAN Lin-yan
(SchoolofNursing,NanyangMedicalCollege,Nanyang473001,China.E-mail:sufangjing322904@126.com)
AIM: To investigate the effects of andrographolide on the invasion and apoptosis of ovarian cancer cell line SKOV-3, and to explore the possible mechanisms. METHODS: SKOV-3 cells were treated with different concentrations (0, 5, 10, 20 or 40 μmol/L) of andrographolide for different time (12, 24, 36 or 48 h), and then the cell viability was determined by CCK-8 assay. The cell invasion ability was analyzed by Transwell assay and cell apoptosis was detected by TUNEL staining. The protein levels of p-PI3K, p-Akt and p-mTOR were examined by Western blot. RESULTS: The results of CCK-8 assay revealed that andrographolide inhibited the growth of SKOV-3 cells in a dose- and time-dependent manner. Treatment with andrographolide at 20 μmol/L for 36 h significantly decreased the invasion ability of SKOV-3 cells, while increased cell apoptosis. In addition, the protein levels of p-PI3K, p-Akt and p-mTOR were reduced after andrographolide treatment. CONCLUSION: Andrographolide inhibits the growth and invasion of ovarian cancer SKOV-3 cells by suppression of PI3K/Akt/mTOR signaling pathway.
Andrographolide; Ovarian cancer cells; PI3K/Akt/mTOR signaling pathway
1000- 4718(2017)07- 1328- 04
2017- 02- 07
2017- 06- 14
河南省教育厅高校重点科研项目(No.15A360011)
R711.75; R730.23
A
10.3969/j.issn.1000- 4718.2017.07.029
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0377-63526369; E-mail: sufangjing322904@126.com
