蜂胶黄酮PB3A作用下结肠癌细胞株中miRNA-198和miRNA-296-5p的表达及功能预测*
2017-08-07胡尼其古丽阿巴克玛依努尔达吾提依米提热合曼阿依努尔玉苏普吾热娅提古丽克维尔买日江古丽阿布力提甫
胡尼其古丽·阿巴克, 玛依努尔·达吾提, 依米提·热合曼, 阿依努尔·玉苏普, 吾热娅提古丽·克维尔, 买日江古丽·阿布力提甫
(新疆大学生命科学与技术学院, 新疆 乌鲁木齐 830046)
·短篇论著·
蜂胶黄酮PB3A作用下结肠癌细胞株中miRNA-198和miRNA-296-5p的表达及功能预测*
胡尼其古丽·阿巴克, 玛依努尔·达吾提, 依米提·热合曼△, 阿依努尔·玉苏普, 吾热娅提古丽·克维尔, 买日江古丽·阿布力提甫
(新疆大学生命科学与技术学院, 新疆 乌鲁木齐 830046)
目的: 探讨蜂胶黄酮短叶松素-3-乙酸酯(pinobanksin-3-acetate,PB3A)对结肠癌SW480细胞微小RNA(microRNA, miRNA)表达谱的影响,为结肠癌的治疗及靶向药物研发提供理论依据。方法: 使用miRNA芯片技术分析检测蜂胶黄酮PB3A处理人类结肠癌SW480细胞后miRNA表达谱的变化。通过实时荧光定量PCR方法检测miRNA-198和miRNA-296-5p的表达水平,以此来验证miRNA芯片结果的准确性和可靠性。利用miRWalk、MicroT、miRanda等12个网上数据库预测这2条miRNAs的靶基因并进行靶基因功能富集分析。结果: miRNA芯片分析结果显示,蜂胶黄酮PB3A干预24 h后结肠癌SW480细胞中差异表达倍数在2倍及以上的miRNA有267条,其中差异表达倍数达10倍及以上的miRNA有30条,28条为上调表达,2条下调表达;RT-qPCR实验结果显示miRNA-198和miRNA-296-5p的表达量趋势跟miRNA芯片结果一致,表达差异有统计学意义(P<0.05)。miRNA靶基因预测发现miRNA-198有859个靶基因,miRNA-296-5p有906个靶基因;对这些可能被调控的靶基因进行Gene Class分析,结果显示miRNA-198和miRNA-296-5p的靶基因功能主要为转录因子、拷贝数变异、细胞分化、癌基因、蛋白激酶、组蛋白、转移癌基因、肿瘤抑制基因等(P<0.05)。信号通路富集分析结果显示,miRNA-198靶基因显著富集于肿瘤通路、Wnt信号通路、胞吞通路、ErbB信号通路、黏着斑通路、黑素生成通路等信号通路,而miRNA-296-5p靶基因在MAPK信号通路、胞吞通路、轴突导向通路、Wnt信号通路、胰岛素信号通路、钙离子信号通路等信号通路中出现聚集(P<0.05)。结论: 蜂胶黄酮PB3A 影响结肠癌SW480细胞的miRNA表达谱。PB3A作用下miRNA-198和miRNA-296-5p的异常表达可能参与PB3A抗结肠癌的过程。
短叶松素-3-乙酸脂; 结肠癌SW480细胞; 微小RNA-198; 微小RNA-296-5p
结肠直肠癌(colorectal carcinoma,CRC)是消化系统最为常见的恶性肿瘤之一,其发病率占全球癌症的10%,在男性中排第3位,女性中排第2位[1]。目前,结肠癌在我国的发病率越来越高,对人们身体健康带来严重威胁,其在我国胃肠道肿瘤中的致死率排第4位,发病率排第3位,城市地区的发病率比农村地区高[2]。
微小RNA(microRNA,miRNA)是一类广泛存在于多种生物体内的长度约18~25个核苷酸的非编码小分子RNA[3]。microRNA突变、缺失或表达水平的异常与人类肿瘤密切相关,它具有癌基因样或抑癌基样作用,因此促进或抑制肿瘤的发生、发展[4]。据报道,已有100多种 miRNA在结肠癌组织和细胞中特异性表达[5],在结肠癌上最初被发现异常表达的miRNA是miR-145和miR-143[6]。
蜂胶黄酮短叶松素-3-乙酸脂(pinobanksin-3-acetate,PB3A)是一种黄色,溶于二甲亚砜的,从蜂胶、蜂蜜及某些植物花苞等分离纯化获得的一种二氢黄酮化合物。本实验室前期研究发现PB3A通过抑制细胞增殖,诱导细胞凋亡而发挥抗癌作用,它对大肠癌HCT116细胞[7]及SW480细胞[8]、胃癌SGC-7901细胞[9]和人肝癌HepG-2细胞[10]有抑制增殖和诱导凋亡作用。然而miRNA在蜂胶黄酮PB3A抑制肿瘤细胞增殖和诱导凋亡中的调控作用及其相关分子机制,国内外向未报到。本研究通过观察PB3A对结肠癌SW480细胞miRNA表达谱的影响,有望丰富PB3A的抗癌作用机制,为其进一步开发成为有效治疗结肠癌药物提供实验依据,并为以miRNA为靶点的新型抗癌药物的开发提供新的策略和思路。
材 料 和 方 法
1 材料
PB3A,质量分数>99%,由Yasuyuki T教授(日本千叶工业大学)和依米提·热合曼博士提供。SW480细胞株购自上海细胞库。
2 主要试剂
MTT试剂和二甲基亚砜(DMSO)购自Sigma; RPMI-1640培养基购自HyClone;胎牛血清购自Gibco;TRIzol总RNA提取试剂,miRNA荧光定量检测试剂盒购自北京天根生化科技公司;miRNA表达谱芯片由上海康成生物工程有限公司检测。
3 主要方法
3.1 细胞培养及药物干预 结肠癌SW480细胞给含有10%胎牛血清及1%青霉素和链霉素的RPMI-1640完全培养基,在含有5% CO2的恒温培养箱内培养。隔2~3 d当细胞融合率达80%~90%时换新的培养基,细胞进入对数生长期后可用于实验。取对数生长期的细胞,以每孔3×107个接种于6孔培养板培养,24 h后吸除原培养基。本实验室前期研究结果显示蜂胶黄酮PB3A对结肠癌SW480细胞具有较强的诱导凋亡的作用,根据前期研究结果,我们选择浓度为100 mg/L PB3A干预结肠癌SW480细胞24 h作为miRNA芯片处理条件:设每孔加入2 mL含有浓度为100 mg/L PB3A(母液是用DMSO稀释的)的RPMI-1640培养液混合培养组为实验组,培养液中不加药物(加相同浓度的DMSO,DMSO浓度≤0.5%)为对照组,继续培养24 h后收集细胞。
3.2 细胞总RNA的提取及质量鉴定 SW480细胞用PB3A处理24 h后采用Trizol试剂提取总RNA,用NanoDrop 2000超微量分光光度计检测RNA浓度及纯度,并以1% 的琼脂糖凝胶电泳检测完整性。
3.3 miRNA芯片 将达到实验要求的细胞总RNA,反转录合成荧光分子Hy3标记的cDNA探针,与miRCURY LNATMArray (Exiqon)芯片杂交,利用Axon GenePix 4000B Microarray Scanner进行扫描,利用GenePix Pro 6.0软件读取图片原始强度并进行分析。差异表达的miRNA通过倍数变化筛选鉴定,差异miRNA筛选标准为实验组和对照组信号差异比值≥2和≤0.5。
3.4 RT-qPCR实验 取100 ng总RNA,使用miRcute miRNA cDNA第一链合成试剂盒对miRNA 3’末端进行加poly(A)处理,然后用Oligo(dT)-universal tag通用逆转录引物进行逆转录反应, 合成miRNA对应cDNA第一链。下一步使用miRcute miRNA荧光定量检测试剂盒进行定量PCR检测。20 μL体系,PCR反应条件: 94 ℃ 2 min; 94 ℃ 20 s, 60 ℃ 34 s,共40循环。以U6作为内参照,所有样品设3个重复。以2-ΔΔCt法分析miRNA的相对表达量。
3.5 差异表达miRNA生物信息学分析 利用miRWalk、MicroT、miRanda、miRBridge、miRDB、miRmap、miRNAMap、PicTar、PITA、RNA22、RNAhybrid以及TargetScan等12个算法或数据库对miRNA芯片结果中差异表达倍数≥10的miR-198和miR-296-5p进行靶基因预测,至少要在7个算法或数据库均预测到才算有效靶基因。然后应用Fisher Exact检验对这些可能被调控的靶基因进行Gene Class、GO分析及KEGG信号通路分析/富集分析,从多个功能角度探索microRNA-靶基因-功能间的关系并统计富集结果。
4 统计学处理
采用SPSS 19.0软件进行统计学分析,结果以均数±标准差(mean±SD)表示。药物干预和非干预组之间miRNA的ΔCt值比较采用独立样本t检验,以P<0.05为差异有统计学意义。
结 果
1 细胞总RNA纯度及浓度测定
用超微量分光光度计检测100 mg/L PB3A 干预24 h候后提取的细胞总RNA浓度和纯度,结果显示其A260/A280值>1.8;经1.5%琼脂糖凝胶电泳检测总RNA,结果28S和18S两条电泳条带清晰,28S∶18S rRNA条带亮度大于或接近2∶1。此结果说明提取的总RNA完整性好,质量符合表达谱芯片实验要求,可用于后续实验。
2 PB3A对miRNA表达谱的影响
对所得的miRNA表达芯片扫描图像进行数字化处理和分析,结果发现,PB3A 作用24 h后实验组与对照组比较,结肠癌SW480细胞中267条miRNA表达有显著性差异,其中218条miRNA上调表达,49条miRNA下调表达,差异倍数(fold change)≥2和≤0.5;差异倍数≥10的上调表达的miRNA 有28条,差异倍数≤0.1的下调表达的miRNA 有2条,见表1。
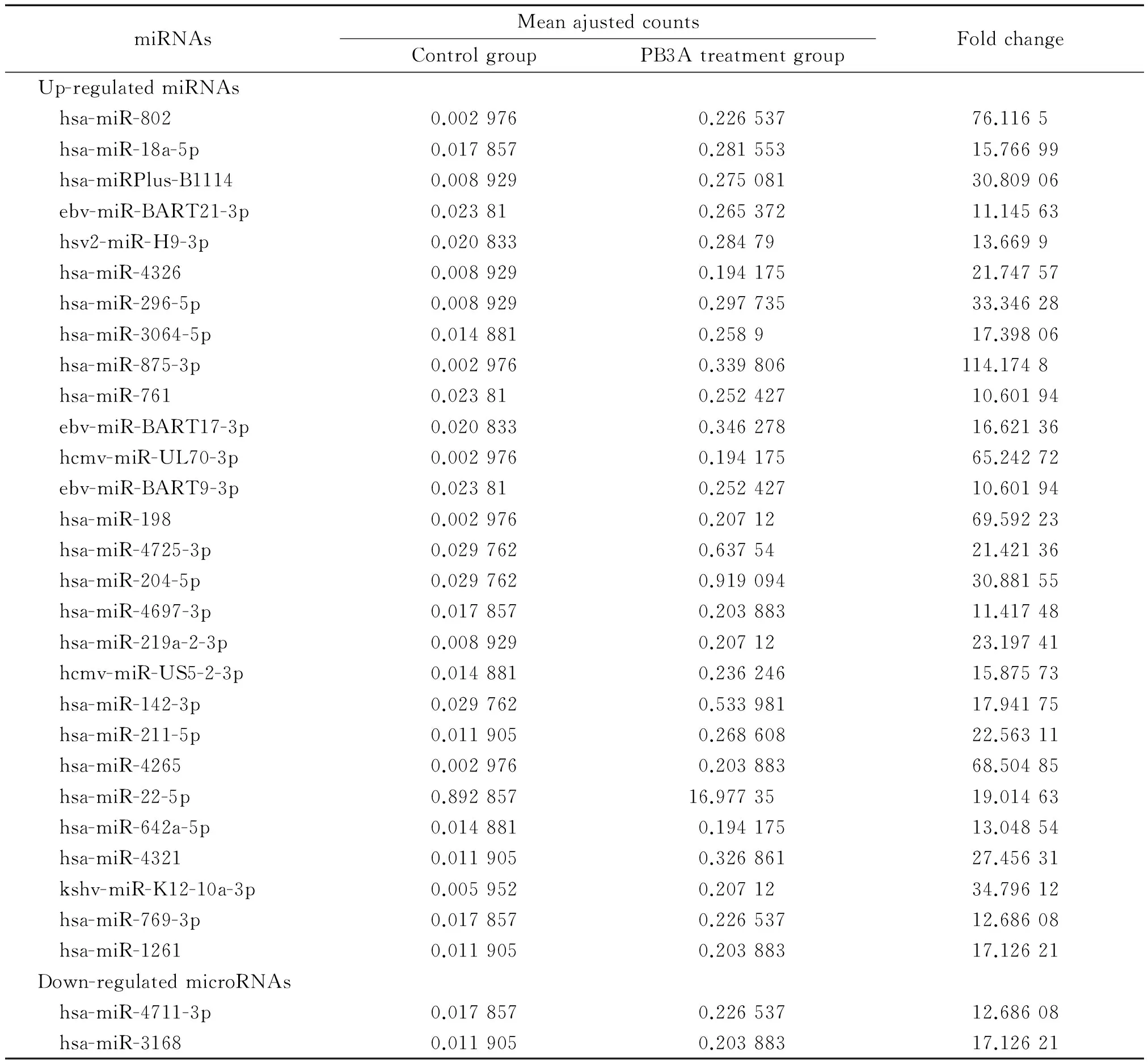
表1 PB3A处理组及对照组SW480细胞中差异表达倍数10倍及以上的miRNA
3 通过RT-qPCR实验检测miRNA-198和miRNA-296-5p在结肠癌SW480细胞株中的表达情况,对miRNA芯片结果进行验证
用100 mg/L PB3A处理结肠癌SW480细胞株24 h后,药物处理组miRNA296-5p和miRNA-198表达上调,与药物未干预组相比有显著差异(P<0.01),见图1;本实验中miRNA296-5p的相对表达量差异倍数2-ΔΔCt值为4.47,miRNA-198的相对表达量差异倍数2-ΔΔCt值为2.74,表达差异有统计学意义(P<0.05),见图2,该表达情况与miRNA 芯片的检测结果一致。
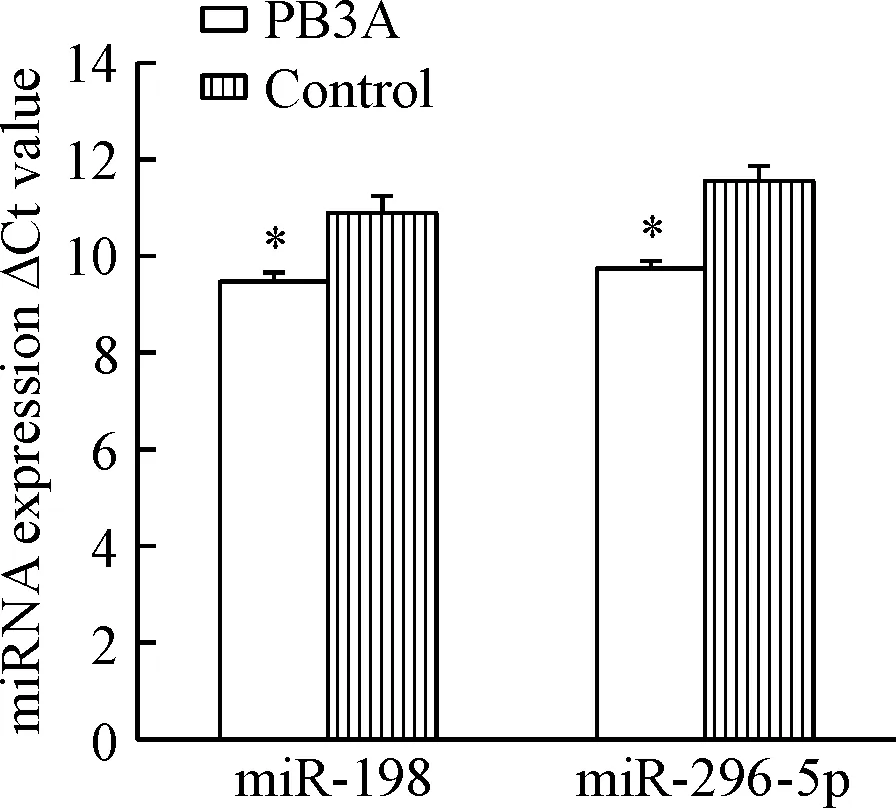
Figure 1.Differential expression levels of miRNAs in drug-treated and untreated SW480 cells. Mean±SD.n=4.*P<0.05vscontrol group.
图1 药物处理与未处理SW480细胞中miRNA的差异表达水平
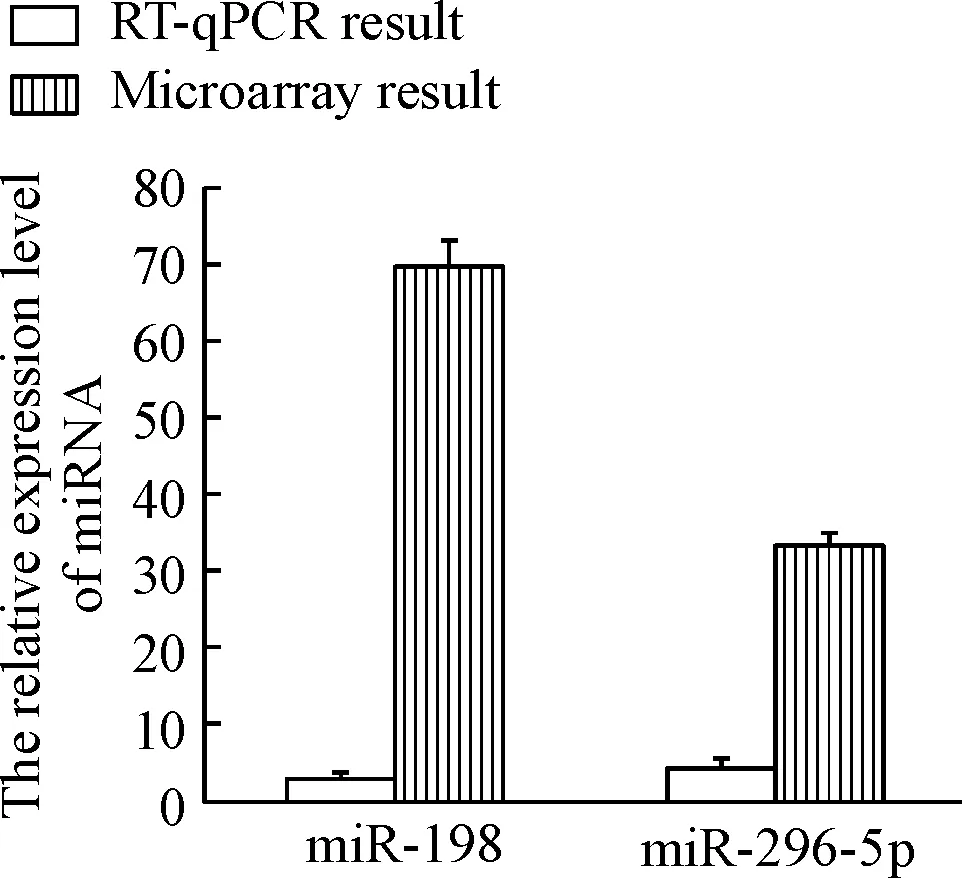
Figure 2.Validating the results of microarray miRNA expression by RT-qPCR.
图2 RT-qPCR验证miRNA表达量并与miRNA芯片结果对比
4 miRNA-198和miRNA-296-5p靶基因的预测及生物学功能分析
采用miRWalk、MicroT、miRanda、miRBridge以及TargetScan等12个数据库对这2条miRNAs的靶基因进行预测,选择7个或以上数据库出现的靶基因,结果显示miRNA-198有859个靶基因,miRNA-296-5p有906个靶基因。下一步通过Fisher Exact检验对这些可能被调控的靶基因进行Gene Class、GO分析及KEGG信号通路分析/富集分析,发现miRNA-198和miRNA-296-5p的靶基因基因功能主要涉及转录因子、拷贝数变异、细胞分化、癌基因、蛋白激酶、组蛋白、转移癌基因、肿瘤抑制基因等(P<0.05)。随后将这些基因分别投射至GO分析的细胞组分、分子功能和生物学过程三大应用功能上,miR-198分别得到90条、 94条及213条相关注释描述, 主要参与细胞质、细胞核、高尔基体、细胞连接、核仁、内质网膜、质膜组成部分、高尔基膜等细胞组分形成;与蛋白结合、ATP结合、锌离子结合、蛋白质丝氨酸-苏氨酸激酶活性、蛋白激酶结合、GTP酶激活活性、Rho鸟嘌呤核苷酸交换因子活性、转录因子结合及金属离子结合等分子功能密切相关;主要与小G蛋白介导的信号转导调控、轴突导向、转录依赖性DNA的正调控、RNA聚合酶II启动子的转录调控、转录DNA依赖性蛋白质转运、细胞内信号转导、跨膜运输、神经生长因子受体信号通路、细胞增殖的负调控、神经系发展等生物过程有关。miR-296-5p分别得到106条、115条及248条相关注释描述, 主要参与细胞胞质细胞核、高尔基体、细胞连接、核仁、内质网膜、质膜组成部分、高尔基膜、胞核周区、突触、细胞质囊泡膜等组分形成;主要分子功能与蛋白结合、序列特异性DNA结合转录因子活性、ATP结合、锌离子结合、相同的蛋白结合、蛋白丝氨酸苏氨酸激酶活性、β-连环蛋白结合等有关;与神经生长因子受体信号通路跨膜转运、转录DNA依赖、正调节转录DNA依赖、蛋白磷酸化、从RNA聚合酶Ⅱ启动子转录的正调节、小GTPase介导的信号转导、调节小肠介导的信号转导、调节转录DNA依赖表皮生长因子受体信号通路等密切相关。在GO分析注释分类的基础上,采用已有生物通路数据,对这2条miRNA的靶基因进行生物通路富集分析。结果显示,在通路数据库KEGG中miRNA-198富集于肿瘤通路(35)、Wnt信号通路(27)、胞吞通路(23)、ErbB信号通路(17)、黏着斑通路(23)和黑素生成通路(17)等重要的信号通路中; 而miRNA-296-5p在MAPK信号通路(41)、胞吞通路(24)、轴突导向通路(17)、Wnt信号通路(17)、胰岛素信号通路(15)、钙离子信号通路(21)、黑素生成通路(17)、磷脂酰肌醇信号系统(11)、黏着斑通路(18)和ErbB信号通路(13)等信号通路出现聚集。
讨 论
结肠癌是一种早期阶段诊断较难,预后较差的,严重威胁人类健康的恶性肿瘤,据报道2015年结肠癌在我国发病率和致死率在所有肿瘤中排第5位[11]。目前治疗该癌最多应用的是化疗,但因为化疗药物的副作用、癌细胞对药物的耐药性等原因,治疗结果不太理想。虽然最近在结肠癌诊断及治疗方面获得了不少成就,但为了提高治疗效率和诊断的精确性发现新的治疗靶点和预后指标仍然是一个研究重点。miRNA是一种转录后水平调节基因表达的非编码RNA,它的异常表达会影响靶基因发挥正常功能,从而引起其靶基表达的改变,参与个体发育、细胞凋亡、增殖及分化等生命活动[12]。据报道超过50%的 miRNAs 位于肿瘤相关的基因组区域或脆性位点,其异常表达有关于肿瘤发生和发展[13]。研究发现多种miRNA参与结肠癌的发生和发展,miRNA-381在结肠癌中下调表达,其下调表达能促进结肠癌增殖和侵袭[14]。下调表达的miRNA-132也能促进结肠癌的发展,可作为结肠癌患者预后的指标[15]。研究还发现过表达的miRNA-128[16]和miRNA-34a[17]可抑制结肠癌细胞的增殖、迁移和侵袭能力。上调表达的miRNA-139-5p能抑制细胞增殖和转移,并且靶向致癌基因NOTCH1促进细胞凋亡和细胞周期停滞而在结肠癌中起关键作用[18]。蜂胶黄酮PB3A对结肠癌细胞具有抑制增殖和诱导凋亡作用[8],本研究中我们通过miRNA芯片技术检测蜂胶黄酮PB3A处理前后SW480细胞中miRNA表达量变化,探讨miRNA在蜂胶黄铜PB3A抗癌作用中起的作用。
根据前期研究结果[8]我们选择了PB3A浓度100 mg/L、处理时间 24 h 为miRNA芯片分析的处理条件, 观察PB3A处理前后SW480细胞中miRNA 表达谱的变化,发现药物处理后结肠癌SW480细胞内267条miRNA表达量发生显著差异。这些PB3A相关差异表达的 miRNAs 中上调表达的miRNA-198(差异倍数69.59223)和miRNA-296-5p(差异倍数33.35)通过RT-qPCR实验检测表达情况时,结果与miRNA芯片结果一致,表明PB3A对结肠癌细胞miRNA表达量有影响。
研究发现在前列腺癌中miRNA-296-5p通过直接靶向Pin1抑制细胞增殖和非依赖性生长[19]。在非小细胞肺癌中miRNA-296-5p通过直接靶向 PLK1,调节其表达起肿瘤抑制作用[20]。Elfimova等[21]研究结果显示miRNA-198充当肿瘤抑制基因通过镇压有丝分裂和无丝分裂通路递减肝癌细胞生长和迁移。在大肠癌中miRNA-198表达下调,其下调显著与大肠癌严重程度有关。它通过以FUT8为靶点抑制大肠癌增殖和侵袭[22]。又有研究发现miRNA-198在体内和体外以SHMT1为靶点抑制肺癌细胞增殖[23]。
miRNA是通过调控其靶基因表达而发挥作用的,因此我们首先预测了这2条miRNAs的靶基因,预测结果显示miRNA-198有859个,miRNA-296-5p有906个靶基因。所以下一步为了探究miRNA-296-5p和miRNA-198在结肠癌细胞内起的作用对它们的靶基因进行功能富集分析。Gene Class分析发现,这2条miRNA靶基因的主要功能聚集转录因子,拷贝数变异,细胞分化,癌基因,蛋白激酶,组蛋白,转移癌基因,肿瘤抑制基因等方面。进行KEGG通路分析发现miRNA-198在肿瘤通路、Wnt信号通路、胞吞通路、ErbB信号通路、黏着斑通路、黑素生成通路等信号通路中,miRNA-296-5p在MAPK信号通路、胞吞通路、轴突导向通路、Wnt信号通路、胰岛素信号通路、钙离子信号通路等信号通路中出现聚集。这2条miRNAs靶基因的转录因子、拷贝数变异、细胞分化等基因功能在癌症发生和发展中起重用,并且这些靶基因参与肿瘤通路、Wnt信号通路、MAPK 信号通路、胞吞通路、ErbB信号通路、钙离子信号通路等肿瘤发生与发展密切相关的信号转导途径,提示miRNA-296-5p和miRNA-198通过靶向调控其靶基因在PB3A抗肿瘤作用中起重要的作用。
本研究确认了结肠癌细胞中蜂胶黄酮PB3A作用下miRNA-198和miRNA-296-5p会差异表达,并预测了这2个miRNA靶基因和相应靶基因在结肠癌中可能的作用。这为今后的通过miRNA诊断和治疗结肠癌提供更丰富的资料。但这些应用生物信息学分析而获得的结果还需要通过进一步靶基因功能验证来确认。
[1] Turrin A, Zorzi M, Giorgi Rossi P, et al. Colorectal cancer screening of immigrants to Italy. Figures from the 2013 National Survey[J]. Prev Med, 2015, 81:132-137.
[2] Fitzmaurice C, Dicker D, Pain A, et al. The global burden of cancer 2013[J]. JAMA Oncol, 2015, 1(4):505-527.
[3] Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function[J]. Cell, 2004, 116(2):281-297.
[4] 孙栋勋,黄栋栋, 金巧智,等. miRNA-7介导Bax和Bcl-2表达对人鼻咽癌CNE-1细胞凋亡的影响[J]. 中国病理生理杂志, 2016, 32(5):933-937.
[5] Uziel O, Lahav M. Proteomic and microRNA data clari-fying the effects of telomere shortening on cancer cells[J]. Data Brief, 2015, 2:48-51.
[6] Michael MZ, O’ Connor SM, van Holst Pellekaan NG, et al. Reduced accumulation of specific microRNAs in colorectal neoplasia[J]. Mol Cancer Res, 2003, 1(12):882-891.
[7] 木塔力甫·艾买提, 盛 磊, Abulizi Abudula, 等. 蜂胶黄酮Pinobanksin-3-acetate对结肠癌HCT-116细胞增殖及凋亡的影响[J].科技导报, 2015, 33(9):69-73.
[8] Amet M, Abudula A, Akela A, et al. Anticancer activity of propolis flavonoid pinobanksin-3-acetate against human colon cancerinvitro[J]. Int J Biosci, 2015, 7(2):45-55.
[9] 其曼古丽·吐尔洪. 蜂胶黄酮PB3A对人肿瘤细胞增殖抑制作用的研究[D]. 乌鲁木齐: 新疆大学, 2015.
[10]其曼古丽·吐尔洪, 木塔力甫·艾买提, 夏米西丁·阿不都热依木, 等. 蜂胶黄酮Pinobanksin-3-acetate对人肝癌HepG-2和肝正常L02细胞增殖和凋亡的影响[J].天然产物研究与开发, 2016, 28(2):216-221.
[11]Chen WQ, Zheng R, Baade PD, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin, 2016, 66(2):115-132.
[12]Dong WH, Li Q, Zhang XY, et al. Deep sequencing identifies deregulation of microRNAs involved with vincristine drug-resistance of colon cancer cells[J]. Int J Clin Exp Pathol, 2015, 8(9):11524-11530.
[13]邓晰月, 洪文旭, 吴运妙, 等. 姜黄素对HeLa细胞增殖、迁移及miRNA表达谱的影响[J]. 中国妇幼保健, 2015, 30(26):4554-4558.
[14]尹 慧, 王 伟, 张 强, 等. MicroRNA-381 的表达下降促进结肠癌的增殖与侵袭[J]. 西南国防医药, 2016, 26(7): 697-700.
[15]赵继明, 彭 健. MicroRNA-132 在结肠癌中的表达及其临床意义[J]. 中国现代医学杂志, 2016, 26(5): 48-52.
[16]曹跃鹏, 庞洪双, 陈 成, 等. miR-128抑制结肠癌侵袭转移的机制研究[J]. 浙江医学, 2016, 38(6):402-404.
[17]庄 彪, 闵志均, 王廷峰, 等. miRNA-34 a对人结肠癌细胞 HCT116增殖及侵袭转移的影响[J]. 实用癌症杂志, 2016, 31(2):179-182.
[18]Zhang L, Dong Y, Zhu N, et al. microRNA-139-5p exerts tumor suppressor function by targeting NOTCH1 in colorectal cancer[J]. Mol Cancer, 2014, 13(1):1-12.
[19]Lee KH, Lin FC, Hsu TI, et al. MicroRNA-296-5p (miR-296-5p) functions as a tumor suppressor in prostate cancer by directly targeting Pin1[J]. Biochim Biophys Acta, 2014, 1843(9):2055-2066.
[20]Xu C, Li S, Chen T, et al. miR-296-5p suppresses cell viability by directly targeting PLK1 in non-small cell lung cancer[J]. Oncol Rep, 2015, 35(1):497-503.
[21]Elfimova N, Sievers E, Eischeid H, et al. Control of mitogenic and motogenic pathways by miR-198, diminishing hepatoma cell growth and migration[J]. Biochim Biophys Acta, 2013, 1833(5):1190-1198.
[22]Wang M, Wang J, Kong X, et al. MiR-198 represses tumor growth and metastasis in colorectal cancer by targeting fucosyl transferase 8[J]. Sci Rep, 2014, 4:6145.
[23]Wu S, Zhang G, Li P, et al. miR-198 targets SHMT1 to inhibit cell proliferation and enhance cell apoptosis in lung adenocarcinoma[J]. Tumor Biol, 2016, 37(4):5193-5202.
(责任编辑: 陈妙玲, 罗 森)
Expression of miRNA-198 and miRNA-296-5P in PB3A-treated colon cancer cell line and its function prediction
Ghunichigul ABAQ, Maynur DAWUT, Yimit RAHMAN, Aynur YUSUP, Wureyatiguli KEWEIER, Marjangul ABLITIP
(CollegeofLifeScienceandTechnology,XinjiangUniversity,Urumqi830046,China.E-mail: 3081599679@qq.com)
AIM: To explore the effect of pinobanksin-3-acetate (PB3A) on microRNA (miRNA) expression profile of human colon cancer cells for providing new methods of treatment of colon cancer and development of targeted drug. METHODS: The method of miRNA expression profiling was used to observe the miRNA differential expression in human colon cancer SW480 cells after treated with PB3A. The expression of miRNA-198 and miRNA-296-5p in the SW480 cells was detected by RT-qPCR. The network databases of miRWalk, MicroT, miRanda and so on were used to predict the target genes regulated by these miRNAs, and pathway significant enrichment analysis was performed. RESULTS: miRNA microarray analysis showed that after treated with propolis flavonoid PB3A for 24 h, 267 miRNAs with differential expression twice or more in the SW480 cells were observed. Among them, there were 30 miRNAs with 10-fold or more differential expression, in which 28 were up-regulated and 2 were down-regulated. The results of RT-qPCR showed that the expression levels of miRNA-198 and miRNA-296-5p were consistent with the results of miRNA microarray analysis, and the difference was statistically significant (P<0.05). Bioinformatic analysis revealed that miRNA-198 has 859 target genes, and miRNA-296-5p has 906 target genes. The target genes of miRNA-198 were clustered in pathways in cancer, axon guidance, Wnt signaling pathway, regulation of actin cytoskeleton, insulin signaling pathway and MAPK signaling pathway, while the target genes of miRNA-296-5p were clustered in axon guidance, Wnt signaling pathway, MAPK signaling pathway, endocytosis, melanogenesis, insulin signaling pathway and calcium signaling pathway. CONCLUSION: Propolis flavonoid PB3A affects the expression of miRNA in colon cancer SW480 cells. The abnormal expression of miRNA-198 and miRNA-296-5p may be involved in the inhibitory effect of PB3A on colon cancer.
Pinobanksin-3-acetate; Colon cancer SW480 cells; MicroRNA-198; MicroRNA-296-5p
1000- 4718(2017)07- 1317- 06
2016- 12- 05
2017- 03- 31
国家自然科学基金资助项目(No. 31660333)
R730.23
A
10.3969/j.issn.1000- 4718.2017.07.027
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 13999406854; E-mail: 3081599679@qq.com
