Src/Stat3通路在高糖诱导的血管平滑肌细胞增殖及迁移中的作用*
2017-08-07秦逸辉
王 军, 秦逸辉
[厦门大学附属成功医院(解放军第174医院)老年病科, 福建 厦门 361003]
Src/Stat3通路在高糖诱导的血管平滑肌细胞增殖及迁移中的作用*
王 军△, 秦逸辉
[厦门大学附属成功医院(解放军第174医院)老年病科, 福建 厦门 361003]
目的: 探讨Src酪氨酸激酶(Src)/信号转导子和转录激活子3(Stat3)在高糖(HG)诱导的血管平滑肌细胞(VSMCs)增殖和迁移中的作用。方法: 首先将VSMC细胞株A7R5与HG (10~40 mmol/L)共同孵育24 h,MTT法及EdU染色检测VSMCs 增殖,Transwell 小室检测VSMCs 迁移,Western blot检测p-Src、Src、p-Stat3和Stat3的蛋白水平。qPCR检测Stat3靶基因细胞周期蛋白D1(cyclin D1)、Myc、基质金属蛋白酶2(MMP2)及基质金属蛋白酶9(MMP9)的表达。为了进一步证实Src在高糖诱导VSMCs增殖和迁移中的作用,将HG与Src抑制剂saracatinib (100 nmol/L)共同孵育24 h,观察Src对HG诱导VSMCs增殖、迁移及Stat3激活的影响。结果: HG能浓度依赖性地促进VSMCs的增殖及迁移并激活Src和Stat3,上调Stat3靶基因cyclin D1、Myc、MMP2及MMP9的表达。抑制Src激活可抑制HG诱导的VSMCs增殖及Stat3的激活,同时下调cyclin D1及Myc的表达。结论: Src/Stat3通路可能在HG诱导的VSMCs增殖及迁移中发挥重要作用。
Src酪氨酸激酶; 信号转导子和转录激活子3; 高糖; 血管平滑肌; 细胞增殖; 细胞迁移
糖尿病是冠状动脉粥样硬化性心脏病的独立危险因素之一。据统计,糖尿病患者冠状动脉粥样硬化性心脏病的发病率和死亡率是无糖尿病者的2~4倍,60%~80%的糖尿病患者将死于心血管疾病[1]。血管平滑肌细胞(vascular smooth muscle cells,VSMCs)的增殖和迁移是动脉粥样硬化发生的重要环节及机制[2]。持续的高糖(high glucose,HG)刺激能诱导VSMC的增殖能力,VSMCs迁移至血管内膜导致血管内膜增厚、管腔狭窄[3-4]。Src酪氨酸激酶(Src tyrosine kinase,Src)是一种分子量为60 kD的非受体酪氨酸激酶,是Src激酶家族的成员,在细胞增殖,迁移及生存等方面发挥重要作用[5-6]。既往研究发现血管紧张素Ⅱ(angiotensin Ⅱ,Ang Ⅱ)诱导的VSMCs中Src激活,Src抑制剂能抑制Ang Ⅱ诱导的大鼠血压升高及肌球蛋白轻链激酶激活[5,7]。还有研究发现Src能介导醛固酮诱导的血管炎症反应[8]。信号转导子和转录激活子3(signal transducer and activator of transcription 3,Stat3)是Stat家族的一员,具有调控细胞增殖、迁移和存活的作用,受到Src的调控[9]。既往研究发现白细胞介素1β能激活Stat3并促进血管平滑肌细胞的增殖和迁移[10]。目前,Src/Stat3信号通路在糖尿病血管并发症中的作用尚不明确。本研究将在HG诱导的VSMC增殖及迁移细胞模型中探讨Src/Stat3的作用机制。
材 料 和 方 法
1 主要材料
DMEM细胞培养基、胎牛血清和0.25%胰蛋白酶均购自Gibco;MTT和D-葡萄糖购自Sigma;蛋白定量试剂盒和ECL显影剂购自Thermo;EdU染色试剂盒购自锐博;Transwell 小室购自Corning;Trizol和qPCR引物购自Life technologies;逆转录试剂盒及荧光定量PCR试剂盒购自TaKaRa公司;抗p-Src、Src、p-Stat3、Stat3和GAPDH抗体购自CST。
2 方法
2.1 VSMCs的培养 VSMC细胞系A7R5购自中国科学院细胞库,置于含有10%胎牛血清的DMEM培养基,在37 ℃、5% CO2的细胞培养箱中培养,取3~5代处于对数生长期的细胞进行实验。
2.2 EdU染色 加入不同处理因素刺激24 h后,加入含50 μmol/L EdU的培养基孵育12 h。弃培养液,PBS洗细胞2次。每孔加入100 μL细胞固定液,于脱色摇床室温孵育15 min。去固定液,每孔加入100 μL (2 g/L)甘氨酸脱色摇床孵育5 min,PBS洗1次。每孔加入100 μL渗透剂,脱色摇床孵育10 min,PBS洗1次。每孔加入100 μL的Apollo染色反应液,避光,于脱色摇床室温孵育30 min。加入100 μL渗透剂,脱色摇床上室温孵育10 min。每孔加入100 μL Hoechst 33342反应液,避光,脱色摇床上室温孵育30 min。PBS洗3次,荧光显微镜观察,每孔随机选择3个视野,计算EdU染色阳性细胞比例。
2.3 MTT法检测细胞活力 取对数生长期细胞,以每孔3 000个细胞的密度接种于96孔培养板,培养24 h后换成2% DMEM细胞周期同步化12~24 h。加入不同的处理因素24 h后加入MTT溶液,37 ℃放置4 h,移除孔内所有液体后加入DMSO将细胞中的结晶溶解,用酶标仪在570 nm波长处检测吸光度(A),计算出细胞活力。
2.4 Transwell小室检测细胞迁移 消化A7R5细胞,每个Transwell 小室接种2×104个细胞,孵育24 h 后棉签擦去上室的细胞,4%多聚甲醛固定15 min,DAPI染色10 min,显微镜下取3个随机视野进行拍照计数。
2.5 Western blot实验 6孔板培养细胞,PBS漂洗后收集细胞,加入适量的RIPA裂解液裂解,提取总蛋白用BCA蛋白定量试剂盒定量,样品加入缓冲液,100 ℃、5 min变性,总蛋白上样量为30 μg,用10%的SDS-PAGE分离,半干电转法将蛋白质转移至PVDF膜,5%脱脂奶粉37 ℃封闭1 h后,分别用相应的 I 抗(1∶1 000稀释)4 ℃孵育过夜,TBST洗膜3次后用 II 抗(1∶5 000稀释)在室温孵1 h,TBST 洗膜3次后用ECL化学发光法检测蛋白条带,用GAPDH蛋白条带作为内参照,计算目的条带和内参照条带的灰度值之比。
2.6 实时荧光定量PCR实验 采用qPCR检测mRNA表达水平。每孔加入1 mL Trizol,室温裂解10 min,加入0.2 mL三氯甲烷,剧烈颠倒混匀15 s。静置10 min后4 ℃、 12 000 r/min离心15 min,吸取上层水样层加入0.5 mL异丙醇,颠倒混匀后,25 ℃放置10 min,4 ℃ 12 000 r/min离心15 min,移去上清。1 mL 75%乙醇沉淀RNA,4 ℃、7 500 r/min离心5 min,在防止丢失RNA沉淀的前提下吸尽上清,静置以挥发乙醇。DEPC水30 μL溶解RNA,参照TaKaRa逆转录试剂盒说明书进行逆转录。以GAPDH作为内参照,按SYBR Premix Ex Taq试剂盒说明书进行qPCR检测。Cyclin D1的上游引物为5’-AAC TAC CTG GAC CGT TTC TTG-3’,下游引物为5’-GGG AAT GGT CTC CTT CAT CTT AG-3’;Myc的上游引物为5’-AGC TTC GCT AAC AGG AAC TAT G-3’, 下游引物为5’-CTG CTG TTG CTG GTG ATA GA-3’;基质金属蛋白酶(matrix metalloproteinase,MMP)2的上游引物为5’-CAC CAA GAA CTT CCG ACT ATC C-3’,下游引物为5’-TCC AGT ACC AGT GTC AGT ATC A-3’;MMP9的上游引物为5’-GAG CGT TAC TCG CTT GGA TAA-3’;下游引物为5’-AAT AGG CCT TGT CTT GGT AGT G-3’;GAPDH的上游引物为5’-GGA GAA ACC TGC CAA GTA TGA-3’, 下游引物为5’-TTG AAG TCA CAG GAG ACA ACC-3’。
3 统计学处理
采用SPSS 13.0软件进行统计分析。实验数据以均数±标准差(mean±SD)表示,多组间均数比较采用单因素方差分析,若方差齐则采用LSD法进行两两比较,若方差不齐,则采用Dunnetts T3法进行两两比较,以P<0.05为差异有统计学意义。
结 果
1 HG促进VSMCs增殖
HG能剂量依赖性地增加EdU染色阳性细胞数量,与control组比较差异有统计学显著性(P<0.01)。此外,HG还能浓度依赖性的升高VSMC的细胞活力,与control组比较,10、20和40 mmol/L的HG可剂量依赖性地促进VSMCs增殖,与control组比较差异有统计学显著性(P<0.01),见图1。

Figure 1.High glucose (HG) enhanced VSMC proliferation. A: the representative images of EdU staining (×100); B: the cell viability was detected by CCK-8 assay. Mean±SD.n=3~6.**P<0.01vscontrol group.
图1 高糖诱导血管平滑肌细胞增殖
2 HG诱导VMSCs迁移
由图2可知, HG能剂量依赖性的增加迁移细胞数量,与control组比较差异有统计学显著性(P<0.01),见图2。
3 HG能激活Src/Stat3通路并上调Stat3靶基因的表达
Western blot结果显示HG能显著升高VSMC中p-Src的含量,与control组比较差异有统计学显著性(P<0.01)。HG能剂量依赖性地增加p-Stat3含量,与control组比较差异有统计学显著性(P<0.01)。qPCR检测结果显示HG能显著升高VSMC中Stat3靶基因cyclin D1及Myc mRNA的水平(P<0.05),见图3。
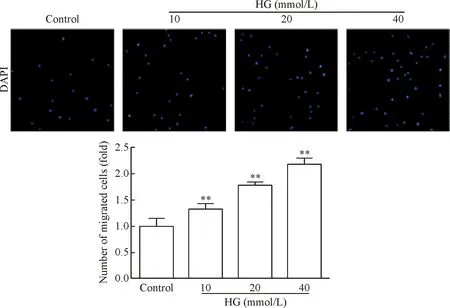
Figure 2.High glucose (HG) induced VSMC migration (×200). Mean±SD.n=3.**P<0.01vscontrol group.
图2 高糖诱导血管平滑肌迁移

Figure 3.High glucose (HG) activated Src/Stat3 pathway and enhanced the expression of Stat3 target genes. A: the representative images and phosporylation levels of Scr and Stat3 detected by Western blot; B: relative mRNA expression levels of cyclin D1, Myc, MMP2 and MMP9. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol group.
图3 高糖激活Src/Stat3通路并升高Stat3靶基因的表达
4 抑制Src部分阻断HG诱导的Stat3激活及其下游靶基因的表达
我们采用Src抑制剂saracatinib验证激活Src在HG诱导Stat3激活中的作用,结果显示,saracatinib(100 nmol/L)和HG(40 mmol/L)共同孵育预处理24 h后,HG和saracatinib共处理组的p-Src和p-Stat3蛋白水平显著低于HG单独处理组,差异有统计学显著性(P<0.01)。我们还进一步验证HG是否通过Src激活Stat3下游靶基因,结果显示。HG与saracatinib共处理组的cyclin D1、Myc、MMP2和MMP9 mRNA表达水平显著低于HG单独处理组(P<0.01),见图4。
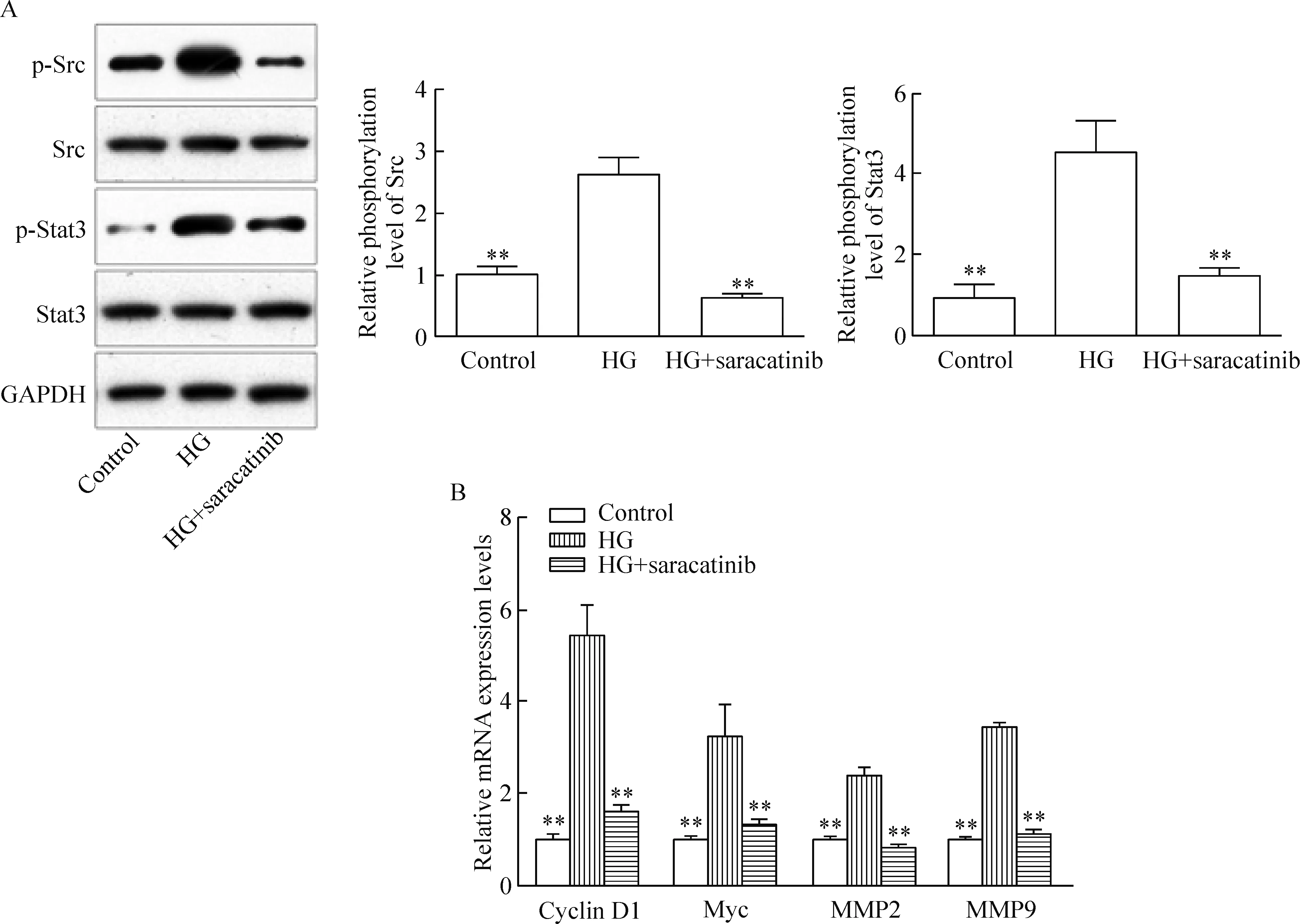
Figure 4.Inhibition of Src partly blocked HG-induced Stat3 activation and the expression of Stat3 target genes. A: the representative images and phosphorylation levels of Src and Stat3 detected by Western blot; B: relative mRNA expression levels of cyclin D1, Myc, MMP2 and MMP9. Mean±SD.n=3.**P<0.01vsHG group.
图4 抑制Src部分阻断了高糖激活Stat3及增加Stat3靶基因表达的作用
5 抑制Src部分阻断HG诱导VSMCs增殖
我们采用Src抑制剂saracatinib验证激活Src在HG诱导VSMCs增殖中的作用。EdU染色结果显示,HG和saracatinib共处理组的EdU阳性细胞数显著减少,与HG组比较差异有统计学显著性(P<0.01)。细胞活力检测结果显示,HG和saracatinib共处理组的细胞活性显著降低,与HG组比较差异有统计学显著性(P<0.01),见图5。
6 抑制Src部分阻断HG诱导VSMCs迁移
我们采用Src抑制剂saracatinib验证激活Src在HG诱导VSMCs迁移中的作用。Transwell检测结果如图6所示, HG和saracatinib共处理组的迁移细胞数显著减少,与HG组比较差异有统计学显著性(P<0.01)。
讨 论
VSMCs增殖加快并由血管中层向内膜迁移是动脉粥样硬化重要机制之一[11]。研究证实HG[12]、氧化低密度脂蛋白[13]、Ang Ⅱ[14]、醛固酮[15]等动脉粥样硬化病理因素均能促进VSMCs的增殖及迁移。还有研究发现,抑制细胞增殖、迁移相关基因能延缓动脉粥样硬化的发展[16]。本研究对HG促进VSMCs增殖及迁移的机制进行探索,对于进一步揭示糖尿病促进动脉粥样硬化发生发展的内在机理有一定的意义。
既往研究发现Ang Ⅱ通过激活Src促进VSMCs增殖及迁移[17]。国内外尚无研究探索Src/Stat3信号通路在HG诱导VSMC增殖及迁移中的作用。首先,本研究利用HG诱导VSMC增殖细胞模型对Src的功能进行了初步研究。我们先采用不同剂量HG刺激24 h后检测VSMCs活力及EdU染色阳性细胞数量,结果显示HG能升高VSMCs活力,增加EdU染色阳性细胞数量。我们还采用Transwell小室检测细胞迁移,结果显示HG能剂量依赖性地促进VSMCs迁移。这些结果提示HG能促进VSMCs增殖及迁移,这与既往研究的结果一致[18-19]。我们进一步检测Src的活性,结果显示HG能剂量依赖性地升高p-Src的表达水平。这提示HG能诱导VSMCs中Src的激活,Src可能在HG诱导的VSMCs增殖中发挥重要作用。接着,我们采用Src抑制剂saracatinib抑制Src激活,验证Src在HG诱导的VSMCs增殖及迁移中的作用,结果显示saracatinib能抑制HG诱导的VSMCs增殖及迁移。这提示Src可能在HG诱导的血管平滑肌增殖及迁移中发挥重要作用。
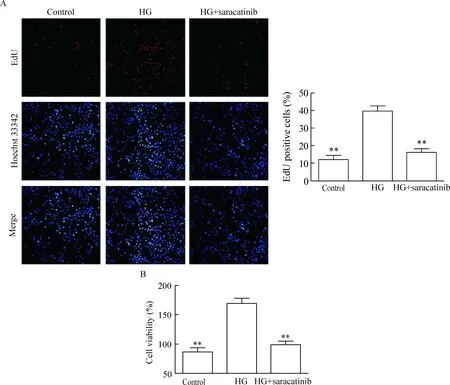
Figure 5.Inhibition of Src partly abolished the pro-proliferative effect of HG on the VSMCs.A: representative images and EdU positive cell ratio after EdU staining (×100); B: the cell viability detected by CCK-8 assay. Mean±SD.n=3~6.**P<0.01vsHG group.
图5 抑制Src部分阻断了高糖促血管平滑肌细胞增殖的作用

Figure 6.Inhibition of Src partly abolished the pro-migratory effect of HG on the VSMCs (×200). Mean±SD.n=3.**P<0.01vsHG group.
图6 抑制Src部分阻断了高糖促血管平滑肌细胞迁移的作用
Stat3是一个具有调控细胞增殖、迁移、存活的作用的转录因子,已被证实与动脉粥样硬化的发展有关[20]。本研究发现HG能升高VSMCs中p-Stat3的水平。我们还发现HG能升高cyclin D1及Myc的表达。Cyclin D1和Myc已被证实是Stat3的靶基因,Stat3能通过上调cyclin D1及Myc的表达促进细胞增殖,MMP2及MMP9具有调控细胞迁移的作用[21]。这些结果提示HG能促进Stat3信号通路的激活。更重要的是,我们还发现抑制Src能抑制HG诱导的Stat3的激活以及上述4个靶基因的表达。这个结果提示HG通过Src激活Stat3信号通路。
在本研究中,我们明确了HG能促进VSMCs增殖、迁移并激活Src/Stat3信号通路。更重要的是我们发现抑制Src能抑制HG诱导VSMCs增殖、迁移及Stat3激活。这提示HG可能通过激活Src/Stat3通路促进VSMCs增殖及迁移。Src/Stat3可能是防治糖尿病动脉粥样硬化并发症的新靶点。
[1] Leon BM, Maddox TM. Diabetes and cardiovascular disease: Epidemiology, biological mechanisms, treatment recommendations and future research[J]. World J Diabetes, 2015, 6(13):1246-1258.
[2] Qiu J, Zheng Y, Hu J, et al. Biomechanical regulation of vascular smooth muscle cell functions: frominvitrotoinvivounderstanding[J]. J R Soc Interface, 2014, 11(90):20130852.
[3] 柴大军, 许昌声, 宁若冰, 等. RXR激动剂通过抑制PKC激活对抗高糖诱导的大鼠血管平滑肌细胞增殖[J]. 中国病理生理杂志, 2013, 29(2): 266-271.
[4] 钱家琦, 钟 赟, 罗翊芝, 等. 黄芪多糖对高糖所致血管平滑肌细胞增殖变化的影响[J]. 中国病理生理杂志, 2009, 25(12):2471-2472.
[5] 项美香, 刘 东. PP60c-Src在血管紧张素II诱导的大鼠血管平滑肌细胞信息转导中的作用(英文)[J]. 中国病理生理杂志, 2005, 21(4): 685-689.
[6] 谢 捷, 龚兴国, 曾冬云. Src蛋白研究进展[J]. 中国病理生理杂志, 2003, 19(8):112-117.
[7] Qin B, Zhou J. Src family kinases (SFK) mediate angiotensin II-induced myosin light chain phosphorylation and Hypertension[J]. PLoS One, 2015, 10(5): e127891.
[8] Callera GE, Yogi A, Briones AM, et al. Vascular proinflammatory responses by aldosterone are mediated via c-Src trafficking to cholesterol-rich microdomains: role of PDGFR[J]. Cardiovasc Res, 2011, 91(4):720-731.
[9] Chen D, Liu J, Rui B, et al. GSTpi protects against angiotensin II-induced proliferation and migration of vascular smooth muscle cells by preventing signal transducer and activator of transcription 3 activation[J]. Biochim Biophys Acta, 2014, 1843(2): 454-463.
[10]王 霄, 杨 易, 刘 洁, 等. JAK2-STAT3信号通路在白细胞介素-1β经动脉外膜给药致平滑肌细胞增殖迁移中的作用[J]. 中国病理生理杂志, 2012, 28(11): 2051.
[11]Bennett MR, Sinha S, Owens GK. Vascular smooth muscle cells in atherosclerosis[J]. Circ Res, 2016, 118(4): 692-702.
[12]Yang J, Chen L, Ding J, et al. MicroRNA-24 inhibits high glucose-induced vascular smooth muscle cell prolife-ration and migration by targeting HMGB1[J]. Gene, 2016, 586(2):268-273.
[13]Lin J, Zhou S, Zhao T, et al. TRPM7 channel regulates ox-LDL-induced proliferation and migration of vascular smooth muscle cells via MEK-ERK pathways[J]. FEBS Lett, 2016, 590(4):520-532.
[14]Ma J, Feng Y, Li Z, et al. The effect of adrenomedullin and proadrenomedullin N-terminal 20 peptide on angiotensin II induced vascular smooth muscle cell proliferation[J]. Iran J Basic Med Sci, 2016, 19(1):49-54.
[15]Yamanaka R, Otsuka F, Nakamura K, et al. Involvement of the bone morphogenetic protein system in endothelin- and aldosterone-induced cell proliferation of pulmonary arterial smooth muscle cells isolated from human patients with pulmonary arterial hypertension[J]. Hypertens Res, 2010, 33(5):435-445.
[16]Mueller MA, Beutner F, Teupser D, et al. Prevention of atherosclerosis by the mTOR inhibitor everolimus inLDLR-/-mice despite severe hypercholesterolemia[J]. Atherosclerosis, 2008, 198(1):39-48.
[17]Bokemeyer D, Schmitz U, Kramer HJ. Angiotensin II-induced growth of vascular smooth muscle cells requires an Src-dependent activation of the epidermal growth factor receptor[J]. Kidney Int, 2000, 58(2):549-558.
[18]Chen J, Dai M, Wang Y. Paeonol inhibits proliferation of vascular smooth muscle cells stimulated by high glucose via Ras-Raf-ERK1/2 signaling pathway in coculture model[J]. Evid Based Complement Alternat Med, 2014, 2014:484269.
[19]裴 星, 韩 勇, 张占华, 等. 芥子酸对高糖诱导下大鼠血管平滑肌细胞增殖和凋亡的影响[J]. 中国病理生理杂志, 2016,32(7): 1174-1179.
[20]Dutzmann J, Daniel JM, Bauersachs J, et al. Emerging translational approaches to target STAT3 signalling and its impact on vascular disease[J]. Cardiovasc Res, 2015, 106(3):365-374.
[21]Teng Y, Ross JL, Cowell JK. The involvement of JAK-STAT3 in cell motility, invasion, and metastasis[J]. JAKSTAT, 2014, 3(1):e28086.
(责任编辑: 林白霜, 罗 森)
High glucose induces vascular smooth muscle cell proliferation and migration through activation of Src/Stat3 signaling pathway
WANG Jun, QIN Yi-hui
(DepartmentofGeratology,ChenggongHospitalofXiamenUniversity,The174thHospitalofPLA,Xiamen361003,China.E-mail:wangjun_xmu@163.com)
AIM: To investigate the role of Src tyrosine kinase (Src)/signal transducer and activator of transcription 3 (Stat3) signaling pathway in high glucose (HG)-induced vascular smooth muscle cell (VSMC) proliferation and migration. METHODS: VSMCs were incubated with HG (10~40 mmol/L) for 24 h. The cell proliferation was detected by MTT assay and EdU staining, while the migration ability of VSMCs was measured by Transwell assay. The protein levels of p-Src, Src, p-Stat3, Stat3 and GAPDH were determined by Western blot. The mRNA expression levels of cyclin D1, Myc, matrix metalloproteinase 2 (MMP2) and matrix metalloproteinase 9 (MMP9) were detected by qPCR. To further confirm the role of Src in HG-induced VSMC proliferation, the VSMCs were exposed to HG (40 mmol/L) and co-treated with Src inhibitor saracatinib (100 nmol/L) for 24 h, and then the proliferation ability and the Stat3 activity of the cells were analyzed. RESULTS: Treatment with HG dose-dependently enhanced the cell viability, increased the ratio of EdU-positive cells, and raised the migration cell number, the protein levels of p-Src and p-Stat3 and the mRNA levels of cyclin D1, Myc, MMP2 and MMP9. Inhibition of Src inhibited HG-induced VSMC proliferation and migration, and suppressed Stat3 activation and the expression of Stat3 target genes cyclin D1, Myc, MMP2 and MMP9. CONCLUSION: Src/Stat3 signaling pathway might play an important role in HG-induced VSMC proliferation and migration.
Src tyrosine kinase; Signal transducer and activator of transcription 3; High glucose; Vascular smooth muscle cells; Cells proliferation; Cells migration
1000- 4718(2017)07- 1237- 07
2016- 08- 03
2017- 05- 17
南京军区医药卫生科研基金(No. 11MA073)
R587.1; R363.2
A
10.3969/j.issn.1000- 4718.2017.07.014
杂志网址: http://www.cjpp.net
△通讯作者 Tel: 0592-63355555; E-mail: wangjun_xmu@163.com
