多发巨大后肾腺瘤1例
2017-08-07方艳琼李文智夏丽娟
方艳琼 李文智 夏丽娟
多发巨大后肾腺瘤1例
方艳琼 李文智 夏丽娟
肾肿瘤;腺瘤;体层摄影术,X线计算机;病理学,外科;诊断,鉴别;病例报告
1 病例简介
男,60岁,体检B超发现左肾占位1周,无发热,无腰痛、血尿、尿频、尿痛等。CT检查见图1A~F,诊断为左肾多发巨大占位,肾癌可能。CT平扫示左肾上、下极各见一巨大类圆形混杂密度肿块,大小分别为10.2 cm×13.5 cm× 12.6 cm和8.8 cm×13.9 cm×13.5cm。术中见肿块突出于肾表面,上极及下极各见一巨大肿块,肿块与周围组织分界清楚,见包膜,质韧,疑诊肾癌,行左肾及肿瘤切除,送病理检查。病理镜下显示肿瘤细胞呈圆形或卵圆形,小而一致,分化成熟,无明显异型性,未见核分裂象,肿瘤细胞密集排列呈腺泡状、小管状结构(图1G)。病理诊断为左肾多发后肾腺瘤(metanephric adenoma,MA)。
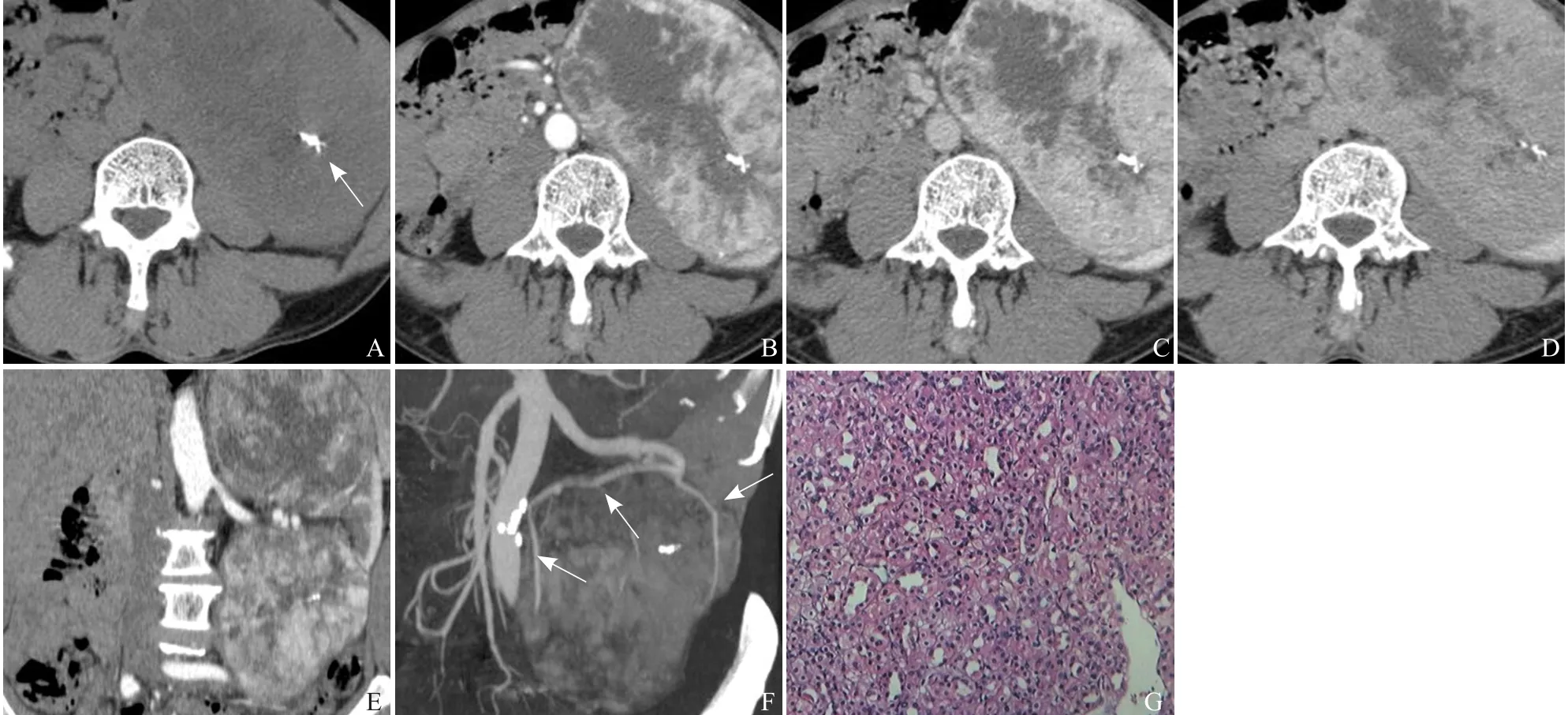
图1 左肾多发MA。CT平扫示左肾上、下极各见一巨大类圆形混杂密度肿块,边界清楚,密度不均,内见大片状低密度影及点结状钙化(箭,A);CT增强扫描动脉期肿块明显不均匀强化,边缘见粗大的供血动脉,强化程度接近肾皮质强化,内见斑片状、星芒状低密度影(B);静脉期肿块强化低于肾皮质,边界更为清楚(C);分泌期肿块内低密度区逐步缩小,呈渐进性延时强化(D);多平面重组显示肿块的位置与邻近器官的关系,左肾皮质受压呈新月形,左侧肾盂、肾盏受压变形,未见明显侵蚀破坏,左肾静脉内未见充盈缺损,腹腔内及腹膜后未见明显肿大淋巴结;多平面重组更加清楚直观地显示肿块的位置(E);CT血管成像示肿瘤由左肾动脉供血,肿瘤血管呈“抱球征”(箭,F);病理镜下显示肿瘤细胞呈圆形或卵圆形,小而一致,分化成熟,无明显异型性,未见核分裂象,肿瘤细胞密集排列呈腺泡状、小管状结构(HE,×10,G)
2 讨论
MA是一种非常罕见的肾脏上皮源性良性肿瘤,1992年由Brisigotti等[1]以MA命名,并认为其可能是Wilms瘤的良性对应体。1996年将MA归入良性肾脏腺瘤[2]。1998年WHO肾脏肿瘤分类中指出,肾腺瘤是来源于肾脏上皮组织的良性肿瘤,包括肾嗜酸细胞腺瘤、肾乳头状腺瘤、MA,以MA最为罕见。2004年WHO肿瘤分类中将MA、后肾腺纤维瘤及后肾基质瘤归为一类,统称为后肾源性肿瘤[3]。
MA可发生于任何年龄,发病率为0.2%~1.0%,以成年女性多见,男女比例为1∶2,好发年龄40~60岁,偶见于儿童,一般为单发[4]。通常为体检或意外发现,无明显临床症状,少数患者可有腰腹部疼痛,扪及包块,无痛性肉眼或镜下血尿,泌尿系感染,还可出现红细胞增多症、高钙血症、高血压等[5-8]。本病目前以个案报道为主,主要发生于肾脏皮质,呈圆形或类圆形,单侧单发多见[9-11]。本例为左肾多发,临床较少见。
MA缺乏特征性临床及影像学表现,术前极易误诊为肾癌。文献报道多数MA的CT表现为肿块呈类圆形或椭圆形,边缘清楚,平扫密度较均匀,相对于周围正常肾实质呈等密度或稍高密度;增强扫描早期实质部分无强化或轻度强化,增强扫描后期及延迟期实质部分强化明显,其强化方式为渐进性不均匀强化,肿瘤较大时易发生囊变、出血坏死。郑吟诗等[12]报道的1例MA动脉期呈明显不均匀强化,与本例强化方式相似。本例CT增强扫描动脉期呈明显不均匀强化,并见粗大供血动脉呈“抱球征”,静脉期及分泌期瘤内低密度区逐步缩小,呈渐进性延时强化,与正常肾皮质分界清楚,肾血管、肾盂肾盏未见明显侵蚀破坏,并无肾脏恶性肿瘤“快进快出”的强化特点及侵袭性表现。误诊的主要原因为多发MA极为罕见,对本病的临床及影像学表现认识不足。
MA术前诊断较为困难,与肾癌难以鉴别。大多数MA增强扫描呈轻至中度强化,与乏血供肾癌鉴别困难,确诊必须依靠病理学检查。巨大MA需与肾母细胞瘤鉴别。肾母细胞瘤多见于儿童,而MA常见于成人,且MA不具有肾母细胞瘤的侵袭性生长的特征。若肾脏肿块较大,边界清楚,平扫密度不均,其内可伴有钙化,增强扫描呈不均匀强化,中央见星芒状低密度区伴有渐进性延时强化,对周围器官推移压迫,无明显侵犯及转移,且无临床症状时,应考虑到MA的可能。
MA是罕见的肾脏良性肿瘤,临床表现及影像学检查缺乏特征性,术前难以明确诊断,大多数误诊为肾癌而行根治性全肾切除,确诊需依靠病理学检查。影像学检查主要显示肿瘤位置、形态、大小、密度以及与邻近组织的结构关系,有无淋巴结及远处转移等信息。目前,一般认为MA为良性肿瘤,预后良好。若术前能明确诊断,治疗上首选采取保留肾单位手术,但也有文献报道可伴有淋巴结转移或伴有其他恶性细胞成分[13-14]。故术后应长期密切随访。
[1]Brisigotti M, Cozzutto C, Febbretti G, et al. Mnephric adenoma. Histol Histopathol, 1992, 7(4): 689-692.
[2]Kovacs G, Akhtar M, Beckwith BJ. The Heidelberg classification of renal cell tumours. J Pathol, 1997, 183(2): 131-133.
[3]Hirabayashi K, Yasuda M, Osamura RY, et al. Ovarian nongestational choriocarcinoma mixed with various epithelial malignancies in association with endometriosis. Gynecol Oncol, 2006, 102(1): 111-117.
[4]Jones EC, Pins M, Dickersin GR, et al. Metanephric adenoma of the kidney. A clinicopathological, immunohistochemical, flow cytometric, cytogenetic, and electron microscopic study of seven cases. Am J Surg Pathol, 1995, 19(6): 615-626.
[5]李红, 全昌斌. 后肾腺瘤1例. 中国医学影像技术, 2010, 26(8): 1526.
[6]季倩, 沈文, 祁吉. 后肾腺瘤1例报告. 实用放射学杂志, 2006, 22(12): 1564-1565.
[7]Yoshioka K, Miyakawa A, Ohno Y, et al. Production of erythropoietin and multiple cytokines by metanephric adenoma results in erythrocytosis. Pathol Int, 2007, 57(8): 529-536.
[8]Mahoney CP, Cassady C, Weinberger E, et al. Humoral hypercalcemia due to an occult renal adenoma. Pediatr Nephrol, 1997, 11(3): 339-342.
[9]史玉书, 冯湛, 杨虹, 等. 后肾腺瘤的CT和MRI影像学表现(附11例报告及文献复习). 临床放射学杂志, 2014, 33(9): 1372-1375.
[10]尹春红, 刘凯, 朱铭. 儿童后肾腺瘤1例. 中国临床医学影像杂志, 2016, 27(2): 150-151.
[11]张兆林, 王晓宁, 邹晓峰, 等. 后肾腺瘤1例报告并文献复习.微创泌尿外科杂志, 2016, 5(2): 104-107.
[12]郑吟诗, 高剑波, 郭华. 后肾腺瘤的CT诊断. 放射学实践, 2011, 26(4): 439-441.
[13]Kumar S, Mandal AK, Acharya NR, et al. Laparoscopic nephronsparing surgery for metanephric adenoma. Surg Laparosc Endosc Percutan Tech, 2007, 17(6): 573-575.
[14]Drut R, Drut RM, Ortolani C. Metastatic metanephric adenoma with foci of papillary carcinoma in a child: a combined histologic, immunohistochemical, and FISH study. Int J Surg Pathol, 2001, 9(3): 241-247.
R445.3;R737
2017-01-10
2017-03-20
(本文编辑 闻 浩)
10.3969/j.issn.1005-5185.2017.07.022
云南省曲靖市第一人民医院放射科 云南曲靖 655000
李文智 E-mail: lwz7910@126.com
