动态增强磁共振与扩散张量成像对前列腺中央区良恶性结节的诊断价值
2017-08-07宋惠贞SONGHuizhen张ZHANGLin
宋惠贞 SONG Huizhen张 林 ZHANG Lin
动态增强磁共振与扩散张量成像对前列腺中央区良恶性结节的诊断价值
宋惠贞1,2SONG Huizhen
张 林1ZHANG Lin
目的 研究动态增强磁共振扫描(DCE-MRI)、扩散张量成像(DTI)及两者联合对前列腺中央区良恶性结节的诊断价值。资料与方法 回顾性分析2015年9月-2016年12月在石河子大学医学院第一附属医院行前列腺MRI扫描的49例前列腺中央区有结节样异常信号患者,均行磁共振T2WI、DTI及DCE扫描。经病理学证实,57例中央区结节样本中21例为前列腺癌(PCa)、36例为良性前列腺增生(BPH)。分别测量结节的各向异性分数值、表观扩散系数值、峰值时间、强化率、曲线斜率值,描述时间-信号强度曲线,比较各参数在PCa与BPH之间的差异,并进行受试者工作特性(ROC)曲线分析。结果 PCa组与BPH组的各向异性分数值、表观扩散系数值、峰值时间、曲线斜率值差异均有统计学意义(P<0.05),强化率组间差异无统计学意义(P>0.05);PCa的时间-信号强度曲线类型以速升下降型为主,BPH曲线类型以平台型为主。DCE、DTI及两者联合诊断的ROC曲线下面积分别为0.87(95% CI:0.751~0.942)、0.85(95% CI:0.734~0.933)和0.94(95% CI:0.837~0.983)。结论与DTI及DCE分别诊断前列腺中央区良恶性结节相比,两者联合诊断具有更高的准确性。
前列腺肿瘤;磁共振成像;扩散张量成像;图像增强;病理学,外科;诊断,鉴别
Address Correspondence to: ZHANG Lin E-mail: zhang123ct@sina.com
中国医学影像学杂志
2017年 第25卷 第7期:550-554
Chinese Journal of Medical Imaging 2017 Volume 25 (7): 550-554
近年前列腺癌(prostate cancer,PCa)的病死率呈上升趋势[1]。MR是目前检出PCa癌灶的最佳影像学诊断手段。临床上约30%的PCa与大多数良性前列腺增生(benign prostatic hyperplasia,BPH)均好发于中央区,准确鉴别中央区的PCa与BPH成为一大难点[2]。此外,中央区的瘤灶更易局限于器官内,应用MRI尽早对瘤灶定位及定性诊断不仅便于临床医师在前列腺组织穿刺活检时选择穿刺点,从而提高病理学诊断的灵敏度和特异度;更有利于协助临床及时制订最佳的诊疗策略[3]。近年来,越来越多的MR研究倾向于功能成像技术;然而,扩散张量成像(DTI)大多局限于正常前列腺或外周带PCa的探究,对前列腺中央区结节的研究甚少[4-6]。本文将探讨动态增强(dynamic contrast-enhanced,DCE)半定量参数、DTI定量参数及两者联合应用对前列腺中央区良恶性结节的诊断价值。
1 资料与方法
1.1 研究对象 回顾性分析2015年9月-2016年12月在石河子大学医学院第一附属医院行前列腺MRI扫描并符合标准的49例泌尿外科患者,年龄52~87岁,平均(69.0±9.6)岁。纳入标准:①患者检查序列,包括轴位T2WI、DTI及DCE扫描,并在T2WI图像中发现前列腺中央区有结节样异常信号;②患者MRI扫描后1~2周经穿刺活检证实为PCa或BPH或PCa合并BPH;③患者行MRI检查前,无前列腺穿刺活检史及内分泌治疗或放疗等相关治疗史。本组经前列腺穿刺病理证实:PCa患者19例,年龄52~87岁,平均(69.0±7.3)岁;BPH患者28例,年龄58~81岁,平均(67.5±5.6)岁;2例PCa合并BPH。49例患者的中央区结节共计57例。其中发生于中央区PCa结节21例,设定为PCa组;发生于中央区前列腺增生结节36例,设定为BPH组。
1.2 仪器与方法 采用GE 3.0T 750MR扫描仪及8通道体部专用相控阵线圈,行前列腺T1WI、T2WI、DTI及DCE扫描。患者检查前均适度充盈膀胱取仰卧位。扫描参数:①横轴位T2WI采用快速自旋回波(FSE):TR 10 270 ms,TE 65 ms,层厚3 mm,0间距,视野(FOV)40 cm×40 cm,激励次数 2,矩阵384×384;②横轴位T1WI采用FSE:TR 607 ms,TE 13 ms,层厚 5 mm,0间距,FOV 40 cm×40 cm,激励次数1,矩阵286×320;③横轴位DTI采用单次激发自旋平面回波成像(SEEPI):TR 4600 ms,TE 89 ms, FOV 25 cm×25 cm,矩阵256×256,层厚3.0 mm,0间距,扩散敏感梯度方向数为25,扩散加权系数b=800 s/mm2,激励次数2;
④DCE:造影剂为钆喷替酸葡甲胺(Gd-DTPA),首先使用高压注射器经上肢静脉快速注射(0.2 ml/kg),流速2.0~3.0 ml/s,然后静脉团注10 ml生理盐水冲洗,以保证药物完全引入体内。DCE采用肝脏容积加速采集(liver acquisition with volume acceleration,LAVA)序列,扫描参数:TR 4.3 ms,TE 1.9 ms,层厚3 mm,0间距,FOV 37 cm×37 cm,矩阵256×256。注射造影剂10 s时开始无间断连续扫描20期相,一期15~20 s,预计5~6 min。
1.3 图像分析及数据处理 通过GE AW 4.6工作站Functool MADC软件进行后处理。①DTI数据生成ADC图和FA图。依据T2WI图像上中央区结节样异常信号灶及病理检查对其结节性质的提示,在b=0参数图上选取病灶的最大层面沿其边缘手动描绘感兴趣区(ROI),ROI直径约30 mm,但不超过病灶边缘,同时避开尿道、钙化、囊变坏死灶等,每个病灶测量3次后取平均值,ROI的放置由2名影像诊断主治医师共同决定。对照病理检查结果将测量的表观扩散系数(ADC)和各向异性分数(FA)分为PCa组和BPH组。②DCE数据通过后处理工作站,自动生成时间-信号强度曲线(TIC)。TIC曲线分为3型:I型为缓慢强化型(早期强化后稳定或缓慢强化);II型为平台型(早期强化后出现平台期);III型为速升下降型(早期强化后随即下降)[7]。对TIC曲线进一步计算:①峰值时间(TTP):增强扫描开始至信号强度达最大值的时间;②强化率(SImax)= (SImax-SIpre)/SIPre×100%;③曲线斜率值(R)=(SImax-SIPre)/Tmax。其中SImax为强化峰值的信号强度,SIPre为注药10 s开始扫描时的信号强度。
1.4 统计学方法 采用SPSS 17.0软件、MedCalc处理。PCa组和BPH组的DTI参数(ADC值和FA值)和DCE参数(TTP、SImax、R)进行t检验;DCE扫描TIC曲线类型比较采用多个独立样本非参数检验(K-independent sample),P<0.05表示差异有统计学意义。对DTI定量参数、DCE半定量参数及两者联合采用受试者工作特性(ROC)曲线比较分析。
2 结果
2.1 两组患者DTI与DCE参数比较 PCa组ADC值低于BPH组,FA值高于BPH组,组间比较差异均有统计学意义(P<0.05);组间TTP及R值比较,差异有统计学意义(P<0.05),SImax组间差异无统计学意义(P>0.05)。见表1。
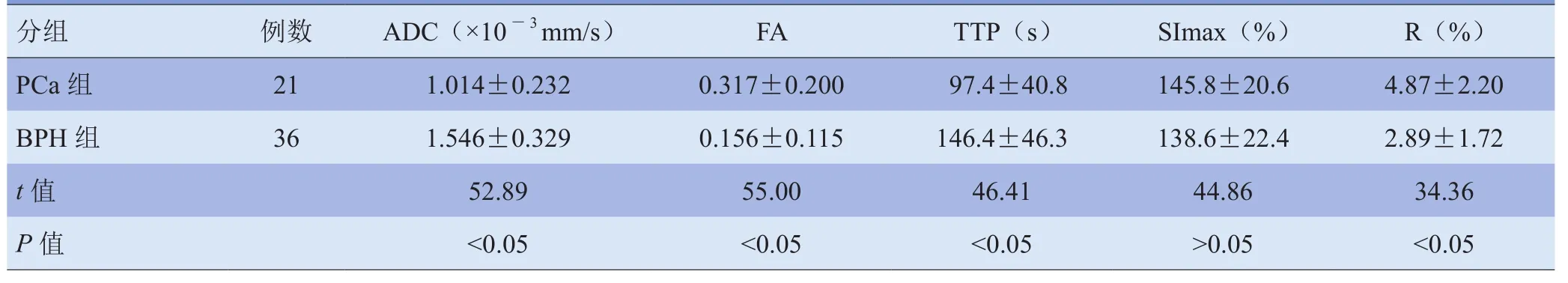
表1 两组患者的DTI及DCE参数比较(x±s)
2.2 两组患者TIC曲线类型比较 DCE扫描PCa中央区结节大多表现为早期明显不均匀强化,而后强化程度显著减低,少数呈持续性强化;BPH组中央区结节也多呈早期明显不均匀强化,而延迟后持续强化,仅5例延迟后强化程度减低。两组患者曲线类型差异有统计学意义(P<0.05)。见表2。
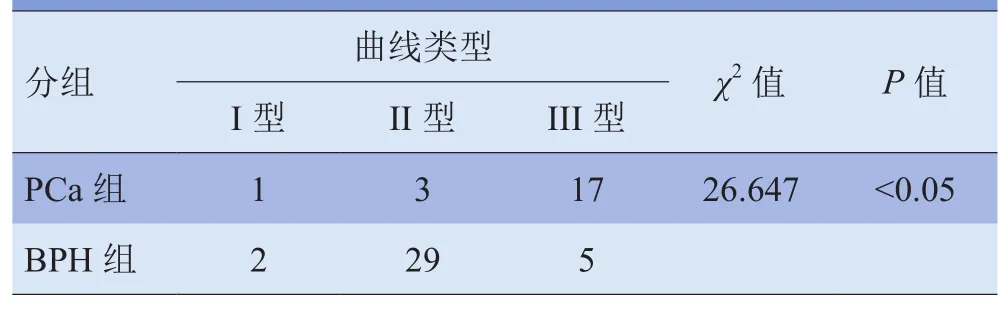
表2 两组患者动态增强TIC曲线类型比较(例)
2.3 DTI、DCE及两者联合诊断价值比较 DTI联合DCE诊断组与DTI组的AUC值比较,差异有统计学意义(Z=1.794,P<0.05);DTI联合DCE诊断组与DCE组的AUC值比较,差异亦有统计学意义(Z=2.367,P<0.05);DTI组与DCE组比较,差异无统计学意义(Z=0.213,P>0.05)。DTI联合DCE诊断组诊断效果最佳(AUC=0.94),其次DTI、DCE诊断组对前列腺中央区良恶性结节鉴别效能均较低。见表3及图1。
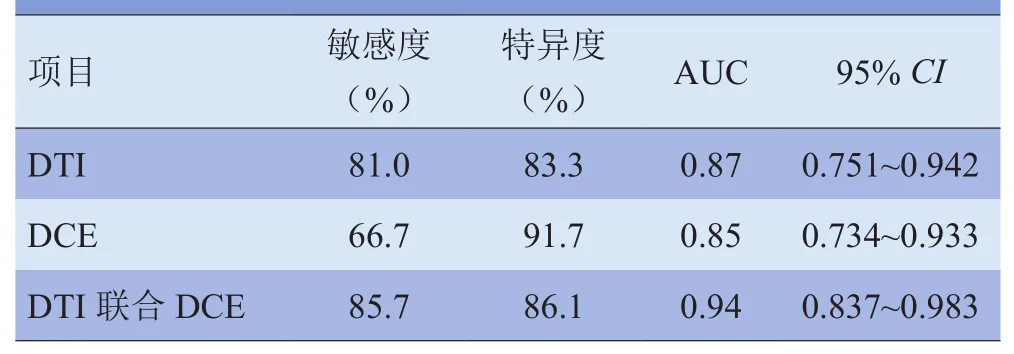
表3 DTI、DCE及两者联合诊断AUC比较
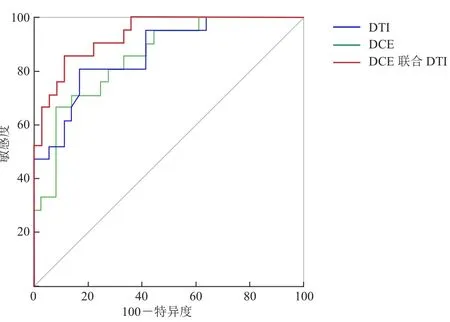
图1 DTI、DCE及两者联合诊断的ROC曲线
2.4 各组患者影像及病理学特征 PCa患者前列腺组织中央区病灶在T2WI上大多呈等、低信号影,ADC图结节大多呈低信号,ADC值低;BPH患者前列腺组织中央区增生结节在T2WI上大多呈高信号、部分呈等或低信号,ADC图大多呈高信号,ADC值较高。中央区PCa和BPH患者的典型T2WI、ADC图、FA伪彩图、TIC曲线及相应病理图,见图2、3。
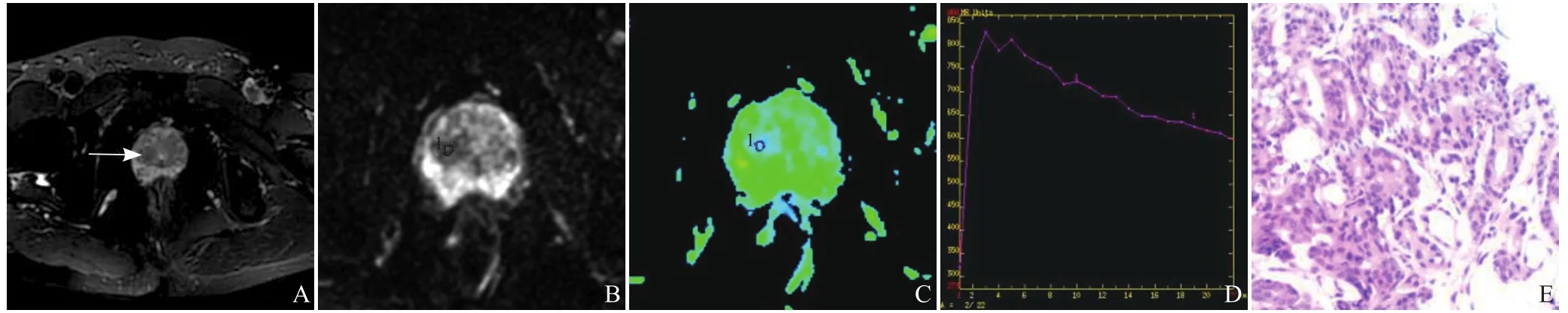
图2 男,62岁,中央区PCa。T2WI图见右侧中央区均匀低信号结节灶(A);ADC图见该结节呈低信号(B);FA伪彩图,复制ROI测量结节的FA值(C);DCE扫描TIC曲线,该结节呈速升下降型(D);前列腺穿刺活检病理染色图:证实为PCa,Gleason评分为3+4=7分(HE,×100,E)
3 讨论
前列腺增生多发生于中央腺体区。增生结节由于成分不同,在T2WI图像上表现为高或低信号。PCa约30%发生于中央腺体,T2WI上大多呈低信号,其与中央区前列腺增生结节在MR常规T2WI序列上均难以鉴别[8]。DTI是在DWI基础上发展起来的一项新技术,除可通过ADC值测定组织内部水分子扩散运动强度外,还可利用参数FA值显示水分子运动的各向异性,更好地推测组织内部微观结构状态的细微变化。
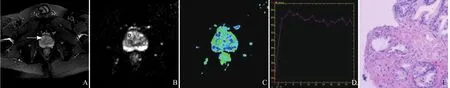
图3 男,68岁,中央区前列腺增生。T2WI图见右侧中央区以高信号为主的混杂信号结节灶(A);ADC图见该结节呈高信号(B);FA伪彩图,复制ROI测量结节的FA值(C);DCE扫描TIC曲线,该结节呈平台型(D);病理证实为良性前列腺增生(HE,×100,E)
3.1 DTI定量参数分析 本研究通过DTI技术测得PCa组ADC值低于BPH组。ADC值反映水分子的扩散程度。肿瘤细胞恶性增殖,致细胞外间隙受压、变小,并使得肿瘤细胞核浆比升高。以上因素限制水分子的扩散,表现为相应的低ADC值。前列腺增生结节的ADC值较高,其原因为微观结构大多以腺体增生为主,腺上皮分泌腺液增多致细胞间质排列疏松,水分子扩散增强,相应ADC值较高;小部分BPH以基质增生为主,水分子自由运动受限,但较肿瘤组织受限程度差别较大[9]。
FA值是在相较于DWI技术的基础上发展起来的一个对水分子扩散运动各项异性程度的定量参数,取值范围0~1。FA值越接近1,表明水分子扩散异性越大。当FA值>0.4时,通常认为组织结构无方向性[10]。FA受肿瘤组织内细胞排列的影响,癌区大量恶性增殖的肿瘤细胞取代了具有正常分泌腺液功能的腺上皮,细胞间质排列、形态失去正常规则,表现为较高的各向异性。本研究中PCa组的FA值显著高于BPH组,与以往研究结论一致[11]。但目前关于FA值的研究尚未达成一致结论。与正常组织相比,癌区FA值相对高[4,6,12-13];而Manenti等[14]的观点与之相反。此外,有研究认为两者之间FA值无差异[15]。目前,FA值的不定性仍然成为争论点,其可能的原因为PCa恶性程度的差异、前列腺局部组织微观结构差别、DTI参数多样化造成不同信噪比对测量结果的影响,以上均有待于进一步研究。
3.2 DCE半定量参数及TIC曲线分析 DCE 技术直接映射组织血流灌注情况。由于肿瘤组织具有丰富的新生血管及高血管渗透性等特点,对比剂能快速并大量进入肿瘤组织,在TIC曲线上呈现“快进快出”特性[16]。本研究PCa组中有17例呈典型速升下降;但有4例呈早期强化后信号减低不明显,与BPH的TIC曲线类型有重叠,其可能的原因之一为BPH合并PCa,中央腺体明显增生,掩盖了癌灶呈现持续强化特点。BPH组有31例呈典型的早期强化后呈平台期或缓慢强化,5例呈强化后迅速下降,与PCa的TIC表现重叠,两者较难鉴别。为此,本研究采用反映对比剂进出病灶速度的半定量参数TTP和R,两者区分中央区PCa及BPH结节差异均有统计学意义。由于发生在PCa与BPH的血供均较正常组织丰富,相应病灶供血区血流量的SImax值在PCa与BPH之间差异无统计学意义,故鉴别诊断意义有限。
3.3 DTI、DCE及两者联合的诊断价值 通过ROC曲线比较DTI、DCE及两者联合对PCa组与BPH组的诊断效能,AUC是衡量某一诊断方法准确性的指标[17]。本研究中3组技术的AUC均>0.8,其中DTI联合DCE技术诊断价值最高,DTI、DCE技术对前列腺中央区良恶性结节的诊断准确性较低。
3.4 本研究的优势及局限性 本试验研究对象设定为前列腺中央区结节,降低了中央区与外周带微观组织结构不同对测量参数所造成的误差,提高了结果的准确度;DCE扫描序列采用LAVA技术进行0间断连续扫描,扫描时相为20~25组,较以往8期相扫描序列相比,能够严密观察病灶强化趋势。但本研究样本量有限,且未对不同级别PCa进行分组;未对位于移行带的PCa癌灶进行比较;DTI的参数单一,有待于采用多b值技术等进一步研究。
[1]Wang XZ, Niu QL, Shen Z, et al. Diffusion tensor imaging in evaluation of benign prostatic hyperplasia: preliminary study. Chin J Magn Reson Imaging, 2010, 1(1): 43-45.
[2]Hoeks CM, Hambrock T, Yakar D, et al. Transition zone prostate cancer: detection and localization with 3-T multiparametric MR imaging. Radiology, 2013, 266(1): 207-217.
[3]Akin O, Sala E, Moskowitz CS, et al. Transition zone prostate cancers: features, detection, localization, and staging at endorectal MR imaging. Radiology, 2006, 239(3): 784-792.
[4]Gürses B, Tasdelen N, Yencilek F, et al. Diagnostic utility of DTI in prostate cancer. Eur J Radiol, 2011, 79(2): 172-176.
[5]Li L, Margolis DJ, Deng M, et al. Correlation of gleason scores with magnetic resonance diffusion tensor imaging in peripheral zone prostate cancer. J Magn Reson Imaging, 2015, 42(2): 460-467.
[6]Gürses B, Kabakci N, Kovanlikaya A, et al. Diffusion tensor imaging of the normal prostate at 3 Tesla. Eur Radiol, 2008, 18(4): 716-721.
[7]陈杰, 任永芳, 曲源. 磁共振LAVA动态增强半定量分析对前列腺癌的诊断价值. 中国CT和MRI杂志, 2016, 14(1): 102-105.
[8]王倩, 房俊芳, 王滨. 磁共振扩散张量成像诊断前列腺癌的理论基础. 磁共振成像, 2015, 6(1): 76-80.
[9]可赞, 王良, 邓明, 等. MR扩散张量成像定量参数FA和ADC值在前列腺移行带结节良恶性分级中的应用价值. 磁共振成像, 2016, 7(5): 332-336.
[10]Jolapara M, Kesavadas C, Radhakrishnan VV, et al. Diffusion tensor mode in imaging of intracranial epidermoid cysts: one step ahead of fractional anisotropy. Neuroradiology, 2009, 51(2): 123-129.
[11]Park SY, Kim CK, Park BK, et al. Diffusion-tensor MRI at 3 T: differentiation of central gland prostate cancer from benign prostatic hyperplasia. Am J Roentgenol, 2014, 202(3): W254-W262.
[12]Reischauer C, Wilm BJ, Froehlich JM, et al. High-resolution diffusion tensor imaging of prostate cancer using a reduced FOV technique. Eur J Radiol, 2011, 80(2): e34-e41.
[13]Gürses B, Tasdelen N, Yencilek F, et al. Diagnostic utility of DTI in prostate cancer. Eur J Radiol, 2011, 79(2): 172-176.
[14]Manenti G, Carlani M, Mancino S, et al. Diffusion tensor magnetic resonance imaging of prostate cancer. Invest Radiol, 2007, 42(6): 412-419.
[15]Xu J, Humphrey PA, Kibel AS, et al. Magnetic resonance diffusion characteristics of histologically defined prostate cancer in humans. Magn Reson Med, 2009, 61(4): 842-850.
[16]宋惠贞, 尹喜, 张林. 磁共振动态增强及扩散加权成像对前列腺癌灶诊断价值的Meta分析. 中国医学影像学杂志, 2016, 24(9): 701-705.
[17]王建华. 流行病学. 第8版. 北京: 人民卫生出版社, 2014: 102-105.
(本文编辑 闻 浩)
Diagnosis of Dynamic Contrast-enhanced Magnetic Resonance Imaging and Diffusion Tensor Imaging in Benign and Malignant Nodules of Central Prostate Gland
Purpose To study the diagnostic value of dynamic contrast-enhanced magnetic resonance imaging (DCE-MRI), diffusion tensor imaging (DTI) and the combination of these two techniques in benign and malignant nodules of central prostate gland. Materials and Methods Forty-nine patients with nodular abnormal signal in central prostate gland who had accepted prostate MRI scan in Shihezi University Medical College First Affiliated Hospital from September 2015 to December 2016 were retrospectively analyzed, and all the subjects had accepted MRI T2WI, DTI and DCE scan. The pathological results confirmed that there were 21 prostate cancer (PCa) and 36 benign prostatic hyperplasia (BPH) among 57 central gland nodule samples. The fractional anisotropy value, apparent diffusion coefficient value, time to peak, SImax, the curve slope and timesignal intensity curve of nodules were respectively detected, the differences of the parameters between PCa group and BPH group were compared, and receiver operating characteristic (ROC) curve analysis was carried out. Results The difference of fractional anisotropy value, apparent diffusion coefficient value, time to peak and R between PCa group and BPH group was statistically significant (P<0.05), and there was no significant difference in SImax (P>0.05); the time-signal intensity curve type of PCa group was mainly in the form of fast-increasing and then decreasing, while the curve type of BPH group was mainly in the form of platform. The area under the ROC curve of DCE, DTI and the combination of DEC and DTI were 0.87 (95% CI: 0.751-0.942), 0.85 (95% CI: 0.734-0.933) and 0.94 (95% CI: 0.837-0.983), respectively. Conclusion In the cases of diagnosing benign and malignant nodules of central prostate gland, the accuracy of DTI and DCE was lower than that of the combination of these two techniques, and the diagnostic effect of DTI combined with DCE was better.
Prostatic neoplasms; Magnetic resonance imaging; Diffusion tensor imaging; Image enhancement; Pathology, surgical; Diagnosis, differential
10.3969/j.issn.1005-5185.2017.07.020
1. 石河子大学医学院第一附属医院MR室新疆石河子 832000
2. 西南医科大学附属医院放射科 四川泸州646000
张 林
Department of MR Room, the First Affiliated Hospital of the Medical College, Shihezi University, Shihezi 832000, China
2016-12-19
修回日期:2017-01-22
R737.25;R445.2
