肺炎链球菌Spr0982的表达纯化及保守性分析
2017-08-02余维丽鹿中华杨翔郑瑶孙昀安徽医科大学第二附属医院重症医学科安徽合肥230601
余维丽,鹿中华,杨翔,郑瑶,孙昀(安徽医科大学第二附属医院重症医学科,安徽合肥230601)
肺炎链球菌Spr0982的表达纯化及保守性分析
余维丽,鹿中华,杨翔,郑瑶,孙昀
(安徽医科大学第二附属医院重症医学科,安徽合肥230601)
肺炎链球菌(Streptococcus pneumoniae)的糖基转移酶是与其耐药性或致病性相关的基因。本文以S.pneumoniae R6菌株基因组为模板,利用PCR克隆S.pneumoniae中的糖基转移酶(spr0982)基因,构建重组p28 (PET28b改造的克隆载体)-Spr0982载体,转化至大肠杆菌BL21-Ril中,利用IPTG诱导表达,并对目的蛋白进行纯化条件的研究。采用ClustalW在线工具对Spr0982蛋白在不同肺炎链球菌菌株中的保守性进行分析。结果显示: p28-Spr0982重组质粒构建成功,经IPTG诱导后于BL21-Ril菌株中获得大量以包涵体形式存在的目的蛋白质;通过QFF阳离子交换柱和分子筛层析获得较纯的可溶目的蛋白;Spr0982蛋白在不同肺炎链球菌中的保守程度高达99.3%。本研究对于理解S.pneumoniae的致病性和耐药机理研究具有指导意义。
肺炎链球菌;Spr0982蛋白;重组表达;保守性;耐药性
肺炎链球菌(Streptococcus pneumoniae),是一种对人类有巨大危害的病原微生物。通常定殖在人的鼻腔中,可以扩散至中耳、肺部或者侵入上皮细胞,进入血脑屏障,可引起局部及全身的感染,从而使宿主患上如败血症、肺炎、脑膜炎、鼻窦炎、中耳炎、关节炎、心内膜炎等多种疾病[1]。抗生素的滥用加剧了肺炎链球菌的耐药性,尤其对作用于细胞壁的β-内酰胺类抗生素的耐药率逐渐上升。因此,对于肺炎链球菌耐药性相关基因的研究也是目前研究的一个热点。
Laible等[2]和Helassa等[3]的研究发现,肺炎链球菌的青霉素耐药性主要是由于β-内酰胺类抗生素的靶蛋白的改变,如青霉素结合蛋白PBP发生了突变。Hakenbeck等[4]的研究表明,在耐药肺炎链球菌株中除了PBP蛋白的突变外,一些其他的非青霉素结合蛋白也发生了突变,也参与β-内酰胺类抗生素药物的耐药。一些糖基转移酶的基因突变与肺炎链球菌耐药相关,如糖基转移酶基因cpo A。在两株耐哌拉西林的肺炎链球菌P106和P104中,发现了cpo A基因的突变,cpo A的突变降低了肺炎链球菌对哌拉西林的敏感性[5]。
基因spr0982编码肺炎链球菌R6中的一个糖基转移酶,与cpo A及其他3个基因位于一个操纵子上。基因spr0982位于cpo A基因的下游,编码一个441个氨基酸的糖基转移酶,属于GT1-YagM类似家族,通常这个家族的成员通过疏水相互作用和电荷作用来锚定膜-细胞质界面[6-7],并且将一个糖单元转移到膜内侧的受体分子上。Spr0982催化转移UDP-葡萄糖中的一个葡糖基至甘油二酯(DAG)上,形成α-单糖甘油二酯(GlcDAG)。而基因cpo A编码肺炎链球菌R6中的另一个糖基转移酶,催化转移UDP-半乳糖中的一个半乳糖基至GlcDAG上,形成α-半乳糖基葡糖基甘油二酯(GalGlcDAG)。体外实验也证明了Spr0982和CpoA参与糖脂的合成,分别起到GlcDAG合成酶和GalGlcDAG合成酶的作用[6-7]。GlcDAG是肺炎链球菌脂磷壁酸的脂锚点,能维持特定的阴离子脂质表面电荷密度来平衡双分子-非双分子层的比例。在肺炎链球菌膜中GlcDAG和GalGlcDAG的比例通常为1∶2.5。spr0982是肺炎链球菌的一个必需基因[8-9]。糖基转移酶Spr0982和CpoA都与肺炎链球菌的细胞壁形成相关[10],且cpo A的突变造成了肺炎链球菌的耐药性,R6Δcpo A的增殖时间(46~48 min)明显比R6野生型时间长,这说明CpoA在肺炎链球菌生长代谢及抗生素耐药过程中都起着非常重要的作用[8]。因此,推测位于cpo A基因下游的糖基转移酶spr0982基因有可能参与肺炎链球菌的毒性和耐药性,是潜在的抗生素药物的靶标。
肺炎链球菌的耐药性已经是不容小觑的一个问题,尤其是对于β-内酰胺类抗生素的耐药率逐渐上升。对于其耐药性相关蛋白的研究也是目前研究的一个热点。糖基转移酶的突变导致了肺炎链球菌荚膜组成的改变,从而影响了肺炎链球菌的毒性及耐药性[11-13]。
目前,关于Spr0982的研究报道并不多,鉴于此,本研究拟对糖基转移酶基因spr0982进行分子克隆,构建重组质粒,转入大肠杆菌中进行IPTG诱导表达,对纯化条件进行摸索,同时在不同肺炎链球菌中进行保守性分析,以期为后续酶活测定等实验提供依据,对筛选研究新型的抗生素靶点提供指导,对理解肺炎链球菌的致病性和耐药性有着重要意义。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
肺炎链球菌R6菌株、大肠杆菌Top10和BL21 (DE3)菌株,原核表达质粒p28均为笔者所在课题组保存。
1.1.2 试剂
细菌基因组DNA抽提试剂盒,北京天根生化科技有限公司;DNA切胶回试剂盒、质粒抽提试剂盒、限制性内切酶(NdeⅠ、XholⅠ),Promega公司;Easy Pfu DNA聚合酶、DNA marker、连接酶Solution I,TaKaRa公司;异丙基-β-D-硫代半乳糖苷(IPTG)、卡那霉素、LB培养基、盐酸胍、NaCl、Tris粉末、咪唑、氯化镍,上海生工生物工程有限公司;镍柱、镍胶、阳离子交换柱QFF及分子筛S200,GE公司。
1.2 方法
1.2.1 目的基因的获取
收集OD600达0.6~0.8的10 mL肺炎链球菌R6菌液,用细菌基因组抽提试剂盒抽提肺炎链球菌R6的基因组。根据NCBI等网站上的靶基因序列(1 323 bp),设计合适的引物(Primer 6.0设计引物),以R6基因组为模板,将spr0982全长构建至由pET28b改造后的p28质粒中,N端带His6-Tag。
引物序列:正向引物5'-CTCCATATG CGAATTGGTTTATTTACAG-3';反向引物5'-GTCCTCGAGC-TATTCTTCATGGTCTTTC-3'(下划线序列为酶切位点)。
PCR反应体系(25μL体系):灭菌ddH2O 18.5 μL,10×Easy Pfu Buffer 2.5μL,dNTPs(2.5 mmol/L) 1μL,基因组1μL,正向引物(8μmol/L)0.5μL,反向引物(8μmol/L)0.5μL,Easy Pfu酶1μL。PCR反应程序:95℃变性10 min,95℃变性45 s,55℃退火45 s,72℃延伸2 min 30 s,30个循环,72℃延伸10 min。
PCR产物经1%的琼脂糖凝胶电泳检测之后进行切胶回收纯化。
1.2.2 重组质粒p28-Spr0982的构建
将回收完毕的目的片段及载体进行NdeⅠ和XholⅠ双酶切反应。之后切胶回收,用连接酶SolutionⅠ进行连接。将连接产物直接转化Top10感受态并涂布于50μg/mL卡那霉素的LB固体培养基平板。第2天挑单菌落于3 mL培养基中培养,待菌液摇至浑浊后取1μL菌液进行PCR验证。选取含有阳性克隆的浑浊菌液,用质粒抽提试剂盒进行质粒抽提。对抽取的质粒用NdeⅠ及XholⅠ进行双酶切验证及质粒PCR验证。经核酸电泳检测是否含有目的条带。选取阳性结果的质粒送至华大基因公司测序来进一步验证重组质粒构建是否成功。
1.2.3 重组Spr0982蛋白的表达
将测序成功的p28-Spr0982质粒转化至大肠杆菌BL21-Ril感受态中,挑选单菌落于液体培养基中培养过夜。再转入500 mL培养基中扩大培养,待OD600达0.6~0.8。用0.2 mmol/L终浓度的IPTG于16℃诱导20 h。12 000 g,离心10 min收菌。用含有20 mmol/L Tris-HCl,pH 8.0,100 mmol/L NaCl的Buffer重悬菌体。重悬的菌体于-80℃中反复冻融3次后,用超声破碎仪对细胞进行充分裂解。将超声后的样品于离心机中4℃、12 000 g离心35 min,收集上清液,经SDS-PAGE检测。
1.2.4 重组Spr0982蛋白的纯化
经检测Spr0982重组蛋白上清中有少量可溶蛋白表达,经多次扩大培养,获得大量目的蛋白用于纯化。由于目的蛋白N端带有6个组氨酸标签,所以首先尝试了镍柱亲和层析,再进行分子筛S200进一步纯化。后来改变纯化方法为QFF阳离子交换柱和分子筛S200,得到的蛋白样品用SDS-PAGE来鉴定。
镍柱亲和层析方法。往镍柱中灌注1 mL镍胶,分别用10 mL的6 mol/L盐酸胍,1 mol/L咪唑20 mL冲洗镍柱,然后补加10 mL 0.1 mol/L的氯化镍。再用20 mL的20 mmol/L Tris-HCl,pH 8.0,100 mmol/L NaCl的Buffer平衡镍柱。取之前离心所得上清上样,然后用含相应缓冲液的50 mmol/L咪唑20 mL洗脱以去除杂蛋白,再用含相应Buffer的6 mL 300 mmol/L咪唑洗脱得到目的蛋白。
QFF阳离子交换层析方法。首先用低盐缓冲液(20 mmol/L Tris-HCl,pH 8.8,20 mmol/L NaCl)来平衡QFF柱(柱体积5 mL),3 mL/min平衡20 min。取之前离心所得上清上样,选择20 mmol/L~1 mol/L NaCl的20 mmol/L Tris-HCl、pH 8.8缓冲液来进行梯度洗脱。选择在280 nm有吸收峰的蛋白用SDS-PAGE鉴定及下一步分子筛纯化。
分子筛S200层析方法。用20 mmol/L Tris-HCl、pH 8.8、50 mmol/L NaCl缓冲液来平衡分子筛S200柱子(柱体积120 mL),1 mL/min平衡140 min,取QFF收集的目的蛋白上样,选择在280 nm有吸收峰的蛋白用SDS-PAGE鉴定。
1.2.5 保守性分析
根据NCBI等网站上的不同肺炎链球菌中GlcDAG合成酶的氨基酸序列,利用ClustalW在线工具对GlcDAG合成酶蛋白在不同肺炎链球菌中的保守性进行分析。
2 结果与讨论
2.1 spr0982目的基因扩增及重组载体构建
通过PCR扩增得到目的片段,进行重组载体构建。首先对PCR扩增得到的结果和重组基因构建进行电泳分析,结果见图1。由图1可知,PCR扩增后的目的条带大小约为1 323 bp(图1(a)),与预测大小相符。将目的片段进行双酶切,然后与p28载体连接,转入Top10菌株中,将阳性克隆经菌液PCR (图1(b))和双酶切验证(图1(c))鉴定,发现酶切片段与扩增片段大小一致,再将目的基因测序。测序结果显示重组载体构建成功。
2.2 重组蛋白的诱导表达
将测序成功的重组质粒转化入大肠杆菌BL21-Ril,挑取单菌落进行扩大培养,经IPTG诱导表达,结果见图2。由图2可知,Spr0982目的蛋白主要以包涵体形式存在,因为上清中有少量可溶蛋白(图2(a)框内为目的蛋白条带)。再将目的蛋白进行Western blotting验证,发现在16℃时诱导表达的上清和沉淀中均有目的蛋白(图2(b))。
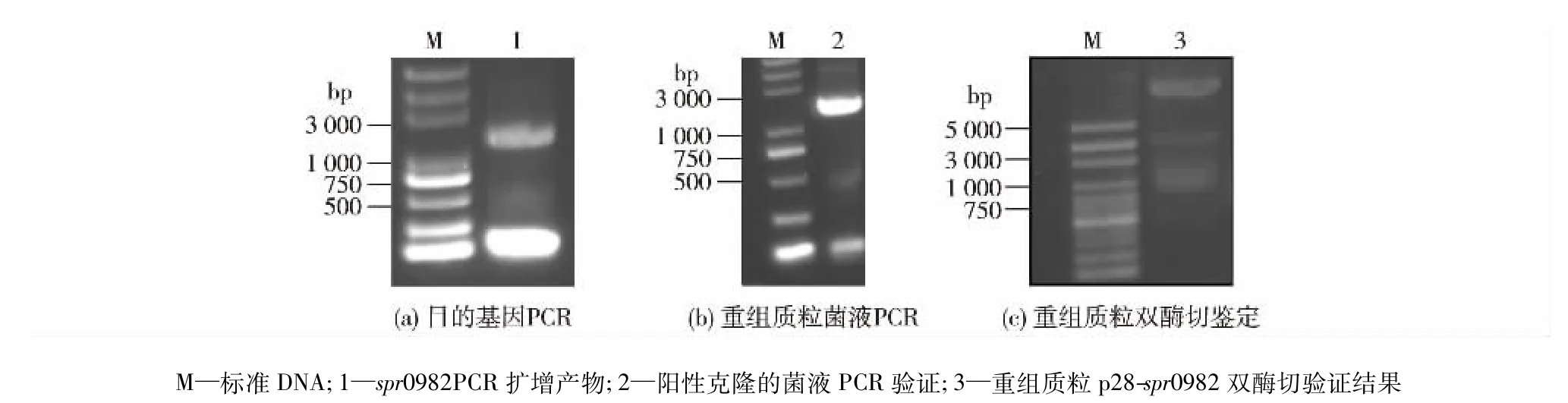
图1 目的基因的扩增(a)、重组质粒菌液PCR(b)与重组质粒双酶切鉴定(c)Fig.1 PCR amplification of target gene(a),bacterial PCR of recombinant plasmid(b)and double enzyme digestion of recombinant plasmid(c)
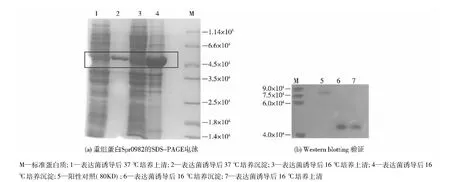
图2 重组蛋白Spr0982的SDS-PAGE电泳和Western blotting验证Fig.2 SDS-PAGE analysis and Western blotting detection of Spr0982
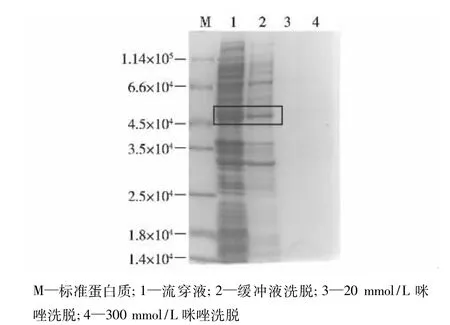
图3 重组蛋白Spr0982镍柱亲和层析的SDS-PAGE电泳图Fig.3 SDS-PAGE detection of nickel column affinity chromatography of Spr0982
2.3 重组蛋白的镍柱亲和层析及分子筛S200纯化
大量培养表达菌株,收集上清中的可溶目的蛋白进行纯化条件的摸索。由于带6个His标签,首先尝试进行镍柱亲和层析,结果见图3。由图3可知,目的蛋白在流穿液和20 mmol/L咪唑的缓冲液中被洗脱出来(图3框内为目的蛋白)。
经镍柱亲和层析及SDS-PAGE检测发现:目的蛋白结合镍的能力很差,大部分目的蛋白在流穿中被洗脱,推测可能N端His被包裹起来从而影响目的蛋白与镍的结合。于是考虑换其他方法来纯化目的蛋白。
2.4 重组蛋白的QFF阳离子交换层析及分子筛S200纯化
重组蛋白经镍柱亲和层析发现效果不佳,于是改变纯化方法为尝试QFF阳离子交换层析初步纯化,并用SDS-PAGE检测,结果见图4和5。由图4和5可见:选取含较多目的蛋白(图4(b)中2、3和4条带,框内为目的蛋白),再用分子筛S200进一步纯化(图5(a))。纯化蛋白经SDS-PAGE检测(图5(b)),显示目的蛋白中的杂蛋白被去除了很多可以得到较纯的目的蛋白(图5(b)中4、5、6、7和9条带,框内为目的蛋白)。
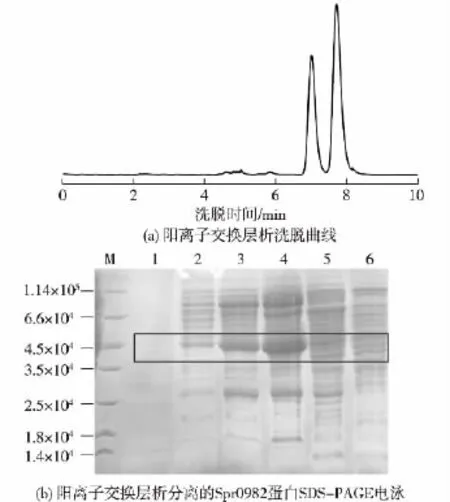
图4 阳离子交换层析(a)及Spr0982蛋白SDS-PAGE电泳图(b)Fig.4 Cation exchange chromatography(a)and SDS-PAGE detection(b)of Spr0982
经QFF及S200纯化后可以得到纯度达到80%左右的目的蛋白,可以用于进行下一步的实验,如分析Spr0982的酶学性质及生理生化特点等。Spr0982催化合成GlcDAG,对肺炎链球菌细胞壁的组成至关重要,其酶学性质对于筛选抑制剂有指导意义。
2.5 蛋白保守性分析
从NCBI蛋白数据库中获得不同型肺炎链球菌GlcDAG合成酶蛋白的氨基酸序列:SPSMRU1009 (AAK99786.1)、HMPREF0837_11410(ADI69638.1)、mgtA(CXF84241.1)、SP_1076(AAK75189.1)、SPH_ 1164(ACA37145.1)、SPD_0961(ABJ53775.1),通过ClustalW在线工具对GlcDAG合成酶(Spr0982)进行了多序列比对,分析其在不同肺炎链球菌菌株中的保守性,结果见图6。
由图6可知,在不同的肺炎链球菌中GlcDAG合成酶的保守性高达99.3%。高保守性的靶蛋白对于筛选杀灭不同型肺炎链球菌的抗生素有重要意义。这些有可能为后续开发和制备GlcDAG合成酶蛋白疫苗及研究新型的抗生素靶标提供依据。

图5 分子筛层析及Spr0982蛋白SDS-PAGE电泳图Fig.5 Sephadex S200 and SDS-PAGE detection of Spr0982
3 结论
通过分子克隆成功构建p28-Spr0982重组质粒,在大肠杆菌中成功表达出了可溶目的蛋白(大量包涵体形式的目的蛋白质),通过多次扩大培养后收集可溶目的蛋白,进行纯化条件的摸索,结合QFF阳离子交换层析和分子筛层析纯化出纯度可达80%的目的蛋白,可供下一步实验。ClustalW在线工具分析得出其在不同肺炎链球菌中具有高度的保守性(99.3%)。
[1]NOBBS A H,LAMONT R J,JENKINSON H F.Streptococcus adherence and colonization[J].Microbiol Mol Biol Rev,2009,73 (3):407-450.
[2]LAIBLE G,HAKENBECK R.Penicillin-binding proteins inβlactam-resistant laboratory mutants of Streptococcus pneumonia[J].Mol Microbiol,1987,1(3):355-363.
[3]HELASSA N,VOLLMER W,BREUKINK E,et al.The membrane anchor of penicillin-binding protein PBP2a from Streptococcus pneumonia influences peptidoglycan chain length[J].FEBS J,2012,279(11):2071-2081.

图6 不同肺炎链球菌中GlcDAG合成酶蛋白(Spr0982)保守性分析Fig.6 Conservation analysis of GlcDAG synthetases from different S.pneumoniae strains
[4]HAKENBECK R,GREBE T,ZHNER D,et al.β-Lactam resistance in Streptococcus pneumoniae:penicillin-binding proteins and nonpenicillin-binding proteins[J].Mol Microbiol,1999,33 (4):673-678.
[5]GREBE T,PAIK J,HAKENBECK R.A novel resistance mechanism forβ-lactams in Streptococcus pneumonia involves CpoA,a putative glycosyltransferases[J].J Bacteriol,1997,179 (10):3342-3349.
[6]LI L,STORM P,KARLSSON O P,et al.Irreversible binding and activity control of the 1,2-diacylglycerol 3-glucosyltransferase from Acholeplasma laidlawii at an anionic lipid bilayer surface[J].Biochemistry,2003,42(32):9677-9686.
[7]EDMAN M,BERG S,STORM P,et al.Structural features of glycosyltransferases synthesizing major bilayer and nonbilayerprone membrane lipids in Acholeplasma laidlawii and Streptococcus pneumonia[J].J Biol Chem,2003,278(10): 8420-8428.
[8]BERG S,EDMANM,LI L,et al.Sequence properties of the 1,2-diacylglycerol 3-glucosyltransferase from Acholeplasma laidlawii membranes:recognition of a large group of lipid glycosyltransferases in Eubacteria and Archaea[J].J Biol Chem,2001,276(25):22056-22063.
[9]SONG J H,KO K S,LEE J Y,et al.Identification of essential genes in Streptococcus pneumonia by allelic replacement mutagenesis[J].Mol Cells,2005,19(3):365-374.
[10]MEIERS M,VOLZ C,EISEL J,et al.Altered lipid composition in Streptococcus pneumonia cpo A mutants[J].BMC Microbiol,2014,14:1-12.
[11]OLIVER M B,VAN DER LINDEN M P,KNTZEL S A,et al.Discovery of Streptococcus pneumonia serotype 6 variants with glycosyltransferases synthesizing two differing repeating units[J].J Biol Chem,2013,288(36):25976-25985.
[12]JAMES D B,GUPTA K,HAUSER J R,et al.Biochemical activities of Streptococcus pneumonia serotype2 capsular glycosyltransferases and significance of suppressor mutations affecting the initiating glycosyltransferase Cps2E[J].J Bacteriol,2013,195(24):5469-5478.
[13]OLIVER M B,JONES C,LARSON T R,et al.Streptococcus pneumonia serotype11D has a bispecific glycosyltransferase and expresses two different capsular polysaccharide repeating units[J].J Biol Chem,2013,288(30):21945-21954.
(责任编辑荀志金)
Expression,purification and conservation analysis of Spr0982 protein from Streptococcus pneumonia R6
YU Weili,LU Zhonghua,YANG Xiang,ZHENG Yao,SUN Yun
(Department of Intensive Care Unit,The Second Affiliated Hospital of Anhui Medical University,Hefei 230601,China)
The glycosyltransferase gene of Streptococcus pneumonia(S.pneumoniae)is related to its drug resistance and pathogenicity.This study was designed to clone the glycosyltransferase gene spr0982 from S.pneumoniae by PCR method with the S.pneumoniae R6 genome DNA as the template.Gene s pr0982 was constructed into p28(modified PET28b)plasmid.Then,p28-Spr0982 plasmid was transferred into E.coli BL21-Ril for induced expression of the target protein using isopropylβ-D-l-thiogalactopyranoside.The purification condition of the target protein was explored by multiple methods.The conservation of Spr0982 protein in different S.pneumonia strains was analyzed by ClustalW tool online.The recombinant plasmid p28-Spr0982 was constructed successfully and a large amount of target protein was obtained by IPTG induction,although mainly in inclusion body.Through QFF cation exchange column and Sephdex S200,relatively pure soluble protein was obtained.The conservation of Spr0982 protein was as much as 99.3% among different S.pneumonia strains.This study has directive significance for understanding the pathogenicity and drug resistance of S.pneumoniae.
Streptococcus pneumoniae;Spr0982 protein;recombinant expression;conservation;drug resistance
R378.4
A
1672-3678(2017)04-0064-06
10.3969/j.issn.1672-3678.2017.04.011
2017-04-14
安徽省自然科学基金(1508085QC49);安徽医科大学校基金(2015XKJ031);安徽医科大学第二附属医院博士科研基金(2014BKJ034)
余维丽(1985—),女,河南商城人,博士,助理研究员,研究方向:微生物生物化学与分子生物学,E-mail:ywl7026@mail.ustc.edu.cn
