一株柴油高级烃降解菌的筛选与鉴定
2017-08-02吕乾川伍元东周俊贾红华韦萍郑涛雍晓雨南京工业大学生物与制药工程学院江苏南京2800南京工业大学生物能源研究所江苏南京2800中国科学院广州能源研究所广东广州50640
吕乾川,伍元东,周俊,贾红华,韦萍,郑涛,雍晓雨(.南京工业大学生物与制药工程学院,江苏南京2800;2.南京工业大学生物能源研究所,江苏南京2800;.中国科学院广州能源研究所,广东广州50640)
一株柴油高级烃降解菌的筛选与鉴定
吕乾川1,2,伍元东1,2,周俊1,2,贾红华1,2,韦萍1,郑涛3,雍晓雨1,2
(1.南京工业大学生物与制药工程学院,江苏南京211800;2.南京工业大学生物能源研究所,江苏南京211800;3.中国科学院广州能源研究所,广东广州510640)
从加油站附近土壤取样,以不同的柴油高级烃为碳源、菌体生物量(OD600)为指示,分离筛选柴油高级烃降解菌株,同时应用高效液相色谱(HPLC)、气相色谱-质谱(GC-MS)分析其降解率以及降解产物。结果筛选到一株对二苯并噻吩、芳香烃类都具有一定降解效果的菌株B5,它对二苯并噻吩的降解率为63.0%,芳香烃类降解率为83.4%。该菌株能将直链烷烃(如正十二烷)的末端羧基化形成羧酸类物质,在实际应用中具有提高油品润滑性质的潜力。经16S rRNA基因鉴定,该菌株为一株红平红球菌(Rhodococcus erythropolis),并被命名为R.erythropolis B5。
柴油高级烃;直链烷烃;红平红球菌;降解菌
汽车工业的发展以及汽车排放标准的日益严格对我国的车用柴油提出更高的要求。经统计发现,2016年我国的柴油表观消费量已高达1.633× 108t[1]。然而,目前我国车用柴油品质不高,主要问题有:辛烷值低、含硫量高、部分柴油密度高以及对芳烃和稠环芳烃的含量尚无限制[2]。日益增长的柴油消费量和较低的柴油品质已经带来了严重的环境压力,其中,最为人们所熟知的就是在2013年成为年度关键词的“雾霾”[3]。我国在2003年出台的柴油车排放污染防治技术政策中提到国家鼓励生产优质、低硫、低芳烃柴油新技术和新工艺的应用[4]。虽然此政策在一定程度上改善了国内柴油品质,但与世界先进国家的产品质量还有着较大的差距。
清洁柴油主要表现为柴油低硫、低芳烃及稠环芳烃等。传统的柴油清洁化方法一般为加氢精制以及电脱硫,而这些方法将消耗大量的电能以及氢气[5]。在自然界中,存在着大量可以利用柴油高级烃(如直连长烃和芳香烃等)生长的微生物(已报道的超过200种)[6]。其中,细菌有假单胞菌属(Pseudomonas)、棒杆菌属(Corynebacterium)等,霉菌有青霉属(Penicillium)、曲霉属(Aspergillus)等。美国的天然气研究所(ITG)在20世纪90年代成功分离出一株能有效脱硫的红平红球菌株[7],该菌株已被休斯顿的能源公司买断并应用在炼油工业上[8]。利用此类微生物对柴油进行清洁化处理,不仅能节省能源,在炼油产业以及车用燃油添加剂方面也会有广阔的应用前景。
本文中,笔者旨在从土壤中自主筛选分离出一株柴油高级烃降解菌株,并针对其降解效率及降解产物进行了初步研究,以期为柴油清洁化工艺提供基础。
1 材料与方法
1.1 材料
1.1.1 土壤样品采集
土壤样品采集自常州邦路加油站及桃园加油站的储油罐进油口附近,深度为20 cm。
1.1.2 培养基
无机盐培养基(g/L):NaCl 24,MgCl2·7H2O 7.0,NH4Cl1.0,KH2PO42.0,Na2HPO43.0;pH 7.2。
种子液培养基(g/L):蛋白胨10,酵母膏5,NaCl 10;pH 7.0。
LB平板培养基(g/L):蛋白胨10,酵母膏5,NaCl 10,琼脂15。
PDA平板培养基(g/L):马铃薯葡萄糖琼脂(PDA)46。
以上培养基均使用高压蒸汽灭菌锅在121℃条件下灭菌20 min。
Gibbs试剂:取0.05 g 2,6-溴苯醌亚胺溶于50 mL乙醇,避光低温保存。
HTP试剂:吡啶7 mL、六甲基二硅胺2 mL、三甲基氯硅烷1 mL,混合后-20℃保存备用。
1.1.3 主要仪器和试剂
培养基所用试剂(分析纯),上海国药集团化学试剂有限公司;752S型紫外可见分光光度计,上海棱光技术有限公司。E100型光学显微镜,日本尼康公司;色谱工作站为美国Agilent 1260系统;GC-MS系统采用Thermo Trace GC Ultra-ISQ。
1.2 菌株筛选
1.2.1 初筛
分别称取两个加油站土壤样品各10 g,加入装有100 mL无机盐培养基的锥形瓶中,同时加入体积分数1%的0#柴油(柴油紫外灭菌20 min后用20μm滤膜过滤)作为唯一碳源。试样放入摇床180 r/min、30℃下培养7 d,再以之为种子液(接种量为1%),接入上述驯化液中,相同添加量下富集培养2次。
21 d后,将培养液依次稀释成10-9、10-8、10-7、10-6和10-5的稀释液,取10-7、10-6和10-5稀释倍数的稀释液100μL涂布于PDA平板培养基上,取10-9、10-8和10-7稀释倍数的培养液100μL涂布于LB平板培养基上,最后将平板放置于30℃培养箱中培养1~2 d。
从平板上挑取生长旺盛的菌落,分别编号并划线接种到对应的平板培养基上,30℃培养1~2 d,再选取单菌落再次平板划线纯化5次。将得到的菌株平板4℃保存,每隔30 d转接活化1次。
1.2.2 复筛
待测菌株种子液制备。将得到的菌株接种至装有100 mL种子液培养基的250 mL锥形瓶中,放入摇床180 r/min、30℃培养1~2 d,制成种子液。
待测菌株芳香烃降解能力检测。将种子液以体积分数1%的接种量加入装有100 mL无机盐培养基的250 mL锥形瓶,并加入0.22 g邻苯二酚,放入摇床,180 r/min、30℃培养7 d,测其OD600。
待测菌株脱硫能力检测。将种子液以1%的接种量加入装有100 mL无机盐培养基的250 mL锥形瓶,并加入0.01 mmol/L的二苯并噻吩(DBT)、5 mL甘油,放入摇床,180 r/min、30℃培养7 d,测其OD600。
1.3 柴油芳烃类降解率测定
将培养好的每份菌种种子液以1%的接种量分别加入20个装有100 mL无机盐培养基的250 mL锥形瓶中,并以1%体积分数的0#柴油作为唯一碳源,放入摇床,180 r/min、30℃条件下培养,每天取出每种菌株的培养液2瓶,以10 mL石油醚(30~60℃)超声振荡萃取3 min后,转移到125 mL分液漏斗中,静置分层后将下层溶液收集于原锥形瓶中,上层溶液则转移到25 mL容量瓶中,再向收集到的下层溶液中加入10 mL石油醚,用同样的方式再次萃取,取上层溶液一并收集到25 mL容量瓶中,并加入石油醚稀释到刻度,混匀,稀释50倍后,以石油醚作为空白,在250 nm波长下测定吸光度[9]。
1.4 邻苯二酚双加氧酶酶活测定
1.4.1 粗酶液的制备
将培养到对数期的菌液离心并收集菌体,超声破碎后取上清液,保存于4℃备用。
1.4.2 酶活测定
由于邻苯二酚2,3-双加氧酶(C23O)在降解邻苯二酚时,可以催化邻苯二酚在两个酚羟基的邻位开环,生成2-羟粘糠酸半醛,而2-羟粘糠酸半醛在375 nm处有最大吸收峰[10]。测定系统总体积3 mL,内含1μmol邻苯二酚、2.8 mL pH 7.5 K3PO4缓冲液和0.2 mL粗酶液。在30℃条件下反应1 min后在375 nm处测定吸光度的增加值[11]。酶活定义:每分钟在375 nm处吸光度增加0.001为一个酶活单位。
1.5 二苯并噻吩降解率测定
1.5.1 二苯并噻吩的检测方法
二苯并噻吩(DBT)是柴油中主要的含硫有机物,在实验中通常也被用作柴油中含硫有机物的模型化合物。二苯并噻吩可采用液相色谱检测。以V(甲醇)/V(水)=90/10作为流动相[12],柱温25℃,流量1 mL/min,检测波长254 nm,进样量10μL。
1.5.2 降解率测定
将培养好的菌种种子液以1%的接种量加入装有100 mL无机盐培养基的250 mL锥形瓶中,并加入0.01 mmol/L的二苯并噻吩、5 mL甘油,放入摇床,180 r/min、30℃下培养7 d后,用等体积二氯甲烷振荡萃取3 min,随后旋转蒸发去除二氯甲烷,然后用10 mL甲醇溶解,HPLC检测其含量,并以未加入菌液、放置7 d后的DBT为对照,检测其降解率。
1.6 直链烷烃降解以及降解产物检测
制作B5菌株种子液,将其以1%的接种量加入装有100 mL无机盐培养基的250 mL锥形瓶中,并加入1 mL正十二烷,放入摇床180 r/min、30℃条件下培养7 d后,用5 mL二氯甲烷超声萃取3次并收集下层清液,N2气流下吹干后,加入1 mL的HTP试剂进行衍生化反应(120℃下反应30 min),样品制备好后运用气质联用(GC-MS)检测降解产物。
1.7 菌株鉴定
1.7.1 生长曲线测定
将菌株接种于200 mL种子液培养基中,放入摇床,180 r/min、30℃条件下培养,每隔1~2 h取样测定其600 nm处的吸光值,以时间(h)为横坐标,OD600值为纵坐标绘制生长曲线。
1.7.2 菌株的16S rRNA基因测序与鉴定
将纯化好的菌株用种子液培养基培养成种子液后,委托南京金斯瑞生物科技有限公司提取并测定菌株的16S rRNA基因序列,测序结果在NCBI上进行BLAST,并与GenBank数据库进行相似性分析,再利用MEGA 4.0软件,采用邻接法(Neighbor-Joining法)构建系统发育树图。
2 结果与讨论
2.1 菌株筛选的结果
以长期经受柴油污染/浸润的土壤作为目标,利用以0#柴油作为唯一碳源的选择性培养基筛选并挑取了能以柴油为唯一碳源快速生长的菌株共22株。再分别通过以二苯并噻吩、邻苯二酚等为唯一碳源的选择性培养基进行复筛,最终得到5株能同时利用邻苯二酚以及二苯并噻吩生长的菌株,分别编号为A4和A9(真菌);B5、B6和B7(细菌)。将5株菌多次纯化并镜检后,斜面保存,并制作甘油菌-80℃保存。
2.2 柴油中芳烃降解率测定结果
测定了5株目标菌株对柴油中典型芳烃的降解率,结果如图1所示。由图1可知:所有菌株在5 d内都表现出较高的降解率,5 d后,降解率开始逐渐下降。这种表现可能是由于5 d内,柴油中芳烃的含量较高,而随着降解时间延长,易降解的芳烃已经被降解,剩余的芳烃由于结构复杂,降解过程缓慢,甚至一部分重芳烃无法降解,导致降解率趋于平缓。而空白样由于柴油中含有的一部分芳烃具有挥发性,因此在空白对照中,芳烃含量也出现了小幅度的减少。总体而言,B5菌株在10 d时间里面,芳烃含量减少了83.4%,明显高于其他4株菌株。与文献报道相比,B5菌株的芳烃降解率高于马宏瑞等[13]所筛选出的Pseudomonas DS-Ⅲ菌株(降解率为81.2%)和黄磊等[14]所筛选出的Rhodococcus erythropolis T7-2菌株(降解率为73.2%)。

图1 柴油中芳烃降解率测定结果Fig.1 Degradation rate of bacteria candidates toward diesel alkanes
2.3 邻苯二酚2,3-双加氧酶酶活测定结果
邻苯二酚双加氧酶是芳香烃类开环、降解的关键酶,能催化邻苯二酚或者邻苯二酚的衍生物在邻位开环生成粘糠半醛,再经由三羧酸循环(TCA)将芳香烃完全代谢。许多芳烃降解菌都具有邻苯二酚2,3-双加氧酶基因,并在一定条件下表现出邻苯二酚2,3-双加氧酶酶活性[15-17]。
配制5株目标菌株的粗酶液并分别测定其邻苯二酚2,3-双加氧酶的酶活,结果见图2。由图2可知:A4和B5菌株表现出较高的比酶活(分别为0.501和0.521 U/mg)。综合所筛选菌株对柴油中典型芳烃降解率,最终选择了B5菌株作为进一步研究对象。虽然所测得的375 nm处的吸光度的增加值仅为孙海波[18]所筛选得到的菌株3A的一半,但所加入酶液的蛋白量也为它的1/2(202 mg/L),因此可以推断,B5菌株的邻苯二酚2,3-双加氧酶的比酶活与3A菌株相当。
2.4 二苯并噻吩降解率测定结果
考察菌株B5对二苯并噻吩的降解能力,结果见图3。由图3可知:菌株B5在添加二苯并噻吩的条件下培养,培养2~5 d后对二苯并噻吩表现出较高的降解率,7 d后降解率达到63.0%。但在降解处理的5 d后,降解率明显下降,可能是由于生成的降解产物浓度过高抑制了酶的活性。魏玉霞等[19]研究发现,降解菌株以不同的物质,如葡萄糖、甘油和乙醇等为碳源的情况下,二苯并噻吩降解率也会有所不同,后续将就此对B5菌株的二苯并噻吩降解进行进一步的优化研究。

图2 邻苯二酚2,3-双加氧酶酶活测定结果Fig.2 Enzyme activity of catechol 2,3-dioxygenase
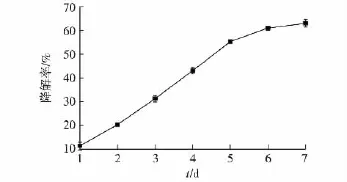
图3 二苯并噻吩降解曲线Fig.3 Degradation curve of dibenzothiophen
2.5 直链烷烃降解产物测定结果
由于菌株是以柴油为唯一碳源筛选所得,因此,若要将菌株运用于柴油清洁化工艺上,就必须考虑菌株是否会连同柴油中的主要成分一起降解代谢。因此,以十二烷(柴油中的主要直链烷烃)为代表,检测菌株是否会将十二烷降解代谢并检测代谢产物具有相当的实际意义[20]。经过培养发现,B5菌株能在以正十二烷为唯一碳源的培养基中生长。对培养7 d后的降解产物进行GC-MS分析,结果见图4~6。由图4~6可以发现:9.05、20.21和25.58 min的吸收峰,经质谱比对分别为正十二烷(图5)、正十二醇(已硅烷化,图6)、正十二烷酸(已硅烷化,图7),但未在其中发现更短碳链的烷烃、醇以及酸。由此可以推断,B5菌株可以将正十二烷代谢为正十二醇,并进一步氧化为正十二酸。
传统工艺下生产的低硫、低芳烃的清洁化燃油在使用中发现因为其中的极性物质的减少,导致了柴油的润滑性下降。而范文琴[21]研究发现添加羧酸型抗磨剂是解决新配方柴油润滑性差的最有效方法。Kajdas等[22]研究发现,在低硫柴油之中,添加入正十二烷酸后,柴油的润滑性能大大提高,即便添加剂量低至50 mg/kg,其检测到的磨斑直径(WS1.4)也可达到203μm,效果相当显著。与Anastopoulos等[23-27]的研究结果相比,脂肪酸类的添加剂相较于脂肪酸单脂化合物、醇醚类化合物、酯类化合物以及胺类化合物有着所需含量少,润滑效果高的明显优势。因此,菌株B5代谢产生正十二酸的特点也可以用来缓解清洁柴油润滑性下降的问题,以减少、甚至移除新配方柴油外源添加润滑剂的消耗。在实际应用时,通过对该菌株烷烃羟化酶系与柴油润滑的关联性进一步深入研究,使菌株能够更好地改良柴油以适应其润滑性要求,将会有更理想的效果[28]。
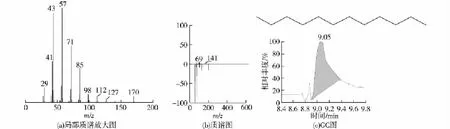
图4 正十二烷GS-MS分析Fig.4 n-Dodecane analyzed by GS-MS

图5 正十二醇GC-MS分析Fig.5 n-Dodecanol analyzed by GS-MS

图6 正十二酸GC-MS分析Fig.6 n-Dodecyl acid analyzed by GS-MS
2.6 菌株鉴定结果
菌株生理生化鉴定结果见表1,革兰氏染色结果见图7。根据图7的革兰氏染色结果(B5菌为革兰氏阳性菌)以及表1中的生理生化鉴定数据,参照《常见细菌系统鉴定手册》,初步推断该菌为红平红球菌。
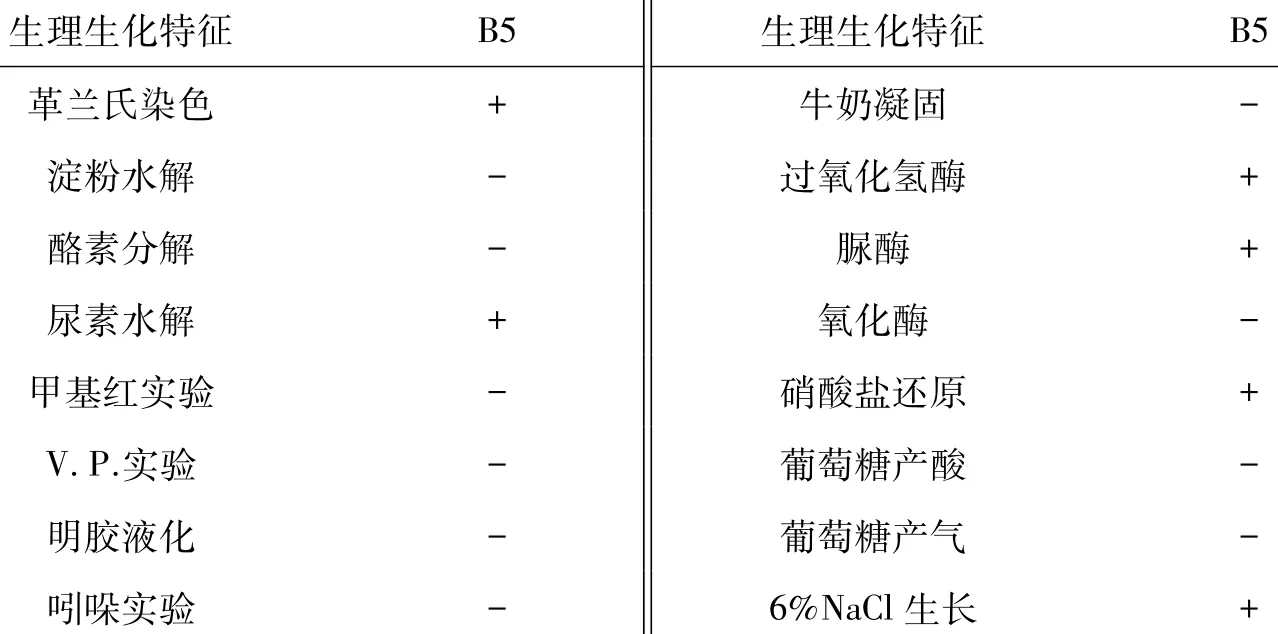
表1 生理生化特征表Table 1 Physiological and biochemical characters of strain B5

图7 菌株B5的革兰氏染色Fig.7 Gram staining of strain B5
菌株B5的生长曲线见图8。由图8可以发现:菌株B5生长8 h开始进入对数期,23 h的时候,菌液浓度不再增加,进入稳定期。提取菌株B5对数生长期细胞的基因组DNA,送至南京金斯瑞生物科技有限公司进行16 S rRNA基因序列的扩增及测序,所获序列上传GenBank进行BLAST分析,再利用MEGA 4.0软件,依据B5菌株的16S r RNA基因序列构建进化树并进行分析,结果见图9。由图9可知,与菌株B5同源性最高的菌株是Rhodococcus erythropolis LC107443,两者16S r RNA基因序列相似性达到99%,因此将B5菌株鉴定为一株红平红球菌,并命名为R.erythropolis B5,制作甘油菌-80℃保存待后续实验使用。

3 结论
从加油站进油口的土壤中筛选分离得到一株能有效降解柴油高级烃类的菌株B5,该菌株能在10 d内使柴油中芳烃类的含量下降83.4%,且能在7 d内,降解柴油中含硫物(DBT)的降解率达到63.0%。同时,该菌株可将柴油中的正构烷烃末端羧基化生成羧酸,在柴油清洁化过程中,为保证柴油润滑性的新型柴油的清洁化工艺提供了基础。

图9 菌株B5基于16S rRNA基因序列构建的系统发育树Fig.9 Phylogenetic tree based on 16S rRNA gene sequences of B5 and reference strains
[1]朱春凯.我国成品油消费首现趋势性拐点[J].中国石化,2017 (2):78.
[2]薛永红.清洁燃油质量标准研究[J].石油化工应用,2007,26 (5):8-12.
[3]韩梦非,郭斌.雾霾天气和柴油车尾气[C]//第八届全国大气细及超细粒子技术研讨会暨PM2.5源谱交流会.北京:中国颗粒学会气溶胶专业委员会,2015.
[4]中国环保产业编辑部.柴油车排放污染防治技术政策[J].中国环保产业,2003(2):39-40.
[5]张景成,南军,于海斌,等.劣质馏分油加氢生产清洁柴油的工艺研究[C]//中国化工学会.厦门:全国工业催化技术及应用年会,2012.
[6]刘秋,张耀尹,曹雪洁,等.海洋石油降解微生物及其降解机理[J].微生物学杂志,2016,36(3):1-6.
[7]KILBANE II J J,JACKOWSKI K.Biodesulfurization of watersoluble coal-derived material by Rhodococcus rhodochrous IGTS8[J].Biotechnol Bioeng,1992,40(9):1107-1114.
[8]MCFARLAND B L.Biodesulfurization[J].Curr Opin Microbiol,1999,2(3):257-264.
[9]田贞乐,朱丽华,吴映辉,等.气相色谱与紫外分光光度法评价石油烃类污染物的微生物降解过程[J].分析化学,2006,34(3):343-346.
[10]章俭,夏春谷.芳香烃双加氧酶的结构与功能研究[J].化学进展,2004,16(1):116-122.
[11]KOJIMA Y,ITADA N,HAYAISHI O.Metapyrocatechase:a new catechol-cleaving enzyme[J].J Biol Chem,1961,236(8): 2223-2228.
[12]高常安,张爱茜,冯峰,等.固相微萃取-液相色谱法测定水中二苯并噻吩[J].环境科学与技术,2009,32(2):106-108.
[13]马宏瑞,赵敏,杜战鹏,等.两株柴油降解菌的性能研究[J].化工环保,2007,27(2):105-108.
[14]黄磊,李丹,孙丹,等.1株低温石油烃降解菌的分类鉴定及降解特性研究[J].环境科学,2007,28(9):2101-2105.
[15]XIA Y,MIN H,LU Z,et al.Characterization and phylogenetic analysis of a phenanthrene-degrading strain isolated from oilcontaminated soil[J].J Environ Sci,2004,16(4):589-593.
[16]IIORI M O,AMUND D I.Degradation of anthracene by bacteria isolated from oil polluted tropical soils[J].Z Naturforsch C, 2000,55(11/12):890-897.
[17]LIU Y,ZHANG J,ZHANG Z.Isolation and characterization of polycyclic aromatic hydrocarbons-degrading Sphingomonas sp.strain ZL5[J].Biodegradation,2004,15(3):205-212.
[18]孙海波.多环芳烃降解菌的筛选、鉴定,降解特性及邻苯二酚-2,3-双加氧酶的初步研究[D].济南:山东大学,2009.
[19]魏玉霞,肖宝清,闫海,等.二苯并噻吩脱硫微生物菌种的筛选与活性[J].中国环境科学,2006,26(3):311-314.
[20]FUNHOFF E G,BAUER U,GARCA-RUBIO I,et al.CYP153A6,a soluble P450 oxygenase catalyzing terminal-alkane hydroxylation[J].J Bacteriol,2006,188(14):5220-5227.
[21]范文琴,赵良.影响柴油润滑性因素初探[J].高桥石化,2005 (3):1-3.
[22]KAJDAS C K,MAJZNER M.The influence offatty acids and fatty acids mixtures on the lubricity of low-sulfur diesel fuels[J].SAE Paper,doi:10.4271/2001-01-1929.
[23]ANASTOPOULOS G,LOIS E,KARONIS D,et al.A preliminary evaluation of esters ofmonocarboxylic fatty acid on the lubrication properties of diesel fuel[J].Ind Eng Chem Res,2000,40(1): 452-456.
[24]ANASTOPOULOS G,LOIS E,ZANNIKOS F,et al.Influence of aceto acetic esters and di-carboxylic acid esters on diesel fuel lubricity[J].Tribol Int,2001,34(11):749-755.
[25]ANASTOPOULOS G,LOIS E,SERDARI A,et al.Lubrication properties of low-sulfur diesel fuels in the presence of specific types of fatty acid derivatives[J].Energy Fuels,2000,15(1): 106-112.
[26]ANASTOPOULOS G,LOIS E,SERDARI A,et al.The impact of aliphatic amines and tertiary amides on the lubrication properties of ultra-low sulfur diesel fuels[J].SAE Tech Paper,DOI:10.4271/2000-01-1916.
[27]ANASTOPOULOS G,LOIS E,ZANNIKOS F,et al.The tribological behavior of alkyl ethers and alcohols in low sulfur automotive diesel[J].Fuel,2002,81(8):1017-1024.
[28]JEON H J,KIM M N.Functional analysis of alkane hydroxylase system derived from Pseudomonas aeruginosa E7 for low molecular weight polyethylene biodegradation[J].Int Biodeter Biodegr,2015,103:141-146.
(责任编辑荀志金)
Isolation and identification of a diesel alkanes degrading bacterium
LYU Qianchuan1,2,WU Yuandong1,2,ZHOU Jun1,2,JIA Honghua1,2,WEI Ping1,ZHENG Tao3,YONG Xiaoyu1,2
(1.College of Biotechnology and Pharmaceutical Engineering,Nanjing Tech University,Nanjing 211800,China; 2.Bioenergy Research Institute,Nanjing Tech University,Nanjing 211800,China;3.Guangzhou Institute of Energy Conversion,Chinese Academy of Sciences,Guangzhou 510640,China)
A bacterium with the ability of diesel alkanesdegradation was isolated from the soil sample near gas station with different diesel alkanes as carbon sources and biomass density(OD600)as indicator.High performance liquid chromatography(HPLC)and gas chromatography-mass spectrometry(GC-MS)were used to analyzed the degradation efficiency and the degradation products of the bacterium.The isolated bacterial strain B5 could metabolize and degrade dibenzothiophene and aromatic hydrocarbons,with the degradation efficiency of 63.0%and 83.4%respectively.In addition,the alkyl group at the end of straight-chain alkanes can be transformed into carboxyl group by the strain through carboxylation,which potentially helps to enhance the lubricating performance of diesel.Finally,this strain was identified to be Rhodococcus erythropolis by sequencing the 16S rRNA gene and was named as R.erythropolis B5.
diesel alkanes;straight-chain alkanes;Rhodococcus erythropolis;degrading bacterium
Q945.78
A
1672-3678(2017)04-0057-07
10.3969/j.issn.1672-3678.2017.04.010
2017-03-23
国家重点基础研究发展计划(973计划)(2013CB733904);江苏省自然科学基金(BK20130932)
吕乾川(1989—),男,江苏南京人,研究方向:生物化工;雍晓雨(联系人),讲师,E-mail:yongxiaoyu@njtech.edu.cn
