力达霉素影响人白血病细胞生长的实验研究
2017-08-02程振辉李昌红郭璐莹
程振辉 李昌红 郭璐莹 陈 静
华北理工大学生命科学学院 河北唐山 063000
力达霉素影响人白血病细胞生长的实验研究
程振辉 李昌红 郭璐莹 陈 静
华北理工大学生命科学学院 河北唐山 063000
①目的 通过研究力达霉素对人急性髓性白血病HL-60细胞和慢性粒系白血病K562细胞生长的影响,为力达霉素在白血病的临床治疗上提供实验依据。②方法 用0.01nM、0.1nM和1nM浓度的力达霉素分别作用于HL-60细胞和K562细胞48小时,通过HE染色观察细胞的形态变化;采用台盼蓝染色法、MTT法检测力达霉素对细胞增殖能力的影响。③结果 不同浓度力达霉素处理细胞后,HL-60细胞和K562细胞的生长明显受到抑制。HE染色结果显示用药组细胞形态发生改变,细胞生长缓慢。台盼蓝染色结果显示,浓度为0.01nM、0.1nM和1nM的力达霉素分别作用HL-60细胞和K562细胞48小时后,细胞的抑制率分别为:HL-60(42.3±2.04)%、(63.7±1.83)%和(78.4±1.38)%;K562(36.9±1.22)%、 (54.5±0.85)% 和 (68.7±1.83)%, 与对照组相比, 差异均有统计学意义 (P< 0.05)。MTT检测结果亦表明力达霉素能够使细胞的存活率降低,抑制细胞生长。④结论 力达霉素能够影响人白血病细胞HL-60和K562的生长,抑制细胞增殖。
力达霉素 白血病 HL-60细胞 K562细胞
白血病(leukemia)亦称血癌,属于造血系统的恶性肿瘤。白血病的主要特征表现为骨髓和淋巴结等造血系统中一种或多种血细胞成分发生恶性增殖,并浸润体内其他组织和器官,最终导致体内正常造血细胞功能受到抑制,致使患者出现多种临床症状[1]。目前临床对于白血病的治疗主要采取化疗手段,大剂量化疗联合造血干细胞移植虽可缓解一些症状,但多数患者仍会复发,并且治疗中出现的不良反应使患者的生活质量受到严重影响,以致使其失去对疾病治疗的希望和信心[2~4]。因此寻找高效低毒的治疗药物,在白血病的治疗中仍然任重而道远。力达霉素(原名C-1027[5,6],lilamycin,LDM)是具有我国自主知识产权的烯二炔类抗肿瘤抗生素,其结构包含一个辅基蛋白和一个发色团,其中发色团是其活性部位,具有切割DNA的特殊作用,能引起核苷酸碱基和序列特异性的DNA单链和双链断裂[7]。大量实验研究表明LDM具有较强的抗肿瘤活性[8~10],能够强烈抑制肿瘤生长和肿瘤转移。另有实验证明LDM可以诱导肿瘤细胞染色体发生异常及端粒发生错排等现象[11]。已往研究显示,不同剂量LDM能够诱导多种类型的肿瘤细胞死亡。本文拟以人急性髓性白血病HL-60细胞和慢性粒系白血病K562细胞为研究对象,探讨LDM对白血病细胞生长的影响,以期为LDM在白血病的临床应用上提供实验依据。
1 材料与方法
1.1 实验材料 人白血病HL-60细胞和K562细胞(本室保存);LDM(由中国医学科学院医药生物技术研究所甄永苏院士惠赠);RPM-1640(购自Gibco公司);胎牛血清(购自Biological公司);MTT检测细胞增殖及细胞毒性试剂盒(购自南京凯基公司);台盼蓝(购自天根生物科技有限公司);HE染液(本室配置)。
1.2 方法
1.2.1 细胞培养 将HL-60和K562细胞株从液氮中取出后迅速复苏,之后用包含10%胎牛血清的RPM-1640培养液在37℃,5% CO2恒温培养箱中培养1~2天,待多数细胞处于对数生长期时开始实验。
1.2.2 HE染色观察细胞形态 将HL-60和K562细胞按照2×105个/mL浓度接种于24孔板中,每孔 2mL, 加入浓度分别为 0.01nM、0.1nM和1nM的LDM,同时设对照组,培养48小时。将细胞转入离心管,离心收集细胞,每孔取0.2mL涂片,冷风吹干。用95%乙醇固定20分钟,磷酸盐缓冲液(PBS)洗涤2次,每次1分钟。苏木素染液染色2~3分钟,自来水洗涤。浸入伊红染液染色1分钟,自来水洗涤,晾干,置于光学显微镜下观察、拍照。
1.2.3 台盼蓝染色 离心收集HL-60和K562细胞,制备单细胞悬液,依照细胞浓度进行适当稀释。将细胞悬浮液与台盼蓝溶液按照9:1的比例混合均匀,涂片后置于光学显微镜下观察。每组浓度选取5个不同视野,在3分钟内对活细胞(无色)和死细胞(蓝色)分别计数,按照以下公式计算LDM对细胞的抑制率:抑制率(%)=死细胞数/(活细胞数+死细胞数)×100%。
1.2.4 MTT检测细胞增殖 在96孔板中加入细胞(100μL/孔,约1×104个/孔),置于37℃,5% CO2细胞培养箱中培养24小时后,加入不同浓度的LDM,再于恒温培养箱中孵育48小时,每孔加入50μL MTT,37℃温育4小时,离心吸出上清液,每孔加入150μL DMSO,平板摇床振荡10分钟,于570 nm波长处检测每孔的光密度值,计算细胞存活率。
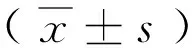
2 结果
2.1 LDM对人白血病细胞生长的影响 不同浓度LDM作用细胞48小时后,细胞形态发生较大变化。与对照组相比,用药组细胞形态不规则,胞浆中出现颗粒性物质,细胞生长缓慢,数量减少,见图1。
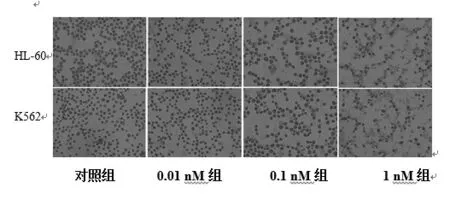
图1 LDM对白血病细胞生长的影响(HE,200×)
2.2 LDM对人白血病细胞活性的影响 分别用0.01nM、0.1nM和1nM浓度的LDM作用细胞48小时后,台盼蓝染色结果显示,LDM对细胞的生长均有一定的影响作用。按公式:抑制率(IR%)=死细胞数/(活细胞数+死细胞数)× 100,计算IR值,见表1。
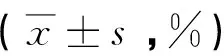
表1 不同浓度LDM对HL-60和K562细胞生长的抑制率比较
注:与对照组比较,*P<0.05;与对照组比较,**P<0.01
2.3 LDM对人白血病细胞增殖的影响 不同浓度LDM作用HL-60和K562细胞48小时后,将96孔板置于全自动连续光谱酶标仪中,在570nm处测定每孔的光密度值(OD值)。按以下公式计算细胞存活率:细胞存活率(%)=(加药细胞OD/对照OD)×100MTT结果显示,不同浓度LDM作用HL-60和K562细胞48小时后,细胞存活率明显降低,具有浓度-效应依赖关系,见图2。
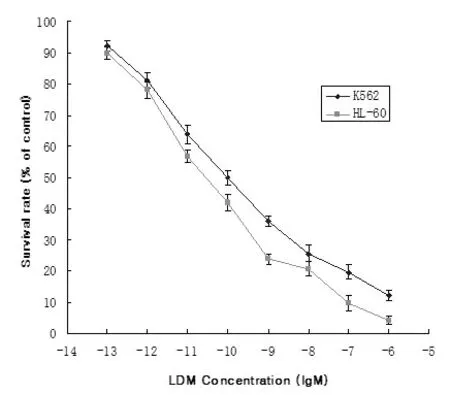
图2 LDM对HL-60和K562细胞增殖的抑制作用
3 讨论
白血病是一类造血干细胞恶性克隆性疾病,克隆性白血病细胞由于增殖失控、细胞分化障碍、细胞凋亡异常等机制在骨髓和其他造血组织中大量增殖、积累,并且浸润其他组织和器官,同时患者的正常造血功能亦受到严重影响[1]。白血病的临床表现大多为不同程度的贫血、出血、感染发热以及肝、脾、淋巴结肿大和骨骼疼痛等,是严重危害人类健康的一类恶性肿瘤。白血病常常按照细胞的分化程度、患病的速度和病程的长短分为急性白血病和慢性白血病两大类,每类又根据细胞的类型再分为若干不同的类型,如急性淋巴白血病、慢性粒细胞白血病等。化疗是临床中治疗白血病最常采用的方法之一,其原理是通过杀死大量白血病细胞来减少肿瘤负荷,因此化疗采用的剂量越大,病情越能得到较大缓解。但化疗药物在杀伤白血病细胞的同时会导致大量正常细胞受损,影响细胞发挥其正常的功能。患者还常常产生耐药抵抗,甚至出现完全缓解后的休眠期,因而寻找高效低毒的治疗方法和药物仍然迫在眉睫。
本研究选用的药物LDM属于一类抗肿瘤抗生素,目前正在我国进行Ⅱ期临床试验研究。LDM由一个酸性辅基蛋白和一个发色团结合而成,其中发色团是其活性部位,具有断裂DNA的作用,而辅基蛋白具有保护发色团的功能[7]。组成LDM的辅基蛋白和发色团可以拆分、同时能够与不同抗体形成耦联物,适宜作为肿瘤靶向药物的“弹头”,可用于肿瘤的精准治疗,减少药物的不良反应。本研究选取人急性髓性白血病HL-60细胞和慢性粒系白血病K562为作用对象,通过HE染色观察了LDM对人白血病HL-60和K562细胞生长状态的影响,利用台盼蓝能够进入死细胞的特性检测了LDM对人白血病HL-60和K562细胞增殖的抑制作用,实验结果表明LDM对人白血病细胞具有极强的杀伤作用。人白血病HL-60和K562细胞经0.01nM、0.1nM和1nM浓度的LDM处理后,细胞的生长状态发生了不同程度的改变,出现了细胞的形状不规则、生长速度缓慢、细胞数量减少等明显的形态学变化,同时经LDM处理后的细胞增殖率明显降低,显示出LDM具有强大的抑制白血病细胞生长的特性,该实验结果为LDM作用于白血病的进一步深入研究奠定了基础。
[1] Goldman J.Chroniemyeliod leukemia-past,present and future[J].Semin Hematol,2003,40(1):1-3
[2] Chiusolo P,Sica S,Piccirillo N,et al.Molecular and clinical follow-up after stem cell transplantanion for multiple myeloma[J].Ann Hematol,2001,80(2):90-95
[3] Leiba M,Jakubikova J,Klippel S,et al.Halofuginone inhibits multiple myeloma growth in vitro and in vivo and enhances cytotoxicity of conventional and novel agents[J].Br J Haematol,2012,157(6):718-731
[4] Naki S,Nace R,Barber GN,et al.Potent systemic therapy of multiple myeloma utilizing oncolytic vesicular stomatitis virus coding for interferon-β[J].Cancer Gene Ther,2012,19(7):443-450
[5] Zhen YS,Ming XY,Yu B,et al.A new macromoleculer antitum or antibiltic,C-1027 III.Antitum or activity[J].J Antibior,1989,42(8):1294-1298
[6] Zhen YS,Xue YC.Antitum or activity of the new enediyne antibiotic C-1027[J].Cancer Chemotherapy and Pharmacology,1990,27(1):41-46
[7] Xu YJ,Zhen YS,Goldberg IH.C-1027 chromophore,a potent new enediyne antitumor antibiotic,induces sequence-specific double-strand DNA cleavage[J].Biochemistry,1994,33(19):5947-5954
[8] Zhong GS,Guo XF,Zhang SH,et al.Optimization of the assembly efficiency for lidamycin chromophore bound to its aporotein:a case study using orthogonal array[J].Biomed Environ Sci,2011,24(6):602-607
[9] Zhang Q,Liu XJ,Hu L,et al.Factor VII light chain-targeted lidamycin targets tissue factor-over expressing tumor cells for cancer therapy[J].Int J Mol Med,2012,29(3):409-415
[10] Zhen HY,He QH,Zhen YZ,et al.Inhibition of mouse embryonic carcinoma cell growth by lidamycin through down-regulation of embryonic stem cell-like genes Oct 4,Sox 2 and Myc[J].Invest New Drugs,2011,29(6):1188-1197
[11] Hu W.H,Johnson H,Shu H B.Activation of NF-kappaB by FADD,Casper,and Caspase-8.J.Biol[J].Chem,2000,275(15):10838-10844
(2017-02-15 收稿)(库雪飞 编辑)
Effect of lidamycin on the growth of human leukemia cells
CHENG Zhenhui,LI Changhong,GUO Luying,et al
(College of Life Science,North China University of Science and Technology,Tangshan 063000,China)
Objective To explore the proliferation inhibition effects of lidamycin (LDM) on human acute myeloid leukemia HL-60 cells and human chronic myelogenous leukemia K562 cells. These results will provide experimental basis for the clinical treatment of lidamycin on leukemia. Methods The HL-60 cells and K562 cells were treated with various concentrations(0.01nM,0.1nM and 1nM)of lidamycin for 48h.The morphological changes of the cells were observed by HE staining.The cell proliferation was detected by trypan blue staining and MTT assay.Results The growth of HL-60 and K562 cells were influenced obviously after treated with various concentrations of LDM.The results of HE staining showed that cell morphological changed and cell growth was slow in drug groups.LDM could inhibit the proliferation of HL-60 and K562 cells significantly.Cells were exposed to LDM with 0.01nM, 0.1nM and 1nM respectively for 48h, the inhibitory rates were (42.3 ± 2.04)%, (63.7 ±1.83)%,(78.4±1.38)%-HL-60 cell and(36.9±1.22)%,(54.5±0.85)%,(68.7±1.83)%-K562 cell respectively.These results were higher than those in control group(P<0.05).Conclusion LDM has the capability of inhibiting proliferation on human leukemia HL-60 cells and K562 cells.
Lidamycin.Leukemia. HL-60 cell.K562 cell
华北理工大学大学生创新创业训练计划项目(编号:X2016098)。
程振辉(1996-),本科生。研究方向:生物技术。
陈 静。
R 329.28
A
2095-2694(2017)04-268-04
