MIN6细胞损伤模型不同造模方法对比研究
2017-08-02程瑞婷王晨斌田春雨高秀娟吴晨曦李继安郑彩莲喇孝瑾
程瑞婷 王晨斌 田春雨 高秀娟 吴晨曦 朱 亮 李继安 郑彩莲 喇孝瑾
华北理工大学中医学院 河北唐山 063000;①唐山市曹妃甸区医院重症医学科
MIN6细胞损伤模型不同造模方法对比研究
程瑞婷 王晨斌 田春雨 高秀娟 吴晨曦 朱 亮 李继安 郑彩莲①喇孝瑾
华北理工大学中医学院 河北唐山 063000;①唐山市曹妃甸区医院重症医学科
①目的 通过比较MIN6细胞损伤模型的不同建立方法,筛选最佳造模方法。②方法 将生长状态良好的MIN6细胞分入96孔板,培养至对数生长期后分别以不同浓度棕榈酸(PA)、葡萄糖(GLU)、棕榈酸+葡萄糖(PA+GLU)、地塞米松(DXM)和过氧化氢(H2O2)干预12小时, CCK-8试剂盒检测细胞活力,计算IC50。设立对照组,以IC50浓度分别干预6小时后流式细胞仪检测细胞凋亡,ELISA法检测细胞胰岛素分泌。③结果 细胞活力结果显示各造模剂均有良好的剂量依赖性;分别以IC50浓度干预后,细胞早期凋亡和晚期凋亡均比对照组有所增加,其中PA+GLU早期凋亡、胰岛素分泌量较高。④结论 PA+GLU干预MIN6细胞后早期凋亡比例增加和刺激胰岛素分泌增加比较接近体内情况,符合造模需求。
2型糖尿病 MIN6细胞损伤模型 胰岛素
在以往的研究中,胰岛素抵抗被认为是2型糖尿病(T2DM)发生、发展的主要因素[1]。随着对T2DM机制研究的日渐深入,胰岛β细胞自身数量减少和功能受损在T2DM中的作用越来越受到重视,二者直接导致胰岛素分泌量的绝对减少、血糖升高,不断升高的血糖又反过来进一步损害β细胞功能,增加β细胞凋亡,从而形成恶性循环[2,3]。近年来,有很多关于胰岛细胞损伤的研究,但是β细胞损伤模型的建立方法以及用药剂量不尽相同,本研究查阅相关文献中用到的β细胞损伤模型建立方法,设立梯度浓度进行造模,对比几种不同造模方法的效果,从而筛选出胰岛β细胞的最佳造模方法。
1 材料与方法
1.1 材料与试剂 小鼠胰岛β细胞瘤株(MIN6细胞株)购自上海复旦大学细胞库;胎牛血清(GEMINI公司,批号:A97D00E);RPMI1640培养基(Gibco,批号:8114158);β-硫基乙醇(MP,批号:R26495);牛血清白蛋白(Beyotime,批号:ST023);0.25%胰酶消化液(Biosharp,批号:65047019);过氧化氢(LIRCON,批号:140601A);棕榈酸(MK,批号:20140620);葡萄糖(BIOSHARP,批号:M-2250);地塞米松(Sigma,批号:D-4902-25MG);CCK-8(DOJINDO,批号:FJ692)。
1.2 主要仪器 M200PRO酶标仪(TECANM200);倒置显微镜(OLYMPUSix51);CO2培养箱(Thermo Scientific 311);BS224S精密电子天平(SARTORIUS)。
1.3 方法
1.3.1 细胞培养 所用MIN6细胞采用RPMI 1640培养液(含10%胎牛血清、1%青链霉素、4μL/100mL硫基乙醇)在37℃、5% CO2培养箱中进行培养。同时对MIN6细胞进行双硫腙染色鉴定,染色结果呈现特异性猩红色。
1.3.2 实验分组 根据不同造模剂将实验分为6组,分别为对照组、棕榈酸(PA)组、葡萄糖(GLU)组、棕榈酸+葡萄糖(PA+GLU)组、地塞米松(DXM)组、过氧化氢(H2O2)组,每组设5个梯度,具体为PA组(0.1、0.2、0.4、0.8、1.6mmol/L)、GLU组(5.5、11、22、44、88mmol/L)、PA+GLU组(0.1+5.5、0.2+11、0.4+22、0.8+44、1.6+88mmol/L)、DXM组(50、100、200、400、800nmol/L)和H2O2组(62.5、125、250、500、1000μmol/L),每孔设7个复孔。
1.3.3 CCK-8法检测细胞活性 将生长状态良好(约80%)的MIN6细胞用0.25%胰酶消化液消化,边消化边晃动培养瓶,倒置显微镜下观察:当看到胞质突起回缩、细胞间隙变大时加入消化终止液终止消化。800rmp离心5分钟,取上清液,加入适量细胞培养液,调整细胞浓度为5×104/mL,混匀后接种于96孔板中,每孔100μL。封口膜封口,置于37℃、5%CO2培养箱培养。待细胞生长至对数期时进行药物干预,抽出孔板中培养液,Hank’s液洗两次,按照不同分组每孔加入100μL造模剂(IC50浓度),造模剂使用5%BSA溶液配制。封口膜封口,置于5%CO2培养箱继续培养。分别在培养12小时后按照加液顺序加入10μL CCK-8,2小时后选择450nm波长处使用酶标仪测定吸光度。
1.3.4 流式细胞仪检测细胞凋亡 同上述方法进行细胞培养,待细胞生长至对数期,分别加入5种造模剂(IC50浓度)各6mL,并设立正常对照组,干预6小时后用0.25%胰酶消化液进行消化,吹打混匀。以Muse Annexin V Dead Cell Kit溶液与细胞混悬液按比例混匀后室温放置20分钟,流式细胞仪检测细胞凋亡。
1.3.5 ELISA法检测细胞胰岛素分泌 同上述方法进行细胞培养,待细胞生长至对数期,分别加入5种造模剂(IC50浓度)各6mL,并设立正常对照组,干预6小时后,收集上清液,用ELISA试剂盒检测各孔细胞胰岛素分泌量。
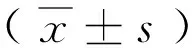
2 结果
2.1 各造模剂对MIN6细胞活性的影响 见表1。
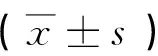
表1 CCK-8法检测细胞活性结果
2.2 各造模剂对MIN6细胞凋亡的影响 Muse Annexin V Dead Cell Kit检测结果发现,各组细胞早期凋亡和晚期凋亡均比对照组有所增加,且早期凋亡变化更加显著,PA组、 GLU组、PA+GLU组、DXM组和H2O2组早期凋亡比例分别增加至17.75%、21.25%、23.60%、16.35%、17.75%,其中 PA+GLU组增加最为显著,见图1。
图1 Muse Annexin V Dead Cell Kit检测细胞凋亡结果
注:与对照组比较,*P<0.05
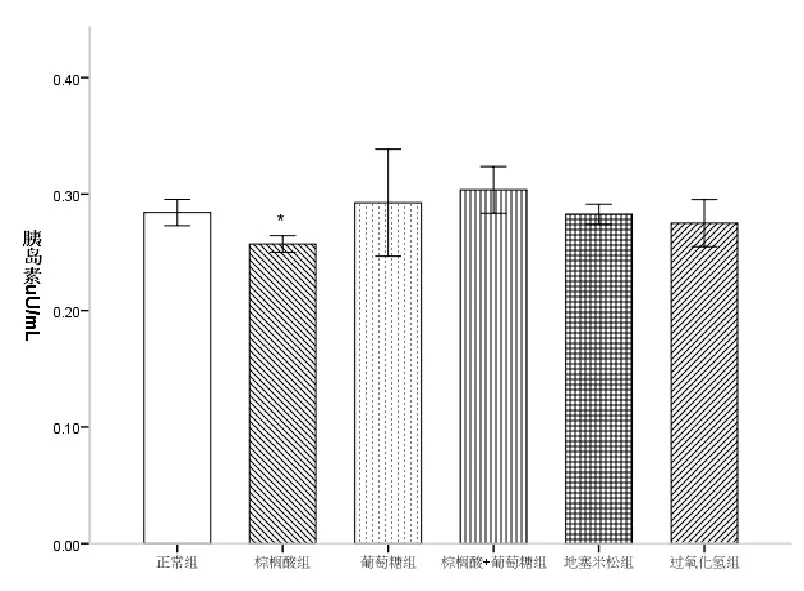
图2 ELISA法检测细胞胰岛素分泌结果
2.3 各造模剂对MIN6细胞胰岛素分泌的影响 ELISA试剂盒检测结果表明,以IC50浓度干预后,各组细胞胰岛素分泌量较对照组均有一定程度的改变,其中PA组胰岛素分泌量较对照组明显降低(F=3.108,P<0.05),GLU组、PA+GLU组、DXM组和H2O2组较对照组无显著性差异,见图2。
3 讨论
据流行病学调查显示,目前我国的成人糖尿病患者总数已达到9240万[4],成为第一大疾病,这其中T2DM患者就占90%左右,严重威胁着人们的健康。但是,目前为止仍未探索出针对T2DM的有效治疗方法,因此,针对T2DM的更深层次的研究很有必要。
T2DM是一种多靶点的代谢紊乱综合征,它的发病机制非常复杂,过去认为,外周胰岛素抵抗导致胰岛素不能发挥正常水平的降糖作用是血糖升高的最主要原因,但是近些年来,越来越多的证据表明β细胞数量的减少以及功能的受损在T2DM中同样发挥着非常重要的作用,纵观胰岛细胞损伤的相关研究,各文献报道的细胞损伤模型建立方法有很多种,最常见的是高糖高脂损伤,此外,还有部分研究者利用过氧化氢或者地塞米松进行造模。
肥胖是导致T2DM发生的主要因素之一,体内脂肪组织的堆积导致饱和游离脂肪酸释放增多,而游离脂肪酸的异常增高与T2DM 的发生、发展密切相关。研究表明,正常情况下,一定量的游离脂肪酸对于胰岛β细胞的增殖以及胰岛素分泌来说是必要的,但是,长期高水平的游离脂肪酸则会损伤胰岛β细胞,减少胰岛素的分泌[5],最终导致T2DM的发生。葡萄糖在体内的作用方式同游离脂肪酸一样呈双向调节作用,适量的葡萄糖对于胰岛素的分泌以及胰岛细胞的增殖起到促进作用,但是长期高糖状态则会导致胰岛细胞损伤、数量的减少以及胰岛素分泌量减少。且研究发现当高糖高脂同时发生时,二者可以产生协同作用,从而加速T2DM的进程[6]。关于游离脂肪酸及高糖导致T2DM的具体作用机制尚未明确,相关研究表明, 过高水平游离脂肪酸、葡萄糖可以诱导β细胞凋亡[7,8],说明二者有可能通过诱导细胞凋亡来参与胰岛β细胞衰竭。而其诱导胰岛β细胞凋亡可能是通过线粒体途径来实现的[9,10]。
DXM是一种糖皮质激素,因其具有免疫抑制以及抗炎、抗休克等多种作用而被广泛应用于临床,但是近年来研究发现,过多的应用糖皮质激素会导致多种不良反应,其中很重要的一项就是会导致糖尿病的发生,其具体机制涉及干扰葡萄糖的摄取和利用,促进胰岛细胞凋亡、减少胰岛素分泌等多个环节[11]。
H2O2可以引起胰岛β细胞损害,H2O2在胰岛素初期由巨噬细胞释放,还可由诱导糖尿病的四氧嘧啶和链脲霉素产生。高剂量的H2O2可引起细胞坏死;而在低剂量时,它可以导致许多培养细胞系凋亡[12]。研究表明,将MIN6细胞于含有250μM H2O2培养液中培养3小时,可以导致胰岛细胞凋亡[13],说明H2O2作为一种细胞毒性分子在早期胰岛细胞功能改变以及最终导致胰岛细胞功能破坏方面起着非常重要的作用。
本实验以MIN6细胞为研究对象,它与原代的胰岛细胞在胰岛素分泌等方面相似, 是研究胰岛细胞损伤以及凋亡的理想模型[14]。本研究通过查阅整理相关文献中的造模方法进行细胞实验,结果发现各造模剂对MIN6细胞活力能够造成不同程度的损伤,且均有良好的剂量依赖性;分别以IC50浓度干预后,细胞早期凋亡和晚期凋亡均对照组有所增加,其中PA+GLU早期凋亡、胰岛素分泌量较高。
本研究发现PA+GLU干预MIN6细胞后早期凋亡比例增加和刺激胰岛素分泌增加,比较接近体内情况,符合造模需求。
[1]Xu C,Niu Y J,Liu X J,et al.Tacrolimus reversibly reduces insulin secretion, induces insulin resistance, and causes islet cell damage in rats[J].International Journal of Clinical Pharmacology & Therapeutics,2014,52(7):620-627
[2]Liu M,Jing S U,Sun J H,et al.Effects of sustained high glucose on the expressions of genes related to apoptosis and function of islet cells[J].Chinese Journal of Endocrinology & Metabolism, 2003
[3]Jun H U,Zhu L,Yang S J,et al.Effects of DL-propargylglycine on isletβ-cell function and apoptosis-related proteins in type 2 diabetic rat[J].Chinese Journal of Hospital Pharmacy,2015
[4]马文心.糖尿病中医治疗的现状刍论[J].糖尿病新世界,2014,17(7):76-78
[5]Nolan C J,Madiraju MS,Delghingaro-Augustov,et al.Fatty acid signaling in thebeta-cell and insulin secretion[J].Diabet es,2006,55(Suppl 2):S16-23
[6]Prentki M,Nolan C J.Isletβcell failure in type 2 diabetes[J].J Clin Invest,2006,116(7):1802-1812
[7]Higa M,Shimabukuro M,Shimajiri Y,et al.Protein kinase B/Akt signalling is required for palmitate-inducedβ-cell lipotoxicity[J].Diabetes Obes Metab,2006,8(2):228-233
[8]何 庆,刘 铭,苏 京,等.高浓度葡萄糖对胰岛细胞凋亡及凋亡相关基因的影响[J].天津医药,2006,34(3):176-179
[9]程 群,彭永德,董维平,等.Visfatin通过线粒体途径抑制胰岛β细胞凋亡[J].上海交通大学学报,2009,29(8):922-924
[10]王 威,张 丹.线粒体功能障碍在胰岛细胞脂性凋亡中的作用[J].中国病理生理杂志,2010,26(1): 163-167
[11]Avram D,Ranta F,Hennige AM,et al.IGF-1 protects against dexamethasone-induced cell death in insulin secreting INS-1 cells independent of AKT/PKB phosphorylation[J].Cell Physiol Biochem,2008,21:455-462
[12]Hui HX,Nourparvar A,Zhao XN,et al.Glucagon-like peptide-1 Inhibits apoptosis of insulin-secreting cells via a cyclic 5’-adenosinemonophosphate-dependent protein kinase A and a phosphatidylinositol3-kinase-dependent pathway[J].Endocrinology,2003,144:1444-1455
[13]Yingdi Luo,Yanhua Lu.2’,4’-Dihydroxy-6’-methoxy-3’,5’-dimethylchalcone inhibits apoptosis ofMIN6 cells via improving mitochondrial function[J].Pharmazie,2012,(67):798-803
[14]H ohm eier HE,Newgard CB.C ell lin es der ived from pan creatic is lets[J].Mol Cell Endocrinol,2004,228(1-2):121-128
(2016-03-04 收稿)(库雪飞 编辑)
敬 告
请登录(http://hblhdx.cbpt.cnki.net)在线投稿
Comparative study on different modeling methods of MIN6 cell injury model
CHENG Ruiting,WANG Chenbin,TIAN Chunyu,et al
(Institute of Traditional Chinese Medicine,North China University of Science and Technology,Tangshan 063000,China)
Objective To select the best modeling method by comparing the different establishment methods of MIN6 cell injury model.Methods The cells with good growth status were divided into 96-well plates,cultured to the logarithmic growth phase and then treated with various concentrations of palmitic acid(PA),glucose(GLU),palmitic acid+glucose(PA+GLU) and dexamethasone (DXM) and hydrogen peroxide (H2O2) for 12h,the cell activity was examined by CCK-8,and calculate the IC50.The normal control group was established and the cells were treated with IC50 concentration for 6h.Apoptosis was detected by flow cytometry;The insulin secretion was detected by ELISA.Results Cell activity results showed a good dose-dependent for each model agent;After intervention with IC50 concentration respectively,the early apoptosis and late apoptosis were increased compared with the normal group,and the early apoptosis and insulin secretion in PA+GLU group were higher.Conclusion After intervention with PA+GLU on MIN6 cells,the increase of the proportion of early apoptosis and insulin secretion are similar to those of patients with type 2 diabetes mellitus,which is in accordance with the requirement of building models.
T2DM.MIN6 cell injury model.Insulin
河北省科技计划项目(编号:14397705D);河北省中医药管理局科研计划项目(编号:2014190)。
程瑞婷(1989-),女,硕士。研究方向:内分泌。
喇孝瑾。
R 329
A
2095-2694(2017)04-258-05
