SPE/GC-MS/SIM法同时测定水中7类27种SVOCs的方法研究
2017-08-01刘同喆袁鹏辉殷淑翠
董 军,刘同喆,袁鹏辉,2,殷淑翠
(1. 山东省地矿工程勘察院,山东 济南 250014;2. 中国石油大学(北京) 重质油国家重点实验室,北京 102249)
SPE/GC-MS/SIM法同时测定水中7类27种SVOCs的方法研究
董 军1*,刘同喆1,袁鹏辉1,2,殷淑翠1
(1. 山东省地矿工程勘察院,山东 济南 250014;2. 中国石油大学(北京) 重质油国家重点实验室,北京 102249)
通过优选色谱柱,进一步改进色谱分离条件,优化前处理方法,建立了一种快速、高效测定水中7类27种半挥发性有机污染物(SVOCs)的GC-MS方法。该法可分析的目标物种类多、前处理速度快、萃取溶剂用量少、环境污染小、色谱运行时间短,40 min内完成分析,适用于大批量样品检测。另外,使用基质匹配标准溶液配制标准曲线,减小了基质效应,采用分段法选择离子(SIM)扫描,可获取更高灵敏度。该方法的检出限为0.000 4~0.013 μg/L,回收率为70.5%~92.8%,相对标准偏差(RSD,n=6)不大于11.2%。
半挥发性;气相色谱-质谱;基质效应;同时测定;批量处理
社会经济的高速发展,城乡一体化进程的加快,以及发展迅猛的化工业和农药化肥的大量使用,均会造成水质恶化[1-4]。环境保护部发布的《2015年中国环境状况公报》中显示,以浅层地下水为监测对象时,水质评价结果总体较差,严重影响了居民生活质量和人体健康。其中,水污染中半挥发性有机污染物(SVOCs)对人体的伤害较大,有机氯、有机磷和多环芳烃等化合物均为目前水体中存在的主要有机污染物,具有致癌、致畸和致突变“三致”作用,已被我国列为水体中的优先控制污染物[5-6]。
测定水中SVOCs的传统方法有气相色谱法、液相色谱法等,需分类分次进行检测,前处理方法通常为液液萃取法,但所需有机试剂种类多,用量大,易造成二次污染。因此,传统方法已不能满足快速的分析要求[7-9],同时快速测定水中多种类SVOCs的方法研究迫在眉睫。本文建立了一种快速测定水中有机氯、有机磷、菊酯类、酚类、氨基甲酸脂类、多环芳烃类以及三嗪类等7类27种SVOCs的分析方法,该法前处理过程高效、快速、绿色,充分发挥了GC-MS同时测定多指标及灵敏度高的优势[10-17],为水中有机污染物的检测、监控以及水质保护提供了技术保障[18]。
1 实验部分
1.1 仪器与试剂
7890B/5977A气相色谱-质谱联用仪(Agilent公司,美国);Turbo Vap Ⅱ全自动氮吹浓缩仪(Biotage公司,瑞典);24道固相萃取装置(Supelco公司,美国);Molelement1810a超纯水机(上海摩勒科学仪器有限公司);其它设备(定制)。

1.2 实验条件
1.2.1 色谱条件 VF-1701MS色谱柱(30 m×0.25 mm×0.25 μm),载气为氦气(纯度99.999%);柱温箱升温程序:70 ℃保持1 min,以25 ℃/min升至160 ℃,再以3 ℃/min升至220 ℃,最后以25 ℃/min升至280 ℃,保持20 min;不分流进样,进样量为1 μL,进样口温度290 ℃,传输线温度280 ℃,全扫描范围:m/z35~510。
1.2.2 质谱条件 电离模式:电子轰击(EI);轰击能量:70 eV;离子源温度230 ℃,四极杆温度150 ℃;溶剂延迟时间:5.0 min;全扫描(SCAN)用于目标物定性分析,选择离子检测(SIM)定量(依据定性分析后得出的保留时间,分成5~14.2、14.2~17.2、17.2~23.2、23.2~30.0、30.0~35.0、35.0 min~试验结束共6段监测,并通过定量离子进行定量分析),每种目标物的定量离子见表1。
1.2.3 预处理条件 将C18柱固定在固相萃取装置上,依次各加5 mL二氯甲烷、5 mL二氯甲烷-乙酸乙酯(1∶1)混合液和5 mL甲醇进行预处理,活化液自然流经萃取柱,近干时加10 mL水,保持水位高于小柱内填料。
1.2.4 基质匹配标准溶液的配制 取空白基质溶液,按照本实验方法进行前处理,不加内标,取1.0 mL空白提取液,放入氮吹仪吹至近干后用标准中间液1.0 mL复溶,分别配制7种不同浓度的基质匹配标准工作液。
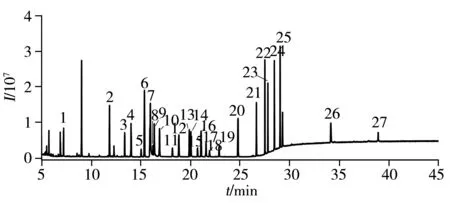
图1 27种SVOCs的全扫描总离子流色谱图(2.00 mg/L)Fig.1 TIC chromatogram of 27 kinds of SVOCs(2.00 mg/L) the peak numbers denoted were the same as those in Table 1
2 结果与讨论
2.1 色谱柱的选择
考察了HP-5MS柱(30 m×0.25 mm×0.25 μm)、DB-35MS柱(30 m×0.25 mm×0.25 μm)、VF-1701MS柱(30 m×0.25 mm×0.25 μm)和DB-FFAP柱(30 m×0.25 mm×0.25 μm) 4种不同极性色谱柱对浓度为2.00 mg/L的27种半挥发性有机物的分离效果。结果显示,HP-5MS色谱柱对目标物分析总用时41 min,其中毒死蜱与对硫磷、七氯与马拉硫磷、莠去津与五氯酚3组化合物的分离效果较差;DB-35MS色谱柱对目标物分析总用时55 min,但乐果与呋喃丹、毒死蜱与马拉硫磷的分离效果较差;DB-FFAP色谱柱的分离效果较差;而VF-1701MS色谱柱对所有化合物均显示了较好的分离效果,且峰形对称,分离度高,基线低,柱流失小。故实验最终选择VF-1701MS(30 m×0.25 mm×0.25 μm)色谱柱进行分离,27种SVOCs的全扫描总离子流色谱图见图1。
2.2 洗脱剂及用量的选择
乙酸乙酯、二氯甲烷、乙腈和丙酮是较常用的洗脱剂,通常能够获得较高的回收率,但考虑到乙腈、丙酮的毒性较强,本研究选取乙酸乙酯、正己烷、二氯甲烷、甲醇4种洗脱溶剂,以1∶1∶1的比例任意搭配其中3者分别进行洗脱,考察了4种洗脱溶剂3种组合情况下的洗脱效果,结果见图2。
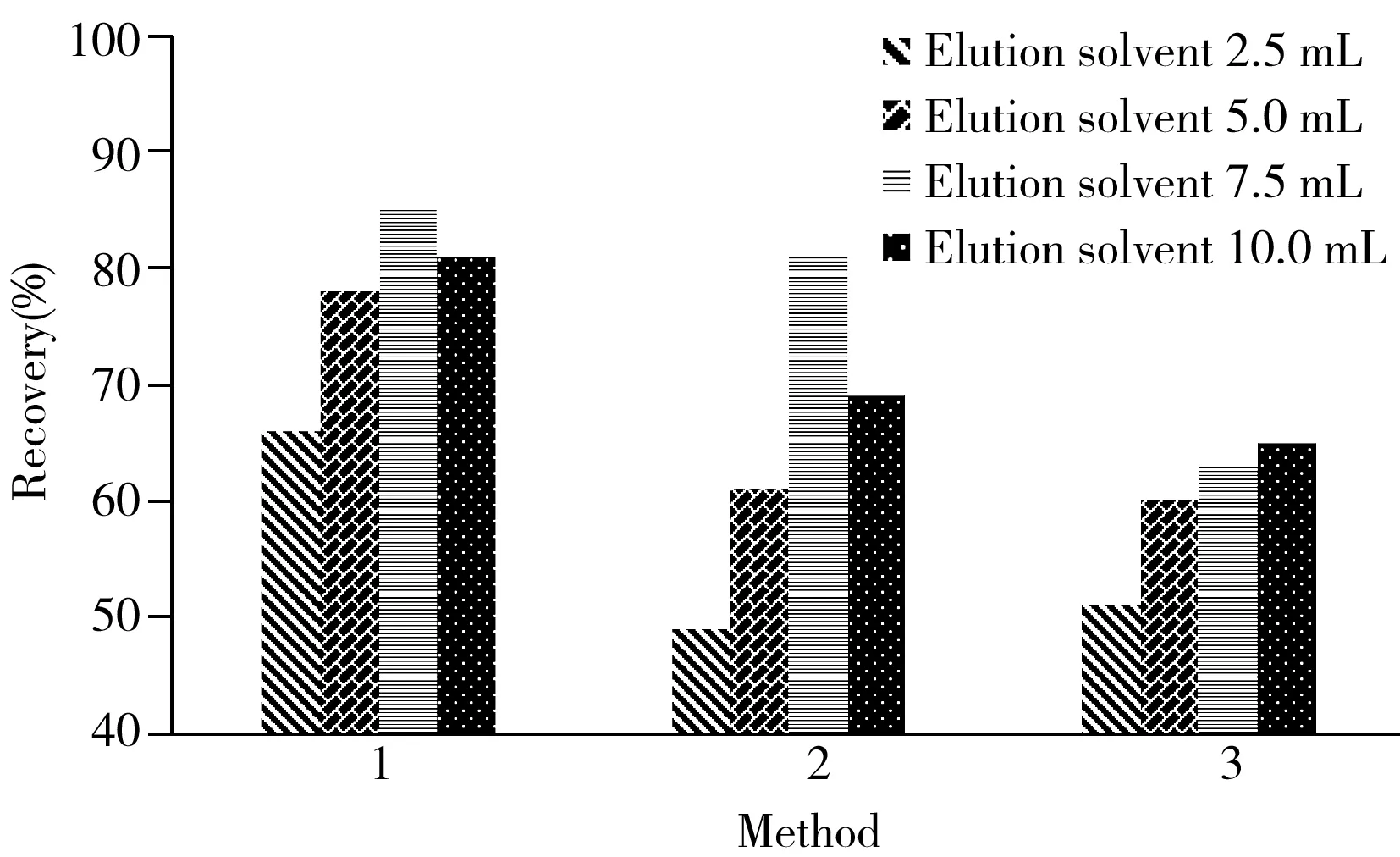
图2 不同洗脱剂及用量对回收率的影响Fig.2 Effect of different eluents and dosage on recovery method 1:hexane-ethyl acetate-dichloromethanee(1∶1∶1);method 2:ethyl acetate-hexane-methanol(1∶1∶1);method 3:methanol-ethyl acetate-dichloromethane(1∶1∶1)
由图2可见,洗脱剂用量各为2.5 mL时27种半挥发性有机物的回收率较低;随着洗脱剂用量的增加,洗脱效率提高;从洗脱剂种类来看,洗脱方法3(甲醇、乙酸乙酯、二氯甲烷以及三者混合液(1∶1∶1))的效果较差,洗脱方法2(乙酸乙酯、正己烷、甲醇以及三者混合液(1∶1∶1))的效果不稳定。基于洗脱剂用量少、洗脱效率高的原则,最终确定洗脱方法1中的正己烷、乙酸乙酯、二氯甲烷以及三者混合液(1∶1∶1)各5 mL进行洗脱。
2.3 富集流速的确定
水样流经固相萃取柱的速率不仅影响目标物的保留效果,而且影响目标物的萃取效率。低流速有利于目标物的保留,而高流速可缩短萃取时间。本文考察了富集流速(5~15 mL/min)对萃取效率的影响。结果表明,富集流速在5~12 mL/min内萃取效率基本保持稳定,进一步增大流速,萃取效率则明显降低。因此,选择最佳富集流速为10 mL/min。
2.4 离子强度与样品pH值的确定
由于目标物的萃取效率受样品基底的干扰,萃取前需向样品溶液中加入NaCl,使溶液的离子强度增强,以降低目标物在水中的溶解度,从而进一步提高萃取效率。
向待测水样中加入不同量的NaCl,结果表明,在0~10 g范围内随着NaCl用量的增加,多数目标物的回收率变化较小,但少数目标物(内吸磷、呋喃丹等)的回收率呈减小趋势。其原因可能为随着离子强度的增加,部分有机物在水溶液中的溶解度降低,相应的萃取效率也下降。考虑到不加NaCl易产生乳化现象,本实验最终选择加入5 g NaCl以改善溶液离子强度。
溶液pH值对萃取效率的影响较大,可通过调节样品基质的pH值,改变目标物的存在形式,从而提高萃取效率。多批次试验结果表明,pH 2.0时,五氯酚、甲萘威、呋喃丹等目标物的萃取效率明显提高,故本方法确定pH值为2.0。
2.5 标准曲线

由于基质的种类和含量会影响回收率,并且有些有机污染物的空白基质加标回收率可能比理论值高(如呋喃丹回收率104.6%、α-六六六回收率113.1%、β-六六六回收率106.2%),因此利用空白基质匹配标准溶液进行校准。
采用基质匹配标准溶液配制7种不同浓度的标准曲线工作液。27种混标和替代物标准曲线工作液浓度分别为5,10,25,50,100,250,500 μg/L(五氯酚浓度为各标准曲线点的4倍),每个标准曲线工作液中的内标浓度均为50 μg/L。采用本方法对标准溶液系列进行分析。结果显示,各目标化合物在5~500 μg/L范围内(其中五氯酚在20~400 μg/L范围内)线性良好,相关系数r2≥0.998 1(见表1)。
2.6 方法精密度、检出限与加标回收率
取1 L水,分别加入不同体积的标准中间液,配制成目标化合物质量浓度分别为0.05,0.25,0.50 μg/L的加标水样(其中内标物浓度为0.05 μg/L,替代物浓度为0.05 μg/L),各浓度重复测定6次,计算6次平行测定的标准偏差,按照MDL=t(n-1,0.99)×S计算方法检出限,并统计加标回收率,结果见表1。由表1可见,该方法检出限为0.000 4~0.013 μg/L,回收率为70.5%~92.8%,相比于《GB 5750-2006》附录B中的检测方法,具有检出限低的优势。
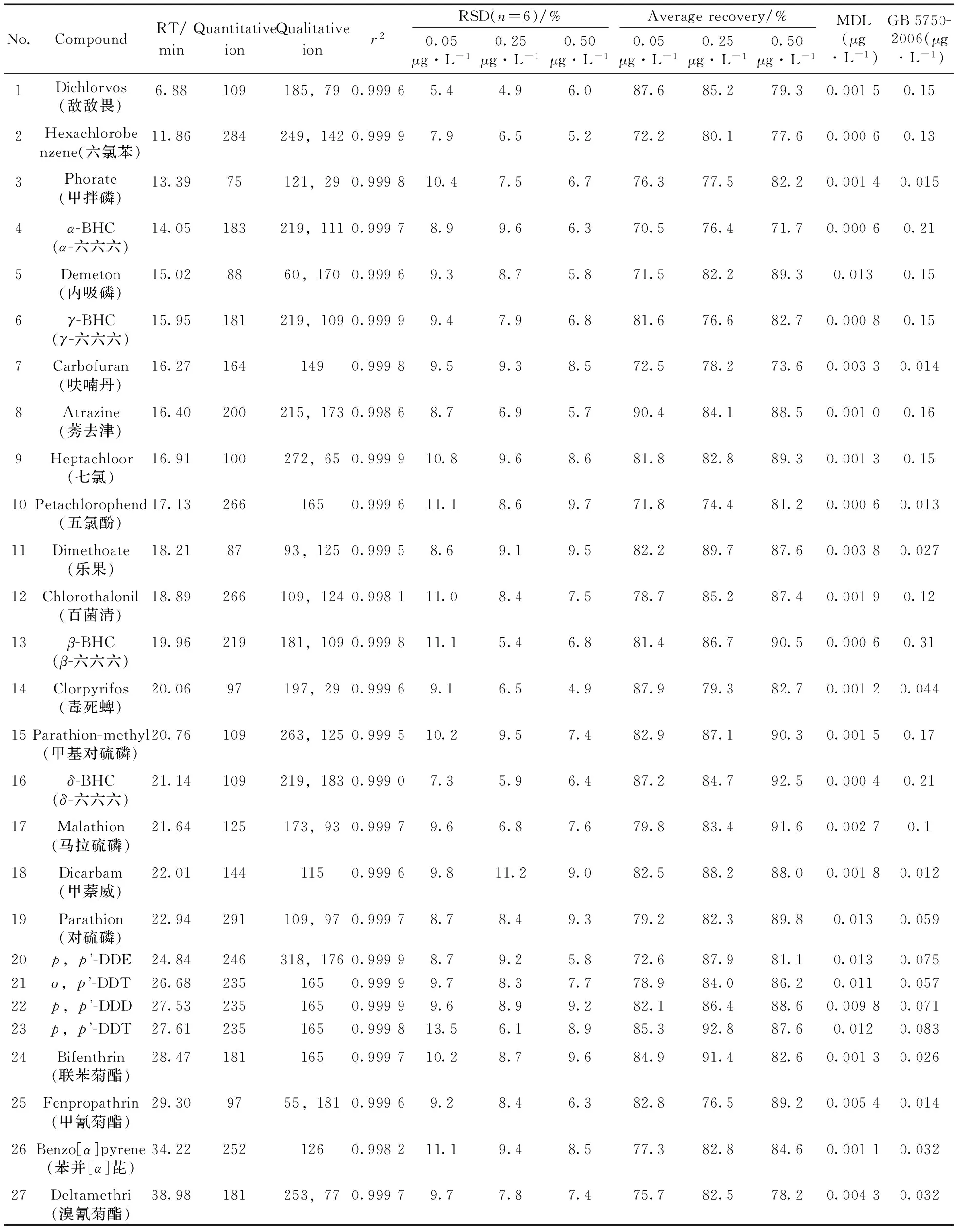
表1 27种SVOCs的保留时间、相关系数、方法精密度、检出限与加标回收率Table 1 Retention time(RT),correlation coefficients,RSDs,MDLs and recoveries of 27 kinds of SVOCs methods
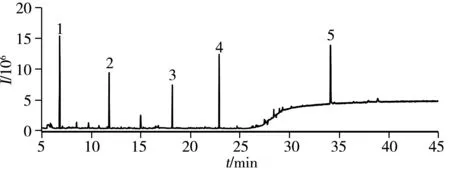
图3 3#水样检测的总离子流色谱图Fig.3 TIC chromatogram of water sample 3# 1.dichlorvos;2.hexachlorobenzene;3.dimethoate; 4.parathion;5.benzo[α]pyrene
2.7 实际样品的测定
采用本方法对济南市某地区的6个实际样品(正副样两组)进行检测,由于靠近蔬菜大棚基地,部分水质中含有痕量半挥发性有机污染物,如敌敌畏(0.002 3~0.003 7 μg/L)、六氯苯(0.000 8 μg/L)、δ-六六六(0.001 4 μg/L)、乐果(0.005 2~0.006 1 μg/L)、对硫磷(0.015~0.026 μg/L)、p,p’-DDT(0.015 μg/L)、苯并[α]芘(0.002 0~0.002 3 μg/L),但均未超出国家限量值。 3#水样检测的总离子流色谱图见图3。
3 结 论
本文建立了固相萃取/气相色谱-质谱法(SPE/GC-MS)测定水中7大类27种半挥发性有机污染物,该法分离效果好、检出限低、重现性好、回收率高,并验证了短时间内批量测定水样的可行性,可为水文地质调查和环境污染保护提供数据支持。
[1] Liu F Z.ShandongEnviron.(刘锋章.山东环境),1998,4:70-77.
[2] Dong W F,Fu D Q.Environ.Sci.Technol.(董文福,傅德黔.环境科学与技术),2009,32(7):75-77.
[3] Qin D L,Luo Y P,Huang Z,Hu J,Fan J,Liao Y H.Environ.Sci.Technol.(秦迪岚,罗岳平,黄哲,胡军,樊娟,廖岳华.环境科学与技术),2012,35(8):193-198.
[4] Bi J,Qu C S,Huang L.Environ.Monit.Forewarn.(毕军,曲常胜,黄蕾.环境监控与预警),2009,1(1):1-5.
[5] Xiao J,Zhao J B.An’huiAgric.Sci.(肖军,赵景波.安徽农业科学),2005,33(12):2376-2377.
[6] Shen G X,Yan G A.Prog.Environ.Sci.(沈国兴,严国安.环境科学进展),1999,7(6):131-139.
[7] Wang T Y,Deng X Y.Anal.Instrum.(王统艳,邓晓燕.分析仪器),2012,1:6-12.
[8] Liu Y,Tang Y F,Song J F,Hu Z W.Chin.J.Chromatogr.(刘永,唐英斐,宋金凤,胡志伟.色谱),2014,32(2):139-144.
[9] Yan K L,Lin L Q,Zheng X X,Xiao X H,Cao Y J.Chin.J.Chromatogr.(严矿林,林丽琼,郑夏汐,肖小华,曹玉娟.色谱),2013,31(7):634-639.
[10] Huo J B,Wang X Y,Sun D L,Zhao J Q,Lin X T.Chin.J.Anal.Chem.(霍江波,王小逸,孙东玲,赵靖强,林兴桃.分析化学),2014,42(4):531-535.
[11] Wang L,Wang B,Luo H Y,Xian Y P,Wu Y L,Dong H,Chen Z L.J.Instrum.Anal.(王莉,王斌,罗海英,冼燕萍,吴玉銮,董浩,陈宗良.分析测试学报),2016,35(12):1548-1553.
[12] Gao R,Rao Z,Guo X C,Huang Y,Li X J.J.Instrum.Anal.(高冉,饶竹,郭晓辰,黄毅,李晓洁.分析测试学报),2014,33(5):539-544.
[13] Duan L C,Zhou J Y,Li J X,Li P F,Xu F,Wang Q.J.Instrum.Anal.(段丽村,周建于,李佳欣,李鹏飞,徐芳,王琦.分析测试学报),2016,35(12):1606-1610.
[14] Peng X J,Liang W H,Peng M,Liang Y Z.J.Instrum.Anal.(彭晓俊,梁伟华,彭梅,梁优珍.分析测试学报),2016,35(10):1267-1272.
[15] Jia Y Y,Tan J H,Xu C,Tang J J,Wang Y L,Xie Q L.Chin.J.Chromatogr.(贾妍艳,谭建华,徐晨,汤嘉骏,王赢利,解启来.色谱),2014,32(3):263-267.
[16] Zheng Y,Xu X L,Ji S L,Yuan F,Huang Z Q,Yang B C,Zhang F.J.Instrum.Anal.(郑阳,许秀丽,纪顺利,袁飞,黄志强,杨丙成,张峰.分析测试学报),2016,35(8):987-992.
[17] Han D F,Gong X H,Liu X J,Ren L H,Qiao D,Luo J J,Xu Y J,Xiao L L.J.Instrum.Anal.(韩典峰,宫向红,刘小静,任利华,乔丹,罗晶晶,徐英江,肖雷雷.分析测试学报), 2016,35(7):839-843.
[18] Liu Y L,Chen Z L,Bi C J,Sun W W,Shen J,Ye M W.Environ.Sci.Technol.(刘耀龙,陈振楼,毕春娟,孙玮玮,沈军,叶明武.环境科学与技术),2008,31(12):116-120.
Simultaneous Determination of 27 Kinds of SVOCs in Water by SPE/GC-MS/SIM
DONG Jun1*,LIU Tong-zhe1,YUAN Peng-hui1,2,YIN Shu-cui1
(1. Shandong Geological Engineering Investigation Institute,Jinan 250014,China;2. State Key Laboratory
of Heavy Oil Processing,China University of Petroleum,Beijing 102249,China)
By optimizing the chromatographic column,further improving the chromatographic separation condition and optimizing the pretreatment method,a rapid and efficient method was established for the determination of 27 kinds of semi volatile organic pollutants(SVOCs) in groundwater by GC-MS. The outstanding features of this method are the variety of analytes,rapid processing,low solvent consumption,low environmental pollution and short chromatographic run time. The method could keep stable for 40 min,and is suitable for the detection of large quantities of samples. In addition,the standard curve was prepared using the matrix matched standard solution,which lead to the matrix effect reduced,and the application of the ion(SIM) scanning could obtain a high sensitivity. The detection limits of the method are in the range of 0.000 4-0.013 μg/L,and the spiked recoveries are 70.5%-92.8% with RSD(n=6) not more than 11.2%.
SVOCs; GC-MS; matrix effect; simultaneous determination;batch processing
2017-01-12;
2017-03-10
山东省2015年度31个省级地质勘查资助项目(SDZS-2015-GTT01 包号:D3)
10.3969/j.issn.1004-4957.2017.07.014
O657.6;O741.6
A
1004-4957(2017)07-0916-05
*通讯作者:董 军,工程师,研究方向:环境中有机污染物分析与监测,E-mail:dkvip801@163.com
