QuEChERS/UPLC-MS/MS法测定水产品中孔雀石绿和结晶紫及其代谢物
2017-08-01宫小明华萌萌王洪涛王炳军马荣桧
宫小明,华萌萌,王洪涛,王炳军,马荣桧
(潍坊出入境检验检疫局,山东 潍坊 261041)
QuEChERS/UPLC-MS/MS法测定水产品中孔雀石绿和结晶紫及其代谢物
宫小明*,华萌萌,王洪涛,王炳军,马荣桧
(潍坊出入境检验检疫局,山东 潍坊 261041)
建立了水产品中孔雀石绿(MG)和结晶紫(CV)及其代谢物隐色孔雀石绿(LMG)和隐色结晶紫(LCV)残留的QuEChERS/UPLC-MS/MS分析方法。样品采用乙腈提取,改进的QuEChERS(EMR-Lipid)分散固相萃取净化,经Agilent Eclipse Plus C18(1.8 μm,3.0 mm×100 mm)色谱柱分离,电喷雾串联四极杆质谱多反应监测正离子方式测定。4种分析物在0.2~10.0 μg/L范围内线性关系良好,相关系数均大于0.997。鱼肉中4种分析物在0.5,1.0,5.0 μg/kg加标浓度水平下,回收率为77.1%~106.6%,相对标准偏差(RSD)为1.3%~4.3%。该方法简单、稳定、可靠,能有效去除样品中的蛋白质、脂肪等大分子杂质,可满足水产品中孔雀石绿、结晶紫以及隐色代谢物残留检测与确证的需要。
QuEChERS;EMR-Lipid;UPLC-MS/MS;孔雀石绿;隐色孔雀石绿;结晶紫;隐色结晶紫
孔雀石绿(Malachite green,MG)、结晶紫(Crystal violet,CV)同属于碱性三苯甲烷类染料,因具有消毒杀菌作用,在水产养殖过程中常作为杀菌剂和抗寄生虫药用于防治各种鱼病。MG和CV在生物体内分别代谢降解为隐性孔雀石绿(Leucomalachite green,LMG)和隐性结晶紫(Leucocrystal violet,LCV)。三苯甲烷类及其代谢物具有较高毒性、致癌、致畸、致突变等特性,在生物体内具有较高残留,对人体危害较大,近年成为水体污染和水产品安全的重点监控污染物[1-8]。美国、加拿大和欧盟等国已将MG和CV列为水产养殖禁用药,许多国家也制定了相关的法律法规及检测措施[9]。中国于2002年5月将MG列入《食品动物禁用的兽药及其化合物清单》,禁止用于所有食品动物中;农业行业标准使用准则《无公害食品渔用药物使用准则》(NY 5071-2002)中也将MG列为禁用药物,同时严禁在水产养殖中使用MG和CV,并规定MG(含LMG)和CV(含LCV)不得检出[10]。但由于MG抗菌效果好、价格低、替代品少等原因,仍有少部分养殖用户违法使用。
目前,三苯甲烷类物质的测定多采用液相色谱法(紫外检测[11]、荧光检测[12])或液相色谱-质谱联用技术[3-7]。由于LMG和LCV在紫外可见区无吸收峰,而MG和CV无荧光响应,故采用高效液相色谱法同时测定这几类物质时常需借助一定的前处理手段,造成过程繁琐且方法检出限较高,无法满足实际检测要求。高效液相色谱-串联质谱分析方法国内外屡见报道[13-14],该方法灵敏度高,对净化要求高,并且可同时进行定量检测和定性确证。本研究采用新型的QuEChERS-EMR技术进行前处理,高效液相色谱-串联质谱法进行检测,建立了水产品中孔雀石绿和结晶紫以及隐色代谢物残留同时检测的方法。本方法简单、快速、可靠,克服了传统QuEChERS[15-19]吸附粉末去除蛋白质、脂肪等大分子效果差的缺点,通过采用新型吸附剂EMR,不仅能够有效去除动物样品中的大分子杂质,降低基质效应,提高方法的准确度和精密度,还能够降低检测过程中对质谱源和液相色谱柱的污染。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1260-6430液相色谱-串联质谱仪(Agilent1200-6430);万分之一天平(Mettler AE163);均质器(IKA T25);振荡器(IKA MS1);离心机(Eppendorf 5810R);氮吹仪(Organomation N-EVAP-111)。
乙腈、甲醇、甲酸(色谱纯);实验用水为Milli-Q超纯水,使用前过0.45 μm滤膜;QuEChERS dSPE EMR-lipid,Final Polish EMR-lipid(Agilent公司);中性Al2O3(分析纯)、N-丙基乙二胺粉(PSA)、二甲基十八碳硅烷粉(ODS)、氨丙基粉(NH2)均购自Agela 公司。孔雀石绿、隐色孔雀石绿、结晶紫、隐色结晶紫标准品(纯度≥99%),均购自Sigma公司;同位素内标孔雀石绿-D5购自Witega公司,隐色孔雀石绿-D6、结晶紫-D6、隐色结晶紫-D6同位素内标均购自Sigma公司,用乙腈溶解定容至100 mL,得浓度为100 mg/L的标准储备液,避光于4 ℃下保存。
1.2 样品处理
1.2.1 提 取 称取4.0 g(精确至0.1 g)样品置于50 mL离心管中,加入10 mL乙腈,均质3 min,4 ℃条件下10 000 r/min离心10 min,上清液过滤备用。
1.2.2 净 化 QuEChERS dSPE EMR-lipid(除脂分散净化包)预先用5 mL水浸润活化(需涡混),加入5 mL上清液(“1.2.1”提取液)至 EMR-lipid管中,涡混5 min,以尽量去除样品中的脂类等杂质。4 ℃条件下10 000 r/min离心10 min。 取上清液5 mL移入Final Polish EMR-lipid(除脂萃取盐包)中,涡混5 min,确保最后一步去除杂质的效果最佳。然后在4 ℃条件下10 000 r/min离心10 min。上清液分为有机层(上层)和水层(下层),取有机层2 mL至10 mL玻璃管中,在45 ℃用氮气浓缩仪吹干。准确加入1.0 mL初始流动相溶解残渣,过0.2 μm滤膜,进行质谱检测。
1.3 液相色谱-串联质谱条件
1.3.1 液相色谱条件 色谱柱:Agilent Eclipse Plus C18(1.8 μm,3.0 mm×100 mm);柱温:40 ℃,流速:0.3 mL/min,进样量:10 μL;流动相:A为 5 mmol/L乙酸铵-0.02%甲酸水,B为乙腈,梯度洗脱程序:0~3 min,20%B ;3~5 min,20%~90%B;5~5.5 min,90%~20%B;5.5~7.5 min,20%B。
1.3.2 质谱条件 电离源:电喷雾离子源(ESI+);扫描方式:多反应监测(MRM)模式;离子源温度:350 ℃;干燥气流速:9 L/min;喷雾针压力:40 psi;电子倍增器电压:4 000 V;碰撞气:高纯氮(纯度为99.999%)。4种待测物及内标的质谱参数见表1。
2 结果与讨论
2.1 提取溶剂的选择
水产品基质的化学成分复杂,且其脂肪含量较高,而孔雀石绿和结晶紫在水产品中主要以其隐色代谢物形式存在,这些隐色代谢物具有很好的亲脂性。本文分别考察了甲醇、乙腈作为提取溶剂的效果,发现两者均可得到良好的提取效果,但乙腈能更有效地沉淀蛋白,减少杂质干扰,同时也利于下一步QuEChERS净化,因此实验选择乙腈作为提取溶剂。
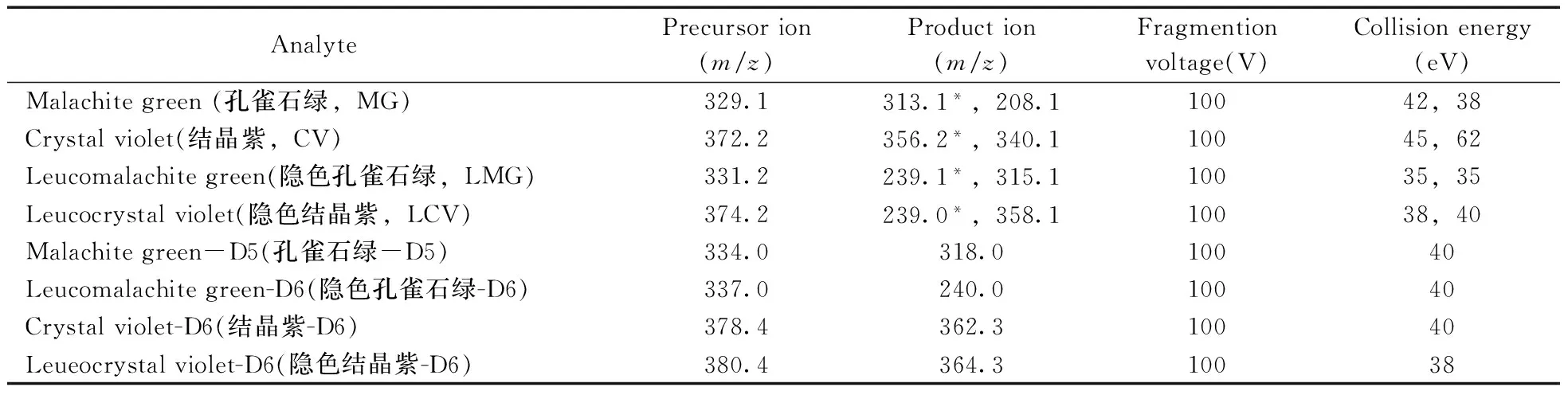
表1 4种待测物及内标的质谱参数Table 1 MS parameters of 4 analytes and their isotope labeled standards
*quantitation ion
2.2 吸附剂粉对目标物回收率的影响
将2 mL用初始流动相溶解的一定浓度的4种待测物混标溶液分别加入150 mg ODS,PSA,NH2以及中性Al2O3中;将5 mL相同浓度的混标溶液加入 1.0 g EMR-Lipid中处理,经涡混、离心后,取1 mL上清液,氮吹,流动相定容,过0.2 μm滤膜,上机检测,计算平均回收率及相对标准偏差,以考察不同吸附剂粉对回收率的影响(数据见表2)。从表2可以看出,PSA和ODS对孔雀石绿和隐色孔雀石绿有基质增强作用,NH2对结晶紫的吸附作用较强,而中性Al2O3和EMR-Lipid对4种待测物无明显吸附作用。
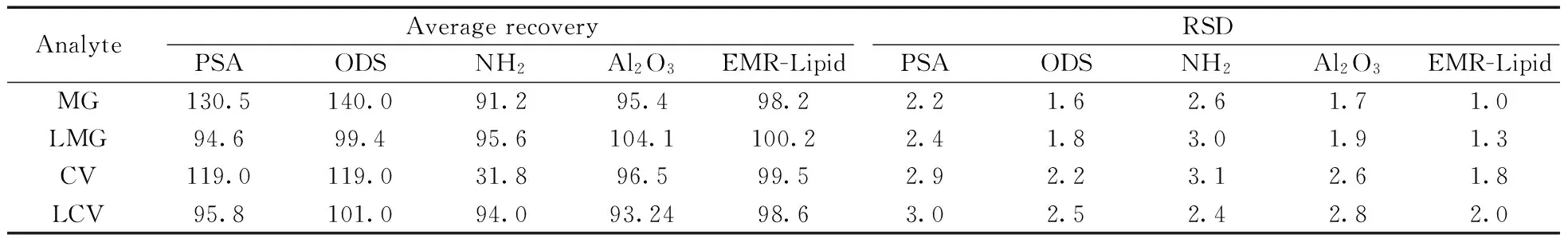
表2 4种待测物分别经不同吸附剂处理后的平均回收率和相对标准偏差 (%)Table 2 Average recoveries and relative standard deviations(RSDs) of 4 analytes after adsorbed by different adsorbents(%)
2.3 EMR净化效果的研究
传统QuEChERS法的原理是通过吸附粉末的吸附作用达到净化效果,此种净化方法主要用于农残检测中中小分子杂质的去除。本方法进一步引入新型的吸附剂(EMR),通过疏水选择性结合吸附作用,可有效去除含有直链烃类结构官能团的脂类等大分子物质,显著降低基质效应,提高方法的准确度和灵敏度。
2.3.1 对净化效果的考察 将未净化的鱼肉基质提取液(“1.2.1”提取液)和经NH2,ODS,PSA,Al2O3,EMR-Lipid净化后的样品液(“2.2”样品液)分别在不接色谱柱的方式下,利用质谱在全扫描方式下进行考察。结果显示,杂质离子峰m/z132.1,441.2,606.2经NH2,ODS,PSA,Al2O3净化后的效果不明显,而经EMR-Lipid净化后明显降低,说明该方法对大分子和小分子杂质均有明显的吸附作用。
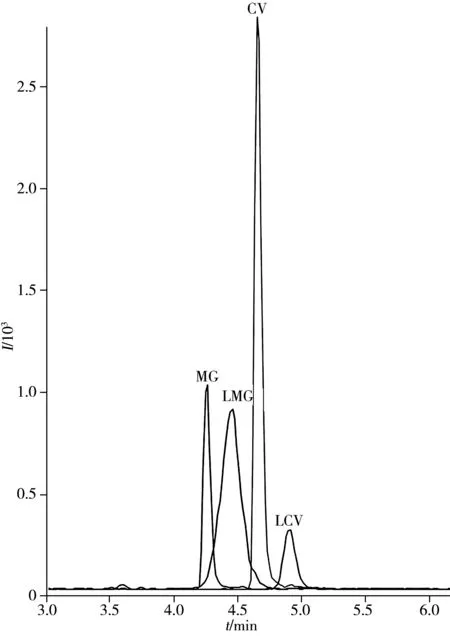
图1 4种目标物的定量离子色谱图(0.4 μg/L)Fig.1 Quantitative ion overlap chromatograms of four analytes (0.4 μg/L)
2.3.2 对目标物出峰时间段杂质干扰净化效果的研究 4种目标物混合标准溶液经液相色谱分离后,其定量离子色谱峰的出峰时间为4.2~5.2 min(如图1)。分别将未净化鱼肉基质提取液(“1.2.1”提取液)和经NH2,ODS,PSA,Al2O3,EMR-Lipid净化后的样品液(“2.2”样品液)经色谱分离,在目标物4.2~5.2 min出峰时间段内通过质谱在全扫方式下进行分析。实验结果显示,主要杂质峰m/z494.3和520.3经EMR-Lipid净化后含量大大降低,有效降低了共流出基质干扰带来的基质效应,提高了方法的准确度和灵敏度。
2.3.3 EMR-Lipid净化后的基质效应研究 通过比较空白鱼肉样品提取液(添加4种目标物0.5 μg/kg)经EMR-Lipid净化前后的MRM色谱图发现,未经EMR-Lipid净化的样品中MG和LMG受基质干扰效应明显,响应值低,峰形差,且有明显的杂质干扰峰;而经EMR-Lipid净化后准确度和灵敏度显著提高,能够进行定量定性分析。
2.4 色谱-质谱条件的优化
孔雀石绿、结晶紫及其代谢物的极性较强,在反相色谱柱上的保留较弱,因此在初始流动相中乙腈的比例较低。本研究比较了0.1%甲酸-乙腈、5 mmol/L乙酸铵-0.1%甲酸-乙腈和5 mmol/L乙酸铵-0.02%甲酸-乙腈3种不同流动相对4种目标物的分离效果。实验表明,在乙腈中加入0.1%甲酸作为流动相时,LCV的响应值低,加入5 mmol/L乙酸铵后,LCV的峰形变差,而在加入0.02%甲酸和5 mmol/L乙酸铵的流动相中,LCV的峰形得到改善,且响应值明显提高,因此实验选择5 mmol/L乙酸铵-0.02%甲酸-乙腈作为流动相。
2.5 线性范围、定量下限、回收率与相对标准偏差
采用内标法定量(内标物为孔雀石绿-D5、隐色孔雀石绿-D6、结晶紫-D6、隐色结晶紫-D6),用初始流动相配制一系列不同浓度的孔雀石绿、结晶紫及其代谢物混合标准溶液作标准曲线进行分析,以峰面积响应强度为纵坐标(Y),待测物浓度为横坐标(X,μg/L),其回归方程及相关系数见表3。结果显示,4种分析物在0.2~10.0 μg/L范围内线性关系良好,相关系数(r)均大于0.997。以3倍信噪比(S/N)对应的加标水平为检出限(LOD),10倍信噪比(S/N)对应的加标水平为定量下限(LOQ),测得4种目标物的检出限均为0.2 μg/kg,定量下限均为0.5 μg/kg。
用空白样品加标方法进行回收率和精密度实验。分别对鱼肉进行0.5,1.0,5.0 μg/kg 3个不同浓度水平的加标回收实验,每个水平平行测定6次,计算回收率和相对标准偏差,结果见表3。4种化合物的回收率为77.1%~106.6%,相对标准偏差(RSD)为1.3%~4.3%。
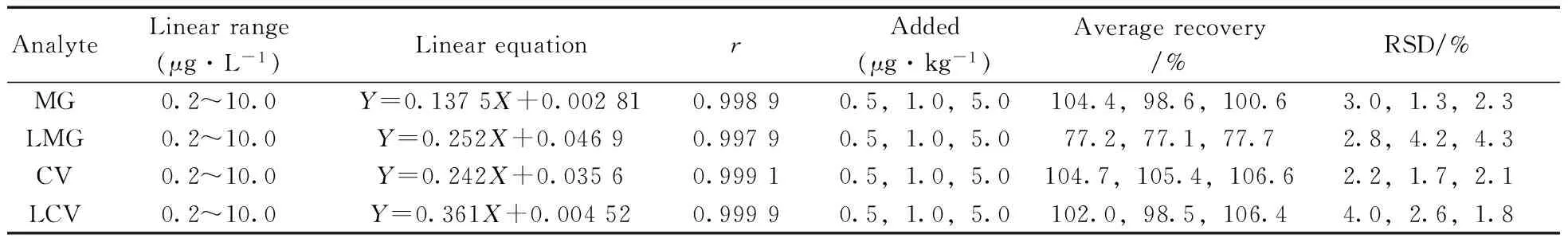
表3 4种待测物的线性范围、回归方程、相关系数、回收率及相对标准偏差Table 3 Linear ranges,regression equations,correlation coefficients(r),recoveries and relative standard deviations(RSDs) of 4 analytes
2.6 实际样品检测
采用本方法对本地市场上销售的多宝鱼进行4种目标物含量的检测,结果测得孔雀石绿为1.48 μg/kg,隐色孔雀石绿为1.34 μg/kg,如图2所示。
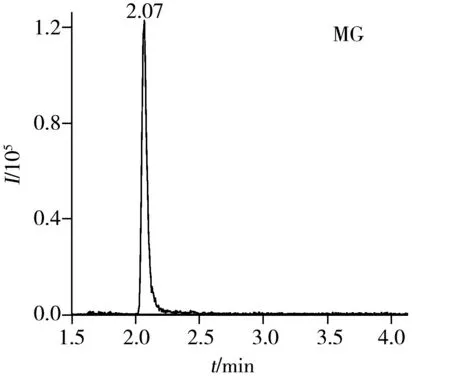
3 结 论
本文采用EMR净化方法的原理通过疏水选择性结合吸附作用,有效去除了含有直链烃类结构官能团的脂类等大分子物质,显著降低了基质效应,提高了方法的准确性和灵敏度。进一步引入新型的吸附剂(EMR),利用改良的QuEChERS(EMR-lipid)法进行样品前处理,不仅能够去除中小分子杂质,还能够有效去除动物组织中的蛋白、脂肪等大分子杂质,再利用高效液相色谱法-串联四极杆质谱进行检测,建立了同时测定水产品中孔雀石绿、结晶紫及其代谢物的方法。该方法具有适用性强、简单快速、经济等特点,可用于实际样品的日常检测。本方法参加了国家认监委组织的“鱼肉中孔雀石绿测定”能力验证项目(合格证书编号:CNCA-16-B11-26),取得了满意结果。
[1] Sun Y C,Li C T,Du N N,Cao D C,Mu Z B,Wu S,Wang H Y,Chen Z X.J.Instrum.Anal.(孙言春,李池陶,杜宁宁,曹顶臣,牟振波,吴松,王海涛,陈中祥.分析测试学报),2013,32(2):205-210.
[2] Liu M Y,Xiao S S,Yu B,Yang C G,Zhao J H,Jin Y,Zhu C Y.J.FoodSaf.Qual.(刘名扬,肖珊珊,于兵,杨春光,赵景红,金雁,朱程云.食品安全质量检测学报),2016,6(1):35-40.
[3] Yin T K,Yang F,Liu Z C,Lin Y H.FisheriesScience(尹太坤,杨方,刘正才,林永辉.水产科学),2016,35(3):272-277.
[4] Song K,Yan Z Y,Zhang X J,Guo Y M.J.AnhuiAgric.Sci.(宋凯,严忠雍,张小军,郭远明.安徽农业科学),2015,43(35):164-166.
[5] Liu W W,Zhu P F, Zhou R,Ling X.J.FoodSaf.Qual.(刘文卫,朱鹏飞,周闰,凌霞.食品安全质量检测学报),2016,7(5):1803-1807.
[6] Li X X,Li J,Sun X J,Feng Y B,Ji X L,Li S,Li J R.Sci.Technol.FoodInd.(李秀霞,李娇,孙协军,冯彦博,季晓琳,李爽,励建荣.食品工业科技),2015,36(3):385-393.
[7] Zhou Y,Zhao Y G,Zhang B B,Zhang Y,Chen G S.Chin.J.Anal.Chem.(周岩,赵永刚,张蓓蓓,章勇,陈国松.分析化学),2014,42(3):367-374.
[8] GB/T 19857-2005.Determination of Malachite Green and Crystal Violet Residues in Aquatic Product.National Standards of the People's Republic of China(水产品中孔雀石绿和结晶紫残留量的测定.中华人民共和国国家标准).
[9] Bergwerff A A,Kuiper R V,Scherpenisse P.Aquaculture,2004,233:55-63.
[10] Gao J F,Gu W X.GuangdongChem.Ind.(高建峰,顾文秀.广东化工),2011,38(10):82-83.
[11] Long C Y,Mai Z B, Zhu B H,Zou X Y,Gao Y H,Huang X Y.J.Chromatogr.A,2008,1203(1):21-26.
[12] Deng J C,Li L H,Yang X Q,Cen J W,Xin S P,Wei Y, Wu Y Y.FoodSci.(邓建朝,李来好,杨贤庆,岑建伟,辛少平,魏涯,吴燕燕.食品科学),2012,33(14):150-153.
[13] Abro K,Mahesar S A,Iqbal S,Perveen S.FoodAddit.Contam.,2014,31(5):827-832.
[14] Kaplon M,Olgun E O,Karaoglu O.J.Chromatogr.A,1349(2014):37-43.
[15] Gong X M,Dong J,Sun J,Yu J L,Pan S Q,Wang H T,Ding K Y.J.Instrum.Anal.(宫小明,董静,孙军,于金玲,潘守奇,王洪涛,丁葵英.分析测试学报),2010,29(9):933-937.
[16] Gong X M,Sun J, Dong J,Yu J L,Wang H T.Chin.J.Chromatogr.(宫小明,孙军,董静,于金玲,王洪涛.色谱),2011,29(3):217-222.
[17] Anastassiades M,Lehotay S J, Stajnbaher D, Schenck F J.J.AOACInt.,2003,86:412-413.
[18] Mastocska K,Dorweiler K J,Lehotay S J,Wegscheid J S,Szpylka K A.J.Agric.FoodChem.,2010,58:5959-5972.[19] Bordin A B,Minetto L,Nascimento F,Beal L L,Moura S.FoodAnal.Methods,2017,10(1):1-9.
Determination of Malachite Green,Crystal Violet and Their Metabolites Residues in Aquatic Product by QuEChERS Combined with UPLC-MS/MS
GONG Xiao-ming*,HUA Meng-meng,WANG Hong-tao,WANG Bing-jun,MA Rong-hui
(Weifang Entry-Exit Inspection and Quarantine Bureau,Weifang 261041,China)
A method for the determination of malachite green(MG),crystal violet(CV) and their metabolites residues leucomalachite green(LMG) and leucocrystal violet(LCV) in aquatic product was developed using QuEChERS combined with UPLC-MS-MS.The sample was extracted with acetonitrile and purified by EMR-Lipid.The target compounds were separated on an Agilent Eclipse Plus C18(1.8 μm,3.0 mm×100 mm) column,and detected by tandem mass spectrometry with electrospray ionization in positive mode.The linear ranges were in the range of 0.2-10.0 μg/L and the correlation coefficients were all above 0.997.The average recoveries of 4 analytes in fish matrix at three spiked concentrations of 0.5,1.0,5.0 μg/kg ranged from 77.1% to 106.6%,with relative standard deviations of 1.3%-4.3%.This method was simple and reliable,and could effectively remove the protein and fat in sample.Therefore,it is suitable for the determination of MG,CV and their leuco metabolites residues in aquatic product.
QuEChERS;EMR-Lipid;UPLC-MS-MS;malachite green(MG);leucomalachite green(LMG);crystal violet(CV);leucocrystal violet(LCV)
2017-02-14;
2017-03-06
10.3969/j.issn.1004-4957.2017.07.010
O657.63;F767.4
A
1004-4957(2017)07-0897-05
*通讯作者:宫小明,硕士,高级工程师,研究方向:农兽药残留及添加剂分析,Tel:0536-8582599, E-mail:9647125@qq.com
