基于QuEChERS提取的超高效液相色谱-串联质谱法测定小麦粉中5种镰刀菌毒素
2017-08-01孙小杰胡文彦王玉梅
杨 军,孙小杰,胡文彦,王玉梅
(南京市食品药品监督检验院,江苏 南京 210038)
基于QuEChERS提取的超高效液相色谱-串联质谱法测定小麦粉中5种镰刀菌毒素
杨 军,孙小杰*,胡文彦,王玉梅
(南京市食品药品监督检验院,江苏 南京 210038)
建立了小麦粉中恩镰孢菌素A、恩镰孢菌素A1、恩镰孢菌素B、恩镰孢菌素B1、白僵菌毒素5种镰刀菌毒素的超高效液相色谱-串联质谱(HPLC-MS/MS)分析方法。小麦粉样品采用改良的QuEChERS方法进行提取,无需进一步净化,以甲醇-2 mmol/L乙酸铵为流动相梯度洗脱,经Agilent Eclipse Plus C18色谱柱(2.1 mm×50 mm,1.8 μm)分离,在电喷雾电离(ESI)正离子模式下采用多反应监测(MRM)进行测定,基质外标法定量。在较宽的线性范围内,5种镰刀菌毒素的相关系数(r2)均不小于0.993,方法检出限为0.3~0.8 μg/kg,定量下限为0.8~2.4 μg/kg。样品在1倍、2倍、10倍定量下限3个加标浓度下的平均回收率为74.0%~85.4%,相对标准偏差(RSDs)为5.6%~13.1%。采用建立的方法对市售的30批次小麦粉中5种镰刀菌毒素进行筛查,数批产品检出不同含量的镰刀菌毒素。该方法简单快速、准确、灵敏,可用于小麦粉中多种镰刀菌毒素的同时分析。
超高效液相色谱-串联质谱(UPLC-MS/MS);镰刀菌毒素;QuEChERS;小麦粉
真菌毒素是一类由丝状真菌的次生代谢产物构成的毒性物质,由于其对人体的毒害性且近年来在食品和植物种子中频繁检出而引起了世界的广泛关注。在农作物生长过程及后续储藏运输过程中,镰刀菌、麦角菌、曲霉菌、青霉菌及链格孢菌均可能产生霉菌毒素,而其中镰刀菌产生的毒素最为流行,在美洲、欧洲及亚洲农产品中均普遍存在[1-4]。
镰刀菌类至少包含100 种以上的植物病菌,所产生的毒素多数化学性质稳定,易残留于最终加工食品中,如脱氧雪腐镰刀菌烯醇(Deoxynivalenol)、玉米赤霉烯酮(Zearalenone)及伏马毒素(Fumonisins)。国家标准《食品安全国家标准食品中真菌毒素限量》(GB2761-2011) 虽对部分已知毒素的限量做了规定,但远不能满足当前食品安全监管的需求[5-7]。近年来,随着研究的不断深入,新兴的镰刀菌毒素(Fusarium mycotoxins)不断被发现,其中4种恩镰孢菌素(Enniatin)A、A1、B、B1,以及白僵菌毒素(Beauvericin)最引人关注。文献表明这些毒素均有不同的毒性,有些毒性甚至超过先前发现的其他毒素,且可能与其他毒素产生协同毒害作用。国外学者曾对全球多个国家和地区的粮食进行该类毒素的筛查,发现潮湿气候的地区粮食中新兴镰刀菌毒素的检出率非常高[8-10]。我国南方地区温暖潮湿,粮谷储存不当极易引起霉菌滋生,产生毒素。迄今为止,国内并无该类毒素公开的检测方法,这给食品安全监管工作带来了很大的风险。
本文采用基于QuEChERS原理的快速提取方法,结合超高效液相色谱-串联质谱技术建立了小麦粉中5种镰刀菌毒素(恩镰孢菌素A、恩镰孢菌素A1、恩镰孢菌素B、恩镰孢菌素B1、白僵菌毒素)的快速测定方法。该方法具有简便快速、可操作性强等优点,可为企业控制产品质量及食品安全监管部门有效监管提供技术支撑。
1 实验部分
1.1 仪器与试剂
Agilent 1290 HPLC-6495 QQQ型超高效液相色谱-串联质谱仪,配有电喷雾离子源(Agilent公司),XS205型电子天平(Metter-Toledo公司),氮吹仪(Organomation公司),离心机(Hettich公司),具塞塑料离心管(50 mL,上海安谱实验科技股份有限公司),有机相微孔滤膜(0.22 μm,上海安谱实验科技股份有限公司),涡旋混合器(Labnet公司)。
甲醇、乙腈(HPLC级,ROE公司);无水硫酸镁(使用前在450 ℃烘烤2 h,冷却后备用)、氯化钠、乙酸铵(分析纯,国药集团化学试剂有限公司);甲酸(纯度≥98.0%,上海安谱实验科技股份有限公司);恩镰孢菌素A(ENA)、恩镰孢菌素A1(ENA1)、恩镰孢菌素B(ENB)、恩镰孢菌素B1(ENB1)、白僵菌毒素(BEA)均购于美国Enzo Biochem公司;实验室用水为经Milli-Q净化系统(0.22 μm过滤膜)过滤的超纯水。
实验样品:购自南京本地超市和小型粮油店,共30个批次。
1.2 色谱-质谱条件
液相色谱柱为Agilent Eclipse Plus C18柱(2.1 mm×50 mm,1.8 μm),柱温35 ℃,进样量1 μL,流动相:A为2 mmol/L乙酸铵,B为甲醇,流速0.3 mL/min,梯度洗脱程序为:0~2 min,10% B;2~7 min,10%~90% B;7~10 min,90% B。每次进样前用10% 流动相B平衡色谱柱3 min。
离子源:电喷雾离子源;扫描方式:正离子扫描;检测方式:多反应监测;毛细管电压:3 500 V;干燥气温度:130 ℃;干燥气流速:11 L/min;雾化气压力:172.4 kPa(25 psi);鞘气温度:350 ℃;鞘气流速:12 L/min;碎裂电压:380 V;高压离子漏斗电压:200 V;低压离子漏斗电压:100 V,其它优化的质谱条件见表1。
1.3 标准溶液的配制
准确称取标准品适量,置于100 mL 棕色容量瓶中,用乙腈分别溶解并定容至刻度,配制成100 mg/L的标准储备溶液,-18 ℃下避光保存备用。用空白样品提取液将标准储备溶液配制成适当浓度的基质混合标准工作溶液,现配现用。
1.4 样品前处理
准确称取2 g样品于50 mL离心管中,加入20 mL含1%甲酸的乙腈-水(50∶50,体积比),再加入1 g氯化钠和4 g无水硫酸镁,涡旋提取2 min,取出,以5 000 r/min离心2 min,取上清液50 ℃下氮吹至近干,用甲醇-2 mmol/L乙酸铵(80∶20,体积比)复溶并定容至1 mL,过0.22 μm滤膜,滤液待上机测试。

表1 5种镰刀菌毒素的优化质谱参数Table 1 Optimized parameters of MS/MS for 5 fusarium mycotoxins
*quantitative ion
2 结果与讨论
2.1 分析条件的优化
2.1.1 色谱条件的优化 考察了甲醇-水、乙腈-水两种常见流动相体系对目标化合物的影响,结果发现,所有目标化合物在甲醇-水体系中的响应均较高。文献表明,待测化合物的化学结构属于离子载体型时,流动相中提供的钠离子和氢离子易与目标物结合形成[M+Na]+和[M+H]+,而在流动相中加入铵盐,可以抑制[M+Na]+的形成,提高离子化效率[11-13]。因此,在水相中分别添加不同浓度的乙酸铵(1,2,5 mmol/L),结果表明乙酸铵浓度为1 mmol/L和2 mmol/L时,目标化合物能得到较好的峰形,且质谱响应较强,本文选用甲醇-2 mmol/L乙酸铵溶液作为流动相。
5种镰刀菌毒素的极性较弱,在反相色谱柱上的保留较强,且本实验前处理过程较为简单,可能带来较大的基质干扰,需要较好的色谱分离条件作为补充,因此流动相选用梯度洗脱程序。通过优化梯度条件(参见“1.2”),能使目标物与干扰组分完全分离,降低了基质影响。

图1 优化条件下5种镰刀菌毒素的HPLC-MS/MS MRM色谱图Fig.1 HPLC-MS/MS MRM chromatogram of 5 fusarium mycotoxins under the optimized condition
2.1.2 质谱条件的优化 在一级质谱全扫描模式下,同时采集正负离子信号,由于目标物的分子量在600~800之间,因此选择扫描范围m/z100~1 000,结果发现目标物在正离子模式下的响应值较好,特征母离子均为[M+H]+。利用离子源和离子漏斗优化软件(Source and iFunnel Optimizer)优化高压离子漏斗电压、低压离子漏斗电压、干燥气温度和流速、鞘气温度和流速。然后在子离子扫描模式下,选择离子响应最高的子离子作为定量离子,响应次高的子离子作为定性离子,最后在多反应监测(MRM)模式下,对目标物的碰撞能量进行优化。5种目标物的优化质谱参数见表1。优化条件下,5种镰刀菌毒素的MRM色谱图如图1所示。
2.2 样品前处理条件的优化
真菌毒素常用的提取溶剂主要有甲醇、乙腈、乙腈-水、酸化甲醇、酸化乙腈[14-15]。文献表明,小麦粉中的淀粉和蛋白等组分在提取过程中极易发生交联而影响毒素的提取效果,因此提取过程中需加水以提高提取效率[16-17]。本文比较了乙腈-水(50∶50,体积比,下同)、1%甲酸的乙腈-水(50∶50)、1%甲酸的甲醇-水(50∶50) 3种提取溶剂对目标物萃取率的影响。结果表明,采用1%甲酸的甲醇-水(50∶50)、乙腈-水(50∶50)提取时,回收率为50%~79%;而采用1%甲酸的乙腈-水(50∶50)提取时的回收率最高,回收率为70%~84%。因此,本文选择1%甲酸的乙腈-水(50∶50)为最佳提取溶剂。
QuEChERS方法中盐析剂对实验结果也有重要影响,盐析剂可以促使有机相与水相的分层,多数研究人员采用4 g无水硫酸镁和1 g氯化钠的混合盐获得了理想的分层效果[18-19]。因此比较了添加盐析剂(4 g无水硫酸镁、1 g氯化钠)和不添加盐析剂对提取效率的影响。实验结果表明,添加盐析剂能有效促进提取液分层,使镰刀菌毒素的回收率提高8%~32%。
进一步比较了涡旋提取时间(1,2,5,10 min)对提取效率的影响,结果显示,涡旋2 min后回收率趋于平稳,因此选择涡旋提取时间为2 min。不同的复溶溶剂对回收率的影响也很大,本文所研究的5种毒素极性较小,需要高比例的有机相才能完全溶解,但直接采用乙腈或甲醇溶解后,上机测试会出现较大的溶剂效应,而采用初始流动相甲醇-2 mmol/L乙酸铵(10∶90)复溶不能完全溶解残留物,回收率较低。通过比较不同比例的甲醇-乙酸铵溶液,最终选择甲醇-2 mmol/L乙酸铵水溶液(80∶20)作为复溶溶剂,此时溶剂效应最小,溶解性好。
2.3 基质效应、线性关系与定量下限
本文采用基质标准溶液曲线的斜率和溶剂标准溶液曲线的斜率之比(K)来评价基质效应,当K大于1时为基质增强效应,K小于1时为基质减弱效应,当K等于1时无基质效应。5种镰刀菌毒素的基质效应见表2。由表可知,小麦粉基质对5种镰刀菌毒素均具有基质减弱效应,因此需采用基质标准溶液对目标物进行定量分析。将5种镰刀菌毒素标准储备液分别用空白样品提取液配制成不同浓度系列的基质标准工作溶液,并按优化条件进行测定,以浓度(x,μg/L)为横坐标,对应目标物的峰面积(y)为纵坐标,绘制标准曲线。结果表明,5种镰刀菌毒素的响应值与其浓度在一定范围内线性关系良好,相关系数均不小于0.993(见表2)。以3倍信噪比(S/N=3)计算方法的检出限(LOD),S/N=10计算方法的定量下限(LOQ),具体结果见表2。结果表明,5种镰刀菌毒素的LOD为0.3~0.8 μg/kg,LOQ为0.8~2.4 μg/kg,方法具有较高的灵敏度。
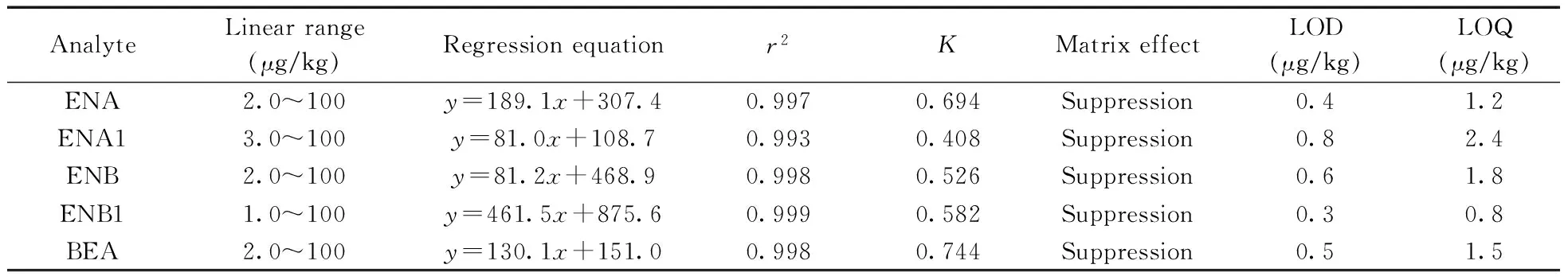
表2 5种镰刀菌毒素的线性范围、线性方程、相关系数、斜率比、基质效应、检出限和定量下限Table 2 Linear ranges,regression equations,correlation coefficients(r2),slopes of matrix/solvent(K), matrix effects,LODs and LOQs of 5 fusarium mycotoxins
2.4 准确度与精密度
向空白小麦粉样品中添加5种镰刀菌毒素的1倍、2倍、10倍定量下限3个浓度水平的混合标准溶液,进行准确度和精密度实验,每个浓度样品平行测定6次,测定结果见表3。由表3可见,5种镰刀菌毒素在3个加标水平下的平均回收率为74.0%~85.4%,相对标准偏差(RSD)为5.6%~13.1%,表明方法具有较好的准确度与精密度。

表3 5种镰刀菌毒素的加标回收率与相对标准偏差(n=6)Table 3 Recoveries and RSDs of 5 fusarium mycotoxins(n=6)

图2 阳性样品经HPLC-MS/MS分析的MRM色谱图Fig.2 HPLC-MS/MS MRM chromatogram of a positive sample
2.5 实际样品的检测
采用建立的方法对市场上30批小麦粉中的5种镰刀菌毒素进行测定,结果有25批样品检出ENB,含量为2.4~54.1 μg/kg,20批样品检出ENB1,含量为2.0~7.1 μg/kg,4批样品检出BEA,含量为5.1~6.2 μg/kg。图2为某阳性小麦粉样品的色谱图。
3 结 论
本文基于QuEChERS原理的前处理技术,结合超高效液相色谱-串联质谱建立了快速测定小麦粉中5种镰刀菌毒素残留的方法。在前处理条件考察过程中,优化了提取溶剂、盐析剂、涡旋提取时间等关键因素。通过优化色谱及质谱参数,得到了最佳的仪器检测条件。本方法简便快捷,灵敏度高,可以满足对小麦粉中镰刀菌毒素残留的检测要求,并为企业控制产品质量及食品安全监管部门有效监管提供了技术支撑。
[1] Bryden W L.Anim.FeedSci.Technol.,2012,173(1/2):134-158.
[2] Jestoi M,Somma M C,Kouva M,Veijalainen P,Rizzo A,Ritieni A,Peltonen K.Mol.Nutr.FoodRes.,2004,48(4):299-307.
[3] Berthiller F,Sulyok M,Krska R,Schuhmacher R.Int.J.FoodMicrobiol.,2007,119(1/2):33-37.
[4] Hussein H S,Brasel J M.Toxicology,2001,167:101-134.
[5] Binder E M.Anim.FeedSci.Technol.,2007,133(1/2):149-166.
[6] Sospedra I,Blesa J,Soriano J M,Maes J.J.Chromatogr.A,2010,1217:1437-1440.
[7] Jestoi M.Crit.Rev.FoodSci.Nutr.,2008,48:21-49.
[8] Meca G,Zinedine A,Blesa J,Font G,Maes J.FoodChem.Toxicol.,2010,48(5):1412-1416.
[9] Oueslati S,Meca G,Mliki A,Ghorbel A,Maes J.FoodControl,2011,22(8):1373-1377.
[10] Sifou A,Meca G,Serrano A B,Mahnine N,Abidi A E,Maes J,Azzouzi M E,Zinedine A.FoodControl,2011,22(12):1826-1830.
[11] Jestoi M,Rokka M,Rizzo A,Peltonen K,Aurasaari S.J.Liq.Chromatogr.Relat.Technol.,2005,28:369-381.
[14] Guo L Q,Gong X M,Ding K Y,Wang K,Sun J,Zhao H.J.Instrum.Anal.(郭礼强,宫小明,丁葵英,王可,孙军,赵晗.分析测试学报),2015,34(2):141-146.
[15] Rasmussen R R,Storm I M L D,Rasmussen P H,Smedsgaard J,Nielsen K F.Anal.Bioanal.Chem.,2010,397(2):765-776.
[16] Ridgway K,Lalljie S P D,Smith R M.J.Chromatogr.A,2007,1153(1/2):36-53.
[17] Hinojo M J,Medina A,Valle-Algarra F M,Gimeno-Adelantado J V,Jiménez M,Mateo R.FoodMicrobiol.,2006,23(2):119-127.
[18] Desmarchelier A,Oberson J M,Tella P,Gremaud E,Seefelder W,Mottier P.J.Agric.FoodChem.,2010,58(13):7510-7519.
[19] Cunha S C,Fernandes J O.J.Sep.Sci.,2010,33(4/5):600-609.
Determination of 5 Fusarium Mycotoxins in Wheat Flour by QuEChERS Extraction Combined with Ultra Performance Liquid Chromatography-Tandem Mass Spectrometry
YANG Jun,SUN Xiao-jie*,HU Wen-yan,WANG Yu-mei
(Nanjing Institute for food and Drug Control,Nanjing 210038,China)
An ultra performance liquid chromatography-tandem mass spectrometric(UPLC-MS/MS) method was developed for the simultaneous determination of 5 fusarium mycotoxins in wheat flour,including enniatins A,enniatins A1,enniatins B,enniatins B1 and beauvericin.The fusarium mycotoxins were extracted from the samples using a modified QuEChERS-based extraction procedure without any further clean-up step.The separation of the analytes was carried out on an Agilent Eclipse Plus C18column(50 mm×2.1 mm,1.8 μm) using the mobile phases of methanol and 2 mmol/L ammonium acetate by gradient elution.The detection was performed in the electrospray ion(ESI) positive mode and multiple reaction monitoring(MRM) mode.The matrix-matched calibrations were used to quantify the residue concentrations.The proposed method showed good linear relationship with correlation coefficients all above 0.993.The limits of detection(LODs)were in the range of 0.3-0.8 μg/kg,and the limits of quantitation(LOQs) were 0.8-2.4 μg/kg.The blank samples were fortified at three spiked levels(1 times,2 times,10 times of LOQ),and the average recoveries ranged from 74.0% to 85.4% with relative standard deviations(RSDs) of 5.6%-13.1%.The developed method was successfully applied in analysis of fusarium mycotoxins in 30 samples bought from the market.The method was simple,rapid,accurate and sensitive,and was suitable for the simultaneous analysis of multi-fusarium mycotoxins in wheat flour.
ultra performance liquid chromatography-tandem mass spectrometry(UPLC-MS/MS);fusarium mycotoxins;QuEChERS;wheat flour
2017-02-06;
2017-03-10
南京市科技发展计划项目(201505025)
10.3969/j.issn.1004-4957.2017.07.007
O657.63;S852.44
A
1004-4957(2017)07-0882-05
*通讯作者:孙小杰,硕士,高级工程师,研究方向:食品质量安全,Tel:025-89636186,E-mail:55223141@qq.com
