分散固相萃取净化/液相色谱-串联质谱法测定化妆品中7种氨基苯甲醚
2017-08-01黄嘉乐李秀英寻知庆黄金凤郭新东
黄嘉乐,李秀英,寻知庆,王 强,黄金凤,郭新东
(广州质量监督检测研究院,广东 广州 511447)
分散固相萃取净化/液相色谱-串联质谱法测定化妆品中7种氨基苯甲醚
黄嘉乐,李秀英,寻知庆,王 强,黄金凤,郭新东*
(广州质量监督检测研究院,广东 广州 511447)
建立了同时测定化妆品中7种氨基苯甲醚类化合物(邻氨基苯甲醚、间氨基苯甲醚、对氨基苯甲醚、2,4-二氨基苯甲醚、2,5-二氨基苯甲醚、3,4-二氨基苯甲醚、3,3′-二甲氧基联苯胺)的分散固相萃取净化液相色谱-串联质谱(LC-MS/MS)分析方法。样品用甲醇-水(1∶1,含0.1%甲酸)溶液提取,经PSA分散固相萃取净化后,样液经Welch Ultimats XB-C18(4.6 mm×150 mm,5 μm)色谱柱分离,多反应监测(MRM)模式检测,以保留时间和特征离子对定性,外标法定量。结果表明,7种氨基苯甲醚类化合物在0.10~200.0 μg/L浓度范围内线性关系良好,相关系数均大于0.998;方法检出限(S/N=3)为0.4~10.9 μg/kg。样品日内回收率为64.7%~98.1%,相对标准偏差(RSD,n=6)为1.2%~10.6%;日间精密度(n=5)为2.3%~9.8%。对30个不同水剂类化妆品检测发现,其中1个样品检出3,3′-二甲氧基联苯胺,含量为5.3 μg/kg。该方法准确可靠,适用于化妆品中7种氨基苯甲醚的同时测定。
液相色谱-质谱联用法(LC-MS/MS);分散固相萃取(d-SPE);化妆品;氨基苯甲醚类化合物
邻氨基苯甲醚(邻茴香胺)、2,4-二氨基苯甲醚(2,4-二氨基茴香)、2,5-二氨基苯甲醚(2,5-二氨基茴香)及3,3′-二甲氧基联苯胺(邻联茴香胺)主要用于有机合成、染料、香料及药物制造。研究[1-3]表明:上述4种邻氨基苯甲醚均能通过皮肤吸收损伤肝脏和膀胱细胞,且为剧毒性致癌物。欧盟法规(EC)No1223/2009[4]中明确禁止化妆品中使用邻氨基苯甲醚、2,4-二氨基苯甲醚、2,5-二氨基苯甲醚和3,3′-二甲氧基联苯胺4种化合物,我国《化妆品安全技术规范》(2015版)[5]亦作出同样规定。其同分异构体:间氨基苯甲醚、对氨基苯甲醚、3,4-二氨基苯甲醚虽未被禁用,但亦具有剧毒性及人体危害性[1-3]。
目前,对氨基苯甲醚化合物的检测方法主要有电化学分析法[6]、薄层色谱法[6]、离子色谱法[7]、气相色谱法[8]、气相色谱-质谱法[9]、液相色谱法[10]、液相色谱-串联质谱法[11-13]以及表面解吸常压化学电离源质谱法[14]等。在上述仪器方法中,LC法和GC法灵敏度不高,定性能力不足。氨基苯甲醚类化合物的氧化性较强,高温状态下不稳定,常需衍生后再进行GC,GC-MS或GC-MS/MS分析,操作繁琐。LC-MS/MS选择性强,采用保留时间与特征离子对定性,定性定量优势明显,抗干扰能力强,无需对氨基苯甲醚继续衍生,前处理较为简便,已在各检测领域中得到广泛应用[15-16]。但以上文献均只涉及部分被限用的氨基苯甲醚类物质,尚未有文献对上述7种氨基苯甲醚类物质进行测定。且上述测定方法主要集中在纺织品、食品、纸制品和环境监测方面,而对化妆品中氨基苯甲醚类物质残留量的测定未见文献报道。由于化妆品的成分复杂,大量共存杂质往往会与待测物质被同时萃取,从而影响待测组分检测的灵敏度。基质分散固相萃取法可有效除去基体中极性干扰物质,且操作简单、 快速,仪器设备要求不高,环境污染少,已广泛应用于纺织品、食品和环境检测。
本文建立了分散固相萃取净化/液相色谱-质谱法测定化妆品中7种氨基苯甲醚类化合物,方法检出限为0.4~10.9 μg/kg,方法回收率为 64.7%~98.1%。该方法前处理简单、适用性好,可为我国化妆品的市场监控和生产企业监管提供检测依据。
1 实验部分
1.1 仪器、试剂与材料
1200高效液相色谱仪(美国Agilent公司);4000Qtrap三重四极杆质谱仪(美国AB SCIEX公司);MS2 Minshaker涡旋振荡器(德国IKA公司);3K15高速离心机(美国Sigma公司);KDC-400低速离心机(科大创新公司);KQ-500E超声波清洗器(昆山市超声仪器有限公司)。
7种氨基苯甲醚类化合物标准品:邻氨基苯甲醚(2-Anisidine,2-ANI)、间氨基苯甲醚(3-Anisidine,3-ANI)、对氨基苯甲醚(4-Anisidine,4-ANI)纯度均大于99.0%,购自德国Dr.Ehrenstorfer公司;2,4-二氨基苯甲醚(2,4-Diaminoanisole,2,4-DANI)、2,5-二氨基苯甲醚(2,5-Diaminoanisole,2,5-DANI)、3,4-二氨基苯甲醚(3,4-Diaminoanisole,3,4-DANI)纯度均大于98%,购自美国Chemservice公司;3,3′-二甲氧基联苯胺(3,3′-Dimethoxybenzidine,3,3′-DMBD)纯度大于98%,购自德国CNW公司;甲酸、丙酮、甲醇、乙醇、乙腈(HPLC级,德国Merck公司);N-丙基乙二胺(PSA)、十八烷基硅烷键合硅胶(C18)、石墨化炭黑(GCB)、碳纳米管(美国Agilent公司);超纯水(18.2 MΩ·cm,由Millipore纯水仪制备):实验室自制;实验所用化妆品样品为市售。
1.2 标准溶液的配制
7种氨基苯甲醚储备溶液:准确称取各标准品10.0 mg,用20 mL乙腈-水(1∶1,体积比)溶解并转移至100 mL容量瓶中,用乙腈定容,配成100 mg/L的单标标准储备液,置于4 ℃冰箱保存。
7种氨基苯甲醚混合标准工作液:分别移取适量的单标储备液,用乙腈逐级稀释成浓度为10 mg/L的7种氨基苯甲醚混合标准工作液,置于4 ℃冰箱保存。
1.3 样品前处理
称取1.0 g试样(精确至0.001 g)置于10.0 mL比色管中,用甲醇-水溶液(1∶1,体积比,含0.1%甲酸)定容至5.0 mL,涡旋分散3 min,常温下超声提取15 min,2 000 r/min 离心2 min,吸取约2 mL上清液于高速离心管中,然后加入200 mg PSA吸附剂,涡旋2 min,20 000 r/min离心1 min,取上清液过0.22 μm滤膜后,供LC-MS/MS测定。
加标样品的制备:准确称取1.0 g(精确至0.001 g)阴性化妆品试样于50 mL具塞聚乙烯离心管中,加入适量7种氨基苯甲醚混合标准溶液,混合均匀,按上述步骤进行前处理。
1.4 仪器条件
1.4.1 色谱条件 色谱柱:Welch Ultimate XB-C18色谱柱(4.6 mm×150 mm,5 μm);流动相:A为0.1%甲酸乙腈,B为0.1%甲酸水,梯度洗脱程序为:0.0~9.0 min,95%~50% B;9.0~11.0 min,50% B;11.1~13.0 min,50%~95% B;流速:0.5 mL/min;进样量:20 μL;柱温:25 ℃。
1.4.2 质谱条件 电喷雾正离子模式(ESI+);电喷雾电压4 500 V;离子源温度500 ℃;雾化气 50 psi;辅助气 60 psi;气帘气 20 psi;检测模式:多反应监测(MRM)模式;7种待测物的监测离子对(m/z)及去簇电压、碰撞电压等参数见表1,各离子对的驻留时间均为50 ms。
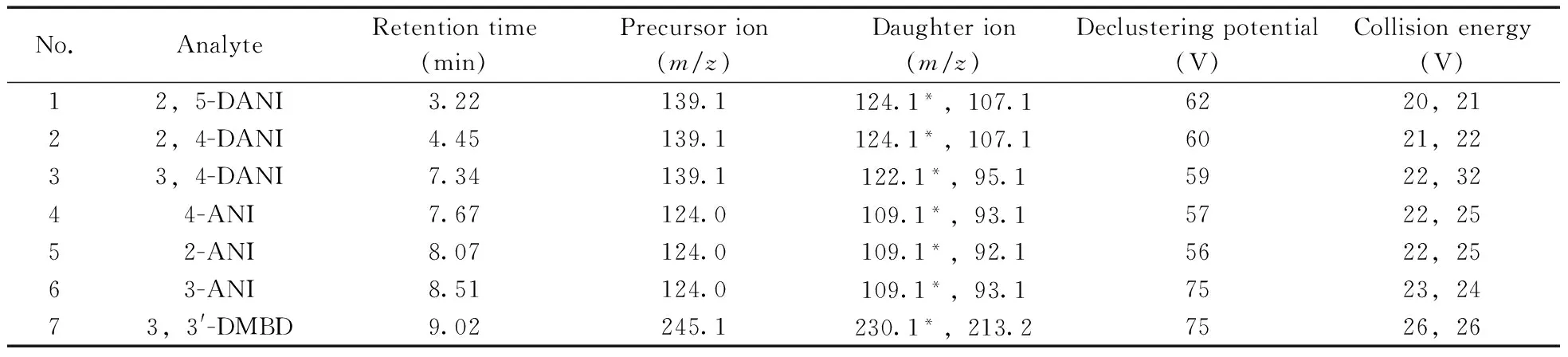
表1 7种氨基苯甲醚类化合物的质谱MRM模式优化参数Table 1 MRM optimized parameters of 7 aminoanisoles
*quantitative ion
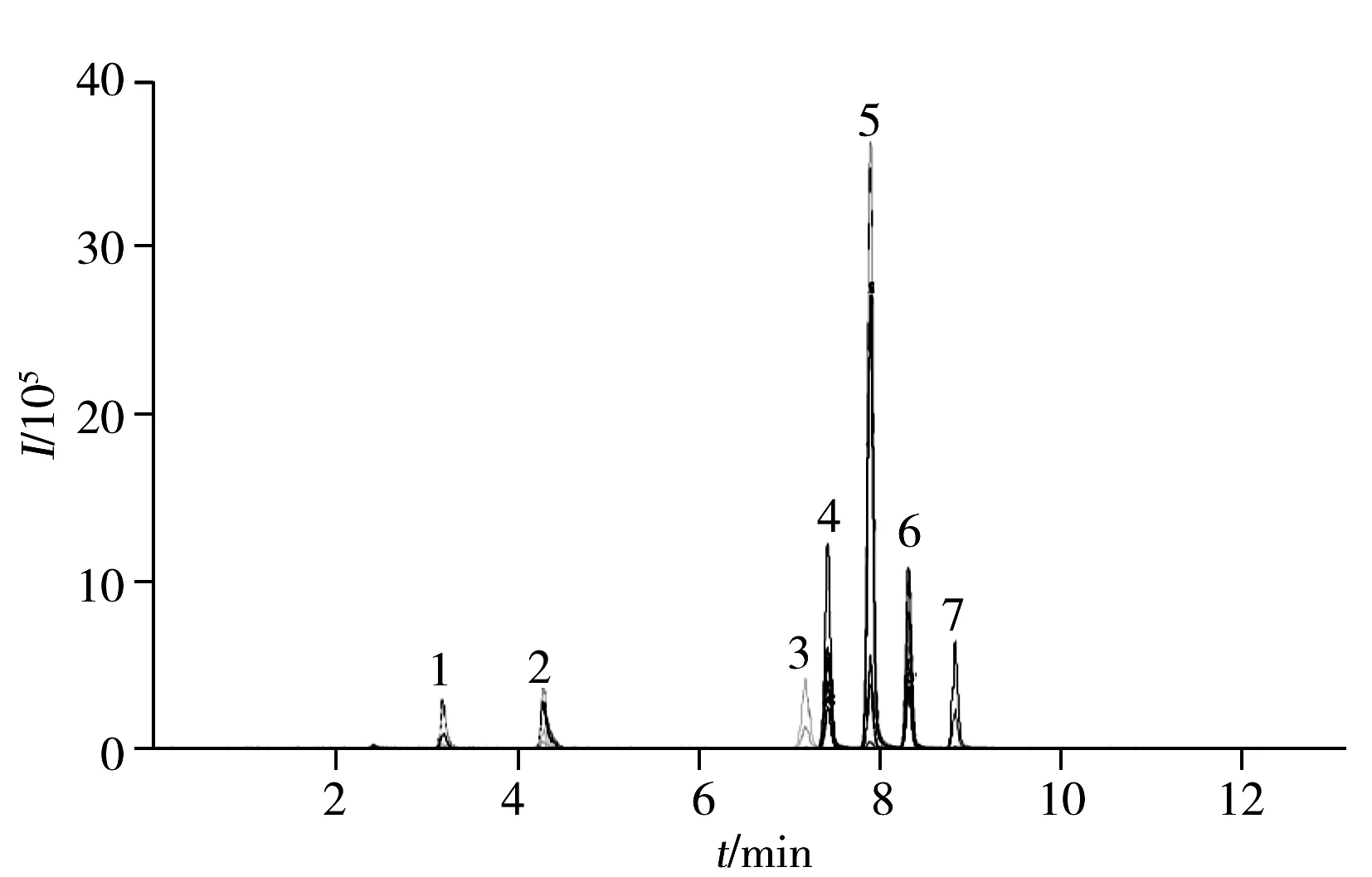
图1 7种氨基苯甲醚混合标准溶液在Welch Ultimate XB-C18色谱柱上的总离子流(TIC)色谱图Fig.1 TIC chromatogram of seven aminoanisoles mixed standard solution on Welch Ultimate XB-C181.2,5-DANI,2.2,4-DANI,3.3,4-DANI,4.4-ANI,5.2-ANI,6.3-ANI,7.3,3′-DMBD
2 结果与讨论
2.1 色谱柱的选择
本文考察的7种氨基苯甲醚类物质均为极性化合物,且含有化学性质较活泼的氨基,应选择末端封尾的色谱柱以减少氨基与未封端的活性基团的次级作用。实验考察了菲罗门 Kinetex PFP(50 mm×2.0 mm,2.6 μm)、Waters UPLCTMBEH C18(50 mm×2.1 mm,1.7 μm)和 Welch Ultimate XB-C18(150 mm×4.6 mm,5 μm )色谱柱的分离效果。结果显示,两组同分异构体2,5-DANI,2,4-DANI,3,4-DANI和4-ANI,2-ANI,3-ANI在Kinetex PFP色谱柱上难以分离,且这两组组内化合物碎片相同,无法单独定量;在Waters UPLCTMBEH C18色谱柱上,由于氨基与色谱柱内未封端的硅羟基产生次级相互作用而导致峰形严重拖尾;Welch Ultimate XB-C18色谱柱对硅羟基进行双封尾,各待测化合物在该色谱柱上的峰形对称,基线平稳(图1),因此本实验选择Welch Ultimate XB-C18色谱柱作为后续研究的色谱柱。
2.2 定性与定量离子的确定
7种目标化合物结构上均带有氨基,在质谱电离时易得到质子,形成较高响应的[M+H]+分子离子峰,故采用正离子模式进行检测。配制一定浓度的7种氨基苯甲醚标准溶液,对标准品进行全扫描,通过仪器自带的自动优化软件在 ESI+模式下得到7种化合物的分子离子峰。通过优化去簇电压(DP)、碰撞电压(CE)等参数,得到7种化合物响应较好的子离子,每种物质选择2个子离子,以响应值高及基质影响较小的子离子作为定量离子,另1个作为定性离子,优化后的质谱参数见表1。
在优化质谱条件下研究离子丰度,发现4-ANI,2-ANI,3-ANI质荷比较小的离子碎片响应比质荷比大的离子碎片高。通过对其裂解机理进行分析,推测可能是因为4-ANI,2-ANI,3-ANI的两个子离子均从母离子裂解得到,其余4种目标化合物质荷比较小的子离子则从质荷比较大的子离子二级裂解得到。7种氨基苯甲醚的典型裂解机理见图2,在优化条件下,7种氨基苯甲醚标准混合溶液定量离子的 MRM色谱图见图1。
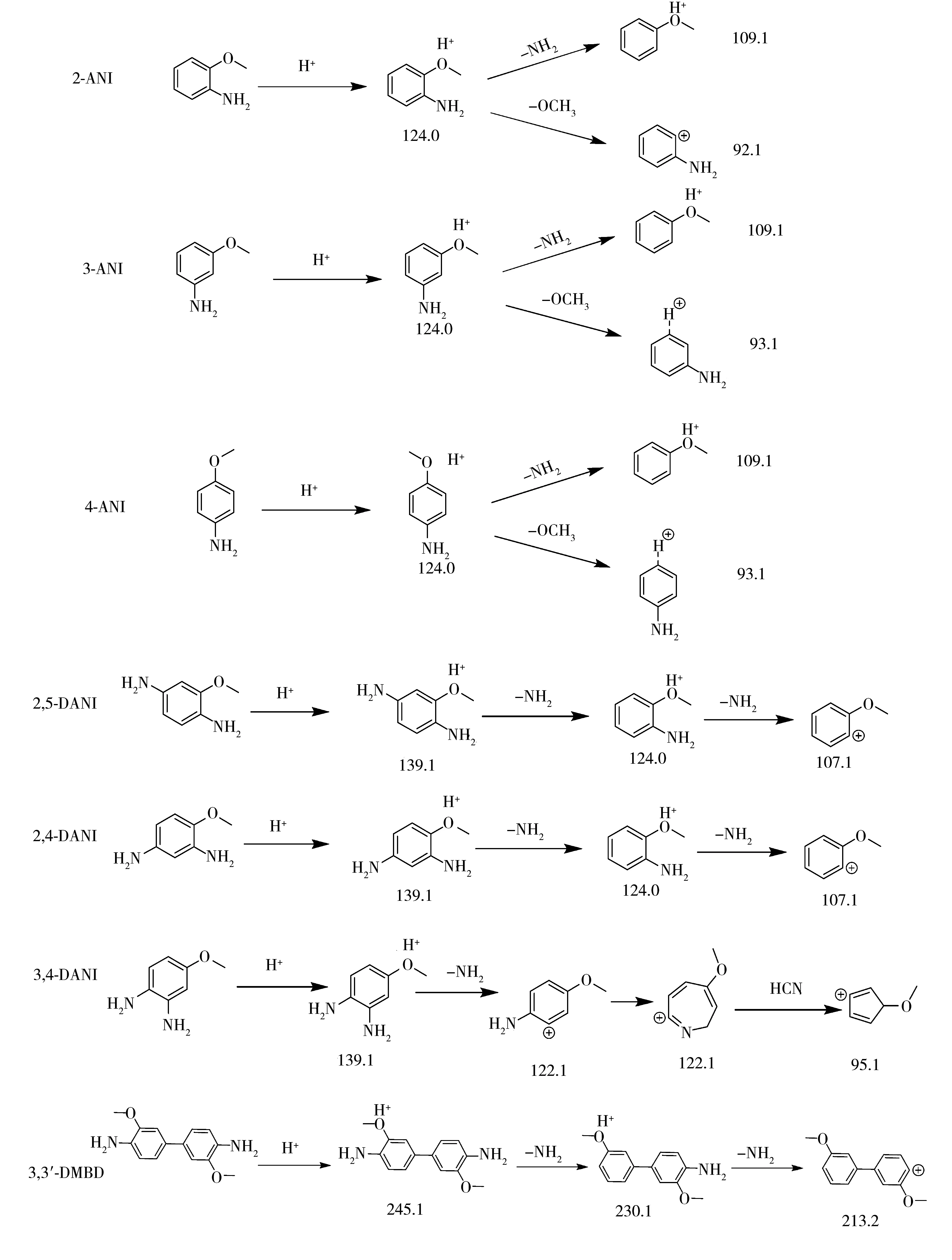
图2 7种氨基苯甲醚的典型裂解机理Fig.2 The cleavage mechanism of seven aminoanisoles
2.3 样品提取条件的优化
氨基苯甲醚类物质的分子结构有苯环、氨基和醚基,具有水溶性和脂溶性,易溶于极性溶剂,在弱酸性条件下呈阳离子形态而易溶于水。因此,为了有效提取目标化合物,考察了常用的极性有机提取溶剂(甲醇、乙醇、乙腈和丙酮,上述溶剂均含0.1%甲酸)及0.1%甲酸水对目标化合物的提取效率(通过阴性加标样品与阴性样品提取回收率的对比得到),并建立了样品提取方法。
由图3可知,对于水剂类样品只有甲醇能同时提取7种目标化合物。而水剂类化妆品一般含有甘油、丙二醇及其非极性物质,为了减少非极性物质进入提取液中,加入0.1%甲酸水,以降低提取液中甲醇的含量。考察了不同比例混合溶剂对目标物回收率的影响,当采用0.1%甲酸水-0.1%甲酸甲醇(50∶50,体积比)时7种目标化合物的回收率最佳。

图3 不同提取溶剂对水剂类化妆品回收率的影响Fig.3 Extraction efficiency comparison of different extraction solvents for the aqueous cosmetics
为了增加目标化合物的提取效率,减少非极性杂质进入提取液,需在提取液中加入适量的甲酸,因此,进一步考察了不同甲酸含量对7种氨基苯甲醚类化合物回收率的影响。结果表明,当提取液不含甲酸时,7种氨基苯甲醚类化合物的回收率均低于60%,这可能是因为在中性条件下,7种目标化合物呈分子状态存在,被包裹在脂溶性基质中,不利于其转移到提取液中,而导致回收率较低;加入0.1%甲酸后,氨基苯甲醚类化合物呈离子状态存在,易溶于含大量水的提取液中,目标化合物的回收率增大;当甲酸浓度增大时,部分目标化合物的回收率下降,可能是在强酸性条件下氨基苯甲醚类物质具有还原性,易产生变质[17],且在强酸性条件下,化妆品会有部分酸溶性杂质转移到提取液中,对样品净化造成干扰。综上所述,本实验选用含0.1%甲酸的甲醇水溶液对样品进行提取。
2.4 样品净化条件的优化
水剂类化妆品基质组分复杂,除含有大量水外,还含有部分表面活性剂和醇类物质,如不经净化直接进入质谱会引起基质效应,从而影响检测结果,并可能污染仪器。未经净化的提取溶剂有部分杂质峰会遮盖目标化合物的色谱峰,为了去除提取液中的干扰杂质,本实验采用分散固相萃取进行净化,并考察了分散固相萃取中常用吸附剂(PSA,ODS,C18,GCB和碳纳米管)的净化效果。
由于GCB和碳纳米管对带苯环官能团的化合物具有较强的吸附作用,易导致氨基苯甲醚类化合物的回收率大大降低;C18对亲脂型杂质的吸附较强,但对提取液中大量的极性杂质保留能力较差,不利于其有效清除;PSA是高纯硅胶基质的极性吸附剂,同时含有伯胺和仲胺基团,具有极性作用和弱阴离子交换作用,可有效地去除提取液中的有机酸、脂肪酸和极性色素等水溶性杂质,从而达到有效清除的目的。实验结果显示,PSA对目标化合物回收率的影响较小,净化效果较好。
为了进一步优化固相萃取剂PSA的用量,本实验考察了5种不同PSA用量(100,200,300,400,500 mg)对待测物的分散净化效果。结果显示,当PSA用量为100 mg时,萃取液中有部分杂质无法除去,在MRM色谱图上会对目标化合物的出峰造成影响;当PSA用量为200~500 mg时,净化效果相似,均能除去萃取液中的杂质且不影响目标化合物的回收率。综合考虑,本实验选择PSA的用量为200 mg,以获得满意的净化效果。
2.5 线性关系与检出限
按照选定的仪器条件对混合标准溶液进样检测,以目标物定量离子的峰面积(y)为纵坐标,对相应的质量浓度(x,μg/L)进行线性回归,由表2可见,7种待测物在一定质量浓度下的相关系数均大于0.998,表明线性关系良好。分别以3倍信噪比(S/N=3)和S/N=10计算仪器的检出限(LOD)和定量下限(LOQ),结合前处理过程,得到不同水剂化妆品中7种待测物的方法检出限(LOD)为0.4~10.9 μg/kg;方法定量下限(MLOQ)为1.0~36.3 μg/kg(表2),表明方法灵敏,能满足检测要求。

表2 7种待测物的线性方程、相关系数、方法检出限及方法定量下限Table 2 Calibration curves,correlation coefficients,MLODs and MLOQs of 7 compounds
2.6 方法的准确度与精密度
选择市售的阴性爽肤水样品,添加低、中、高3个浓度水平的混合标准溶液,混合均匀后,按照本方法进行样品前处理和色谱检测,每个加标水平平行测定6次,计算日内回收率和精密度(RSD);选取中间添加水平,连续测试5 d,计算日间回收率和精密度,实验结果见表3。在50.0~150 μg/kg加标水平下,7种氨基苯甲醚的日内平均回收率为64.7%~98.1%,日内RSD(n=6)为1.2%~10.6%;对于中间添加水平,日间RSD为(n=5)为2.3%~9.8%,表明方法具有良好的回收率和精密度,能够满足水状化妆品中7种氨基苯甲醚的测定要求[18]。

表3 阴性化妆品中7种氨基苯甲醚类化合物的加标回收率及相对标准偏差Table 3 Recoveries and RSDs for seven aminoanisoles in cosmetics
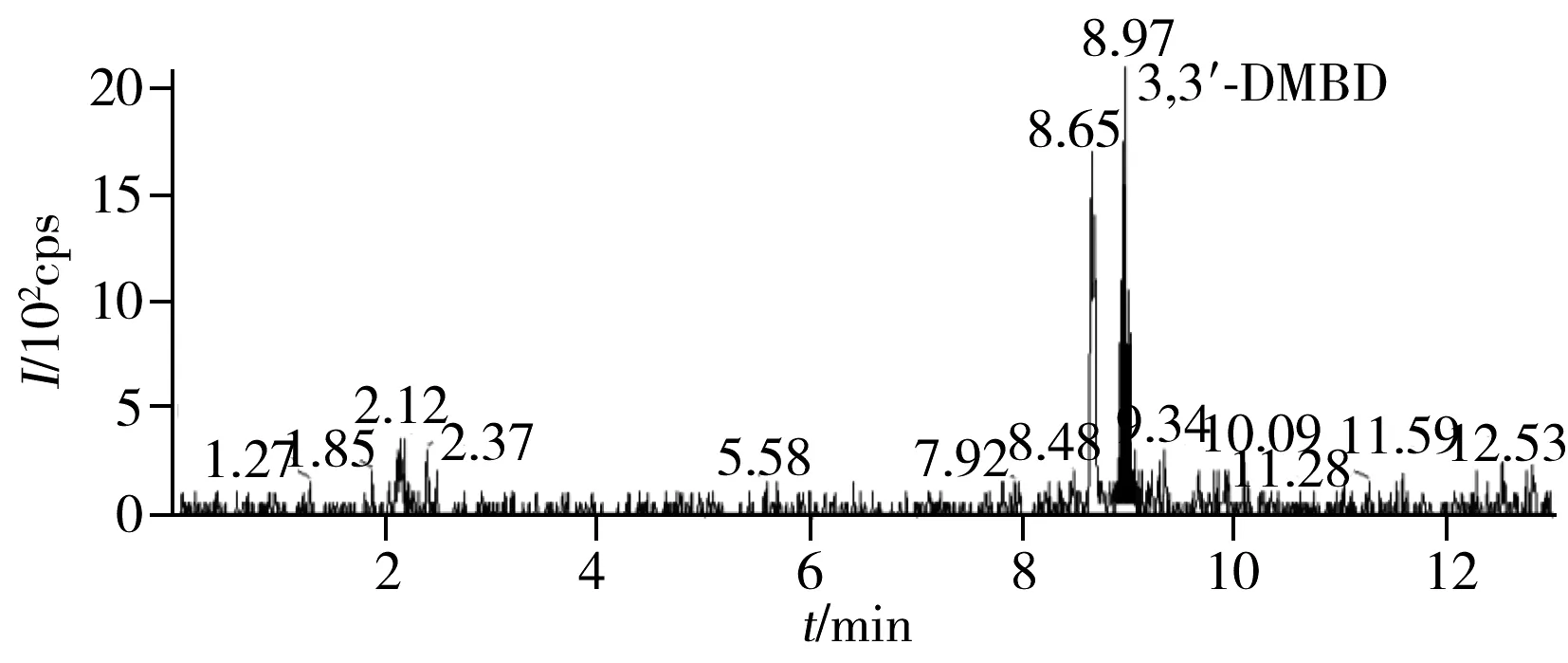
图4 化妆品阳性样品的MRM色谱图Fig.4 MRM chromatogram of a positive sample
2.7 实际样品的测定
采用本文建立的方法对从市场购买的30份化妆品样品(精华露15个,爽肤水15个)进行分析,结果显示,1个爽肤水样品检出3,3′-DMBD,含量为5.3 μg/kg,图4为此阳性化妆品样品的MRM色谱图。其余样品均未检出另外6种目标化合物。由此可见,化妆品中存在残留氨基苯甲醚类化合物的潜在风险,其主要残留物为3,3′-DMBD。
3 结 论
本文建立了化妆品中7种氨基苯甲醚的分散固相萃取净化/液相色谱-质谱检测方法。实验优化了高效液相色谱分离条件和质谱参数,优选出0.1%甲酸的甲醇水溶液提取和PSA净化体系。方法学评价结果表明,该方法日内回收率(64.7%~98.1%)和精密度(1.2%~10.6%)良好,对于中间添加水平,日间精密度(n=5)为2.3%~9.8%,7种目标化合物的方法检出限为0.4~10.9 μg/kg;定量下限为1.0~36.3 μg/kg。该方法前处理简单、适用性好,有利于快速监测化妆品中禁用氨基苯甲醚类物质的残留情况,可为化妆品中禁限物质的监管和产品质量的控制提供技术支持。
[1] Cheng J,Wu Y H.IndustrialHealthandOccupationalDiseases(程娟,吴永会.工业卫生与职业病),2003,29(2):124-126.
[2] Martelli A,Robbiano L,Carrozzino R,Porta Puglia C,Mattioli F,Angiola M,Brambilla G.Toxicol.Sci.,2000,53:71-76.
[3] Curtis B,Payne T J,Ash D E,Mohanty D K.Bioorg.Med.Chem.,2013,21(5):1123-1135.
[4] Regulation(EC) No 1223/2009 of the European Parliament and of the Council of 30 November 2009 on cosmetic products(Text with EEA relevance).[2010-01-11]http://eur-lex.europa.eu/legal-content/EN/TXT/PDF/uri=CELEX:32009R1223&from=EN.
[5] Safety and Technical Standards for Cosmetics(食品药品监管总局.化妆品安全技术规范2015版),[2015-12-23].http://www.sda.gov.cn/directory/web/WS01/images/MjAxNcTqtdoyNji6xbmruOa4vbz+LnBkZg==.pdf.[6] Jiao K,Ren L Q,Yang T,Lü G,Wu J F.J.Instrum.Anal.(焦奎,任立清,杨涛,吕刚,吴俊峰.分析测试学报),2002,21(2):8-10.
[7] Wu S Y,Zhu Q,Xue M,Chen Z Q ,Xu M,Jia L,Wang M C,Lin Z H,Meng Z H.ChineseJournalofExplosives&Propellants(吴思宇,祝巧,薛敏,陈智群,徐敏,贾林,王民昌,林智辉,孟子晖.火炸药学报),2015,38(3):73-76.
[8] Wang J H.J.Chromatogr.A,2001,918(2):435-438.
[9] He D,Li X Y,Xian Y P,Fang J,Guo X D.J.Instrum.Anal.(何东,李秀英,冼燕萍,方军,郭新东.分析测试学报),2015,34(8):911-916.
[10] Chen Z H,Huang W J,Liu X J,Fang J H.Phys.Test.Chem.Anal.:Chem.Anal.(陈张好,黄文静,刘小娟,方继辉.理化检验:化学分册),2014,50(2):184-186.
[11] Gadaj A,di Lullo V,Cantwell H,McCormack M,Furey A,Danaher M.J.Chromatogr.B,2014,960:105-115.
[12] Tlgyesi A,Sharma V K,Fekete S,Fekete J,Simon A,Farkas S.J.Pharm.Biomed.Anal.,2012,64/65:40-48.[13] Guo J,Ding L P,Wu W F,Zhao J H,Chen Z T.J.Instrum.Anal.(郭菁,丁立平,吴文凡,赵建晖,陈志涛.分析测试学报),2015,34(1):28-34.
[14] Ouyang Y Z,Chen L F,Deng J L.Chin.J.Anal.Lab.(欧阳永中,陈林飞,邓金连.分析试验室),2014,33(3):277-281.
[15] Luo H T,Huang X L,Wu H Q,Zhu Z X,Huang F,Lin X S,Ma Y F,Deng X,Zhou P C,Zhang Q Y,Jian Y T.J.Instrum.Anal.(罗辉泰,黄晓兰,吴惠勤,朱志鑫,黄芳,林晓珊,马叶芬,邓欣,周培才,张秋炎,简艳婷.分析测试学报),2016,35(2):119-126.
[16] Liu M,Hashi Y K,Song Y Y,Lin J M.Chin.J.Anal.Chem.(刘敏,端裕树,宋苑苑,林金明.分析化学),2006,34(7):941-945.
[17] Zhang W J,Li X L,Yuan X Z,Jiang S J.ChinaLeather(张文军,李晓龙,袁绪政,姜苏杰.中国皮革),2013,42(13):6-9.
[18] Official Journal of the European Communities.Commission Decision of 12 August 2002 Implementing Council Directive 96/23/EC Concerning the Performance of Analytical Methods and the Interpretation of Results Brussels European Commission.2002.
Determination of Seven Aminoanisoles in Cosmetics by Dispersive Solid Phase Extraction Purification Coupled with Liquid Chromatography-Tandem Mass Spectrometry
HUANG Jia-le,LI Xiu-ying,XUN Zhi-qing,WANG Qiang,HUANG Jin-feng,GUO Xin-dong*
(Guangzhou Quality Supervision and Testing Institute,Guangzhou 511447,China)
A dispersive solid phase extraction(d-SPE) purification coupled with liquid chromatography tandem mass spectrometric(LC-MS/MS) method was developed for the simultaneous determination of seven aminoanisoles including 2-anisidine(2-ANI),3-anisidine(3-ANI),4-anisidine(4-ANI),2,4-diaminoanisole(2,4-DANI),2,5-diaminoanisole(2,5-DANI),3,4-diaminoanisole(3,4-DANI) and 3,3′-dimethoxybenzidine(3,3′-DMBD) in cosmetics.The samples were extracted with methanol aqueous solution containing 0.1% formic acid,and purified by a simple d-SPE employing PSA as adsorbents.The target analytes were separated on a Welch Ultimate XB-C18chromatographic column(4.6 mm×150 mm,5 μm) and subsequently detected through an electrospray ionization(ESI) source in the positive mode under multi-reaction monitoring(MRM) conditions.An external standard method was adopted for the quantification.Under the optimized conditions,the callibration curves of seven analytes were linear in the concentration range of 0.10-200.0 μg/L,with correlation coefficients(r2) greater than 0.998.The limits of detections(LODs) were in the range of 0.4-10.9 μg/kg.The average recoveries were calculated to be between 64.7%and 98.1%, with relative standard deviations(RSDs) of 1.2%-10.6% for intra-day precision(n=6) and 2.3%-9.8% for inter-day precision(n=5).The method was successfully applied in the determination of aminoanisole contents in thirty complex cosmetics samples,and 3,3′-dimethoxybenzidine(3,3′-DMBD) was detected in one sample with a content of 5.3 μg/kg.The method is accurate and reliable,and could be used for the simultaneous determination of 7 aminoanisoles in cosmetics.
liquid chromatography tandem mass spectrometry(LC-MS/MS);dispersive solid phase extraction(d-SPE);cosmetics;aminoanisole
2017-02-25;
2017-03-14
国家质检总局科技计划项目(2015QK165)
10.3969/j.issn.1004-4957.2017.07.003
O657.63;O625.14
A
1004-4957(2017)07-0858-07
*通讯作者:郭新东,教授级高级工程师,研究方向:食品及相关产品安全检测技术,Tel:020-83376692,E-mail:gdone@21cn.com
