北京油鸡混合感染副鸡禽杆菌和禽偏肺病毒的诊治
2017-08-01李淑芳张培君龚玉梅王宏俊
梅 晨,李淑芳,闫 旭,侯 婷,张培君,龚玉梅,王宏俊
(1.北京市农林科学院畜牧兽医研究所,北京 海淀 100097;2.北京市延庆区农业局,北京 延庆 102100)
北京油鸡混合感染副鸡禽杆菌和禽偏肺病毒的诊治
梅 晨1,李淑芳1,闫 旭1,侯 婷2,张培君1,龚玉梅1,王宏俊1
(1.北京市农林科学院畜牧兽医研究所,北京 海淀 100097;2.北京市延庆区农业局,北京 延庆 102100)
副鸡禽杆菌(Apg)为鸡传染性鼻炎的致病菌,本病的特点是潜伏期短,传播迅速,短时间内便可波及全群[1]。处于产蛋高峰的鸡群产蛋大幅度降低(10%~40%),混合感染时会导致病鸡死亡,给养殖业造成较大经济损失,我国自1987年首次在北京分离到该菌后[2]陆续在不同省市分离到不同血清型的副鸡禽杆菌[3-5]。禽偏肺病毒会引起一种以禽呼吸道症状、头部肿胀和产蛋率下降为主要特征的疾病,该病毒属于副黏病毒科、肺病毒亚科、肺病毒属[6],于1978年首次发现于南非共和国[7],现已成为危害世界养禽业的重要疫病之一,禽偏肺病毒对火鸡的影响非常明确,但对鸡的影响却知之甚少,一般认为可以引起鸡的呼吸道感染而且是导致肉鸡肿头综合征的重要诱因之一[8]。近年来由于养殖水平的提高及鸡场保健意识的增强,单纯的鸡传染性鼻炎在规模化鸡场已经很少发病,但是如果混合感染了其他病原,导致抵抗力下降时,副鸡禽杆菌会大量增殖,引起比较严重的呼吸道疾病。本实验室于2016年3月接诊了1例这两种病原混合感染的病例,报告如下。
1 临床症状
初期病鸡出现轻微的呼吸道症状,表现为流鼻涕、甩鼻,随着病情发展,病鸡精神委靡,进食量减少,呼吸啰音,面部一侧或双侧肿胀,重者双眼因肿胀而完全失明,羽毛松乱,瘦弱。产蛋率急剧下降达30%。
2 剖检变化
剖检可见单侧或双侧眶下窦肿胀,内有脓性分泌物;部分鸡喉部及气管有干酪样渗出物;产蛋鸡可见输卵管萎缩,卵黄性腹膜炎。
3 实验室诊断
3.1 细菌学分离鉴定
3.1.1 细菌分离 无菌操作采取病死鸡眶下窦积液接种于TSA培养基,于厌氧罐中37℃培养16 h左右,挑取疑似副鸡禽杆菌的菌落进行纯化培养,连续3代以后平板上可见单一的针尖样菌落。
3.1.2 PCR鉴定及分型 参考陈小玲[9]的方法,用1对特异性引物:F:5'-TGAGGGTAGTCTTGCACGCGAAT-3';R:5'-CAAGGTATCGATCGTCTCTCTACT-3',做菌种鉴定。结果显示,可以扩增出与预期条带大小相同的DNA片段。初步鉴定为副鸡禽杆菌(图1)。
同时,参照Ryuichi SAKAMOTO[10]的分子分型方法,用如下分型引物进行分型鉴定:ABCF:5'-GGCTCACAGCTTTATGCAACGAA-3';
AR:5'-CGCGGGATTGTTGATTTTGTT-3'; BR:5'-GGTGAATTTCACCACACCAC-3';
CR:5'-TAATTTTCTTATTCCCAGCATCAATACCAT-3',结果如图2所示,表明本次分离的副鸡禽杆菌为A型。

图1 PCR检测结果
3.1.3 血清型鉴定 参考Page程序进行HA和HI试验鉴定副鸡禽杆菌分离株的血清型[11],分离株与800倍稀释后的A型标准阳性血清发生阳性反应(表1),而与B型和C型副鸡禽杆菌的特异性阳性血清没有反应。表明该分离株属于 A型副鸡禽杆菌。
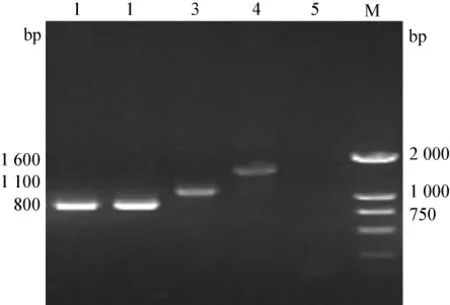
图2 PCR检测结果

表1 Page方法的HI分型结果
3.1.4 回归鸡试验 取6周龄SPF鸡8只,眶下窦接种细菌分离物,106CFU/mL,0.2 mL/只,并设PBS接种空白对照,观察发病情况。接种后24 h,所有分离培养的细菌接种后的试验鸡均出现了典型的鸡传染性鼻炎症状,而对照鸡没有任何临床症状。
3.1.5 药敏试验 取分离的培养菌按常规纸片法进行药敏试验,结果显示,分离株对头孢氨苄、庆大霉素、头孢哌酮、头孢克罗高度敏感;对环丙沙星、左氧氟沙星、卡那霉素、头孢拉定中度敏感;对磺胺嘧啶、土霉素、强力霉素、头孢克肟不敏感(表2)。
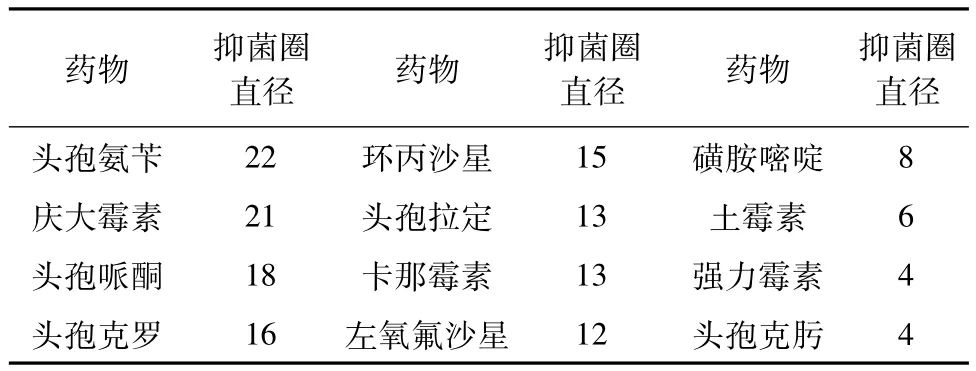
表2 分离株药敏试验结果 (mm)
3.2 禽偏肺病毒核酸鉴定
3.2.1 RNA提取及反转录 将气管棉拭子浸泡于PBS中充分洗下待检病料后按照TRIZol说明书操作进行RNA提取,最后用5μL DEPC水溶解。反转录按照M-MLV Reverse Transcriptase说明书进行,具体反应体系如下:RNA 5μL,随机引物1μL,5× M-MLV RT Buffer 4μL,核糖核酸酶抑制因子1μL, M-ML反转录酶1μL,dNTP(2.5 mmol/L)8μL。混匀后按以下程序进行反转录:42℃ 50 min,70℃15 min,反应结束后,立即置于-20℃保存备用。
3.2.2 PCR检测 根据GenBank发表的禽偏肺病毒的Matrix(M)基因(登录号为KF364615.2)的保守序列设计引物:上游引物5'-GAT GAC TAC AGC AAA CTA GAG-3';下游引物5'-CTT CAG GAC ATA TCT CGT AC-3'。预计扩增片段大小为468bp。引物由上海生工生物工程技术服务有限公司合成。PCR反应总体系为20μL:cDNA 2μL,2×PCR Buffer 10μL,上、下游引物各1μL,以ddH2O加足体系。PCR反应条件为:94℃预变性5 min;94℃ 45 s,51℃ 45 s,72℃ 45 s,进行30个循环;72℃延伸5 min。反应结束后取5 uL产物进行琼脂糖凝胶电泳检测,结果能成功扩增出目的条带(图3)。
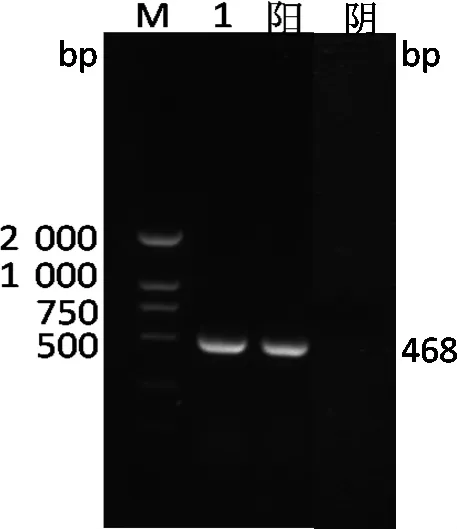
图3 PCR检测结果
3.2.3 DNA序列分析 按照胶回收试剂盒说明书回收目的片段,在参照pGEM-T载体试剂盒说明书构建克隆载体。经菌液PCR鉴定为阳性克隆子后送上海生工生物工程技术服务有限公司进行测序。使用DNAStar软件将测序结果与GenBank中登录的M基因进行序列比对分析(图4),结果显示与 C亚型(登录号为 FJ195332.1—FJ19534.1,FJ5344.1,FJ195345.1)核苷酸序列同源性极高,为96%~99%,同时也表明同一亚型不同毒株的这段基因相对比较保守,由以上结果确定病料中含有C型禽偏肺病毒。
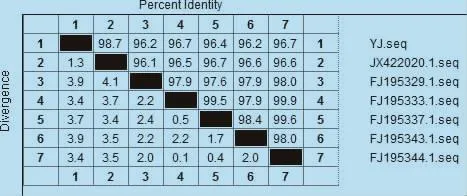
图4 序列比对结果
3.2.4 ELISA鉴定用IDEXX的禽偏肺病毒试剂盒检测病鸡的血清样品,阳性值为0.306,阴性值为0.14,待检血清值为0.5,结果显示,血清中亲偏肺病毒的抗体很高。
4 分析与讨论
鸡传染性鼻炎和禽偏肺病毒感染是近期我国养鸡场常见的两种传染病。病原体分别是副鸡禽杆菌和禽偏肺病毒。单独感染都能引起鸡只的眼睑肿胀,呼吸道症状,继而导致采食量减少,产蛋下降等相似的临床表现。根据鸡场兽医介绍,该鸡群进行了马立克、新城疫、传染性囊病等常见疫病的疫苗免疫,没有接种过鸡传染性鼻炎、支原体或偏肺病毒等相关疫苗。跟踪调查结果显示,新城疫,传染性囊病免疫抗体水平较高。现场的调查发现,饲养密度不是很大,鸡舍通风良好,但病鸡症状表现得特别严重,单侧或双侧眼睑肿胀致盲。剖检还发现部分产蛋鸡输卵管萎缩,或卵黄性腹膜炎。综合发病情况、临床症状、剖检病变,我们初步怀疑是鸡传染性鼻炎。为进一步确诊,我们开展了实验室诊断工作。分离鉴定出A型副鸡禽杆菌,诊断为副鸡禽杆菌。通过ELISA抗体检测,发现禽偏肺病毒血清抗体呈阳性,进一步的PCR鉴定,发现样品中含有C型偏肺病毒的核酸,综合诊断为副鸡禽杆菌和禽偏肺病毒的混合感染,但不排除还有其他病原体的共同感染。
5 治疗措施
隔离病鸡,病死鸡销毁进行无害化处理。同时对全群鸡只每羽肌肉注射10 000 IU头孢氨苄;以庆大霉素饮水,连用3 d。对禽舍及饲养用具用0.1%百毒杀溶液进行彻底的消毒处理;场内健康鸡与其他鸡群紧急免疫鸡传染性鼻炎疫苗和偏肺病毒疫苗。经治疗,病情迅速得到控制。
[1] 张培君,陈小玲,苗得园,等.鸡传染性鼻炎流行病学调查(Ⅱ)[J].中国兽医杂志,2001,35(1):21-23.
[2] 冯文达.北京鸡传染性鼻炎病原菌的分离鉴定[J].微生物学报,1987,27(5):216-219.
[3] Chen X,Zhang P,Blackall P J.Characterization of Haemophilus paragallinarum isolates from China[J].Avi Dis,1993,37: 574-576.
[4] 张培君,苗得园,龚玉梅.B型副鸡嗜血杆菌的分离鉴定[J].中国预防兽医学报,2003,25(1):56-58.
[5] 路迎迎,路明华,陈小玲,等.B型副鸡禽杆菌安徽株的分离与鉴定[J].动物医学进展,2014,35(1):122-125.
[6] Saif Y M,Fadley A M,Glisson J R,et al.Diseases of Poultry[M],12th ed.Am:Blackwell Publishing professional,2008: 100-110.
[7] Nienga M K,Lwamba H M,Seal B S.Metapneumoviruses in birds and humans[J].Virus Res,2003,91:163-169.
[8] Banet-Noach C,Simanov L,Perk S,Characterization of Isracliavian metapneumovirus strains in turkeys and chickens[J].Avian Pathol,2005,34(3):220-226.
[9] Chen X,Mifilin J K Zhang P,et al.Development and application of DNA probes and PCR tests for Haemophilus Paragallinarum[J].Avian Dis,1996,40:398-407.
[10] Ryuichi SAKAMOTO,Yoichiro KINO,Masashi SAKAGUCHI.Developmentofa multiplex PCR and PCR-RFLP method for serotyping of Avibacterium paragallinarum[J].Vet Med Sci,2012,74(2):271-273.
[11] Blackall P J,Eves L E,Aus G.Serotrping of Haemophilus paragallinarum by the page scheme:com-Parison ofthe use of agglutination and hemagglutination inhibition tests[J].Avian Dis,1990,34:643-645.
S855.1+2
B
0529-6005(2017)06-0056-03
2016-06-20
国家自然科学基金项目(31272558);农业部公益性行业专项(201303044);北京市农林科学院创新能力建设项目(KJCX20140410)
梅晨(1989-),女,硕士,从事预防兽医学工作,E-mail:bjmeichen@sina.com
王宏俊,E-mail:whj_1209@163.com
