低温微滤技术制备富含β-酪蛋白和乳清蛋白的新型功能性乳蛋白配料
2017-07-31李珺珂刘大松赖瑞业余韵周鹏
李珺珂,刘大松,赖瑞业,余韵,周鹏
(江南大学 食品学院 食品科学与技术国家重点实验室 食品安全与质量控制协同创新中心,江苏 无锡,214122)
低温微滤技术制备富含β-酪蛋白和乳清蛋白的新型功能性乳蛋白配料
李珺珂,刘大松,赖瑞业,余韵,周鹏*
(江南大学 食品学院 食品科学与技术国家重点实验室 食品安全与质量控制协同创新中心,江苏 无锡,214122)
以市售的巴氏杀菌脱脂乳为原料,探究膜孔径、温度、洗滤液和洗滤次数等条件对β-酪蛋白和乳清蛋白分离效果和膜通量的影响,最终制备了富含β-酪蛋白与乳清蛋白的新型功能性乳蛋白配料。研究采用聚丙烯酰胺凝胶电泳和高效液相色谱对蛋白做定性和定量分析。研究表明,在4 ℃条件下,使用30 nm孔径的陶瓷膜,以水作为洗滤液,可使得β-酪蛋白的分离效果最佳;在最优条件下,脱脂乳经微滤浓缩3倍后,再在相同条件下补水洗滤4次,将膜过滤各阶段所得的透过液混合,可得到β-酪蛋白和乳清蛋白的产率分别为51.7%和99.7%,复合蛋白中β-酪蛋白和乳清蛋白所占比例分别为51.1%和40.0%,而αs-酪蛋白的含量得以大大降低,该功能性复合蛋白可作为一种新型的功能性蛋白配料用于配方乳粉等婴幼儿食品的研制。
脱脂乳;微滤;β-酪蛋白;乳清蛋白;婴幼儿配方乳粉
牛乳蛋白具有良好的营养和功能特性,因而被广泛地运用到婴幼儿配方乳粉的生产中。然而,人乳蛋白与牛乳蛋白在蛋白分子组成方面差异较大。人乳蛋白中乳清蛋白含量较高,约占总蛋白质的60%,酪蛋白则占40%;而牛乳蛋白中含80%的酪蛋白,乳清蛋白仅占20%[1]。研究表明,酪蛋白在牛乳中以胶束状态存在,等电点约为4.6[2],在婴幼儿胃液中易形成致密的絮凝结构,不易于蛋白的消化吸收。目前,调节婴幼儿配方乳粉中乳清蛋白和酪蛋白的比例来模拟人乳蛋白的组成是国内外的研究热点,常用的方法是将脱脂乳粉与乳清蛋白粉复配,以提高牛乳蛋白中乳清蛋白的含量。然而,牛乳中的酪蛋白为αs1、αs2、β和κ,其比例约为4∶1∶3∶1;人乳中的酪蛋白为β和αs1,且以前者为主[3]。因此,同时提高牛乳蛋白中乳清蛋白和β-酪蛋白的含量,可以使其在蛋白分子组成水平上更接近人乳蛋白,从而为配方乳粉等婴幼儿食品的生产提供更加优质的乳蛋白配料。
膜分离技术是根据分离物尺寸的不同而选择相应孔径的膜材料来实现物料分离的,具有非热、高效、绿色等特点[4]。牛乳中的酪蛋白主要是以胶束形式存在,胶束粒径在100 nm左右,而乳清蛋白和极少量的酪蛋白则游离于胶束之外的乳清中[2]。在胶束中,αs-酪蛋白和部分β-酪蛋白通过其所带的磷酸基团与胶体磷酸钙相互作用形成了胶束骨架,而部分β-酪蛋白则通过疏水作用镶嵌在胶束骨架之间。在低温条件下,蛋白疏水作用会减弱,部分β-酪蛋白则会逐渐从胶束解离到乳清中,并以分子单体或低分子量聚集体的形式存在[5]。因此,通过设定合适的微滤条件,可选择性的使部分β-酪蛋白从胶束中解离,并保留胶束骨架结构,从而使解离的β-酪蛋白和乳清蛋白一起通过微滤膜进入到透过液中,而胶束骨架则被保留在截留液中。目前,乳清蛋白通常是从奶酪加工的副产物(乳清)中分离得到的,而采用膜技术直接从牛乳中分离乳清蛋白和酪蛋白可更好地维持蛋白原有的营养和功能特性。因此,本实验研究膜孔径、温度、洗滤液和洗滤次数对β-酪蛋白分离效果和膜通量的影响,并利用聚丙烯酰胺凝胶电泳(sodium dodecyl sulphate-polyacrylamide gel electrophoresis, SDS-PAGE)和高效液相色谱(high performance liquid chromatography, HPLC)对蛋白质分离效果进行定性和定量的分析,以建立制备含乳清蛋白与β-酪蛋白的复合蛋白的生产工艺。
1 材料与方法
1.1 材料与试剂
光明优倍巴氏杀菌脱脂乳,上海光明集团;三氟乙酸,美国Sigma公司;乙腈,赛默飞世尔科技(中国)有限公司;丙烯酰胺(Acr)、甲叉丙烯酰胺(Bis)、三羟甲基氨基甲烷(Tris)、十二烷基硫酸钠(SDS)、N,N,N’,N’-四甲基乙二胺(TEMED)、过硫酸铵(APS),尿素(Urea),1,3-二[三(羟甲基)甲氨基]丙烷、二硫苏糖醇,美国Amresco公司;叠氮化钠、甲醇、乙酸、HCl、甘氨酸、甘油、正丁醇、溴酚蓝,国药集团化学试剂有限公司;考马斯亮蓝G250、β-巯基乙醇,上海生工生物工程技术服务有限公司;αs-酪蛋白、β-酪蛋白、κ-酪蛋白,美国Sigma公司;β-乳球蛋白、α-乳白蛋白,美国Davisco公司;膜清洗剂LC-66,三达膜科技(厦门)有限公司。
1.2 仪器与设备
MF-1陶瓷膜微滤系统,无锡赫普轻工设备技术有限公司;LX-0250低温制冷循环器,无锡冠亚恒温制冷技术有限公司;微滤陶瓷膜元件CRM301940,上海科琅科技有限公司;超滤中试设备,三达膜科技(厦门)有限公司;分析天平,美国Mettler Toledo公司;IKA T25高速分散机,德国IKA集团;Waters e2695 Separations Module高效液相色谱分析仪,美国Waters公司;Protean Ⅱ xi Cell电泳仪、GelDox XR凝胶成像仪,美国Bio-rad 公司;LRH-250CA低温培养箱,上海一恒医疗器械有限公司;705超低温冰箱,赛默飞世尔科技公司。
1.3 实验方法
1.3.1 微滤膜孔径的确定
取巴氏杀菌脱脂乳15 L,加入0.02%的叠氮化钠以防止微生物生长。通过低温循环器将其温度冷却至4 ℃左右,并在此温度下平衡稳定1 h后进行微滤操作,操作过程中仍控制4 ℃的温度和0.1 MPa的压力。采用30、50、100 nm三种不同孔径的陶瓷膜(表1)分别进行微滤,直至浓缩倍数为3,收集透过液进行后续分析。

表1 微滤膜相关技术信息
1.3.2 微滤分离温度的确定
取巴氏杀菌脱脂乳15 L,加入0.02%的叠氮化钠。使用膜孔径为30 nm的陶瓷膜进行分离,分别采用4、25和50 ℃三个不同温度进行膜分离实验,4 ℃采用低温制冷循环器进行控制,25 ℃和50 ℃下采用水浴循环的方式进行控制,微滤过程保持压力为0.1 MPa。脱脂乳料液浓缩3倍时停止微滤,收集透过液进行后续分析。
1.3.3 洗滤液和洗滤次数的确定
取巴氏杀菌脱脂乳50 L,加入0.02%的叠氮化钠。采用10 kDa截留分子质量的聚醚砜超滤膜在4 ℃条件下超滤,收集超滤透过液40 L作为后续微滤所需的洗滤液。
取巴氏杀菌脱脂乳15 L,加入0.02%的叠氮化钠。采用膜孔径为30 nm的陶瓷膜在4 ℃和0.1 MPa的压力条件下进行分离,整个过程分为1次微滤和4次洗滤,第1次微滤是原始脱脂乳的浓缩分离,即将15 L脱脂乳浓缩3倍,收集10 L的透过液;洗滤操作是分别使用2种不同的洗滤液,即补加水或超滤透过液至料液原体积15 L,收集分离各阶段所得的透过液。
1.3.4 平均膜通量的测定
膜通量即在单位时间内通过单位膜面积上的透过液的质量,其计算公式可表示为:

(1)
式中:J,平均膜通量,kg/(m2·h);M,透过液质量,kg;A,膜面积,m2;t,时间,h。
1.3.5 透过液成分的SDS-PAGE分析
采用SDS-PAGE对透过液的蛋白组成做定性分析。取脱脂乳和透过液分别与超纯水以体积比1∶7的比例稀释,然后再与样品缓冲液(含有5%β-巯基乙醇)1∶1混合,煮沸3 min后立即于碎冰上冷却。采用浓缩胶浓度为4%,分离胶浓度为13%,上样量为10 μL,浓缩胶和分离胶的电流为10 mA/Gel和20 mA/Gel。
1.3.6 透过液成分的HPLC分析
采用反相高效液相色谱法(RP-HPLC)对透过液的蛋白组成做定量分析。实验使用的分离柱为4.6 mm×250 mm的C18反相柱。样品与缓冲液1(0.1 mol/L Bis-Tris-Propane,pH 7,8 mol/L Urea,20 mmol DTT,1.3% 柠檬酸钠)等体积混合,然后在10 000 g的条件下离心5 min,取上清液与3倍体积的缓冲液2[V(乙腈)∶V(水)∶V(三氟乙酸)=100∶900∶1;6 mol/L Urea]混合,过0.45 μm有机膜。梯度洗脱所用的流动相A和B中乙腈-水-三氟乙酸的体积比分别为100∶900∶1和900∶100∶0.7,流动相流速为0.8 mL/min,检测波长为220 nm[6]。洗脱曲线上的各个峰根据αs-酪蛋白、β-酪蛋白、κ-酪蛋白、β-乳球蛋白和α-乳白蛋白标品进行定性归属;各个峰面积的相对定量采用Empower软件进行积分换算得到。
2 结果与分析
2.1 陶瓷膜孔径对β-酪蛋白分离效果的影响
在4 ℃条件下,采用不同孔径的膜对脱脂乳进行分离,其中透过液中含有的蛋白组成可以用SDS-PAGE表征,如图1所示。图1中结果显示,使用30 nm的微滤膜进行低温微滤时,透过液中主要含有β-酪蛋白、β-乳球蛋白和α-乳白蛋白;使用50 nm和100 nm时,透过液中还含有αs-酪蛋白。从图2可以发现,30 nm膜的透过液呈现出澄清状态,说明没有胶束穿过微滤膜;50 nm和100 nm膜的透过液呈现出浑浊状态,且后者更加浑浊,说明部分胶束穿过了微滤膜[7]。对于3种膜孔径,β-乳球蛋白、α-乳白蛋白和游离的β-酪蛋白都可以穿过膜进入透过液,但50 nm和100 nm的膜对于酪蛋白胶束的阻挡效果较差,因而其透过液中含有较多的αs-酪蛋白。

图1 不同孔径陶瓷膜在4 ℃条件下微滤分离脱脂乳所得透过液的电泳图Fig.1 SDS-PAGE of skim milk protein separation by ceramic membranes with different sizes at 4 ℃

图2 不同孔径陶瓷膜在4 ℃条件下微滤分离脱脂乳所得的透过液 Fig.2 Appearance of permeates obtained by ceramic membranes with different sizes at 4 ℃
不同孔径陶瓷膜在4 ℃条件下微滤分离脱脂乳所得透过液中αs-酪蛋白占原脱脂乳中αs-酪蛋白的比例如图3所示。30 nm膜的透过液中,αs-酪蛋白所占比例约为0.8%,这对应于牛乳中游离的αs-酪蛋白[8];50 nm和100 nm膜的透过液中,αs-酪蛋白所占比例分别为1.4%和2.0%,说明部分酪蛋白胶束进入到了透过液中,这进一步表明50 nm和100 nm孔径的陶瓷膜在分离过程中对酪蛋白胶束的阻挡能力不如30 nm陶瓷膜。因此,为了选择性地使β-酪蛋白和乳清蛋白富集到透过液中,确定陶瓷膜孔径为30 nm。

图3 不同孔径陶瓷膜在4 ℃条件下微滤分离脱脂乳所得透过液中αs-酪蛋白占原脱脂乳中αs-酪蛋白的比例Fig.3 The ratio of αs-casein isolated under different membrane pore sizes to total αs-casein in skim milk at 4℃
在4 ℃条件下,采用不同孔径的膜对脱脂乳进行分离,其平均膜通量的变化如图4所示。
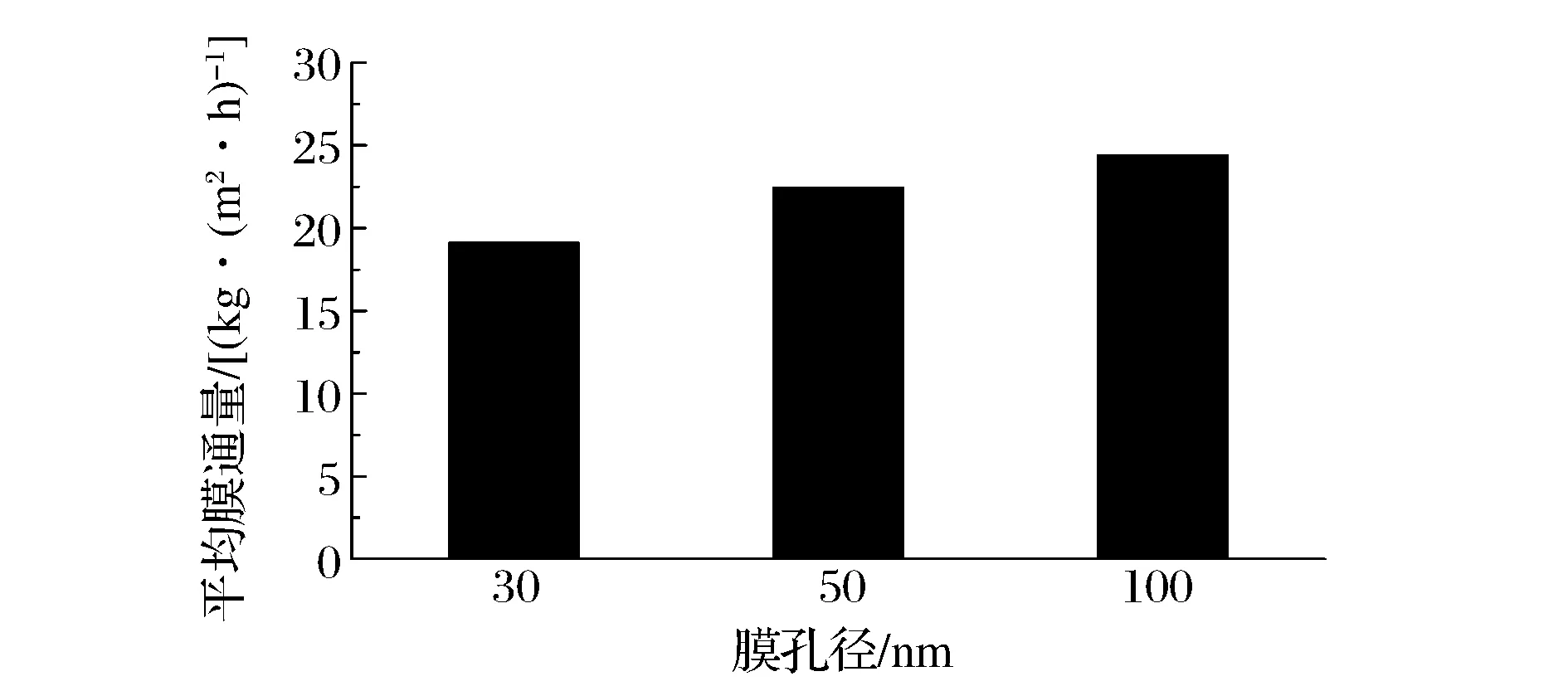
图4 不同孔径下膜通量的变化Fig.4 The change of membrane flux under different membrane pore sizes
从图4中可以看出,4 ℃下,使用30、50、100 nm陶瓷膜进行分离时的平均膜通量分别为19.1、22.5、24.4 kg/(m2·h)。故随着膜孔径的增加,平均膜通量逐渐增大;但孔径较小则对胶束的阻挡能力强。随着浓缩倍数的增加,截留液中固形物含量增加,因此会造成膜表面阻力增加,从而降低膜通量,所以膜过滤采用的浓缩倍数通常为2~4[9-10]。同时在每一次微滤过程中,随着时间的延长,膜通量明显降低,这是由于随着浓缩时间的增加,截留液的浓度逐渐变大,膜表面的浓差极化现象越严重,因而膜通量逐渐降低。
2.2 温度对β-酪蛋白分离效果的影响
在传统的膜分离过程中,分离工艺的温度通常会控制在45~50 ℃,因为在此温度下膜通量较高,分离速率快,同时又可以抑制微生物的生长[11-12]。但是,若要分离出含β-酪蛋白和乳清蛋白的混合蛋白,则需要控制低温条件使得部分β-酪蛋白从胶束中解离到乳清中。30 nm孔径陶瓷膜在不同温度条件下微滤分离脱脂乳所得透过液的电泳结果如图5所示。从图5中可以看出,在4 ℃条件下,有较多的β-酪蛋白出现在透过液中,这是由于部分β-酪蛋白是通过疏水作用结合在酪蛋白胶束中,当温度降低时,疏水作用变弱,这部分β-酪蛋白会逐渐游离到乳清中[13]。在25 ℃和50 ℃的条件下,没有观察到β-酪蛋白所对应的条带,这与HOLLAND[14]和LE BERRE[15]报道一致,即采用膜技术从脱脂乳中分离β-酪蛋白需要控制温度在20 ℃以下,且在10 ℃以下效果最理想。

图5 30 nm孔径陶瓷膜在不同温度条件下微滤分离脱脂乳所得透过液的电泳图Fig.5 SDS-PAGE of skim milk protein separation by 30 nm ceramic membranes at different temperature
如图6所示,通过HPLC定量分析可以得到不同温度条件下微滤分离脱脂乳所得透过液中β-酪蛋白占原脱脂乳中β-酪蛋白的比例。在4 ℃条件下,β-酪蛋白所占比例约为9.4%;在25 ℃和50 ℃条件下,β-酪蛋白所占比例分别为2.6%和2.1%。这进一步说明控制低温条件能使β-酪蛋白从胶束中解离而进入到透过液中,而酪蛋白胶束由于其直径较大则被阻挡在截留液中。
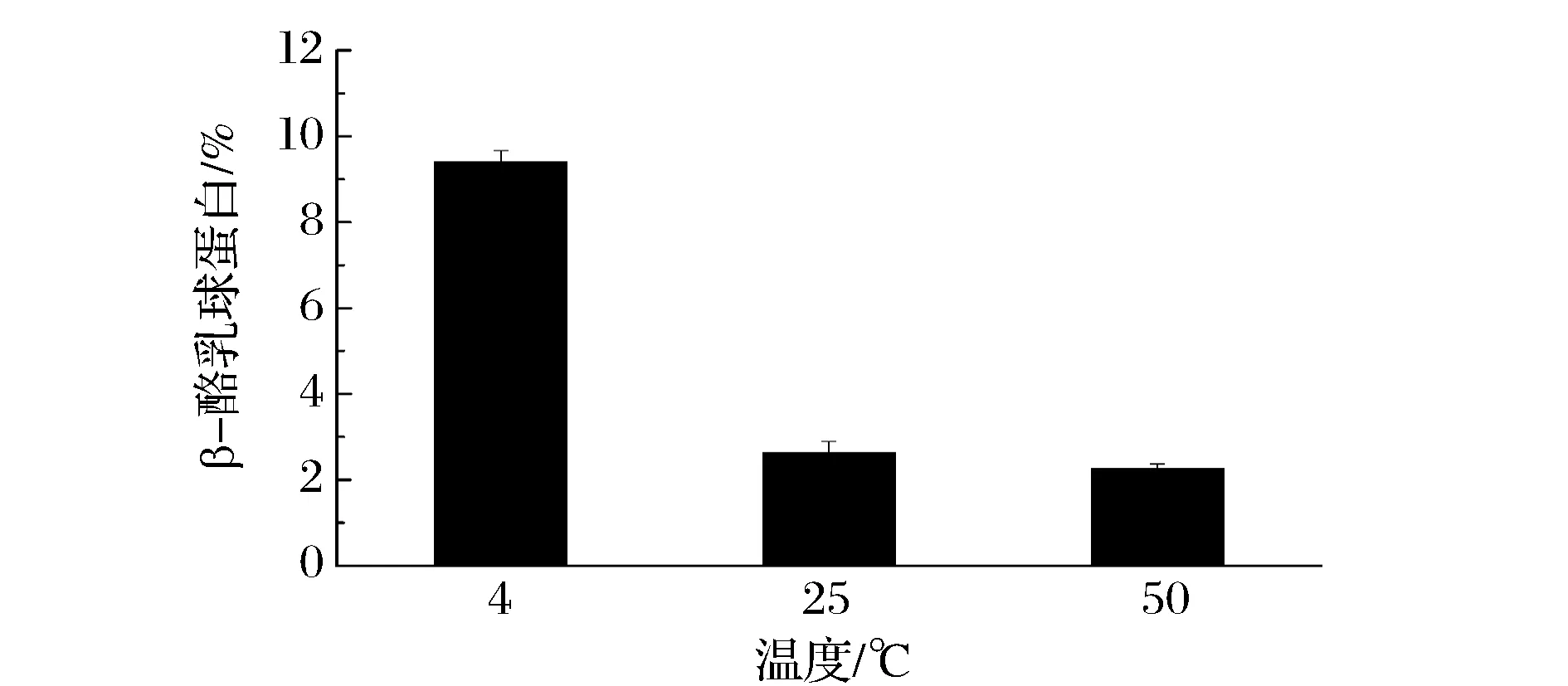
图6 30 nm孔径陶瓷膜在不同温度条件下微滤分离脱脂乳所得透过液中β-酪蛋白占原脱脂乳中β-酪蛋白的比例Fig.6 The ratio of β-casein isolated under different temperatures to total β-casein in skim milk at 4℃
图7为使用30 nm陶瓷膜分离时,不同温度下的平均膜通量的变化。从图7中可以明显观察到4 ℃条件下,平均膜通量最低,仅为19.1 kg/(m2·h);而50℃条件下微滤的平均膜通量则高达71.9 kg/(m2·h)。这种膜通量的差异主要是料液的黏度造成的,温度的降低会造成牛奶黏度增大,在膜分离过程中容易产生浓差极化,造成膜孔径的堵塞,从而影响平均膜通量[16]。

图7 不同温度下膜通量的变化Fig.7 The change of membrane flux under different temperatures
2.3 洗滤液和洗滤次数对β-酪蛋白分离效果的影响
在膜分离过程中,随着浓缩倍数的增加,位于膜表面的浓差极化效应将逐渐增强,最终降低膜通量和膜分离效率,因此单次膜分离的浓缩倍数通常为2~4。因此,仅通过1次低温微滤所得的β-酪蛋白和乳清蛋白的产率较低,为了尽可能多的分离出β-酪蛋白和乳清蛋白,需要反复多次的加入洗滤液至原体积进行洗滤[17]。工业中常用的洗滤液有水,本实验还采用超滤透过液做对比。超滤透过液是将脱脂牛乳或微滤透过液采用超滤膜进行浓缩后得到的透过液,含乳糖、水和无机盐类等。用超滤透过液进行微滤洗滤的好处是酪蛋白胶束保持在原始的乳清环境中,降低膜分离过程对胶束结构的破坏[18]。
30 nm陶瓷膜在4 ℃条件下微滤和洗滤分离脱脂乳脱所得透过液的电泳结果如图8所示。从图中可以看出,随着洗滤次数的增加,透过液中乳清蛋白的量在逐渐减少,而β-酪蛋白在各个阶段所对应的蛋白条带都较为明显,说明在洗滤过程中β-酪蛋白逐渐从胶束中解离到了乳清中。

(W1)脱脂乳的微滤;(W2)第一次补水洗滤;(W3)第二次补水洗滤;(W4)第三次补水洗滤;(W5)第四次补水洗滤;(U1)脱脂乳的微滤;(U2)第一次用超滤透过液洗滤;(U3)第二次用超滤透过液洗滤;(U4)第三次用超滤透过液洗滤;(U5)第四次用超滤透过液洗滤图8 30 nm陶瓷膜在4 ℃条件下微滤和洗滤分离脱脂乳脱所得各阶段透过液的电泳图Fig.8 SDS-PAGE of skim milk protein separation by 30 nm ceramic membranes with different solutions during diafiltration at 4 ℃
如图9和图10所示,通过HPLC定量分析可得出脱脂乳在微滤和洗滤过程中乳清蛋白和β-酪蛋白的累积脱除率。随着洗滤次数的增加,乳清蛋白的脱除率逐渐增加,且在洗滤4次后,乳清蛋白的脱除率达到99.7%;用水和超滤透过液分别作洗滤液,所得乳清蛋白脱除率无显著差异。此外,一次微滤能分离出脱脂乳中9.4%左右的β-酪蛋白,随着洗滤次数的增加,β-酪蛋白的脱除率逐渐增加。当用水洗滤时,经4次洗滤后总共可以分离出脱脂乳中51.7%的β-酪蛋白;而使用超滤截留液进行洗滤时,每次洗滤分离出的β-酪蛋白都比用水洗滤时低,经过4次洗滤后β-酪蛋白的累积脱除率为37.8%,比用水洗滤时少13.9%。这可能是因为当用水做洗滤液时,不断地补水洗滤改变了胶束原有的乳清环境,会使维持胶束骨架的胶体磷酸钙发生部分解离,从而在一定程度上破坏了胶束结构,使参与形成胶束骨架的部分β-酪蛋白和通过疏水作用镶嵌在胶束骨架中的β-酪蛋白一起从胶束中解离出来,进而富集到了透过液中[19]。

图9 30nm陶瓷膜在4 ℃条件下微滤和洗滤分离脱脂乳的过程中乳清蛋白的累积脱除率Fig.9 The ratio of whey protein isolated to total whey protein in skim milk by 30 nm ceramic membranes with different solutions during diafiltration at 4 ℃

图10 30 nm陶瓷膜在4 ℃条件下微滤和洗滤分离脱脂乳的过程中β-酪蛋白的累积脱除率Fig.10 The ratio of β-casein isolated to total β-casein in skim milk by 30 nm ceramic membranes with different solutions during diafiltration at 4 ℃
图11所示为微滤和洗滤分离脱脂乳所得透过液的累积混合液中β-酪蛋白占总蛋白的比例。第一次微滤透过液中β-酪蛋白所占比例为35.3%。当用水做洗滤液时,随后随着洗滤次数的增加,累积混合液中β-酪蛋白的比例逐渐增加,分别为41.8%、45.9%、48.8%和51.1%;当用超滤透过液进行洗滤时,随着洗滤次数的增加,累积混合液中β-酪蛋白比例也不断增加,但是一直要小于用水洗滤时的比例,最后一次洗滤后,所得到的累积混合液中β-酪蛋白比例为43.6%。

图11 30 nm陶瓷膜在4 ℃条件下微滤和洗滤分离脱脂乳所得透过液的累积混合液中β-酪蛋白占总蛋白的比例Fig.11 The ratio of β-casein isolated to total proteins in permeate by 30 nm ceramic membranes with different solutions during diafiltration at 4 ℃
图12为微滤和洗滤分离脱脂乳所得透过液的累积混合液中αs-酪蛋白占总蛋白的比例。第一次微滤透过液中αs-酪蛋白所占比例为4.7%,这对应牛乳中原本游离的αs-酪蛋白。当用水洗滤时,随着洗滤次数的增加,累积混合液中αs-酪蛋白所占比例逐渐增加,分别为7.2%、8.1%、8.8%和8.9%;当用超滤透过液进行洗滤时,累积混合液中αs-酪蛋白所占的比例约为5.1%、5.5%、5.8%和6.2%。这进一步说明当用水做洗滤液时,膜分离过程对胶束结构的破坏程度更高,使得参与形成胶束骨架的αs-酪蛋白的解离程度更高。但这种解离程度有限,累计混合液中αs-酪蛋白的含量很少,且用水洗滤仅比用超滤透过液洗滤时多出2.7%的αs-酪蛋白。
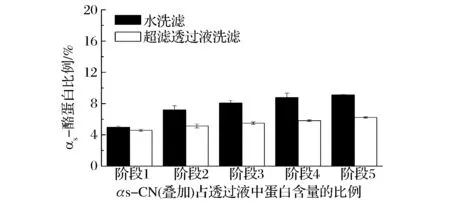
图12 30 nm陶瓷膜在4 ℃条件下微滤和洗滤分离脱脂乳所得透过液的累积混合液中αs-酪蛋白占总蛋白的比例Fig.12 The ratio of αs-casein isolated to total proteins in permeate by 30 nm ceramic membranes with different solutions during diafiltration at 4 ℃
图13为使用不同的洗滤液进行多次洗滤时,膜通量的变化情况,这决定了整个过程中膜分离的速度。分离过程中,随着β-酪蛋白、乳清蛋白、乳糖和矿物质等的逐渐脱除,截留液中的固形物总量逐渐减少,补水稀释使得料液固形物浓度进一步下降,降低浓差极化效应,膜通量逐渐上升[20]。使用超滤透过液进行洗滤时,随着洗滤次数的增加平均膜通量大幅度下降,这可能是由于添加了超滤透过液以后,胶束仍存在于原始的乳清环境中,体系固形物总量变化不明显,长时间的浓差极化效应导致膜孔径的堵塞,从而使平均膜通量逐渐降低。

图13 不同洗滤液下膜通量的变化Fig.13 The change of membrane flux under different solutions during diafiltration
3 结论
本研究以市售巴氏杀菌脱脂乳为原料,通过控制低温和膜分离结合的方法制备了含β-酪蛋白和乳清蛋白的新型功能性蛋白配料。使用经济耐用的陶瓷膜为微滤膜材料,比较膜孔径、分离温度、洗滤液和洗滤次数对分离效果和膜通量的影响,旨在为工业化生产提供相关参考。通过聚丙烯酰胺凝胶电泳和高效液相色谱2种方法测定蛋白质的组成和含量。在使用100 nm和50 nm的陶瓷膜进行分离时,仍会有部分的酪蛋白胶束通过陶瓷膜;而使用30 nm膜进行分离时,透过液澄清透亮,几乎不含有酪蛋白胶束。采用30 nm陶瓷膜,在25 ℃和50 ℃分离时,透过液中主要含乳清蛋白,几乎不含有β-酪蛋白;在4 ℃分离时,透过液中含有较多的β-酪蛋白,因此在低温下有利于β-酪蛋白的分离。对比不同的洗滤液,可明显的发现用水洗滤比用超滤透过液洗滤更有利于β-酪蛋白的分离,而且膜通量较大,有利于膜分离效果的提高。由此采用30 nm膜,控制4 ℃低温条件,脱脂乳经微滤浓缩3倍后,再在相同条件下补水洗滤4次,将膜过滤各阶段所得的透过液混合,可得到β-酪蛋白和乳清蛋白的产率分别为51.7%和99.7%,复合蛋白中β-酪蛋白和乳清蛋白所占比例分别为51.1%和40.0%,而αs-酪蛋白的含量较低。所得复合蛋白可作为一种新型功能性蛋白配料用于婴幼儿配方乳粉的生产,这样在提高乳清蛋白含量的同时,也可以增加β-酪蛋白的含量,使得蛋白组成和比例更加接近于人乳蛋白。
[1] WIT J. Nutritional and functional characteristics of whey proteins in food products[J]. Journal of Dairy Science, 1998, 81(3): 597-608.
[2] SAEED Y Y, CORREDIG M, DOUGLAS G D. Studying the structure of β-casein-depleted bovine casein micelles using electron microscopy and fluorescent polyphenols[J]. Food Hydrocolloids, 2004, 42: 171-177.
[3] SWAISGOOD H E. Chemistry of the Caseins. In: Advanced Dairy Chemistry, Vol. 1[M]. London: Elsevier,1993: 63-110.
[4] 陈建行.酪蛋白胶束粉的膜分离生产工艺研究 [D].北京:中国农业科学院,2013.
[5] KRUIF C G D, HUPPERTZ T, URBAN V S, et al. Casein micelles and their internal structure[J]. Advances in Colloid and Interface Science, 2012, 171/172(2): 36-52.
[6] VISSER S, SLANGEN C J, ROLLEMA H S. Phenotyping of bovine milk proteins by reversed-phase high-performance liquid chromatography[J]. Journal of Chromatography A, 1991, 548(1/2): 361-370.
[7] ADAMS M C, HURT E E, BARBANO D M. Effect of ceramic membrane channel geometry and uniform transmembrane pressure on limiting flux and serum protein removal during skim milk microfiltration [J]. Journal of Dairy Science, 2015, 98(11): 7 527-7 543.
[8] DALGLEISH D G, CORREDIG M. The structure of the casein micelle of milk and its changes during processing[J]. Annual Review of Food Science and Technology, 2012, 3(1): 449-467.
[9] NELSON B K, BARBANO D M. A microfiltration process to maximize removal of serum proteins from skim milk before cheese making[J]. Journal of Dairy Science, 2005, 88(5): 1 891-1 900.
[10] PIERRE A, BRULE G. Mineral and protein equilibria between the colloidal and soluble phases of milk at low temperature[J]. Journal of Dairy Research, 1981, 48(48): 417-428.
[11] HURT E, ZULEWSKA J, NEWBOLD M W, et al. Production of micellar casein concentrate with a 3-stage UTP ceramic membrane process at 50 C[J]. Journal of Dairy Science, 2010, 93(12): 5 588-5 600.
[12] ZULEWSKA J, NEWBOLD M W, BARBANO D M. Efficiency of serum protein removal from skim milk with ceramic and polymeric membranes at 50 degrees C[J]. Journal of Dairy Science, 2009, 92(4): 1 361-1 377.
[13] CREAMER L K, BERRY G P, MILLS O E. A study of the dissociation of β-casein from the bovine casein micelle at low temperature[J]. New Zealand Journal of Dairy Science and Technology, 1977, 12: 58-66.
[14] HOLLAND B, CORREDIG M, ALEXANDER M. Gelation of casein micelles in β-casein reduced milk prepared using membrane filtration[J]. Food Research International, 2011, 44(3): 667-671.
[15] BERRE O L, DAUFIN G. Fouling and selectivity of membranes during separation of β-casein[J]. Journal of Membrane Science, 1994, 88(2/3): 263-270.
[16] DAVIES D T, LAW A J R. Variation in the protein composition of bovine casein micelles and serum casein in relation tomicellar size and milk temperature[J]. Journal of Dairy Research, 1983, 50(50): 67-75.
[17] BRANS G C, SCHROEN G P H, SMAN R G M V D. Membrane fractionation of milk: state of the art and challenges[J]. Journal of Membrane Science, 2004, 243(1/2): 263-272.
[18] O'MAHONY J A, SMITH K E, LUCEY J A (2007). Purification of beta casein from milk. Patent 11/272,331 (US 2007/0104847 A1).
[19] OUANEZAR M, GUYOMARC H F, BOUCHOUX A. AFM imaging of milk casein micelles: evidence for structural rearrangement upon acidification[J]. Langmuir the ACS Journal of Surfaces and Colloids, 2012, 28(11):4 915-4 919.
[20] HURT E,BARBANO D M. Processing factors that influence casein and serum protein separation by microfiltration[J]. Journal of Dairy Science, 2010, 93(10): 4 928-4 941.
Whey protein and β-casein enriched new functional milk protein by microfiltration at low temperature
LI Jun-ke, LIU Da-song, LAI Rui-ye, YU Yun, ZHOU Peng*
(School of Food Science and Technology, State Key Laboratory of Food Science and Technology,Collaborative Innovation Center of Food Safety and Quality Control,Jiangnan University, Wuxi 214122, China)
Commercial pasteurized skim milk was used as raw material, the pore size of membranes, temperatures, filtrate washing solutions and washing times on the effect of seperation and membrane flux were studied. SDS-PAGE and HPLC were used as qualitative and quantitative analysis to accurately characterize proteins’ separation. Results showed that at 4 ℃, using 30 nm ceramic membrane can obtain purified β-casein from skim milk, and with almost non- αs-casein. Besides, in order to maximize the separation of β-casein, deionized water was added to do the second level of filtration (or we called it as “diafiltration”) for 4 times. The yields of the β-casein and whey protein were 51.7% and 99.7% respectively; β-casein was 51.1% and whey protein was 40.0% in the compound protein. The compound protein can be used in infant formula powder.
skim milk; microfiltration; whey protein; β-casein; infant formula
硕士研究生(周鹏教授为通讯作者,E-mail: zhoupeng@jiangnan.edu.cn)。
国家自然科学基金(31471697);教育部科学技术研究项目(113032A)
2016-09-29,改回日期:2016-11-09
10.13995/j.cnki.11-1802/ts.201706014
