地衣芽胞杆菌碱性蛋白酶嗜碱突变体的特征分析
2017-07-31黄磊董自星金鹏王正祥路福平
黄磊,董自星,金鹏,王正祥,路福平*
1(天津科技大学 生物工程学院,工业发酵微生物教育部重点实验室,天津,300457)2(天津科技大学 化工与材料学院,生物化工系,天津,300457)
地衣芽胞杆菌碱性蛋白酶嗜碱突变体的特征分析
黄磊1,董自星2*,金鹏2,王正祥2,路福平1*
1(天津科技大学 生物工程学院,工业发酵微生物教育部重点实验室,天津,300457)2(天津科技大学 化工与材料学院,生物化工系,天津,300457)
地衣芽胞杆菌碱性蛋白酶是工业上重要的蛋白酶类,进一步提高其在碱性条件下的活力可改善其在洗涤剂工业方面的应用价值。该研究通过筛选获得一种在碱性条件下酶活水平显著提高的地衣芽胞杆菌B186来源的蛋白酶,并在枯草芽胞杆菌WB600中对其编码基因进行了成功克隆与表达,获得了重组菌WB600 (pHY-E209)。然后通过离子交换色谱和凝胶层析法,从重组菌的发酵液中纯化获得了重组碱性蛋白酶AprE209。对酶学性质的研究表明,重组酶AprE209的最适作用pH为11.0,最适作用温度为50 ℃,在30~37 ℃下和pH 12.0时仍具有很高的活力。进一步通过生物信息学的手段对其耐碱机制进行了初步解析。该嗜碱突变体具有进一步用于洗涤剂的潜在研究价值。
蛋白酶;嗜碱性突变体;洗涤剂行业;酶学特征
碱性蛋白酶是指在pH偏碱性范围内水解蛋白质肽键的一大酶类,是工业酶制剂中使用量最大的酶制剂之一,它在皮革、造纸、洗涤、化妆品、动物饲料等领域具有重要应用[1]。地衣芽胞杆菌碱性蛋白酶是工业上重要的蛋白酶,其中最具代表性的是地衣芽胞杆菌2709生产菌株生产的碱性蛋白酶(2709碱性蛋白酶),它是我国最重要的碱性蛋白酶来源[2]。2709碱性蛋白酶的全部编码序列长度为1140 bp,其中,信号肽、前导肽以及成熟肽的序列长度分别为87、228和825 bp,它是典型的Subtilisin Carlsberg类蛋白酶[3]。
地衣芽胞杆菌碱性蛋白酶曾经被成功应用于我国洗涤剂工业[2]。但其最适作用pH在9.5~10.0左右[4],而国际上现阶段则采用最适作用pH可以达到10.5~12.0或以上、其他细菌来源的碱性蛋白酶应用于洗涤剂工业[5]。与此同时,在相对较低温度保持较高的酶活力,也是洗涤剂工业应用中需要考虑的因素[6]。TINDBAEK等[7]和SIDDIQUI等[8]通过对枯草杆菌蛋白酶(subtilisins)进行分子改造,成功获得了适冷的碱性蛋白酶。除了对现有的蛋白酶进行分子改造,从嗜碱和适冷微生物中筛选新的蛋白酶也是目前研究的热点之一[5]。
本研究通过对地衣芽胞杆菌分离菌株保藏物所产碱性蛋白酶的最适作用pH进行初筛,获得1株能够在更高碱性条件下保持较高蛋白酶活性的菌株;并对其碱性蛋白酶进行了分子克隆与表达、生化特征分析以及耐碱机制的初步解析。研究结果可为新型碱性蛋白酶的研制奠定基础。
1 材料和方法
1.1 菌株、质粒及培养基
大肠杆菌(EscherichiacoliJM109)、枯草芽胞杆菌(BacillussubtilisWB600)和表达载体pHY-WZX[9]由本实验室保藏。地衣芽胞杆菌分离菌株保藏物由中国高校工业微生物资源与信息中心(http://cicim-cu.jiangnan.edu.cn)提供。克隆载体T-Vector pMD19 (simple)购于宝生物工程(大连)有限公司。
微生物的常规培养采用LB培养基,加入2%琼脂为固体培养基。必要时,添加100 μg/mL的氨苄青霉素或20 μg/mL卡那霉素。筛选培养基:以LB培养基为基础,使用前添加5%的无菌脱脂牛奶和终质量浓度为20 μg/mL的卡那霉素。发酵培养基(g/L):乳糖 40,玉米浆 30,豆饼粉 30,硫酸铵 5,pH 7.0。
1.2 主要试剂
LATaqDNA Polymerase和T4DNA ligase等为宝生物工程(大连)有限公司产品。质粒小量提取试剂盒、胶回收试剂盒等购于OMEGA Bio-Tek公司。蛋白分子量标准、限制性内切酶等由Thermo Fisher Scientific公司提供。2709碱性蛋白酶(20万 U/g)购于天津诺奥科技有限公司。牛血清白蛋白V部分、氨苄青霉素、硫酸卡那霉素和引物等由生工生物工程(上海)股份有限公司提供;其他试剂均为国产分析纯。
1.3 嗜碱性蛋白酶的筛选
将工业微生物菌种资源库中的地衣芽胞杆菌保藏物(共350株)在LB固体培养基平板上进行三区划线,37 ℃培养过夜。第2天,从平板上挑取单菌落并接种至含有20 mL LB液体培养基的250 mL三角瓶中,37 ℃、230 r/min培养12 h。然后按2%(v/v)的接种量接种至装有50 mL发酵培养基的500 mL三角瓶中,于37 ℃和230 r/min下培养72 h。发酵结束后,离心(8 000 r/min,10 min)收集上清。按照1.4小节的酶活测定方法,在不同pH下进行酶活测定。
1.4 碱性蛋白酶酶活力的测定
蛋白酶酶活力测定使用福林法[10]。其基本步骤为:取1 mL酶液至1 mL 1%(w/v)酪蛋白溶液中,在40 ℃和pH 10.5条件下作用10 min后,加入等体积的0.4 mol/L三氯乙酸终止反应,在反应温度下显色20 min,并于680 nm处测OD值。1个蛋白酶的酶活力单位定义为:在40 ℃和pH 10.5条件下,1 min水解酪蛋白产生1 μg酪氨酸所需的酶量,以U/mL表示。
蛋白质含量的测定参照Bradford法[11],以牛血清白蛋白V部分为标准参照品。
1.5 嗜碱性蛋白酶的克隆与表达
1.5.1 嗜碱性蛋白酶基因的克隆
PCR产物和质粒的纯化、酶切、连接、转化以及转化子的筛选等均按照实验室常规方法进行[12],使用试剂盒时按照试剂盒说明书进行。以筛选得到的地衣芽胞杆菌基因组DNA为模板,采用引物aprE-BL1(5’-AGCTCTAGAGCTCAGCCGGCGAAAAATG-3’)和aprE-BL2(5’-GGGTTATTGAGCGGCAGCTTCGACAT-3’)PCR扩增(下划线部分为人工设计XbaI位点)。PCR反应条件为:95 ℃ 5 min;95 ℃ 10 s,58 ℃ 45 s,68 ℃ 1 min,30个循环;68 ℃ 10 min。将PCR产物连接到载体T-Vector pMD19 (simple)上,并转化到大肠杆菌JM109中。通过蓝白斑筛选阳性克隆,提取重组质粒酶切验证后,采用双脱氧核苷链终止法进行核苷酸序列测定[13]。
1.5.2 重组菌的构建
将PCR扩增获得的碱性蛋白酶基因用XbaI进行酶切,并与经XbaI和SmaI酶切的载体pHY-WZX连接。然后采用更改的Spizizen方法[14]将连接产物转化到枯草杆菌WB600中,利用筛选培养基筛选阳性重组菌。进一步通过限制性酶酶切验证重组质粒的正确性。
1.5.3 嗜碱蛋白酶突变体的发酵制备
将重组菌接种于含20 μg/mL卡那霉素的50 mL LB液体培养基中。于37 ℃、220 r/min过夜培养后,取10 OD600nm菌体接种于50 mL发酵培养基中培养3~5 d,每隔24 h取样进行酶活测定。发酵结束后,离心(4 ℃,8 000 r/min)取上清,经真空冷冻干燥后,于-20 ℃保藏备用。
1.6 重组碱性蛋白酶的分离纯化与SDS-PAGE分析
将2709碱性蛋白酶(AprE2709)的分离纯化方法[15]进行适当修饰后用于重组酶AprE209的纯化,即采用盐析(30%~60%硫酸铵)、透析、Mono Q 5/50 GL阴离子交换色谱和Sephadex G-75凝胶层析法对AprE209进行纯化。通过酶活测定和SDS-PAGE分析蛋白的纯化情况。SDS-PAGE参照文献[16]进行,采用5%的浓缩胶,12%的分离胶。
1.7 酶学性质的分析与比较
1.7.1 最适反应pH和pH稳定性的测定
最适反应pH的测定:分别配制0.5 mol/L的乳酸-乳酸钠缓冲液(pH 4.0、5.0和6.0)、柠檬酸-磷酸氢二钠缓冲液(pH 7.0和8.0)和硼酸缓冲液(pH值分别为9.0、9.5、10.0、10.5、11.0、11.5和12.0)。分别用不同pH的缓冲液将酶粉进行适当稀释,并用该缓冲液配制1%(w/v)的酪蛋白溶液。在50 ℃条件下,测定酶样在不同pH值下的酶活,酶活数值最大者计为100%。
pH稳定性的确定:在上述不同pH值的缓冲液里和50 ℃恒温水浴下保温60 min,取出酶样,调整pH至10.5,按照上述酶法测定方法在pH 10.5和50 ℃下进行酶活测定,以未经过上述不同pH下孵育的酶样本酶活为100%进行计算。
1.7.2 最适反应温度和热稳定性的测定
最适反应温度的确定:在最适pH条件下,分别测定酶样在30、35、37、40、45、50、55和60 ℃下的酶活力,以酶活最高者计为100%。
热稳定性的测定:首先将酶样置于不同温度下保温不同时间,每隔30 min取样,按照1.4的方法测定其酶活,以未经水浴处理的酶活为100%。
1.7.3 金属离子和螯合剂对酶活的影响
在酶活测定反应体系中,分别加入终浓度为5 mmol/L或10 mmol/L的K+、Ca2+、Mg2+、Zn2 +、Mn2+、Co2+、Cu2 +、Fe3+和EDTA,然后按照1.4的方法进行酶活测定。以不加金属离子和螯合剂的反应体系的酶活力为100%。
1.8 生物信息学分析
利用BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行核苷酸序列相似性比对,并采用Clustal X2和BioEdit 7.0.9对氨基酸序列进行比对与分析。然后通过在线软件Swiss Model(http://swissmodel.expasy.org/)对嗜碱性蛋白酶和2709蛋白酶的3-D结构进行模拟,并利用软件Discovery Studio 2.5对其进行分析和比较。疏水相互作用、二硫键及离子键由PIC在线服务器(http://pic.mbu.iisc.ernet.in/index.html)进行分析。
2 实验结果
2.1 嗜碱性蛋白酶产生菌的筛选
对菌种库中的350株地衣芽胞杆菌分离菌株的产蛋白酶的嗜碱性能进行筛选,在pH 11.0和pH 9.0酶活的比值(pH 11.0/pH 9.0)最高的10株菌的酶活测定结果汇总于表1。其中菌株B0209所产蛋白酶在pH 11.0下显示较明显的蛋白酶酶活,而且它在pH 11.0时的酶活是pH 9.0时酶活的1.25倍,高于其它菌株所产的蛋白酶。为此,选择此菌株所产蛋白酶进行后续进一步研究。

表1 产碱性蛋白酶菌株的筛选
2.2 AprE209的分泌表达与分离纯化
以上述筛选获得的地衣芽胞杆菌B186的基因组DNA为模板,通过PCR扩增获得蛋白酶编码基因aprE209。进一步将aprE209克隆入表达质粒pHY-WZX,获得重组表达质粒pHY-E209,将此重组表达质粒遗传转化入蛋白酶基因缺失的枯草杆菌WB600中,获得重组菌WB600 (pHY-E209)。然后将重组菌进行摇瓶发酵,发酵结束后,发酵上清液中重组酶AprE209的酶活达到400 U/mL。再将发酵液中的AprE209冻干后,再经盐析、透析、阴离子交换色谱和凝胶层析进行纯化,并用SDS-PAGE分析纯化效果,结果如图1所示。由图1可知,AprE209的分子量大小约为30 kDa,在SDS-PAGE中呈现为单一条带,达到了电泳纯。

M-蛋白分子量标准;1-纯化获得的AprE209图1 SDS-PAGE分析重组酶AprE209的纯化效果Fig.1 SDS-PAGE analysis of the purified recombinant enzyme AprE209
2.3 重组酶的酶学性质比较分析
2.3.1 最适反应pH
在不同pH反应条件下分析AprE209的酶活并与2709碱性蛋白酶进行比较,结果如图2所示。AprE209在pH 11.0时表现出最高酶活,而2709碱性蛋白酶则在pH 10时呈现最高酶活力,二者的最适作用pH呈现显著差异。AprE209在偏碱性的条件下仍具有较高酶活。
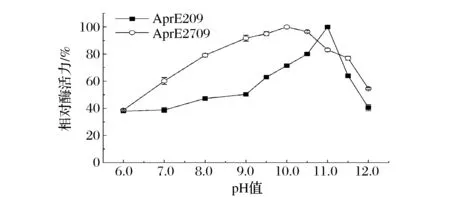
图2 碱性蛋白酶AprE209和AprE2709的最适反应pHFig.2 pH optima of alkaline proteases AprE209 and AprE2709
2.3.2 pH稳定性
在不同pH条件下处理酶液,取样恢复pH后分析此过程对酶活力的影响,结果见图3。在pH 5.0~11.0范围内,AprE209和2709碱性蛋白酶的稳定性皆很好,酶活保持率>80%。另外,我们也观察到,AprE209在pH 12.0的条件下仍然具有很好的pH稳定性(残留酶活>80%),而2709碱性蛋白酶在此条件下的pH稳定性显著变差。
2.3.3 最适反应温度
分别在不同温度下测定碱性蛋白酶AprE209的酶活并与2709碱性蛋白酶进行比较,结果见图4。可以看出,AprE209和2709碱性蛋白酶的最适反应温度存在差异性,AprE209的最适反应温度为50 ℃,而2709碱性蛋白酶为55 ℃;在温度下降到37 ℃时,两者仍维持60%左右的酶活;在30 ℃范围内仍保持有40 %左右的酶活。此外,在35~50 ℃范围内,AprE209的相对酶活高于AprE2709。

图4 碱性蛋白酶AprE209和AprE2709的最适温度Fig.4 Optimum temperatures of alkaline proteases AprE209 and AprE2709
2.3.4 热稳定性
将酶液在不同温度下孵育90 min,定时取样分析酶液的酶活,结果显示, AprE209和2709碱性蛋白酶在耐热性能上存在显著差异(图5)。AprE209在37 ℃时热稳定性较好,90 min内相对酶活均保持在95%以上;45 ℃孵育30 min后,该碱性蛋白酶的相对酶活下降至50%左右,而当水浴60 min时,其残余酶活仅剩30%左右。50 ℃孵育30 min时,残留酶活小于10%(图5a)。相对应地,2709碱性蛋白酶则具有更高的热稳定性(图5b)。热不稳定的用途更多体现在酶发挥作用之后需要对残余酶进行灭活。由此也表明,AprE209可能具有与2709碱性蛋白酶不同的应用温度环境与应用领域。
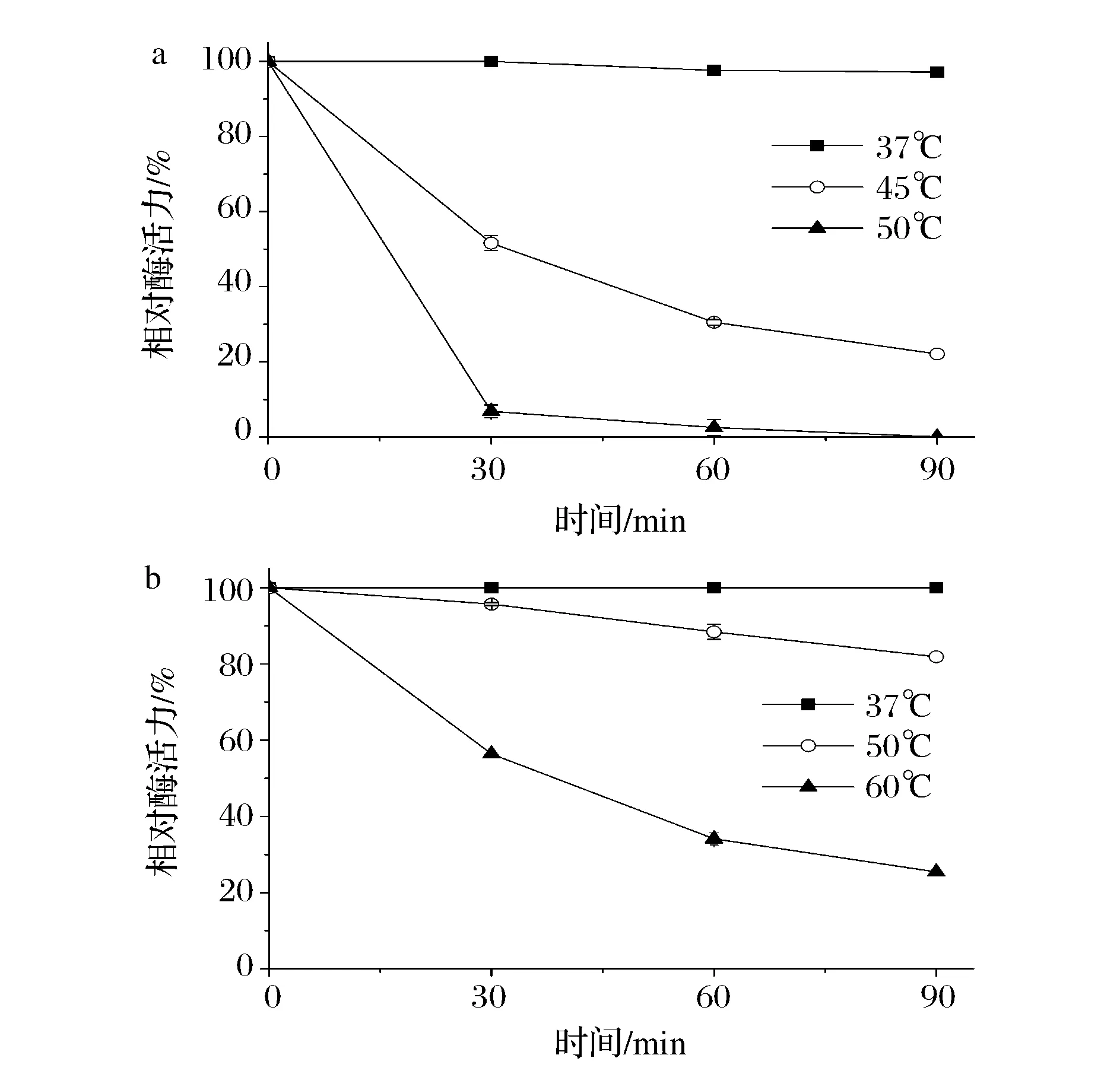
a-AprE209;b-AprE2709图5 碱性蛋白酶AprE209和AprE2709的热稳定性Fig.5 Thermostability of alkaline proteases AprE209 and AprE2709
2.3.5 金属离子对酶活的影响
在酶促反应体系中加入终浓度为5 mmol/L或10 mmol/L不同的金属离子和EDTA,研究其对AprE209酶活的影响并与2709碱性蛋白酶进行比较,结果见表2。
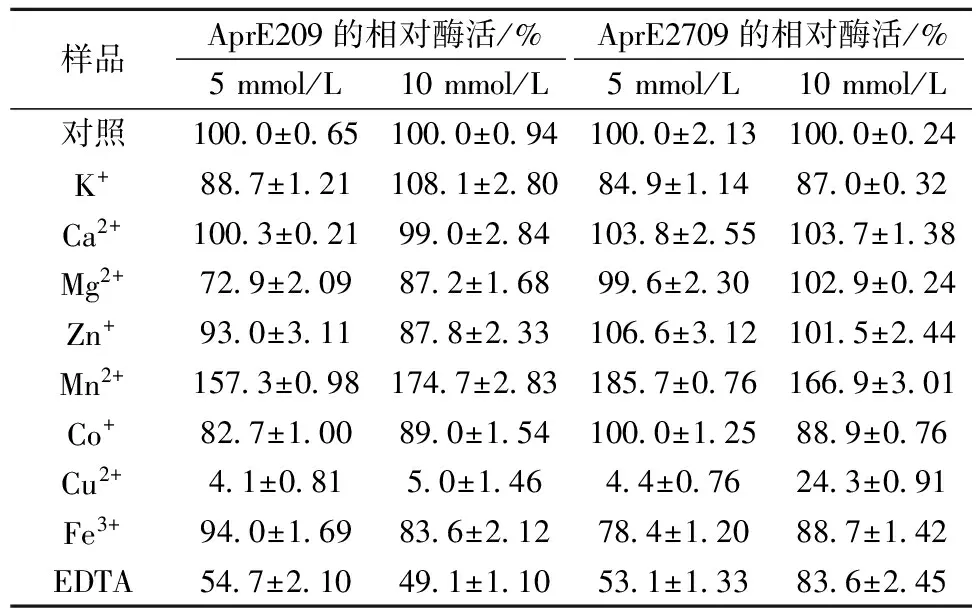
表2 金属离子对AprE209和2709碱性蛋白酶酶活的影响
表2中金属离子对AprE209和2709碱性蛋白酶的影响具有一定的相似性,其中Ca2+、Zn2+对2种蛋白酶的酶活均没有明显影响;Mg2+对AprE209有一定的抑制作用,而对2709碱性蛋白酶无明显影响;K+、Co+、Cu2+、Fe3+、EDTA对这2种蛋白酶均具有不同程度的抑制作用,且Cu2+的抑制作用非常显著。Mn2+对AprE209和AprE2709的酶活具有显著的激活作用。此外,这2种蛋白酶对EDTA均较为敏感。
2.4 重组酶AprE209耐碱机制的初步解析
为了初步解析嗜碱性蛋白酶AprE209的耐碱机制,将其核苷酸及其演绎的氨基酸序列与现在工业上使用的碱性蛋白酶2709(AprE2709)进行比对,结果如图6所示。

图6 AprE209和AprE2709的氨基酸序列比对Fig.6 Multiple sequence alignment of AprE209 and AprE2709
可以看出,AprE209前体与AprE2709的氨基酸序列相似度为98.29%。AprE209的氨基酸序列中有6个氨基酸残基与蛋白酶2709存在差异,分别是Ile28、Ala124、Asn162、Pro204、Lys270和Ser287(图6)。其中,Ile28位于蛋白酶的前肽序列中,会随着AprE209前体的激活被切割掉[17];而另外5个氨基酸位于成熟肽上,应该是该突变体酶AprE209的相关酶学特征发生变化的基础。

a-AprE209; b-AprE2709;催化三联体和发生突变的氨基酸残基分别用黑色和深灰色标注;浅灰色标注的是其他氨基酸;虚线表示的氢键,数字表示的是距离图7 突变的氨基酸残基以及催化三联体周围的氢键作用Fig.7 Hydrogen-bonding network formed around mutated amino acids and catalytic triads
进一步对上述两种碱性蛋白酶的三维结构进行模拟与分析,结果表明,在5个有差异的氨基酸残基以及催化三联体周围,AprE209比AprE2709多了2个氢键(图7)。接着采用PIC在线服务器对AprE209和AprE2709的分子间作用力(包括离子键、二硫键及疏水相互作用等)进行了分析,发现二者的离子键和二硫键没有差异,但是AprE209比AprE2709多了两对疏水相互作用力。
3 讨论
由于可以大大缩短洗涤时间,提高洗涤效率,碱性蛋白酶已经作为添加剂广泛应用于洗涤剂行业。第一代商业化的洗涤剂用蛋白酶主要是来源于地衣芽胞杆菌、解淀粉芽胞杆菌和史密斯芽胞杆菌液的碱性蛋白酶,其最适反应pH为9~10,如2709碱性蛋白酶、诺维信的Subtilisin Carlsberg以及Alcalase等[4]。由于这些碱性蛋白酶在洗涤衣物的环境中(pH 11.0)的酶活显著下降,来源于嗜碱微生物的高碱性蛋白酶(最适反应pH大于10.5)成为第2代洗涤剂用蛋白酶[4]。而目前国内洗涤剂生产厂家采用的嗜碱性蛋白酶主要被国外企业垄断。因此,获得1株适用于工业化生产的嗜碱性蛋白酶的高产菌株,建立起具有我国自主知识产权的嗜碱性蛋白酶生产技术体系显得非常必要和重要。
本研究通过菌株筛选以及基因的克隆与表达,获得一个能在高碱性条件下保持较高活力的碱性蛋白酶嗜碱突变体AprE209。氨基酸序列比对的结果表明,该酶与2709碱性蛋白酶的氨基酸序列差异性仅为1.71%(图6),但二者的酶学特征却有较大的差异。酶学性质的研究表明,AprE209的最适反应pH为11.0,高于2709碱性蛋白酶的最适反应pH(图2);并且,AprE209在pH 5.0~12.0的范围内具有良好的稳定性,在pH 12.0的碱性条件下仍能保留80%以上的酶活,pH稳定性也优于2709碱性蛋白酶(图3)。
分子间的相互作用力,如疏水相互作用、静电相互作用以及氢键在稳定蛋白质结构及改变催化残基的pKa值等方面发挥着重要的作用[18]。本文进一步通过生物信息学的研究发现,重组酶AprE209比AprE2709多了2对疏水相互作用力,这可能是其在碱性条件下仍具有良好的活性和稳定性的原因。嗜碱突变体AprE209中活性位点His139周围比AprE2709多了1个氢键(图7,His139与Asp135之间形成的氢键),这可能也是其具有耐碱性的重要原因之一,因为丝氨酸蛋白酶对pH的依赖性与活性中心里组氨酸的pKa值有关[19]。此外,AprE209中Lys270比AprE2709的Glu270周围多了2个氢键(图7),这也可能与其耐碱性有关。后续将通过定点突变,进一步确认这些氨基酸残基在AprE209的耐碱性中发挥的作用。
此外,本研究获得的AprE209在较低的温度下(30~37 ℃)仍能保持相对较高的酶活,将它加入洗涤剂中清洗衣物时,不需要用40~60 ℃的热水浸泡便能发挥其洗衣效力。这样既避免了能源的浪费,也符合亚洲特别是发展中国家用自来水洗衣服的习惯,还将促进全球洗衣行业向着低温、节水型发展。
综上所述,本研究通过菌株筛选和分子克隆技术获得了碱性蛋白酶嗜碱突变体AprE209,它在高碱性和低温条件下能保持相对较高的活性,在洗涤剂、食品、化妆品以及水产饲料等行业具有潜在的应用价值。
[1] GUPTA R, BEG Q, LORENZ P. Bacterial alkaline proteases: molecular approaches and industrial applications[J]. Applied Microbiology and Biotechnology, 2002, 59(1): 15-32.
[2] 孙倩. 高产碱性蛋白酶菌种的选育及发酵过程优化[D]. 郑州:河南工业大学, 2012.
[3] 洪扬, 雷虹, 赵玉风, 等. 地衣芽孢杆菌2709碱性蛋白酶基因的克隆、序列测定及其表达[J]. 生物工程学报, 1994, 10(03): 271-276.
[4] FUJINAMI S, FUJISAWA M. Industrial applications of alkaliphiles and their enzymes——past, present and future[J]. Environmental Technology, 2010, 31(8-9): 845-856.
[5] LYLLOFF J E, HANSEN L B, JEPSEN M, et al. Genomic and exoproteomic analyses of cold- and alkaline-adapted bacteria reveal an abundance of secreted subtilisin-like proteases[J]. Microbial Biotechnology, 2016, 9(2): 245-256.
[6] SAEKI K, OZAKI K, KOBAYASHI T, et al. Detergent alkaline proteases: enzymatic properties, genes, and crystal structures[J]. Journal of Bioscience and Bioengineering, 2007, 103(6): 501-508.
[7] TINDBAEK N, SVENDSEN A, OESTERGAARD P R, et al. Engineering a substrate-specific cold-adapted subtilisin[J]. Protein Engineering, Design & Selection : PEDS, 2004, 17(2): 149-156.
[8] SIDDIQUI K S, PARKIN D M, CURMI P M, et al. A novel approach for enhancing the catalytic efficiency of a protease at low temperature: reduction in substrate inhibition by chemical modification[J]. Biotechnology and Bioengineering, 2009, 103(4): 676-686.
[9] NIU Dan-dan, WANG Zheng-xiang. Development of a pair of bifunctional expression vectors forEscherichiacoliandBacilluslicheniformis[J]. Journal of Industrial Microbiology & Biotechnology, 2007, 34(5): 357-362.
[10] 中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会. GB/T 23527-2009蛋白酶制剂[S]. 北京: 中国标准出版社,2009.
[11] BRADFORD M M. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J]. Analytical Biochemistry, 1976, 72: 248-254.
[12] 诸葛健, 王正祥. 工业微生物实验技术手册[M]. 北京: 中国轻工业出版社, 1994: 413-450.
[13] SANGER F, NICKLEN S, COULSON A R. DNA sequencing with chain-terminating inhibitors[J]. Proceedings of the National Academy of Sciences of the United States of America, 1977, 74(12): 5463-5467.
[14] 夏雨. 枯草芽孢杆菌食品级表达系统的构建和分泌表达研究[D]. 无锡: 江南大学, 2007.
[15] 马永强, 张浩, 杨春华, 等. 地衣芽孢杆菌2709蛋白酶分离纯化研究[J]. 食品科学, 2010,31 (11): 141-146.
[16] 奥斯伯 F M, 金斯顿 R E, 塞德曼 J G, 等. 精编分子生物学实验指南[M]. 北京: 科学出版社, 2008: 42-50.
[17] 令桢民. Streptomyces griseus胰蛋白酶的分子改造[D]. 无锡:江南大学, 2013.
[18] TIWARI M K, SINGH R K, SINGH R, et al. Role of conserved glycine in zinc-dependent medium chain dehydrogenase/reductase superfamily[J]. The Journal of Biological Chemistry, 2012, 287(23): 19 429-19 439.
[19] RUSSELL A J, FERSHT A R. Rational modification of enzyme catalysis by engineering surface charge[J]. Nature, 1987, 328(6 130): 496-500.
Biochemical characterization of alkalophilic mutant ofBacilluslicheniformisprotease
HUANG Lei1,DONG Zi-xing2*,JIN Peng2,WANG Zheng-xiang2,LU Fu-ping1*
1(Key Laboratory of Industrial Fermentation Microbiology,Ministry of Education,College of Biotechnology,Tianjin University of Science & Technology,Tianjin 300457,China)2(Department of Biochemical Engineering,College of Chemical Engineering and Materials Science,Tianjin University of Science & Technology,Tianjin 300457,China)
Alkaline protease fromBacilluslicheniformisis an important protease in the industry. Improving its activity and stability under alkaline pH conditions can broaden the range of applications in detergent industry. In this study, a high-alkaline protease fromB.licheniformisB186 was screened, and its encoding gene was successfully cloned and expressed inB.subtilisWB600 to generate the recombinant bacterium WB600 (pHY-E209). Recombinant alkaline protease AprE209 was then purified to apparent homogeneity from the supernatant of the recombinant bacterium using ion exchange chromatography and filtration chromatography. The optimum pH and temperature of recombinant enzyme AprE209 were 11.0 and 50 ℃, respectively. This recombinant enzyme also retained high activities at temperatures of 30-37 ℃ or pH 12.0. Furthermore, the mechanism of alkali-tolerance of AprE209 was analyzed by bioinformatics tools. The alkalophilic mutant ofB.licheniformisprotease obtained in this study had potential applications in detergent industry.
protease;alkalophilic mutant;detergent industry;enzymatic properties
硕士研究生(董自星博士、路福平教授为共同通讯作者,E-mail: dzx@tust.edu.cn; lfp@tust.edu.cn)。
国家自然科学基金面上项目(31370076);福建省自然科学基金(2016J01157)
2016-12-15,改回日期:2017-01-04
10.13995/j.cnki.11-1802/ts.201706006
