丁酸钠对匙吻鲟生长和肠道黏膜形态的影响
2017-07-31汪富荣孙浪何纯希廖伏初肖调义任建舟
汪富荣,孙浪,何纯希,廖伏初,肖调义,任建舟
(1.益阳市赫山区畜牧水产局,湖南益阳413000;2.湖南省水产科学研究所,湖南长沙410153;3.湖南省特色水产资源利用工程技术研究中心,湖南农业大学,湖南长沙410128;4.益阳市泊湖岭绿色农林有限公司,湖南益阳413041)
丁酸钠对匙吻鲟生长和肠道黏膜形态的影响
汪富荣1*,孙浪1,何纯希1,廖伏初2,肖调义3,任建舟4
(1.益阳市赫山区畜牧水产局,湖南益阳413000;2.湖南省水产科学研究所,湖南长沙410153;3.湖南省特色水产资源利用工程技术研究中心,湖南农业大学,湖南长沙410128;4.益阳市泊湖岭绿色农林有限公司,湖南益阳413041)
本试验以初始体质量(48.87±3.13)g的匙吻鲟(Polyodon spathula)为研究对象,在基础饲料中分别添加0、1.0、2.5、5.0、7.5 g/kg的包膜丁酸钠,配制成5种等氮等能的试验饲料,研究不同浓度包膜丁酸钠对匙吻鲟生长和肠道黏膜形态的影响。试验在水库网箱中进行,每网箱饲喂15尾,每处理组3个重复,投喂量为鱼体质量的3%~5%,日投喂3次,试验持续10周。试验结果表明:在饲料中添加丁酸钠对匙吻鲟有一定的促生长作用,显著提高了匙吻鲟肠道绒毛高度/隐窝深度的比值。当丁酸钠添加量为1.0 g/kg时,匙吻鲟增重率和特定生长率最高,比对照组分别提高了16.87%和9.3%(P<0.05);丁酸钠添加量为1.0 g/kg时,匙吻鲟肠道绒毛高度显著升高,比对照组提高153.4%(P<0.05)。综上,饲料中添加适量的丁酸钠可通过显著提高匙吻鲟肠绒毛高度,从而促进其生长,并且适宜添加量为1.0 g/kg。
丁酸钠;匙吻鲟;生长;肠道黏膜形态
匙吻鲟(Polyodon spathula)俗称鸭嘴鲟,原产于美国密西西比河流域,隶属于鲟形目(Acipenseriformes)匙吻鲟科(Polyodontidae),是一种大型淡水食用兼观赏鱼类。匙吻鲟生长快、个体大、肉味鲜美、营养价值高,卵、肉、皮具有极高的经济价值。研究表明,丁酸钠能促进肠道细胞增殖和成熟,维持肠黏膜上皮细胞的正常形态,从而促进营养物质在小肠的消化吸收(Scheppach,1994;Galfi等,1990;Gaubatz等,1990;Roediger,1982)。大量研究报道,在仔猪、雏鸡饲料中添加丁酸钠能提高其摄食量和增重率,降低饲料系数,调节肠道微生态系统和提高免疫功能(邹杨等,2010;郭传珍等,2009;刘丽华等,2009;Julia等,2007;Piva等,2007)。目前,丁酸钠在匙吻鲟饲料中应用的研究鲜见报道,本研究拟在饲料中添加不同剂量的包膜丁酸钠,研究其对匙吻鲟生长性能和肠道黏膜形态的影响,以期为丁酸钠在匙吻鲟营养中的应用及其作用机理提供理论参考。
1 材料与方法
1.1 试验饲料参照匙吻鲟的营养参数和商品饲料配方,以豆粕和鱼粉作为蛋白源,油脂为脂肪源,面粉作为糖源,参考孙浪等(2013)配方,在匙吻鲟基础饲料中分别添加0、1.0、2.5、5.0、7.5 g/kg五种剂量的包膜丁酸钠(由浙江康德权科技有限公司提供,30%微囊包膜丁酸钠),配制成5种等氮等能的饲料(粗蛋白质42%,粗脂肪7.5%)。基础饲料组成及营养水平见表1。
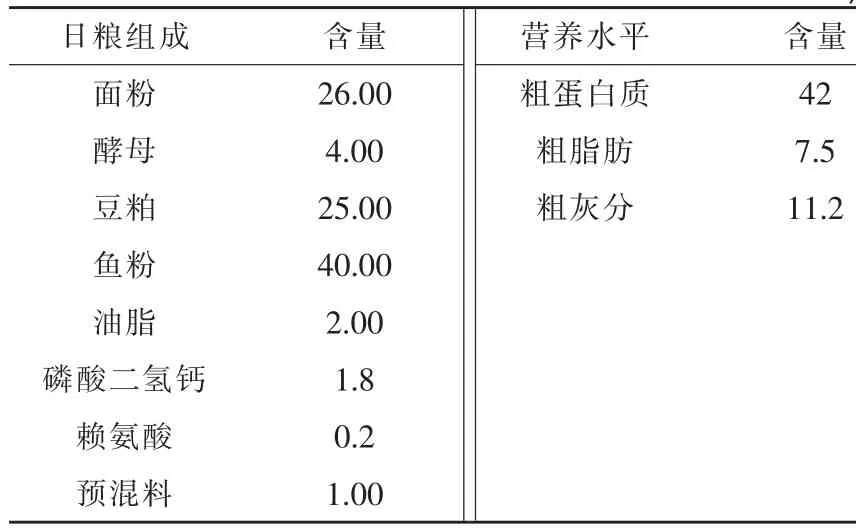
表1 基础饲料组成及营养水平(干重)%
1.2 动物饲养与管理选用初始体质量为(48.87±3.13)g,大小规格一致和体质健壮的同批孵化匙吻鲟(由长沙美珍匙吻鲟繁殖基地提供)作为试验对象,进行10周的摄食生长试验。共设5个处理组,每个处理设3个重复,每个重复15尾鱼。养殖试验在益阳市赫山区建新家庭农场养殖基地(衡龙桥镇青竹塘水库)网箱中进行,网箱规格为2 m×3 m×3 m。试验开始后,每日于7∶00,12∶00,17∶00投喂3次,养殖过程均采用鱼体质量3%~5%投喂量投喂,饲料在投喂20 min后基本被摄食完全。试验期间配置2.2 kW微孔增氧机一台,适时增氧,水温25~28℃,pH值6.8~8.5。每天记录水温、投喂量和摄食情况等。
1.3 样品收集、分析与计算生长和形体指标:养殖试验结束后,停止喂食24 h,分别称量每箱鱼体重并记录鱼尾数,计算每箱匙吻鲟的平均体重、增重率、成活率、特定生长率。然后,每箱随机取4尾试验鱼,分别量其体重和体长,对应冰盘上解剖取其内脏并称重,计算肥满度和脏体比。计算公式如下:
增重率/%=(鱼末均重-鱼初均重)/初始均重× 100;
特定生长率/(%/d)=(In鱼末均重-In鱼初均重)/试验天数×100;
成活率/%=试验末尾数/试验初尾数×100;
肥满度/(g/cm3)=鱼体质量/鱼体长3×100;
脏体比/%=内脏重量/鱼体质量×100。
肠道黏膜形态测定:试验结束后,每个重复随机取2尾鱼,称重后,分离出肠道,用生理盐水洗净肠道内容物,测量肠道长度并称量其肠重,分别计算肠道相对长度和肠道相对重量。称重后,固定于4%多聚甲醛溶液中,按常规组织切片程序进行脱水、石蜡包埋、切片和H-E染色,显微镜观察拍照,在放大40倍的切片中,每张随机选取10根走向平直且完好的绒毛,测量绒毛高度及相邻的隐窝深度,并计算绒毛高度/隐窝深度,各指标取平均数作为测定数据。肠道相对长度、肠道相对重量计算公式如下:
肠道相对长度/%=肠长/鱼体长×100;
肠道相对重量/%=肠重/鱼体重×100。
1.4 数据统计分析肠道切片图像用Imagepro plus软件进行图像分析,所有试验数据以“平均值±标准差”表示,并用Excel和SPSS软件(版本16.0)进行分析和统计,在单因素方差分析(ANOVA)的基础上,采用Duncan’s多重比较法检验组间差异(P<0.05)。
2 结果与分析
2.1 丁酸钠对匙吻鲟生产性能的影响从表2可见,与对照组相比,试验组匙吻鲟增重率、成活率和特定生长率都有提高。随着丁酸钠添加剂量的增加,不同处理组匙吻鲟增重率和特定生长率都表现为先增大后减小趋势,1.0 g/kg丁酸钠处理组匙吻鲟增重率(273.7%)和特定生长率(1.88%)最高,比对照组分别提高了16.87%和9.3%(P<0.05)。因此,初步分析认为饲料中添加1.0 g/kg剂量丁酸钠对匙吻鲟生产性能效果较合适。
2.2 丁酸钠对匙吻鲟形体指标的影响由表3可知,与对照组相比,丁酸钠对匙吻鲟脏体比和肥满度影响不显著(P>0.05),但1.0 g/kg丁酸钠处理组匙吻鲟脏体比有增高趋势,且肥满度表现为最高(0.244%)。
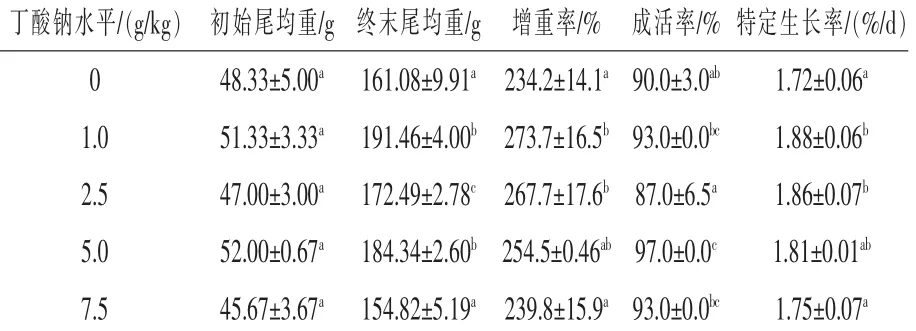
表2 丁酸钠对匙吻鲟生产性能的影响
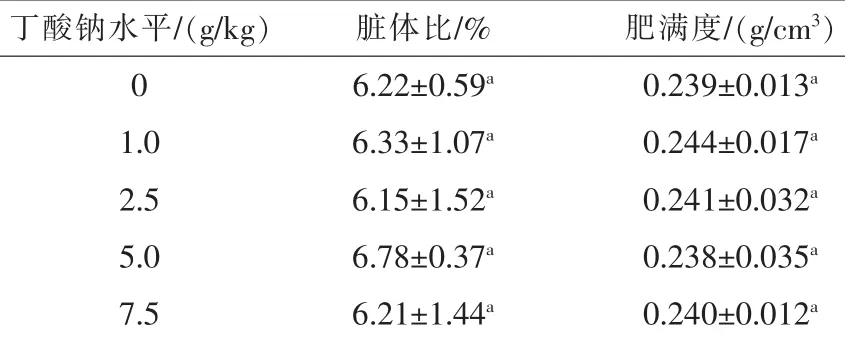
表3 丁酸钠对匙吻鲟形体指标的影响
2.3 丁酸钠对匙吻鲟肠道黏膜形态的影响由表4可知,各处理组匙吻鲟肠道相对长度和肠道相对重量差异不显著(P>0.05),但丁酸钠显著影响了匙吻鲟肠道绒毛高度和隐窝深度,其比值随着饲料中丁酸钠含量的升高表现为先升高后降低趋势(P<0.05)。当饲料中丁酸钠含量为1.0 g/kg时,匙吻鲟肠道绒毛高度显著高于对照组,比对照组提高了153.4%,且相应的隐窝深度低于对照组,比对照组降低了6.84%。而当添加浓度大于1.0 g/kg后,匙吻鲟前肠绒毛高度/隐窝深度的比值有降低的趋势。
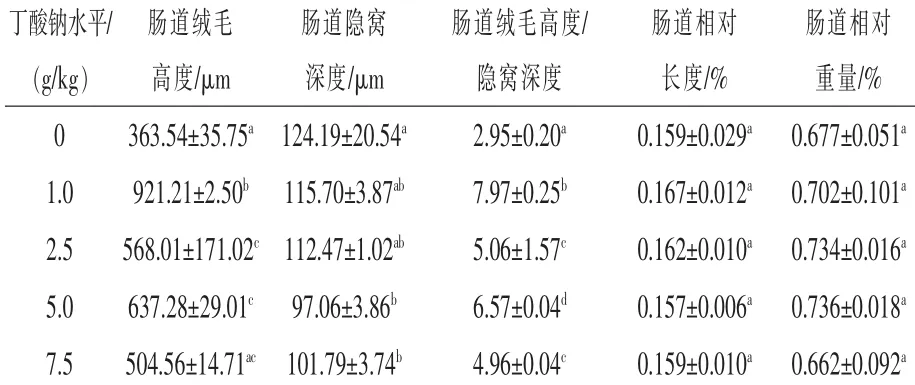
表4 丁酸钠对匙吻鲟肠道黏膜形态的影响
3 讨论
丁酸钠具有提高动物生产性能的作用,在畜禽上已有大量的研究报道。柘丽等(2016)研究表明,在母猪妊娠后期及泌乳期间添加微囊丁酸钠,能够提高母猪泌乳期采食量,还能够提高其后代仔猪的初生重及断奶重。鞠婷婷等(2015)发现,包膜丁酸钠可显著提高1~21日龄肉鸡日增重并显著降低料重比。在水产动物上,张淞琳等(2011)报道,饲料中添加1.0‰丁酸钠对鳗鱼的生长有明显促进作用,比对照组提高37%。孙浪等(2013)研究表明,在鲫鱼饲料中添加0.25%的包膜丁酸钠,显著提高了鲫鱼的增长率和特定生长率。本试验结果表明,在饲料中添加一定剂量的包膜丁酸钠对匙吻鲟具有促生长的效果,这与上述研究报道相似。随丁酸钠添加量的增加,不同处理组匙吻鲟的增重率、特定生长率和肥满度有先增后减的趋势,1.0 g/ kg丁酸钠处理组,匙吻鲟的增重率、特定生长率和肥满度最高,显著高于对照组,但较高的丁酸钠剂量下匙吻鲟的生长变差,这可能与其抑制了匙吻鲟的肠道发育水平和降低了匙吻鲟对营养物质的消化吸收率有关,具体原因还有待相关研究进一步证实。为了避免丁酸钠的特殊气味,提高产品流动性,减慢在动物消化道内释放速度,包膜丁酸钠在动物饲料生产上更具有推广应用价值。
肠道是鱼类机体的主要消化吸收器官,黏膜上皮细胞(IEC)和肠绒毛是肠道的重要功能组织,参与肠道营养物质的消化吸收及应激反应,并与肠道的分泌功能关系密切。有研究表明,丁酸钠作为动物肠道细胞的快速能量来源(Chapman等,1995),能促进肠道细胞更新和刺激损伤肠绒毛的恢复。此外,丁酸盐还可以刺激结肠内水和钠离子的吸收,产生促使黏膜修复的酶,同时刺激细胞内mRNA和蛋白质的合成,提高肠绒毛增殖,增深隐窝深度,降低绒毛宽度,从而提高机体对养分的消化吸收能力(唐明红等,2010;钟翔等,2009;Piva等,2002)。Galfi和Bokori(1990)报道,在断奶仔猪日粮中添加丁酸钠,与对照组相比,空肠绒毛高度提高18.33%,隐窝深度降低10.29%,回肠绒毛高度提高30.09%。孙浪等(2013)在鲫鱼饲料中添加2.5 g/kg包膜丁酸钠,结果发现,鲫鱼前肠绒毛高度显著高于对照组,且相应的隐窝深度显著低于对照组。本研究结果显示,当丁酸钠添加量为1.0 g/kg时,匙吻鲟肠道绒毛高度显著高于对照组,且相应的隐窝深度低于对照组,这与上述研究结果相一致。因此,本研究表明饲料中添加适量丁酸钠能影响匙吻鲟肠道绒毛高度和肠道其他组织的发育水平,以及匙吻鲟对其饲料的消化吸收能力,具体的作用机理还有待进一步深入研究。
4 结论
在本试验条件下,饲料中添加包膜丁酸钠不仅能提高匙吻鲟的生长及形体指标,还能显著提高其肠道发育水平,其适宜添加量为1.0 g/kg。
[1]郭传珍,曹兵海.丁酸钠对肉鸡肠道pH值、微生物菌群和挥发性脂肪酸的影响研究[J].中国家禽,2009,31(21):16~21.
[2]鞠婷婷,郭孝烨,肖雪,等.饲粮添加丁酸钠对黄羽肉鸡生产性能、血清生化指标、消化功能和肠道形态的影响[J].中国家禽,2015,37(9):32~36.
[3]刘丽华,张卫辉,夏新成,等.丁酸钠对肉仔鸡生产性能及免疫功能的影响[J].中国粮油学报,2009,24(10):84~88.
[4]孙浪,刘臻,郝光,等.丁酸钠对鲫鱼生长和肠细胞增殖的影响[J].中国水产科学,2013,20(4):893~901.
[5]唐明红,王启军,田科雄,等.丁酸钠对生长肥育猪胴体品质和小肠形态的影响[J].饲料研究,2010,6:49~52.
[6]张淞琳,常建波,叶继丹,等.丁酸钠对美洲鳗鲡摄食、生长性能和抗氧化能力的影响[J].福建农业学报,2011,26(4):549~551.
[7]柘丽,余荣,侯嘉,等.饲粮添加微囊丁酸钠对母猪及后代生产性能的影响[J].饲料工业,2016,37(18):12~15.
[8]钟翔,陈莎莎,王恬,等.丁酸钠对断奶仔猪生产性能和肠道形态的影响[J].饲料研究,2009,10:19~22.
[9]邹杨,杨在宾,杨维仁,等.不同剂型丁酸钠与抗生素对肉仔鸡生产性
[30]张永泉,尹家胜,杜佳,等.哲罗鱼仔鱼饥饿实验及不可逆生长点的确定[J].水生生物学报,2009,5:945~950.
[31]郑凯迪,陈桂来,孙彬,等.胭脂鱼仔鱼的生长和消化酶活力变化[J].淡水渔业,2010,40(6):9~14.
[32]中国渔业统计年鉴2016[M].北京:中国农业出版社,2016.
[33]Andrde C A,Nascimento F,Conceicao L E,et al.Red porgy,Pagrus pagrus,larvae performance and nutritional condition in response to different weaning regimes[J].Journal of the world aquaculture society,2012,43(3):321~334.
[34]Baras E,Dugué R,Legendre M.Do cannibalistic fish forage optimally An experimental study of prey size preference,bioenergetics of cannibalism and their ontogenetic variations in the African catfish Heterobranchus longifilis[J]. Aquatic Living Resources,2014,27(2):51~62.
[35]Bolasina S,Perez A,Yamashita Y.Digestive enzymes activity during ontogenetic development and effect of starvation in Japanese flounder,Paralichthys olivaceus[J].Aquaculture,2006,252(2~4):503~515.
[36]Cahu C L,Gisbert E,Villeneuve L,et al.Influence of dietary phospholipids on early ontogenesis of fish[J].Aquaculture Research,2009,40(9):989~999.
[37]Gisbert E,Piedrahita R H,Conklinm D E.Ontogenetic development of the digestive system in California halibut(Paralichthys californicus)with notes on feeding practices[J].Aquaculture,2004,232(3):455~470.
[38]Hamre K,Yufera M,Ronnestad I,et al.Fish larval nutrition and feed formulation:Knowledge Gaps and bottlenecks for advances in larval rearing[J]. Reviews in Aquaculture,2013,5(S1):S26~S58.
[39]Infante J L Z,Cahu C L.Dietary modulation of some digestive enzymes and Metabolic processes in developing marine fish:Applications to diet formu-能、肠道pH及挥发性脂肪酸含量的影响[J].动物营养学报,2010,22(3):675~681.
[10]Chapman M A,Grahn M F,Hutton M,et al.Butyrate metabolism in the terminal ileal mucosa of patients with ulcerative cohtis[J].Surg,1995,82:36~38.
[11]Galfi D,Bokori J.Feeding Trial in Pigs with a Diet Containing Sodium N-butyrate[J].Acta Vet Hung,1990,38(2):3~17.
[12]Gaubatz U,Rudecki P,Schiemann S K.Bergmann.Population transfer between molecular vibrational levels by stimulated Raman scattering with partially overlapping laser fields.A new concept and experimental results[J].Chemical Physics,1990,9:5363~5377.
[13]Julia S,Konrad K R,Beatrice L P.Physiological Concentrations of Butyrate Favorably Modulate Genes of Oxidative and Metabolic Stress in Primary Human Colon Cells[J].Nutr Biochem,2007,18(11):736~745.
[14]Piva A,Morlacchiul M.Sodium Butyrate Improves Growth Performance Of Weaned Piglets During the First Period After Weaning[J].Ital Anim Sci,2002,1(1):35~41.
[15]Piva A M,Oschini M,et al.Performance,Intestinal Micro Flora,and Wall Morphology of Weanling Pigs Fed Sodium Butyrate[J].Anh sci,2007,85:1184~1191.
[16]Roediger W E.Utilization of nutrients by isolated epithelial cells of the rat colon[J].Gastroenterology,1982,83(2):424~429.
[17]Scheppach W.Effects of short chain fatty acids on gut morphology and function[J].Gut,1994,35:35~38.■ lation[J].Aquaculture,2007,268,98~105.
[40]Langdon C.Micro~particle types for delivering nutrients to marine fish larvae[J].Aquaculture,2003,227(1):259~275.
[41]Lazo J P,Mendoza R,Holt G J,et al.Characterization of digestive enzymes during larval development of red drum(Sciaenops ocellatus)[J].Aquaculture,2007,265(1~4):194~205.
[42]Lee C S.Biotechnological advances in finfish hatchery production:A review[J].aquaculture,2003,227(1):439~458.
[43]Lindsey D W,Gavin J P.The effect of different rotifer feeding regimes on the growth and survival of yellowtail kingfish Seriola lalandi(Valenciennes,1833)larvae[J],Aquaculture Research,2016,47:2723~2731.
[44]Martinez L R,Tovar R D,Gracia L V,et al.Changes in digestive enzyme activities during larval development of leopard grouper(Mycteroperca rosacea)[J].Fish Physiology and Biochemistry,2014,40(3):773~785.
[45]Pradhan P K,Jena J,Mitra G,et al.Effects of different weaning strategies on survival,growth and digestive development in butter catfish Ompok bimaculatus(Bloch)larvae[J].Aquaculture,2014,424(3):25~32.
[46]Qin J,Fast A W.Size and feed dependent cannibalism with juvenile snakehead Channa striatus[J].Aquaculture,1996,144(4):313~320.
[47]Rønnestad I,Yúfera M,Ueberschär B,et al.Feeding behavior and digestive physiology in larval fish:Current knowledge,and gaps and bottlenecks in research[J].Reviews in Aquaculture,2013,5(1):S59~S98.
[48]Russo T,Boglione C,Marz P D,et al.Feeding preferences of the dusky grouper(Epinephelus marginatus,Lowe 1834)larvae reared in semi~intensive conditions:A contribution addressing the domestication of this species[J].Aquaculture,2009,289(3~4):289~296.■
A 10-week feeding experiment was conducted to evaluate the effects of dietary sodium butyrate on growth performance and intestinal mucosa morphology in paddlefish(Polyodon spathula)with body weight(48.87±3.13)g.The grade levels of sodium butyrate at 0(control),1.0,2.5,5.0,7.5 g/kg respectively.Each diet was randomly fed to a group of 15 fishes per cage in triplicates.The fish were fed three times daily at a rate of 3%~5%of body weight.The results showed that sodium butyrate could significantly affect growth,intestinal villus height and crypt depth in paddlefish(P<0.05).Compared with the control group,the weight gain rate(WGR),special growth rate(SGR),as well as the condition factor(CF)were the highest in fish fed with diet supplemented with 1.0 g/kg sodium butyrate,which were increased by 16.87%,9.3%and 2.09%respectively,and the intestinal villus height was increased by 153.4%(P<0.05).To sum up,the sodium butyrate could promote the growth of paddlefish via affecting intestinal villus height and the optimun sodium butyrate supplementary concentration was 1.0 g/kg for paddlefish.
sodium butyrate;Polyodon spathula;growth;intestinal mucosa morphology
S963
A
1004-3314(2017)13-0039-03
10.15906/j.cnki.cn11-2975/s.20171310
国家大宗淡水鱼类产业技术体系项目(CARS-46-42);益阳市科技局重点项目(YK1644)
*通讯作者
