复合微生物制剂对全混合日粮贮存时间及品质的影响
2017-07-31刘博王丹杨维东杨文艳杨连玉
刘博,王丹,杨维东,杨文艳,2,杨连玉,2*
(1.吉林农业大学动物科学技术学院,吉林长春130118;2.吉林省动物营养与饲料科学重点实验室,吉林长春130118;3.正大永吉实业有限公司,吉林永吉132100;4.广泽农牧科技有限公司,吉林长春130000)
复合微生物制剂对全混合日粮贮存时间及品质的影响
刘博1,王丹3,杨维东4,杨文艳1,2,杨连玉1,2*
(1.吉林农业大学动物科学技术学院,吉林长春130118;2.吉林省动物营养与饲料科学重点实验室,吉林长春130118;3.正大永吉实业有限公司,吉林永吉132100;4.广泽农牧科技有限公司,吉林长春130000)
为研究微生物添加剂对全混合日粮(TMR)贮存时间及营养水平的影响,本试验共设3个处理组,处理组0(对照未添加组),处理组1(TMR+0.5%米曲霉、纤维素分解菌),处理组2(TMR+0.5%酵母菌、纤维素分解菌),每组6个重复,每个重复1个贮存罐,发酵时间为30 d。三处理TMR的含水量均为50%,密闭保存。在第0、3、5、7、15和30天对TMR进行感官鉴定并测定其霉菌毒素、pH、铵态氮、有氧稳定性及养分含量。结果表明:(1)0~30 d,霉菌毒素含量随着贮存时间呈上升趋势,处理组0在第30天,黄曲霉毒素超标,其他两组各时间点均未超标。(2)0~30 d,各处理组pH呈下降趋势,且第7天处理组2显著高于处理1组(P<0.05)。(3)0~30 d,处理组2铵态氮始终高于处理组1,但差异不显著(P>0.05)。(4)有氧稳定性和贮存时间呈正相关,且处理组1高于处理组0、2,处理组0有氧稳定性最差。(5)7~30 d,处理组1、2干物质,粗蛋白质含量均显著高于对照组(P<0.05)。(6)5~30 d,处理组0的酸性洗涤纤维(ADF)及中性洗涤纤维(NDF)的含量显著低于处理组1、2(P<0.05),处理组1、2差异不显著(P>0.05)。(7)挥发性脂肪酸含量与贮存时间呈正相关。3~30 d,处理组0乙酸含量显著低于其他两组(P<0.05),5~30 d,处理组0丙酸含量显著低于其他两组处理(P<0.05)。第15天,处理组1乙酸含量较处理组0、2提高了111.08%、34.27%。(P<0.05),处理组1、2丙酸含量较处理组0提高了365.62%、356.86%(P<0.05)。综上所述,TMR中添加米曲霉、酵母菌和白蚁肠道分解菌可提高饲料有氧稳定性,延长TMR贮存时间和品质,由pH、NDF、乙酸、丙酸等含量变化来看,米曲霉与白蚁肠道纤维菌有累加效应。
全混合日粮;酵母菌;米曲霉;纤维素分解菌
全混合日粮(TMR)是根据反刍动物不同阶段营养需要,将精粗饲料按一定比例均匀混合,调制成的营养水平相对平衡的日粮。研究表明,TMR的使用不仅可提高反刍动物的平均日采食量和消化率,还能为瘤胃微生物提供均衡稳定的营养,增强瘤胃机能,降低反刍动物发病率(赵钦君等,2016;张广凤等,2014)。目前,TMR饲养技术已被广泛使用,但仍存在一些制约因素。TMR日粮贮存时间很短,易发霉变质,造成饲料浪费(杨文艳等,2016)。因此,本研究采用微生物处理,在TMR中添加复合微生物制剂(米曲霉,酵母菌和纤维素分解菌),研究其对TMR贮存时间,有氧稳定性及对霉菌毒素生长的影响,为TMR进一步推广提供实践依据。
1 材料和方法
1.1 试验材料处理1中的复合微生物制剂由酵母菌和纤维素分解菌组成,处理2中的复合微生物制剂由酵母菌和纤维素分解菌组成(两处理菌数均为1∶1)。其中米曲霉购自北京正农农业科技有限公司,活菌数≥200亿/g。酵母购自安琪酵母有限公司,反刍专用活性酿酒酵母活菌数≥200亿/g。白蚁肠道纤维分解菌由高云航等分离(高云航等,2013),菌落活性为≥20亿/mL。黄曲霉毒素B1,玉米赤霉烯酮和赭曲霉素A检测使用的ELISA试剂盒购自上海快灵生物科技有限公司。1.2试验设计和管理采用完全随机设计,将试验分为3组,即对照组(未添加微生物制剂),处理组1(TMR+0.5%米曲霉、白蚁肠道纤维素分解菌混合菌)和处理组2(TMR+0.5%酵母菌、纤维素分解菌混合菌),每个处理设置6个重复,每个重复1个贮存罐,共计18个贮存罐,室温密闭保存。
试验在吉林农业大学动物科学技术学院进行,将处理组1和处理组2日粮加入贮存罐中,每罐2000 g,并将其含水量调至50%,试验期间对贮存的TMR进行观察、取样、记录和部分测定。
1.3 试验日粮TMR由吉林省广泽农牧科技有限公司配制,并按试验设计添加复合微生物制剂,全混合日粮组成及营养成分见表1。

表1 TMR日粮组成及营养成分(干物质基础)
1.4 样品采集和指标测定试验期第0、3、5、7、15、30天打开贮存罐,对其表面及内部TMR进行感官鉴定,并对试验样品进行多点取样(8个部位),共计每罐取出样品200 g。将样品混合均匀后,分为2份,100 g/份。一份用于测定常规数据,另一份样品置于-20℃保存,用于发酵指标测定。
1.4.1 pH、铵态氮和霉菌毒素含量TMR样品的pH、铵态氮和霉菌毒素均参照杨文艳等(2016)测定方法。
1.4.2 TMR营养成分测定测定初水,再粉碎后过40目筛。饲料中干物质(DM)粗蛋白质(CP)、酸性洗涤纤维(ADF)和中性洗涤纤维(NDF)均参照杨胜(1993)的《饲料分析及饲料质量检测技术》中的方法进行测定。
1.4.3 挥发性脂肪酸测定参照赵红艳(2014)的测定方法,采用Agilent Technologies 7890A气相色谱仪进行测定。
1.4.4 有氧稳定性测定将采集的1 kg TMR鲜样置于塑料皿中,使其与空气充分接触,处于室温22~25℃。每隔6 h对样品进行记录,当样品中心温度超出室温2℃,判定为有氧条件下不稳定。
1.5 数据分析使用SAS 9.2一般线性模型进行数据统计分析,采用Duncan’s法进行多重比较,以P<0.05作为差异显著判断标准,试验结果以“平均值±标准差”表示。
2 结果与分析
2.1 感官评定由表2可知,两处理TMR感官特征随贮存时间的推移而发生变化。贮存时间越长,TMR中心与外周颜色差异越大,且酸味越浓。0~15 d,处理组1、2 TMR均无发霉现象。15 d,处理组0有外周。30 d,处理组1外周出现少量霉点。

表2 不同存放时间TMR的感官评定
2.2 不同贮存时间TMR的霉菌毒素含量由表3可知,贮存TMR在0~30 d,各处理组黄曲霉毒素、玉米赤霉烯酮,赭曲霉素含量呈上升趋势。0~3 d,各处理组黄曲霉毒素变化差异不显著(P>0.05)。5~30 d,处理组1、2黄曲霉毒素显著低于处理组0(P<0.05),15~30 d,处理组2黄曲霉毒素显著高于处理组1(P<0.05)。3~30 d,处理组0玉米赤霉烯酮显著高于处理组1、2(P<0.05),3~7 d,处理组2玉米赤霉烯酮显著高于处理组1(P<0.05)。15~30 d,处理组1、2的玉米赤霉烯酮含量差异不显著(P>0.05)。5~7 d,处理组2的赭曲霉毒素显著低于处理组0、1(P<0.05)且处理组0、1的赭曲霉毒素含量差异不显著(P>0.05)。15~30 d,处理组0的赭曲霉含量急剧上升,且高于处理组1、2(P<0.05),处理组1、2的赭曲霉毒素含量差异不显著(P>0.05)。

表3 不同贮存时间TMR霉菌毒素的变化情况
2.3 有氧稳定性贮存TMR有氧稳定性变化如表4所示,0~3 d,3处理样品有氧稳定性均为12 h。自5~15 d,处理组1、2有氧稳定性优于处理组0。至试验第30天,处理组1、2有氧稳定都超过了168 h。
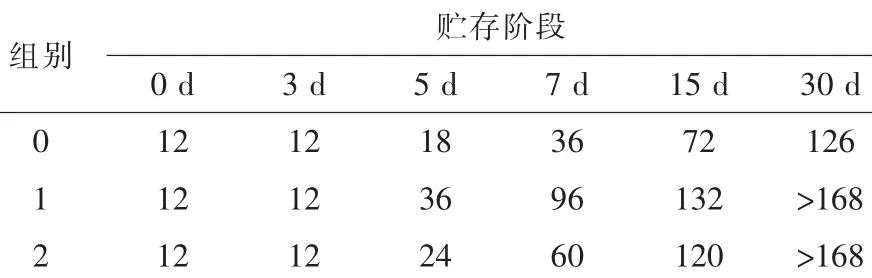
表4 不同贮存时间TMR的有氧稳定性h
2.4 不同贮存时间TMR的pH和铵态氮的变化2.4.1pH变化由表5可知,随着贮存时间的推移,3个处理的pH均呈下降趋势,且在7~30 d中对照组的pH值均显著高于处理组1、2(P<0.05)。3个处理组的pH值都在第30天出现最小值,其中在第7天,处理组1的pH显著低于处理组0、2(P<0.05)。
2.4.2 NH3-N变化由表5可知,在3~30 d整个贮存阶段,处理组0的NH3-N含量均显著高于处理组1、2(P<0.05),且7~15 d的NH3-N含量较其他时间段增幅度最大,处理组0、1、2第15天的NH3-N含量与第7天相比分别增加了32.01%、53.10%、55.17%。

表5 不同贮存时间TMR的pH及NH3-N的变化情况
2.5 不同贮存时间TMR营养成分的变化
2.5.1 DM变化由表6可知,贮存TMR DM的变化随时间推移呈下降的趋势。第7天,处理组1的DM含量显著低于处理组0、2(P<0.05)。15~30 d,处理组0 DM含量显著低于处理组1、2(P<0.05)。

表6 不同贮存时间TMR营养成分的变化情况%
2.5.2 CP变化由表6可知,各处理组的CP含量随时间推移呈下降趋势,处理组0的下降趋势大于其他两组。0~5 d各处理组CP含量差异不显著(P>0.05)。7~30 d,处理组0的CP显著低于处理组1、2(P<0.05),且处理组1、2间CP含量差异不显著(P>0.05)。
2.5.3 NDF及ADF变化由表6可知,各处理组的NDF及ADF随贮存时间延长,其含量呈下降趋势,0~3 d各处理组NDF及ADF含量差异不显著(P>0.05)。5~30 d,处理组0的ADF及NDF的含量显著低于处理组1、2(P<0.05),7~30 d,处理组1、2的NDF及ADF含量差异不显著(P>0.05),第30天,处理组1较处理组0 NDF下降了5%。
2.5.4 不同贮存时间TMR的乙酸和丙酸含量由表7可知,0~30 d,各个处理组乙酸含量呈上升趋势,3~30 d,处理组1、2乙酸含量显著高于处理组0(P<0.05)。7~30 d,处理组1乙酸含量显著高于其他两处理组(P<0.05),且第15天,处理组1对比处理组0、2分别提高了111.08%、34.27%,第30天,处理组1对比处理组0、2分别提高了91.83%、10.08%。0~3 d,各组间丙酸含量差异不显著(P>0.05)。5~30 d,处理组1、2的丙酸含量显著高于处理组0,(P<0.05)。第15天,处理组1、2较处理组0分别提高了365.62%、356.86%(P<0.05),其他时间段处理组1、2差异不显著(P>0.05)。

表7 不同贮存时间TMR营养成分的变化情况mmol/L
3 讨论
TMR的感官评定是其质量评估的重要手段。本试验各组TMR存放的时间越长、酸味越重,内外颜色差异明显,且三种霉菌毒素也呈上升趋势。其中未处理的TMR在30 d,有部分结块,外周白色丝状量霉点,已检测出黄曲霉毒素超标,与Woolford(1990)研究结果相似,说明米曲霉毒素及啤酒酵母均可抑制霉菌毒素。徐丹等(2012)通过共培养体系证实米曲霉对产毒黄曲霉有降解作用。Joannis等(2011)研究表明,啤酒酵母细胞壁能够不同程度的吸附玉米赤霉烯酮、黄曲霉毒素、赭曲霉毒素。
国内外相关研究报道,TMR中添加复合微生物制剂能够提高其发酵后的有氧稳定性,降低pH值,延缓铵态氮上升。其机制可归结如下:(1)有益微生物在TMR厌氧发酵时,其代谢物中有机酸的分泌促使pH下降,抑制不耐酸有害菌繁殖。此外,非酸类代谢物如酿酒酵母分泌的乙醇等也能够抑制有害菌增殖(林丽芳,2010)。(2)TMR在耗氧环境时,一般认为酵母菌>1×105cfu/g·FM时,经过梭菌等有害微生物对乳酸等有机酸和可溶性碳水化合物为底物发酵,释放二氧化碳和能量,致使TMR腐败变质(Filya和Sucu,2010),而复合微生物可与有害微生物竞争底物,降低不利影响从而延长TMR稳定性(张莉,2012)。(3)复合微生物的添加能降解、吸附发酵初期有害菌的代谢物(Kankaanpää等,2010),这可能是减少有害菌发酵的诱导因素之一。TMR在pH接近4,铵态氮含量不超过干物质10%条件下,其发酵品质和有氧稳定性均较好(王慧丽,2015;Weinberg等,2003)。本试验添加米曲霉、酵母菌和白蚁肠道分解菌达到了上述效果。其原因可能是一方面纤维降解菌可为米曲霉和啤酒酵母提供可溶性碳水化合物从而促进发酵,另一方面米曲霉代谢物曲酸、酵母菌代谢物乙醇可抑制梭菌对蛋白的降解。
DM、CP、ADF、NDF为TMR的重要营养指标,研究表明,TMR短期发酵,DM和CP较贮前低,这可能是微生物分泌蛋白酶在降解植物蛋白时还能将一部分真蛋白降解为有益非蛋白氮,如氨基酸等营养物质,同时也可将营养物质水解,进一步导致DM下降(管武太等,2002;吴彦奇等,1995)。本试验7~30 d,添加复合微生物制剂的TMR中DM、CP呈下降趋势,且都显著高于对照未添加组。这与Kim等(2011)研究结果一致,王启芝等(2016)利用米曲霉对桂闽引象草进行青贮发酵,其DM、CP含量也显著高于未添加米曲霉的对照组。导致这样结果可能是米曲霉和酵母菌抑制了有害菌对蛋白的降解,同时添加复合菌发酵过程中产生的菌体蛋白减缓了总CP、DM的降解。本研究证实,米曲霉和白蚁肠道纤维降解菌组合可更有效的降解纤维素、半纤维素。马光和郭继平(2010)、Wang等(2010)与本研究结果一致。米曲霉和白蚁肠道纤维降解菌分别是降解纤维的真菌和细菌,一方面其代谢产生的纤维酶更加多元化,能更好的促进纤维酶的协同效应(Kim等,2011),另一方面酵母菌的有氧呼吸能迅速消耗氧气从而为纤维素分解菌的发酵提供有利的厌氧环境。
本试验中TMR未检测出丁酸,证明米曲霉和酵母菌分别与白蚁肠道纤维降解菌的组合效应对酪酸菌等腐败菌产丁酸有抑制所用。陈雷等(2015)、赵政等(2009)、Taylor等(2002)均研究表明,添加微生物制剂对TMR产丁酸有抑制作用。Shao等(2002)研究表明,青贮饲料随贮存时间延长乙酸、丙酸含量呈上升趋势,本试验中,添加复合微生物可增加乙酸丙酸的积累(15 d较复合微生物组乙酸含量高出0.7倍以上,丙酸含量高出3.5倍以上)可能是因为青贮贮存早期好氧微生物发酵产物为乙酸和丙酸。在TMR贮存后期,饲料原料中的异型乳酸发酵逐渐占主导优势从而生成部分乙酸、丙酸,其原因是米曲霉及白蚁肠道纤维分解菌能分泌多种纤维分解酶,将纤维降解为葡萄糖,为饲料初始原料中的异型乳酸菌提供更多底物和碳源。
4 结论
TMR中添加米曲霉、酵母菌和白蚁肠道纤维分解菌可提高饲料有氧稳定性,延长TMR贮存时间。从黄曲霉毒素B1、pH、NH3-N及NDF变化看,米曲霉与白蚁肠道纤维分解菌有累加效应。
[1]陈雷,原现军,郭刚,等.添加乳酸菌制剂和丙酸对全株玉米全混合日粮青贮发酵品质和有氧稳定性的影响[J].畜牧兽医学报,2015,1:104~110. [2]高云航,王巍,李秋菊,等.白蚁肠道木质素及纤维素分解菌的分离鉴定及产酶条件优化[J].中山大学学报:自然科学版,2013,2:84~89.
[3]管武太,Ashbell G,Hen Y,等.微生物添加剂对青贮高粱发酵品质和稳定性的影响[J].中国农业科学,2002,35(11):1401~1405.
[4]林丽芳.添加山梨酸,乙醇对紫花苜蓿和白三叶发酵品质的影响:[硕士学位论文][D].南京:南京农业大学,2010.
[5]马光,郭继平.米曲霉发酵玉米秸秆产纤维素酶饲料条件的优化[J].生物技术,2010,20(6):81~85.
[6]王慧丽.TMR在发酵过程中及有氧状态下酵母菌群落演替规律研究:[博士学位论文][D].北京:中国农业大学,2015.
[7]王启芝,黄光云,周志扬,等.米曲霉对桂闽引象草青贮营养价值的影响试验[J].上海畜牧兽医通讯,2016,5:34~35.
[8]吴彦奇,徐刚毅,韩延明.添加不同比例的氮硫对玉米秸青贮料营养价值的影响[J].草地学报,1995,3(2):120~125.
[9]徐丹,王洪新,张银志,等.共培养体系下米曲霉与产毒黄曲霉的相互影响[J].食品与生物技术学报,2012,31(6):587~591.
[10]杨连玉,高阳.玉米秸秆饲料化高效利用的瓶颈及解决策略[J].吉林农业大学学报,38,5:634~638.
[11]杨胜.饲料分析及饲料质量检测技术[M].北京:中国农业大学出版社.1993.
[12]杨文艳,于锦皓,高阳,等.益生菌对秸秆型全混合日粮发酵效果的影响[J].吉林农业大学学报,2016,5:623~628.
[13]张广凤,朱风华,王利华,林英庭.发酵全混合日粮的生产及应用[J].黑龙江畜牧兽医,2014,19:108~111.
[14]张莉.乳杆菌的有氧代谢与枯草芽孢杆菌益生作用机制研究[D].济南:山东大学,2012.
[15]赵红艳.驴日粮粗饲料的组合效应及其对盲肠主要纤维分解菌的影响:[硕士学位论文][D].吉林长春:吉林农业大学,2014.
[16]赵钦君,吴甜,刘大森.发酵TMR及其在生产中的应用[J].中国饲料,2016,14:34~36.
[17]赵政,陈学文,朱梅芳,等.添加乳酸菌和纤维素酶对玉米秸秆青贮饲料品质的影响[J].广西农业科学,2009,40(7):919~922.
[18]Filya I,Sucu E.The effects of lactic acid bacteria on the fermentation,aerobic stability and nutritive value of maize silage[J].Grass and Forage Science,2010,65(4):446~455.
[19]Joannis-Cassan C,Tozlovanu M,Hadjeba-Medjdoub K,et al.Binding of zearalenone,aflatoxin B1,and ochratoxin A by yeast-based products:A method for quantification of adsorption performance[J].Journal of Food Protection®,2011,74(7):1175~1185.
[20]Kankaanpää P,Tuomola E,El-Nezami H,et al.Binding of aflatoxin B1 alters the adhesion properties of Lactobacillus rhamnosus strain GG in a Caco-2 model[J].Journal of Food Protection®,2000,63(3):412~414.
[21]Kim S H,Alam M J,Gu M J,et al.Effect of total mixed ration with fermented feed on ruminal in vitro fermentation,growth performance and blood characteristics of Hanwoosteers[J].Asian-Australasian journal of animal sciences,2011,25(2):213~223.
[22]Shao T,Ohba N,Shimojo M,et al.Dynamics of early fermentation of I-talian ryegrass(Loliummultiflorum Lam.)silage[J].Asian-Aust.J.Anim.Sci,2002,15(11):1606~1610.
[23]Taylor C C,Ranjit N J,Mills J A,et al.The effect of treating wholeplant barley with Lactobacillus buchneri 40788 on silage fermentation,aerobic stability,and nutritive value for dairy cows[J].Journal of Dairy Science,2002,85(7):1793~1800.
[24]Wang P,Wang P,Zuo R,et al.Study on isolation and identification of Aspergillusoryzae from bovine rumen and analysis of its effect on corn straw degradation[J].Journal of Henan Agricultural University,2010,3:11.
[25]Weinberg Z G,Ashbell G,Chen Y.Stabilization of returned dairy products by ensiling with straw and molasses for animal feeding[J].Journal of dairy science,2003,86(4):1325~1329.
[26]Woolford M K.The detrimental effects of air on silage[J].Journal of Applied Bacteriology,1990,68(2):101~116.■
The aim of this study was to investigate the influence of total mixed ration(TMR)supplied compound microbial on its storage period and nutrition level.According to the different compound microbial supplied,3 treatment groups were designed(with 6 replicates in each groups and 1 tanker of diet per replicate).Treatment 0 was basal TMR,treatment 1 was TMR with 0.5%compound microbial supplement(Saccharomyces cerevisiae and Fiber decomposing bacteria),treatment 2 was TMR with 0.5%supplement(Aspergillusoryzae and Fiber decomposing bacteria).The addition ratio of two probiotics was 1∶1.This experiment lasted for 30 days.The water content of three treatments was 50%and airtight preservation. Samples obtained at 0,3,5,7,15 and 30 d.Organoleptic investigation,mycotoxins,pH,ammonium nitrogen,aerobic stability and nutrient content were determined and analyzed.The results showed as follows:(1)During the 0~30 d period,the content of mycotoxins showed an upward trend and aflatoxin of treatment 0 exceeded and other groups were not exceeded at each time.(2)In 0~30 d,pH value was decreased,the pH value of 7 d in treatment 2 was significantly higher than treatment 1(P<0.05).(3)In the whole experiment period,ammonium nitrogen content of treatment 2 was higher than treatment 1(P>0.05).(4)Aerobic stability and storage time were positively correlated,the aerobic stability of treatment 1 was better than other treatments.(5)During the process of 7~30 d,the dry matter content of treatment 2 was significantly higher than treatment 1(P<0.05).(6)The contents of acid detevgent fibre(ADF)and neutral detevgent fibre(NDF)of treatment 0 was significantly lower than other treatments(P<0.05),and there was no significant difference between treatment 1 and 2(P>0.05).(7)The content of volatile fatty acid was also positively correlated with storage time.In 3~30 d,compared with the treatment 1 and 2,acetic acid content of treatment 0 descended significantly(P<0.05),5~30 d,the propanoic acid content in treatment 0 was significantly lower than the others two groups(P<0.05).The day of 15th,compared with the treatment 0,2,the acetic acid content in treatment 1 were increased by 111.08%,34.27%(P<0.05),and compared with the treatment 0,the propionic acid in treatment 1,2 were increased by 365.62%,356.86%.In conclusion,supplementation of Aspergillusoryae,Saccharomyces cerevisiae and Termite intestinal decomposing bacteria could improve the aerobic stability and nutritional quality of TMR.By analyzed pH,NH3-N,NDF,acetic acid and propionic acid,Aspergillusoryae and Termite intestinal decomposing bacteria showed accumulated effect.
total mixed ration;Aspergillusoryae;Saccharomyces cerevisiae;Fiber decomposing bacteria
S816.9
A
1004-3314(2017)13-0027-05
10.15906/j.cnki.cn11-2975/s.20171307
*通讯作者
