羊膜衍生膜负载干细胞通过PI3K/MAPK修复及优化软骨损伤的评估
2017-07-25张治金曾林如朱芳兵郭林李倩晓
张治金 曾林如 朱芳兵 郭林 李倩晓
[摘要] 目的 探討人羊膜衍生膜(human acellular amniotic membrane,HAAM)负载干细胞通过PI3K/MAPK修复及优化软骨损伤的作用。 方法 新西兰白兔分离出骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)并与软骨细胞按4∶1接种于HAAM上,接种后7 d和14 d观察软骨细胞的修复及优化情况。细胞计数CCK-8法检测软骨细胞的存活率;TUNEL法检测软骨细胞凋亡发生;Western Blot法检测软骨细胞中Ⅰ型胶原、Ⅱ型胶原,磷酸化蛋白p-PKC、p-p38、p-JNK和p-ERK蛋白表达水平。 结果 与对照组相比,实验组细胞存活率显著升高,细胞凋亡显著降低,差异具有统计学意义(P<0.05);与对照组相比,实验组中Ⅰ型胶原、Ⅱ型胶原含量显著增加;PI3K/MAPK信号通路磷酸化蛋白含量变化明显,差异具有统计学意义(P<0.05)。 结论 羊膜衍生膜负载骨髓间充质干细胞可以修复和优化软骨的损伤,且PI3K/MAPK信号通路在此过程中有重要作用。
[关键词] HAAM;BMSCs;软骨细胞;PI3K/MAPK
[中图分类号] R363 [文献标识码] A [文章编号] 1673-9701(2017)18-0031-04
Evaluation of acellular amniotic membrane loaded stem cells in repairing and optimizing cartilage injury by PI3K / MAPK pathway
ZHANG Zhijin1 ZENG Linru1 ZHU Fangbing1 GUO Lin2 LI Qianxiao3
1.Department of Orthopaedics, Xiaoshan District Traditional Chinese Medicine Hospital of Hangzhou City, Hangzhou 311201, China; 2.Department of Joint Surgery, Zhongshan Hospital Affiliated to Dalian University, Dalian 116000, China; 3.Department of Cardiology, Hangzhou Red Cross Hospital, Hangzhou 310000, China
[Abstract] Objective To investigate the effect of human acellular amniotic membrane (HAAM) loaded stem cells in repairing and optimizing cartilage injury by PI3K/MAPK pathway. Methods Bone mesenchymal stem cells (BMSCs) were isolated from New Zealand white rabbits and were plated on HAAM combined with chondrocytes at 4:1. The repair and optimization of chondrocytes were observed at 7 and 14 days after inoculation. The survival rate of chondrocytes was detected by cell count CCK-8 method. The apoptosis of chondrocytes was detected by TUNEL method. Western Blot was used to detect the expression of type Ⅰcollagen, type Ⅱ collagen, expression levels of phosphorylated protein p-PKC, p-p38, p-JNK and p-ERK. Results Compared with that in the control group, the survival rate of the experimental group was significantly higher, and cell apoptosis of the experimental group was significantly reduced, and the difference was statistically significant(P<0.05). Compared with those in the control group, the typeⅠcollagen and typeⅡcollagen content in the experimental group increased significantly(P<0.05), and the changes of phosphorylated protein content of PI3K/MAPK signal pathway was significant, the difference was significant(P<0.05). Conclusion Acellular amniotic membrane loaded bone marrow mesenchymal stem cells can repair and optimize the damage of cartilage, and the PI3K/MAPK signaling pathway plays an important role in this process.
[Key words] HAAM; BMSCs; Chondrocytes; PI3K/MAPK
炎症、衰老、创伤和其他各种疾病与骨性关节炎及关节软骨损伤的发生密切相关。抑制软骨细胞降解,促进软骨细胞的生长可明显延缓和优化软骨损伤[1,2]。软骨细胞是骨性损伤的主要靶细胞,各种生化因素和机械因素作用于软骨细胞,可刺激软骨细胞分泌细胞因子、软骨变性蛋白酶、各种炎性介质,它们可使软骨变性[3,4]。而骨性关节软骨的自我修复能力很差,如何刺激软骨细胞分泌胶原,改善软骨损伤是临床骨科面临的重要问题之一。骨髓间充质干细胞(bone mesenchymal stem cells,BMSCs)是一类具有多项分化潜能的细胞,来源丰富容易分离培养,已成为骨组织工程研究中的最佳种子细胞[5]。人羊膜衍生膜(human acellular amniotic membrane,HAAM)是一种从细胞滋养层衍化而来的半透明的薄膜,羊膜基底膜上含有多种胶原蛋白、糖蛋白和蛋白多糖等成分,可以促进细胞的增殖分化和组织修复[6-8]。本研究主要利用组织工程技术将骨髓间充质干细胞和软骨细胞种植于HAAM上,观察软骨细胞在HAAM上的生长增殖情况,为修复和优化软骨损伤的进一步研究提供实验依据。
1 材料与方法
1.1 一般材料
一抗多克隆抗体Ⅰ型胶原、Ⅱ型胶原;p-p38、p-JNK、p-ERK、p-PKC、ACTB购于美国SantaCruz生物技术有限公司;二抗碱性磷酸酶标记山羊抗兔IgG购于北京中杉金桥生物技术有限公司;CCK-8试剂盒购自日本同仁化学研究所;Western Blot电泳仪(Bio-Rad Laboratories,Hercules,CA,USA)。
1.2 方法
1.2.1 实验分组及其处理 2只1月龄新西兰白兔,雌雄不限,BMSCs与软骨细胞按4∶1接种于HAAM上,调整总细胞终浓度为5.0×107/mL,随机分为以下各组:A组为HAAM-BMSCs-软骨细胞组(其中BMSCs:软骨细胞=4∶1,实验组)、B组为BMSCs-软骨细胞组(其中BMSCs:软骨细胞=4∶1,对照组)。接种后7 d、14 d观察软骨细胞的修复及优化情况。
1.2.2 BMSCs分离、培养和鉴定[9] 1月龄实验兔术区常规消毒、铺巾后行骨穿,用骨髓穿刺针在股骨及胫骨近端进针,连接10 mL注射器,抽取骨髓液4~5 mL,注入含肝素和DMEM/F12的离心管内,采用全骨髓贴壁分离筛选法分离、培养BMSCs细胞,制成细胞悬液,放入37℃、5%CO2培养箱中常规培养。显微镜下观察细胞的生长状况,48 h后首次给予全量换液,流式细胞检测抗原表达,选择表面抗原CD29、CD90、CD105和CD45进行鉴定,PBS为阴性对照,IgG-PE做为同型对照。
1.2.3 软骨细胞的分离、培养和鉴定[10] 取上述同一只兔,无菌条件下取双侧膝关节软骨,以PBS冲洗3次,用眼科剪剪成1 mm×1 mm×1 mm软骨块,加入0.25%的胰蛋白酶37℃消化。用200目不锈钢无菌滤网过滤,收集细胞,接种到培养瓶中常规培养,台盼蓝染色细胞活性>95%。取P3软骨细胞以1×105/mL浓度接种于涂多聚赖氨酸的盖玻片上培养3 d,4℃丙酮固定30 min,行Ⅱ型胶原免疫组化染色。
1.2.4 羊膜的制备与负载[11] 取健康剖宫产产妇的羊膜并进行相关传染性检验,结果均呈阴性。在超净台上清洗并分离羊膜,用含1000 U/mL庆大霉素+25 μg/mL两性霉素B的生理盐水浸泡20 min后,用胰蛋白酶于消化30 min,去除杂质细胞。制备成合适大小的羊膜鋪于培养皿中,按比例接种骨髓间充质干细胞和软骨细胞,37℃、5% CO2条件下培养。
1.2.5 CCK-8法检测细胞存活率 细胞按照对照组与实验组培养后,取细胞制备成细胞悬液,接种到96孔板中(100 μL/孔),37℃、5%CO2条件下过夜培养,隔天换液后加入10 μL CCK8试剂,37℃、5%CO2条件下孵育2 h,使用酶标仪在450 nm波长处测定OD值,计算细胞存活率。
1.2.6 TUNEL检测细胞凋亡 细胞按照对照组与实验组培养后,取细胞制备成细胞悬液,按照细胞凋亡检测试剂盒说明逐步加入生物标记素,在荧光显微镜下查找荧光阳性细胞,根据阳性细胞所占百分率来计算DLBCL细胞的细胞凋亡率。
1.2.7 Western Blot法检测磷酸化蛋白表达水平 细胞按照对照组与实验组培养后,收集细胞于冰上裂解2 h,4℃离心后收集蛋白上清液。测定蛋白浓度后,将各组蛋白浓度总量调整为30 μg/μL,加入到10%变性聚丙烯酰胺凝胶中电泳,转膜后,用牛血清白蛋白封闭1 h,加入一抗4℃过夜。隔天用TBST洗膜3次,并加入二抗孵育1 h。TBST洗膜2次,TBS洗膜1次。用ECL显色液进行显色,并对各泳道条带进行灰度扫描,得出相应的蛋白表达量。
1.3 统计学处理
数据采用SPSS22.0软件处理,采用单因素方差分析和Bonferroni's Multiple Comparison Test,结果用(x±s)表示。以P<0.05为差异具有统计学意义。
2 结果
2.1 骨髓间充质干细胞鉴定
应用Beckman counter流式细胞仪分析大鼠间充质干细胞表面标志抗原。如封三图1所示,培养的第3代细胞已表达 BMSCs细胞表型阳性特征,其CD29、CD90、CD105,阳性率分别为96.72%、98.53%、98.99%;CD45呈阴性,阳性率为0.53%。流式结果表明,收获的高纯度的BMSCs可用于下一步实验。
2.2 软骨细胞鉴定
经ColⅡ免疫细胞化学染色可见细胞胞浆内的ColⅡ染成棕黄色。Ⅱ型胶原免疫组化染色显示,收获的高纯度软骨细胞可用于下一步实验,见封三图2。
2.3 CCK-8法检测细胞存活率
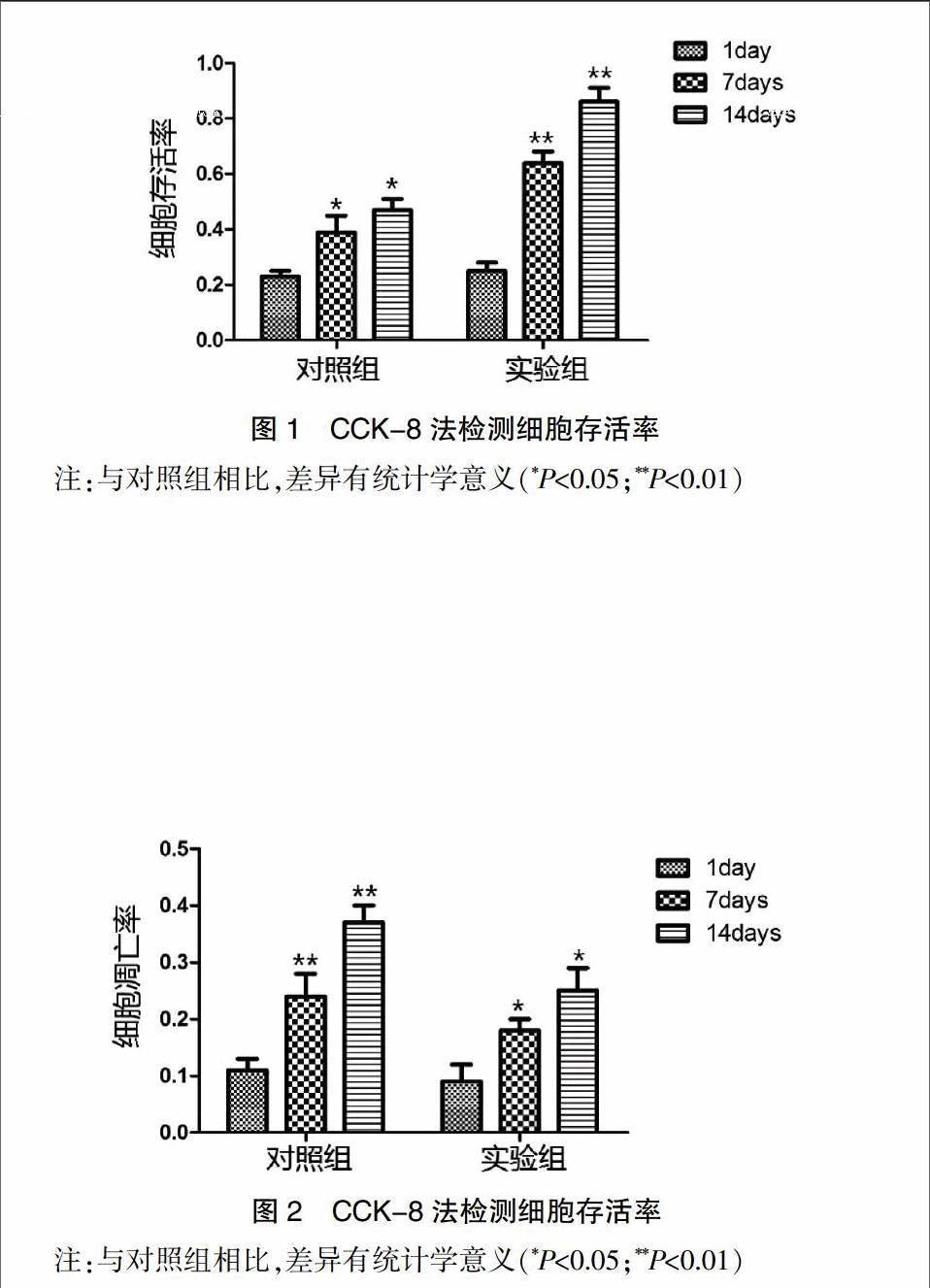
CCK8检测细胞存活率结果可知,与对照组相比,随着培养时间的延长,实验组软骨细胞存活率显著增高,差异有统计学意义(P<0.01)。见图1。
2.4 TUNEL检测细胞凋亡结果
凋亡检测结果可知,与对照组相比,随着培养时间的延长,实验组软骨细胞凋亡率显著降低,差异有统计学意义(P<0.01)。见图2。
2.5 磷酸化蛋白表达水平
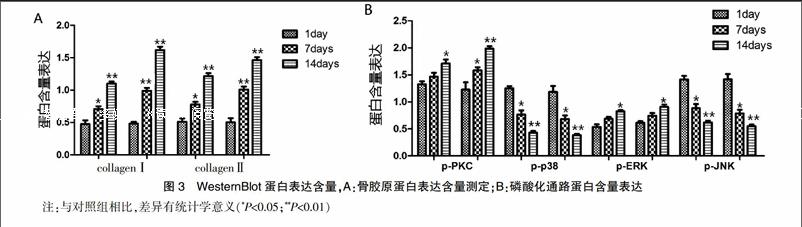
用Western Blot法测得结果可知,随着培养时间的延长,Ⅰ型胶原和Ⅱ型胶原、磷酸化蛋白p-PKC和p-ERK蛋白含量的蛋白水平明显上升,磷酸化蛋白p-p38和p-JNK的蛋白水平显著降低,差异有统计学意义(P<0.01)。见图3。
3 讨论
人羊膜衍生膜(human acellular amniotic membrane,HAAM)是一种从细胞滋养层衍化而来的半透明的薄膜,羊膜具有抗黏附能力,炎性反应轻,纤维包裹少;同时HAAM抗原性极低,控制排斥反应的发生,具有良好的生物相容性[12,13]。羊膜基底膜上含有多种胶原蛋白、纤维连接蛋白、层粘连蛋白、糖蛋白和蛋白多糖等成分,这些有效成分增强了其抗拉力,为细胞生长提供了足够的三维空间结构;为细胞的增殖、分化提供丰富的营养成分,并且有利于种植在羊膜上的细胞粘附和生长[13,14]。羊膜作为一种良好易得的生物材料,易于加工、处理和运输,为组织工程学的研究提供了便利的条件。研究表明在人羊膜細胞外基质上负载培养的角膜细胞、结膜细胞、成纤维细胞、软骨细胞等均能良好生长,并保持原本的细胞功能[14,15]。
本研究为了探讨羊膜衍生膜负载骨髓间充质干细胞通过PI3K/MAPK信号通路对损伤软骨的保护作用,研究结果表明随着培养时间延长,软骨细胞的存活率逐渐上升,细胞凋亡率逐渐降低,能够分泌出Ⅰ型胶原和Ⅱ型胶原,说明软骨细胞在羊膜衍生膜负载骨髓间充质干细胞的条件下可以生长良好,处于良性增殖状态。PI3K/MAPK作为两条经典的细胞信号转导通路,可显著调控细胞增殖分化和细胞凋亡等过程[16]。PI3K是一种参与细胞生长及骨架重塑的重要磷脂酰肌醇激酶,也是重要的抗凋亡调节因子,活化后可导致脂质底物磷酸化并激活下游AKT,通过磷酸化作用激活或抑制其下游靶蛋白Caspase3、NF-κB、mTOR等,参与调节细胞凋亡与代谢过程[17,18]。同时,在哺乳类细胞中已经发现三条并行的MAPK信号通路,分别是p38MAPK、JNK/SAPK和ERK信号通路,它们在细胞的生长和分化、细胞的炎性反应及细胞凋亡等应激反应中起重要作用[19-21]。由Western Blot结果可知,磷酸化蛋白p-PKC和p-ERK的蛋白水平明显上升,磷酸化蛋白p-p38和p-JNK的蛋白水平显著降低,说明羊膜衍生膜负载骨髓间充质干细胞的条件下可以促进PI3K信号通路的抗凋亡作用,且抑制MAPK信号通路的促凋亡作用,从而调控细胞增殖与凋亡的发展过程。
综上所述,在羊膜衍生膜负载骨髓间充质干细胞的作用可以通过有效调控PI3K/MAPK信号通路,促进软骨细胞的发生发展过程。进一步了解羊膜衍生膜负载骨髓间充质干细胞对软骨细胞的修复和活化机制,对治疗软骨损伤和骨关节疾病等具有重要的临床意义。
[参考文献]
[1] B.C. Sondergaard M.Sc.y,H. Wulfy,K. Henriksen M.Sc,et al. Calcitonin directly attenuates collagen type Ⅱ degradation by inhibition of matrix metalloproteinase expression and activity in articular chondrocytes[J]. Osteo Arthritis and Cartilage,2006,14(8):759-768.
[2] Tian-Fang Lia,Kiminori Yukata,Guoyong Yin,et al.BMP-2 induces ATF4 phosphorylation in chondrocytes through a COX-2/PGE2 dependent signaling pathway[J].Osteoarthritis Cartilage,2014,22(3):481-489.
[3] Wu JJ,Weis MA,Kim LS,et al.Type Ⅲ collagen,a fibril network modifier in articular cartilage[J]. J Biol Chem,2010,285(24):18537-18544.
[4] 黄开,杨金华,王筱林,等.Pluronic F-127负载骨髓间充质干细胞和碱性成纤维细胞生长因子修复兔膝关节软骨缺损[J].临床医学,2011,31(12):92-95.
[5] Martinez C,Hofmann TJ,Marino R,et al.Human bone marrow mesenchymal stromal cells express the neural ganglioside GD2:A novel surface marker for the identification of MSCs[J].Blood,2007,109(10):4245-4248.
[6] Koizumi NJ,Inatomi TJ,Sotozono CJ,et al. Growth factor mRNA and protein in preserved human amniotic membrane[J].Curr Eye Res,2000,20(3):173-177.
[7] 钟金晟,梅芳,齐伟宏,等.聚乳酸/羟基磷灰石膜与人羊膜基质细胞联合构建骨组织工程细胞/支架复合体[J].中国组织工程研究,2012,16(8):1345-1348.
[8] 王日新.羊膜包裹羟基磷灰石复合材料修复爆裂性眶壁骨折[J].国际眼科杂志,2013;13(3):605-606.
[9] 束波,刘志江,范芳.基质细胞衍生因子-1a预处理对大鼠骨髓间充质干细胞体外存活及旁分泌的影响[J].基础医学与临床,2012,32(8):884-888.
[10] 洪佳琼,高雅,宋洁,等.人羊膜间充质干细胞与骨髓间充质干细胞的生物学特性及免疫抑制作用的比较[J].中国实验血液学杂志,2016,24(3):858-864.
[11] 闫国和,粟永萍,艾国平,等.人羊膜负载猪骨髓间充质干细胞生长的形态学研究[J]. 第三军医大学学报,2002, 24(7):775-777.
[12] Eynch D,Wiese H,Maier G,et al. In vitro and in vivo cartilage engineering using a combination of chondrocyte-seeded long-term stable fibrin gels and polycaprolactone-based polyurethane scaffolds[J]. Tissue Eng,2007, 13(9):2207-2218.
[13] 姜晓琪,史其林.羊膜在掌骨干骨折中的临床应用研究[J].中华临床医师杂志,2009,3(6):1013-1016.
[14] 郭林,张治金. 脱细胞羊膜负载骨髓间充质干细胞修复软骨缺损的实验研究[J].中华显微外科杂志,2012, 10(35):399-401.
[15] 霍双枝,施萍,庞希,等.人羊膜负载人羊膜间充质干细胞对SD大鼠皮肤创面愈合的影响[J].中国医学科学院学报,2011,33(6):611-614.
[16] 郁迪,莫绪明.PI3K/Akt和MAPK信号通路在缺血性脑损伤中的保护作用[J]. 医学综述,2015,21(2):210-213.
[17] 游晓星,马小华,刘良,等.专支原体巨噬细胞活化脂肽-2经PI3K/Nrf2诱导单核细胞表达HO-1和NQ01[J].中南医学科学杂志,2014,42(1):6-10.
[18] Arslan F,Lai RC,Smeets MB,et al. Mesenchymal stem cell-derived exosomes increase ATP levels,decrease oxidative stress and activate PI3K/Akt pathway to enhance myocardial viability and prevent adverse remodeling after myocardial ischemia/reperfusion injury[J]. Stem Cell Res, 2013,10(3):301-312.
[19] Wang Q,Yin XH,Liu Y,et al. K252a suppresses neuronal cells apoptosis through inhibiting the translocation of Bax to mitochondria induced by the MLK3/JNK signaling after transient global brain ischemia in rat hippocampal CA1 subregion[J]. J Recept Signal Transduct Res,2011,31(4):307-313.
[20] 柯昌斌,黄晓霞,许先成,等. P38MAPK和PI3K/Akt信號通路在大鼠糖尿病神经病理性疼痛中的交互作用[J].临床麻醉学杂志,2010,26(9):790-793.
[21] 刘斌,匡安仁. MAPK/ERK和PI3K/AKT信号通道的基因变异与甲状腺癌的发生发展及诊治[J].生物医学工程学杂志,2012,29(6):1221-1225.
(收稿日期:2017-03-01)
