不同民族教职工肥胖对胰岛素抵抗的影响
2017-07-25刘丽江赵晓霞高静李晓玲
刘丽江,赵晓霞,高静,李晓玲
(西北民族大学医院,甘肃兰州730030)
不同民族教职工肥胖对胰岛素抵抗的影响
刘丽江,赵晓霞,高静,李晓玲
(西北民族大学医院,甘肃兰州730030)
目的研究不同民族教职工肥胖对胰岛素抵抗的影响,分析肥胖对胰岛素抵抗的影响是否有民族差异。方法通过随机抽样方法,对在民族高校工作的25岁以上教职工(藏族129人、汉族133人、回族109人)进行问卷调查、身体测量及实验室检测,计算体重指数(BM I)和胰岛素抵抗指数(H-IR),分析体重指数对胰岛素抵抗指数的影响是否有民族差异。结果藏、汉、回族教职工的胰岛素抵抗指数均随体重指数增加而增加,而体重指数对其胰岛素抵抗指数的影响各有不同,藏族教职工体重指数对胰岛素抵抗指数的影响较汉族和回族教职工小,汉族和回族教职工间无显著性差异。结论肥胖可以导致胰岛素抵抗,但是肥胖对藏族教职工胰岛素抵抗的影响较汉族和回族教职工小。
肥胖;胰岛素抵抗;体重指数;民族
近年来,由于饮食结构改变、缺乏运动、不良生活方式等原因,我国居民普遍能量过度摄入,肥胖患者迅速增加。1992—2002年短短10年时间,我国体重超标以及肥胖发生率从14.6%飙升到21.8%(超重率为18.9%,肥胖率为2.9%)。以体重指数(BMI)25 kg/m2和30 kg/m2作为分界值,我国成年人超重肥胖率达29.9%(超重率22.8%,肥胖率7.1%)[1,2]。肥胖已成为严重威胁人民群众健康的公共卫生问题。
肥胖症患者往往伴有高血压、血脂异常和葡萄糖耐量异常[3]。胰岛素抵抗(insulin resistance,IR)被视为肥胖、2型糖尿病、糖耐量异常、高血压、高脂血症及动脉粥样硬化的共同危险因素。本研究以民族高校教职工作为研究对象,探讨肥胖与胰岛素抵抗的关系,从而为预防不同民族教职工肥胖及胰岛素抵抗提供参考。
1 对象与方法
1.1 对象
采用整群抽样的方法,于2014年5—10月,对371例民族高校教职工进行调查。其中,藏族129例(男70例,女59例),汉族133例(男60例,女73例),回族109例(男57例,女52例)。调查包括问卷调查、身体测量及实验室检测。入选者为西北民族大学教职工,年龄25岁以上,少数民族教职工父母均为同一民族,保留本民族饮食习惯。排除已患有糖尿病及血糖升高(空腹血糖>6 mmol/L)者,排除严重心、肝、肾及其他内分泌疾病者。
1.2 方法
1.2.1 问卷调查包括基本资料(姓名、性别、出生日期、民族、联系电话、家庭住址、婚姻状况、文化程度、职业),饮食生活行为(主食、摄盐量、蔬菜、水果、食用油、体力劳动、体育锻炼情况、吸烟情况、饮酒情况、睡眠情况、精神压力),疾病史调查(糖尿病等内分泌疾病及严重心、肝、肾疾病)。
1.2.2 身体测量测量身高者脱鞋帽,双脚平放地面,脚后跟并紧、直立,背部挺直,双肩放松,双眼正视前方,头部保持水平。读数精确到小数点后一位。测量体重者脱去鞋帽、外套等,取出口袋里的物品,保持身体直立,双臂放松于身体两侧,只穿简单衣裤进行称量。读数精确到小数点后一位。
1.2.3 实验室检测研究对象至少10小时未进食,早上7:30—8:30抽取血标本检测空腹血糖与空腹胰岛素水平。采集血标本后马上进行血清分离、空腹血糖测定。糖测定采用改良的己糖激酶法,检测仪器为日立7020自动临床分析仪。胰岛素水平测定采用化学发光免疫分析法,检测仪器为拜耳公司中佳GC-1200 r放射免疫检测仪。
1.2.4 诊断标准体重指数(BMI)=体重(kg)/身高(m)2。正常:18.5≤BMI≤23.9 kg/m2,超重:24.0≤BMI≤27.9 kg/m2,肥胖:BMI≥28.0 kg/m2。
胰岛素抵抗指数(H-IR)=空腹胰岛素水平(FINS,uIU/m l)×空腹血糖(FPG,mmol/L)/22.5。
1.2.5 统计分析采用SPSS 19.0统计软件进行数据分析。各项参数以(±s)表示。组间比较采用单因素方差分析,BMI和HOMA-IR的相关性比较采用Pearson相关分析。
2 结果
2.1 调查对象的人口统计学资料及人体测量指标分布(见表1)
表1 调查对象基本情况(±s)
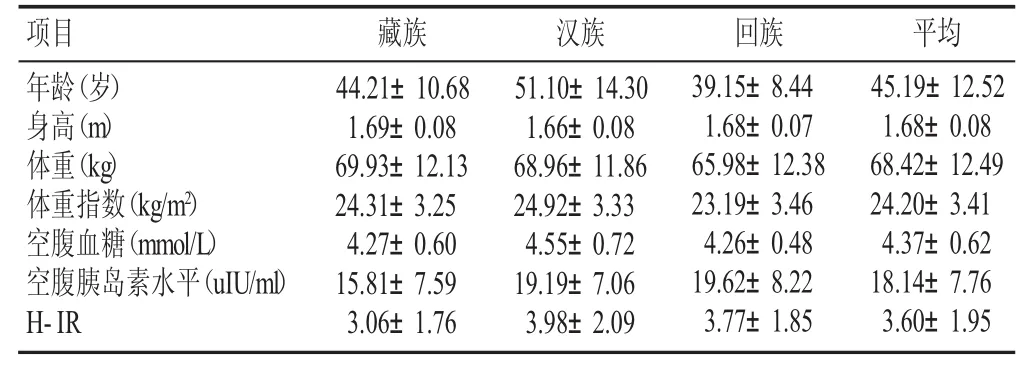
表1 调查对象基本情况(±s)
项目汉族51.10±14.30 1.66±0.08 68.96±11.86 24.92±3.33 4.55±0.72 19.19±7.06 3.98±2.09藏族年龄(岁)身高(m)体重(kg)体重指数(kg/m2)空腹血糖(mmol/L)空腹胰岛素水平(uIU/ml)H-IR 44.21±10.68 1.69±0.08 69.93±12.13 24.31±3.25 4.27±0.60 15.81±7.59 3.06±1.76回族39.15±8.44 1.68±0.07 65.98±12.38 23.19±3.46 4.26±0.48 19.62±8.22 3.77±1.85平均45.19±12.52 1.68±0.08 68.42±12.49 24.20±3.41 4.37±0.62 18.14±7.76 3.60±1.95
2.2 胰岛素抵抗指数随体重指数增加而增加
藏族正常、超重、肥胖组,胰岛素抵抗指数分别为(2.52± 0.81)、(3.35±1.99)、(4.44±2.78),超重组与正常组间、肥胖组与正常组间差异显著,且随着体重指数的升高,胰岛素抵抗指数升高。汉族正常、超重、肥胖组,胰岛素抵抗指数分别为(3.03±1.04)、(4.46±2.58)、(5.27±1.60),超重组与正常组间、肥胖组与正常组间、肥胖组与超重组间差异显著。回族正常、超重、肥胖组,胰岛素抵抗指数分别为(3.21±1.36)、(4.10±1.60)、(5.29±2.42),超重组与正常组间、肥胖组与正常组间、肥胖组与超重组间差异显著。随着体重指数的升高,藏、汉、回族各组胰岛素抵抗指数均明显升高(见表2)。
表2 不同民族教职工体重指数对胰岛素抵抗的影响(±s)

表2 不同民族教职工体重指数对胰岛素抵抗的影响(±s)
注:与正常组比较,*P<0.05,**P<0.001;与超重组比较,#P<0.001;与藏族组比较,aP<0.05,bP<0.01
藏族组汉族组回族组n H-IR n H-IR n H-IR正常组超重组肥胖组合计65 48 16 129 2.52±0.81 3.35±1.99* 4.44±2.78** 3.06±1.76 56 56 21 133 3.03±1.04a4.46±2.58**a5.27±1.60**#3.98±2.09 67 34 8 109 3.21±1.36b4.10±1.60* 5.29±2.42**#a3.77±1.85
2.3 体重指数对胰岛素抵抗指数影响的民族差异
在正常组中,藏族组与汉、回族组间H-IR有显著性差异,汉族与回族组间无显著性差异。在超重组中,藏族组与汉族组间H-IR有显著性差异,藏族组与回族组间、汉族与回族组间无显著性差异。在肥胖组中,藏族组与回族组间H-IR有显著性差异,藏族组与汉族组间、汉族组与回族组间H-IR无显著性差异(见表2)。
3 讨论
肥胖现已被归类为慢性病,世界卫生组织(WHO)将肥胖列为影响人类健康与长寿的十大威胁之一。肥胖患者死亡的风险比体重正常者高50%~100%,因病死亡的患者中有15%~20%的人合并肥胖[4]。近年来,对肥胖的研究已成为热点。
我国人群一直以低体重为特点,长期以来我国对肥胖的重视程度不如发达国家。但是,随着生活方式改变、膳食结构变化和体力活动减少,我国超重和肥胖患病率迅速上升[5~7],加强对肥胖的研究势在必行。多项研究证实,减轻体重可以降低胰岛素抵抗水平[8~12]。
Matthews等[13]于1985年提出[13]用稳态模型(HOMA)来测定胰岛素抵抗及β细胞功能,此法简单实用,与评价胰岛素抵抗的金标准——正常葡萄糖胰岛素钳夹技术(EICT)有较好的相关性。但EICT方法复杂、技术要求高、价格昂贵、设备特殊,限制了临床推广[14,15]。
3.1 肥胖与胰岛素抵抗关系密切
肥胖导致脂肪细胞肥大及数量增多,致使其分泌激素的能力增强或减弱,从不同层面影响胰岛素的作用,导致IR。研究发现,脂肪细胞分泌的FFA、瘦素、肿瘤坏死因子、抵抗素、脂联素等与IR关系密切。过氧化物酶增殖体激活物受体γ亦是肥胖导致IR重要机制之一[16]。除此之外,遗传因素在肥胖导致IR的过程中也起到至关重要的作用。有证据表明,肥胖、2型糖尿病和心血管疾病有共同的遗传背景,“节俭基因”或“肥胖糖尿病基因”可能参与肥胖及其相关代谢异常的发生[17~20]。
肥胖的发生与遗传因素、环境因素、社会因素、膳食结构等有关,是多种因素相互作用的结果。近年来,生活方式的改变极大地促进了肥胖的发生,遗传因素对个体间肥胖差异的影响可达40%~70%,BMI、腰围、臀围比等均受遗传影响[21,22]。我国是一个多民族国家,不同民族尤其是游牧民族的生活习惯与汉族差异很大。但是,国内对于少数民族肥胖与胰岛素抵抗及糖尿病的研究非常有限。
本次研究中,我们采用稳态模型(HOMA)来测定个体胰岛素抵抗情况,探讨肥胖对不同民族群众胰岛素抵抗的影响,对比同一层次的体重指数对不同民族群众的胰岛素抵抗的影响有无差异性。研究发现,藏族、汉族、回族教职工的胰岛素抵抗指数均随体重指数升高而升高。
3.2 肥胖对胰岛素抵抗的影响具有民族差异
本项研究中,在年龄、身高及体重指数均相差不大的前提下,藏族组的H-IR值较汉族组及回族组低。在正常、超重及肥胖3组中,藏族组H-IR值均低于汉族组和回族组,且差异显著。
肥胖受环境及遗传因素共同作用,藏族群众生活习惯与汉族及回族群众不同,他们食肉量大,喜食奶制品,进食碳水化合物种类较简单,量也相对较少。肉食及奶油等热量较高,胃排空慢,容易引起体重增加。藏族群众饮食结构与西方国家高脂、高蛋白饮食结构相似。Mcauley等[23]认为西方国家的高脂、高蛋白饮食,比目前推荐的高碳水化合物饮食在降低胰岛素抵抗方面的作用更大,认为高碳水化合物饮食只有增加富含粗纤维的食品摄入才能达到高蛋白饮食的益处。汉族及回族群众饮食习惯较接近,虽然回族食肉量相对较多,但进食碳水化合物较多,吃蔬菜水果也较多。单核苷酸多态性(SNP)与体力活动、饮食交互作用,肥胖相关的遗传效力可以被生活方式干预减弱[24,25]。全基因组关联研究(GWAS)加速了对肥胖易感基因的研究。对于藏族群众肥胖相关性遗传基因位点是否有遗传异质性,还有待进一步研究。
由于此次调查的人群生活在同一环境,运动量的区别不是很大,因此考虑藏族、汉族及回族教职工胰岛素抵抗指数的区别主要和遗传因素及饮食有关。
研究表明,肥胖会增加糖尿病等代谢性疾病的患病风险,而肥胖是可控因素[24]。所以,各民族群众都需要避免肥胖,而控制体重的最好方法是健康的生活方式。所以,要避免久坐、少运动等生活方式。但是,不同民族有自己的饮食喜好,不必完全改变饮食习惯,藏族饮食热量较高,但是并未引起更强的胰岛素抵抗,在同一体重水平下,胰岛素抵抗水平反而较低。可以在尊重民族生活习惯的基础上,提出有效的代谢性疾病预防方案,注意低脂低糖饮食与适量运动。考虑到藏族群众进食热量高,胰岛素抵抗不明显,可以糖苷酶抑制剂等药物治疗,而罗格列酮等胰岛素增敏剂则不作为首选。
[1]曾龙驿.肥胖与胰岛素抵抗[J].中华医学杂志,2012(8):2091-2092.
[2]Wang Y,Mi J,Shah X Y,et a1.Is China facing an obesityepidemic and the consequences?The trends in obesity and chronic disease in China[J]. Int JObes(Lond),2007(31):177-188.
[3]Bray G A.Overweight is risking fate.definition,classification,prevalence,and risks[J].Ann NYMcAcad Sci,1987(499):14-28.
[4]陈春明.肥胖防治刻不容缓[J].中华预防医学杂志,2001,35(5):1-3.
[5]米杰,程红,侯冬青,等.北京市2004年2~18岁儿童青少年超重和肥胖流行现状[J].中华流行病学杂志,2006,27(61):469-474.
[6]董智强,马文军,许燕君,等.2002年广东省成年人向心性肥胖流行特征分析[J].中国公共卫生,2005,21(3):264-266.
[7]武阳丰,马冠生,胡永华,等.中国居民的超重和肥胖流行现状[J].中华预防医学杂志,2005,39(5):316-320.
[8]Macarena L,Patrieia B,Hugo A,et a1.Is waist circumference a better predictor of blood pressure,insulin resistance and blood lipids than body mass index in young Chilean adults[J].BMC Public Health,2012(12):638-645.
[9]Kateryna K,Peter W,Joyce M L.Is Waist Circumference a BetterPredictor?Of Insulin Resistance Than Body Mass Index in USAdolescents[J].JAdolescent Health,2011(19):330-333.
[10]Pou K M,Massaro JM,Hoffmann U,et a1.Patterns of abdominal fat distilbution:the Framingham Heart Study[J].Diabetes Cam,2009(32):481-485.
[11]王冠怡,许岚,蒋艳敏,等.无锡地区50岁以上居民肥胖及相关指标与胰岛素抵抗的关系[J].中华内分泌代谢杂志,2014(30):495-498.
[12]闫彩凤,向红丁,陈伟,等.腰围、BMI与胰岛素抵抗指数的相关性[J].中国糖尿病杂志,2008(16):215,217.
[13]Matthews D R,Hosker JP,Rudenski A S,et al.Homeostasismodel assessment:insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man[J].Diabetologia,1985,28(7):412-419.
[14]李光伟,潘孝仁,Lillioga S,等.检测人群胰岛素敏感性的一项新指数[J].中华内科杂志,1993(32):656-660.
[15]熊婷,邱少红,余蓉.利用HOMA指数评价胰岛素抵抗及β细胞分泌胰岛素功能[J].湖北中医杂志,2012(10):16-17.
[16]杨凌辉,邹大进.肥胖致胰岛素抵抗的机制[J].中华内分泌代谢杂志,2002(6):246-248.
[17]Hales C N,Barker D J.Type 2(non-insulin-dependent)diabetesmellitus:the thrifty phenotype hypothesis[J].Diabetologia,1992(35):595-601.
[18]Kazuyuki H,Jun W,Jun E,et al.Visceral adipose tissue-derived serine protease inhibitor.A unique in insulin-sensitizing adipocytokine in obesity [J].PNAS,2005(102):10610-10615.
[19]Jiandi Z,Jiafu O,Yuriy B,et al.Goldstein Insulin inhibits transcription of IRS-2 gene in rat liver through an insulin response element(IRE)that resembles IREsof other insulin-repressed genes[J].PNAS,2001(98):3756-3761.
[20]James P,Roneker C A,Mu W P,et al.Langlais P,Development of insulin resistance and obesity in mice overexpressing cellular glutathione peroxidase[J].PNAS,2004(101):8852-8857.
[21]王涛,贾伟平,胡承.亚裔人群肥胖的多基因遗传研究进展[J].中华内分泌代谢杂志,2015(31):248-262.
[22]Maes H H,Neale M C,Eaves L J.Genetic and environmental factors in relative body weight and human adiposity[J].Behav Genet,1997,27(4):325-351.
[23]Mcauley K A,Hopkins C M,Smith K J,et al.Comparison of high-fat and high-protein diets with a high-carbohydrate diet in insulin-resistant obese women[J].Diabetologla,2005(48):8-16.
[24]黄亚,徐敏,徐瑜,等.2型糖尿病基因与环境交互作用研究进展[J].中华内分泌代谢杂志,2015(31):277-299.
[25]Moore A F,Jablonski K A,McAteer JB,et al.Extension of type 2 diabetes genome-wide association scan results in the diabetes prevention program[J].Diabetes,2008,57(9):2503-2510.
G451
A
1671-1246(2017)13-0114-03
注:本文系中央高校基本科研业务费项目(31920130030)
