钙拮抗剂调节钙非依赖磷脂酶A2拮抗心脏微血管内皮细胞缺氧/复氧损伤的研究
2017-07-25周巧玲王远航石刚刚郑付春
周巧玲,王远航,林 泓,汪 彬,石刚刚,郑付春
(汕头大学医学院 1.药理学教研室、2.第一附属医院药剂科,广东 汕头 515041)
钙拮抗剂调节钙非依赖磷脂酶A2拮抗心脏微血管内皮细胞缺氧/复氧损伤的研究
周巧玲1,王远航1,林 泓1,汪 彬1,石刚刚1,郑付春2
(汕头大学医学院 1.药理学教研室、2.第一附属医院药剂科,广东 汕头 515041)
目的 探讨经典钙拮抗剂维拉帕米(Ver)、硝苯地平(Nif)、地尔硫(Dil)及本课题组合成的新型钙拮抗剂-碘化N-正丁基氟哌啶醇(F2)通过调节钙非依赖磷脂酶A2(iPLA2)抗心脏微血管内皮细胞(CMECs)缺氧/复氧(H/R)损伤的作用与机制。方法 培养大鼠原代CMECs,制作H/R模型,在H/R的基础上,用不同浓度梯度的钙拮抗剂及F2处理细胞,比色法测定细胞培养上清液中乳酸脱氢酶(LDH)的漏出反映细胞损伤程度;酶联免疫吸附法(ELISA)测定白介素-6(IL-6) 和花生四烯酸(AA)的含量;TUNEL法检测细胞晚期凋亡水平;Real-time PCR检测iPLA2mRNA表达,Western blot检测iPLA2蛋白表达。结果 钙拮抗剂F2、Ver和Nif均可量效-依赖性地减少H/R过程中LDH漏出(P<0.05),降低IL-6和AA含量(P<0.05),减少细胞凋亡(P<0.05),而Dil对上述指标均无作用;同时,F2和Ver均可量效-依赖性地降低iPLA2mRNA和蛋白表达水平,Nif和Dil对H/R过程中iPLA2mRNA和蛋白表达水平并无影响。结论 H/R可导致CMECs损伤,钙拮抗剂F2、Ver、Nif能保护CMECs抗H/R损伤,Dil无抗H/R损伤的作用;而F2和Ver是部分通过调节iPLA2抗H/R损伤作用的。
钙拮抗剂;碘化N-正丁基氟哌啶醇;钙非依赖磷脂酶A2;花生四烯酸;心脏微血管内皮细胞;缺氧/复氧
心肌缺血/再灌注(ischemia/reperfusion, I/R)损伤是临床常见的病理现象,是指心肌在缺血的基础上恢复血流后组织损伤反而加重,甚至发生不可逆损伤的现象。I/R损伤主要表现在生物膜损伤、细胞器功能改变、炎症发生和细胞凋亡发生等[1-2]。钙非依赖磷脂酶A2(iPLA2)是磷脂酶A2(PLA2)家族的一大亚族,其发挥催化活性不需要钙离子的参与,可以水解膜磷脂,生成花生四烯酸(AA)和溶血磷脂酰胆碱(LPC)[3]。AA和LPC作为细胞内信号分子,涉及广泛的生理病理效应,主要包括类花生四烯酸的产生、葡萄糖诱导胰岛素分泌、Fas诱导的细胞凋亡、细胞增殖、细胞膜代谢融合等,这些都与心肌缺血有密切关系[4-5]。AA作为iPLA2的主要产物之一,也是生成众多炎症因子的一个关键因子,能激发下游瀑布式的炎症反应。
钙拮抗剂(calcium antagonists),也叫钙通道阻滞剂(calcium channel blockers,CCB),主要通过阻断心肌和血管平滑肌细胞膜上的L-型钙离子通道,抑制细胞外钙离子内流,使细胞内钙离子水平降低而改善心血管等组织器官功能[6]。碘化N-正丁基氟哌啶醇(N-n-butyl haloperidol iodide, F2)是我们实验室在氟哌啶醇(haloperidol, Hal)的基础上改造合成的一种具有心血管活性的新型钙拮抗剂,通过阻断心肌细胞膜钙通道而拮抗心I/R损伤[7]。本实验室前期研究表明,F2无论是对整体的I/R损伤,还是对离体的心肌细胞缺氧/复氧(hypoxia/reoxygenation, H/R)损伤均有保护作用,其作用机制可能与阻断心肌细胞细胞膜上L-型钙通道(L-VDCC),拮抗心肌细胞钙超载,抑制早期生长反应基因-1(early growth response gene-1, Egr-1)过表达有关[8-10]。实验室前期研究表明,心肌细胞转染iPLA2质粒使iPLA2高表达后,H/R损伤加重;转染iPLA2-siRNA沉默iPLA2基因,H/R损伤减轻,验证了iPLA2参与心肌细胞H/R损伤[11]。而关于iPLA2能否作为钙拮抗剂的作用靶点介导细胞抗H/R损伤,成为钙拮抗剂抗心肌I/R损伤的另一个机制,未有文献报道。故本研究拟采用I/R损伤中最先受累且参与调控I/R病理生理进程的心脏微血管内皮细胞(CMECs)制备H/R模型[12],选取3种经典钙拮抗剂硝苯地平(Nif)、地尔硫(Dil)、维拉帕米(Ver)及F2,探讨其调节iPLA2抗H/R损伤的保护作用及机制。
1 材料与方法
1.1 材料 新生(1~4 d)SD乳鼠(汕头大学医学院实验动物中心)♀♂不限。胎牛血清(FBS)、DMEM高糖培养基(Gibco公司,美国);肝素钠注射液(成都市海通药业有限公司,中国);内皮细胞生长添加剂(ECGS)(Merk Millipore公司,德国);青霉素-链霉素溶液(Biosharp公司,中国);iPLA2兔多克隆抗体(Proteintech,美国);β-actin小鼠单克隆抗体、HRP标记山羊抗兔IgG、HRP标记羊抗小鼠IgG(武汉博士德生物工程有限公司,中国);TRIzol、PrimeScript RT Master Mix Perfect Real Time、SYBRPrem ExTaqII(TaKaRa公司,日本);乳酸脱氢酶(LDH)试剂盒 (南京建成生物研究所,中国);白介素-6(IL-6) ELISA试剂盒(Ebioscience公司,美国);花生四烯酸(AA) ELISA试剂盒(Cusabio公司,中国);DeadEndTMFlourumetric TUNEL System(Promega公司,美国);盐酸维拉帕米(Ver)注射液(上海禾丰制药有限公司,中国);硝苯地平(Nif)、地尔硫(Dil)(Sigma公司,美国);F2由汕头大学医学院药物研究室化学组合成,实验前用DMSO配成所需浓度;其他试剂均为国产分析纯。SW-CJ-1F超净工作台(苏州净化设备有限公司,中国);CO2培养箱(Sanyo公司,日本);倒置相差显微镜(Nilkon公司,日本);PB-10 pH酸度计(Sarotorius公司,德国);低温高速离心机(Heraeus公司,德国);SpectraMax M2多功能酶标仪(Molecular Devices公司,美国);Olympus BX53正置荧光显微镜(Olympus公司,日本);ABI 7500实时荧光定量仪(ABI公司,美国);Invivo 2400低氧/厌氧工作站(Ruskinn公司,英国);Gel-pro图像分析软件(Media cybernetics, USA)。
1.2 原代CMECs培养 将出生1~4 d的SD乳鼠经75%酒精消毒,仰卧,四肢固定(以下步骤均为无菌操作)。开胸,剥离心脏,取心脏下端1/3心室肌部分,置于预冷(4℃)PBS中充分清洗,用眼科剪将心肌组织剪成1 mm×1 mm×1 mm组织块,加入10倍体积的0.1%胰蛋白酶,37℃消化5 min,轻轻吹打,静置1 min,吸取上清液,余下组织块加入0.1%胰蛋白酶消化5 min,收集上清液。将2次收集的上清液合并,加入含10%FBS的DMEM完全培养基灭活胰酶终止消化,1 000 r·min-1,4℃离心10 min,弃上清,收集细胞。加入含10%FBS的DMEM完全培养基(含有100 kU·L-1青霉素、100 kU·L-1链霉素、6 250 U·L-1肝素钠、15 mg·L-1ECGS),置于37℃、5%CO2恒温培养箱中培养6 h,6 h后,更换培养基去除未贴壁细胞。CO2恒温培养箱培养,24 h后更换培养基,以后每2 d换液1次,至CMECs融合成单层,当细胞长至85%~90%可进行消化传代培养。采用3~8代CMECs进行实验。
1.3 实验分组及H/R模型建立 将CMECs随机分为对照(Control,简称Ctrl)组、H/R组、H/R+溶剂(DMSO)组、H/R+F2(10.0、1.0、0.1 μmol·L-1)组、H/R+Ver(10.0、1.0、0.1 μmol·L-1)组、H/R+Nif(10.0、1.0、0.1 μmol·L-1)组、H/R+Dil(10.0、1.0、0.1 μmol·L-1)组。Ctrl组于实验前更换为0.5%FBS DMEM培养基(复氧液),按正常培养条件培养4.5 h。其余各组制备缺氧模型,均更换为高纯度氮气饱和30 min的缺氧液,放入低氧/厌氧工作站中培养4 h。缺氧完成后,更换复氧液,放入CO2恒温培养箱培养0.5 h,造成CMECs H/R损伤。
1.4 CMECs上清液中LDH活性测定 将CMECs接种于24孔板中,待细胞融合率达到85%~90%,按上述分组。复氧结束后,收集细胞上清复氧液,按LDH试剂盒说明书操作,比色法测定LDH活性。
1.5 酶联免疫吸附法测定IL-6和AA浓度 将CMECs接种于24孔板中,待融合率达到85%~90%时制备H/R模型。收集细胞上清复氧液,按ELISA试剂盒说明书操作,于450 nm波长处检测各组吸光值,并拟合标准曲线,代入各组OD值,计算各组IL-6和AA浓度。
1.6 荧光显微镜观测细胞凋亡水平 首先将75%乙醇消毒过的盖玻片紫外灭菌30 min后放入24孔板中,接种CMECs,爬片成功后,根据实验要求分组处理。预冷PBS洗涤3次,将盖玻片浸没在4%甲醛溶液(溶于1×PBS)中固定,室温孵育15 min。去掉多余液体,每孔加入500 μL 0.3% TritonX-100,室温孵育15 min。在1×TBS溶液中浸没清洗样本3次,轻轻去掉多余液体。滴加100 μL 1×TdT平衡缓冲液(蒸馏水稀释),使其全部覆盖样本,室温孵育10 min。吸干样本周围的平衡缓冲液,立即滴加50 μL TdT标记反应混合物(平衡缓冲液 ∶核苷混合物 ∶rTDT=45 ∶5 ∶1)。用Paraflim®封口膜覆盖样本,置于湿盒中37℃避光孵育60 min。移走封口膜,并将盖玻片置于1×TBS溶液中室温孵育1 min。去掉多余液体,换用新鲜的1×TBS溶液室温孵育1 min,重复1次。用滤纸轻轻擦掉样本周围及背面的TBS溶液。逐滴滴加Mounting Media封片剂并盖上盖玻片。荧光显微镜下观察,使用DAPI的滤光片观察样本中的全体细胞,使用标准的绿色荧光滤光片观察凋亡的细胞。
1.7 Real time-PCR检测iPLA2mRNA表达 将CMECs接种于24孔板中,待细胞融合率达到85%~90%,按上述分组。采用TRIzol一步法提取细胞总RNA,Nano2000测其RNA浓度。用RT逆转录试剂盒逆转录成cDNA,以cDNA为模板,通过Real time-PCR检测iPLA2的表达。以β-actin为内参,计算 2-ΔΔCT值。
1.8 Western blot检测iPLA2蛋白表达 CMECs接种至直径7 cm的培养皿中,待铺满皿底,给予相应处理后,每皿加70 μL裂解液,冰上裂解30 min,12 000 r·min-1、4℃离心收集上清液。BCA法蛋白定量。将蛋白样本进行SDS-PAGE凝胶电泳,电转膜法将蛋白转移至硝酸纤维素膜,5%脱脂奶粉封闭1 h,一抗4℃孵育过夜;二抗37℃孵育1 h,ECL化学发光,暗室曝光。Gel-pro图像分析软件分析蛋白条带的灰度值。
2 结果
2.1 钙拮抗剂对CMECs H/R后LDH漏出的影响 如Fig 1所示,与Ctrl组相比,H/R组与H/R+DMSO组LDH漏出量明显增加(P<0.05);与H/R+DMSO组相比,H/R+F2(10.0、1.0、0.1 μmol·L-1)组、H/R+Ver(10.0、1.0、0.1 μmol·L-1)组、H/R+Nif(10.0、1.0、0.1 μmol·L-1)组均能量效依赖性地减少LDH漏出量,差异具有统计学意义(P<0.05);而H/R+Dil(10.0、1.0、0.1 μmol·L-1)组与H/R+DMSO组相比,有剂量依赖减少LDH漏出量的趋势,但差异无统计学意义。
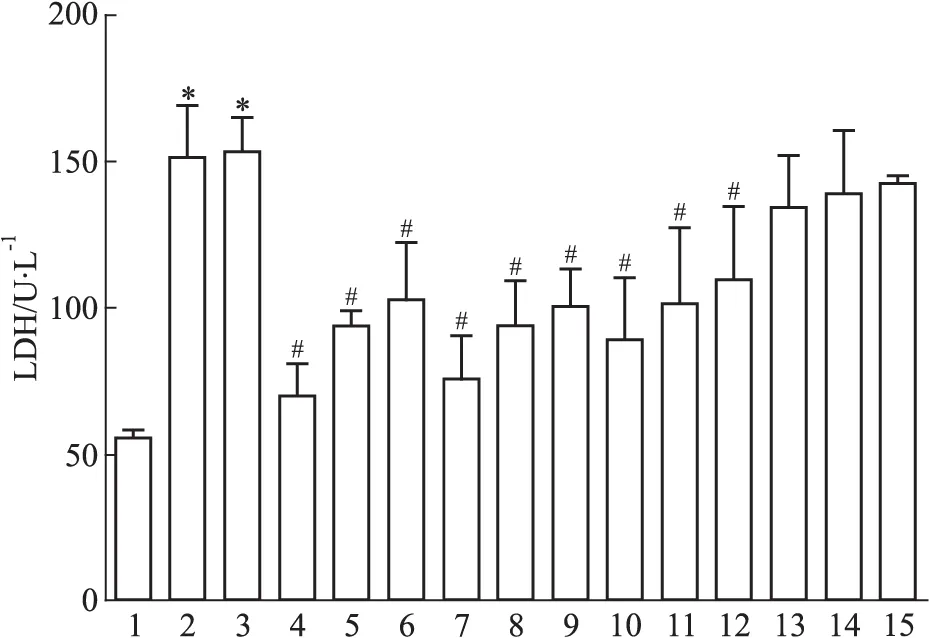
Fig 1 Effect of calcium antagonists on LDH induced by H/R(±s,n=5)
1:Ctrl;2:H/R;3:H/R+DMSO;4:H/R+F2(10.0 μmol·L-1);5:H/R+F2(1.0 μmol·L-1);6:H/R+F2(0.1 μmol·L-1);7:H/R+Ver(10.0 μmol·L-1);8:H/R+Ver(1.0 μmol·L-1);9:H/R+Ver(0.1 μmol·L-1);10:H/R+Nif(10.0 μmol·L-1);11:H/R+Nif(1.0 μmol·L-1);12:H/R+Nif(0.1 μmol·L-1);13:H/R+Dil(10.0 μmol·L-1);14:H/R+Dil(1.0 μmol·L-1);15:H/R+Dil(0.1 μmol·L-1).*P<0.05vsCtrl;#P<0.05vsH/R+DMSO
2.2 钙拮抗剂对CMECs H/R后IL-6浓度的影响 如Fig 2所示,与Ctrl组相比,H/R组与H/R+DMSO组IL-6浓度明显增加(P<0.05);与H/R+DMSO相比,H/R+F2(10.0、1.0、0.1 μmol·L-1)组、H/R+Ver(10.0、1.0、0.1 μmol·L-1)组均能量效-依赖性地降低IL-6浓度,H/R+Nif(10.0、1.0 μmol·L-1)组能明显降低IL-6浓度,差异具有统计学意义(P<0.05),且呈量效-依赖性;而H/R+Nif(0.1 μmol·L-1)组和H/R+Dil(10.0、1.0、0.1 μmol·L-1)组与H/R+DMSO组相比,IL-6浓度差异没有显著性。
2.3 钙拮抗剂对CMECs H/R后细胞凋亡的影响 如Fig 3所示,与Ctrl组相比,H/R组与H/R+DMSO组细胞凋亡明显增加(P<0.05);与H/R+DMSO组相比,H/R+F2(1.0 μmol·L-1)组、H/R+Ver(1.0 μmol·L-1)组、H/R+Nif(1.0 μmol·L-1)组均能减少细胞凋亡,差异具有统计学意义(P<0.05);而H/R+Dil(1.0 μmol·L-1)组与H/R+DMSO组相比,未发现细胞凋亡减少,两组间差异无统计学意义。
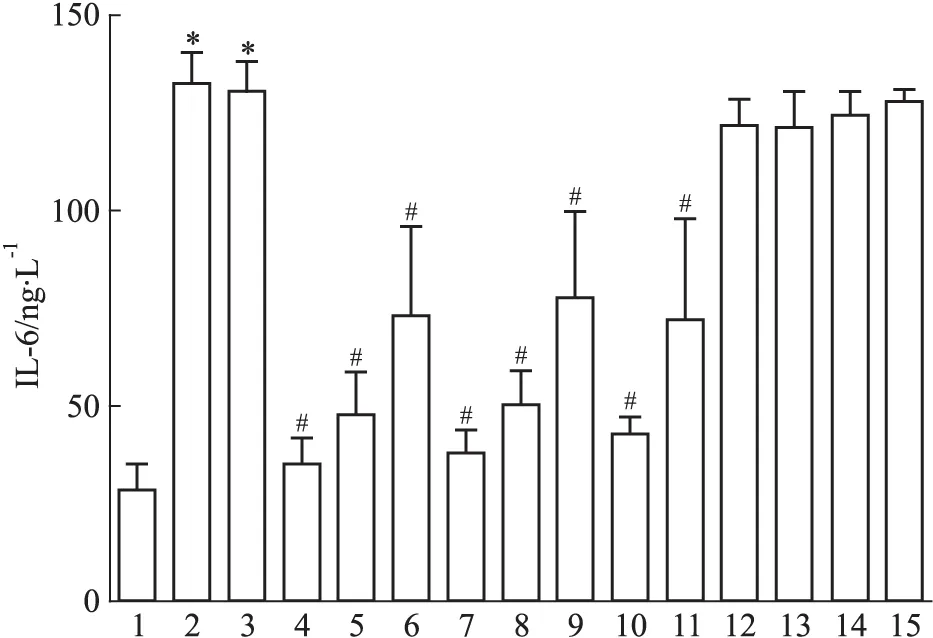
Fig 2 Effect of calcium antagonists on IL-6 induced by H/R(±s,n=5)
1:Ctrl;2:H/R;3:H/R+DMSO;4:H/R+F2(10.0 μmol·L-1);5:H/R+F2(1.0 μmol·L-1);6:H/R+F2(0.1 μmol·L-1);7:H/R+Ver(10.0 μmol·L-1);8:H/R+Ver(1.0 μmol·L-1);9:H/R+Ver(0.1 μmol·L-1);10:H/R+Nif(10.0 μmol·L-1);11:H/R+Nif(1.0 μmol·L-1);12:H/R+Nif(0.1 μmol·L-1);13:H/R+Dil(10.0 μmol·L-1);14:H/R+Dil(1.0 μmol·L-1);15:H/R+Dil(0.1 μmol·L-1).*P<0.05vsCtrl;#P<0.05vsH/R+DMSO
2.4 钙拮抗剂对iPLA2的影响 如Fig 4、5所示,与Ctrl组相比,H/R组与H/R+DMSO组iPLA2表达明显增高(P<0.05);与H/R+DMSO组相比,H/R+F2(10.0、1.0、0.1 μmol·L-1)组和H/R+Ver(10.0、1.0、0.1 μmol·L-1)组均能量效依赖性地降低iPLA2mRNA和蛋白表达,差异具有统计学意义(P<0.05);而H/R+Nif(10、1.0、0.1 μmol·L-1)和H/R+Dil(10、1.0、0.1 μmol·L-1)组与H/R+DMSO组相比,未发现iPLA2mRNA和蛋白表达的降低,两组间无统计学差异。
2.5 钙拮抗剂对CMECs H/R后AA浓度的影响 如Fig 6所示,与Ctrl组相比,H/R组与H/R+DMSO组AA浓度明显增加(P<0.05);与H/R+DMSO组相比,H/R+F2(10.0、1.0、0.1 μmol·L-1)组、H/R+Ver(10.0、1.0、0.1 μmol·L-1)组均能量效依赖性地降低AA浓度,H/R+Nif(10.0 、1.0 μmol·L-1)组能明显降低AA浓度,差异具有统计学意义(P<0.05);而H/R+Nif(0.1 μmol·L-1)组和H/R+Dil(10.0、1.0、0.1 μmol·L-1)组与H/R+DMSO组相比,AA浓度没有统计学差异。
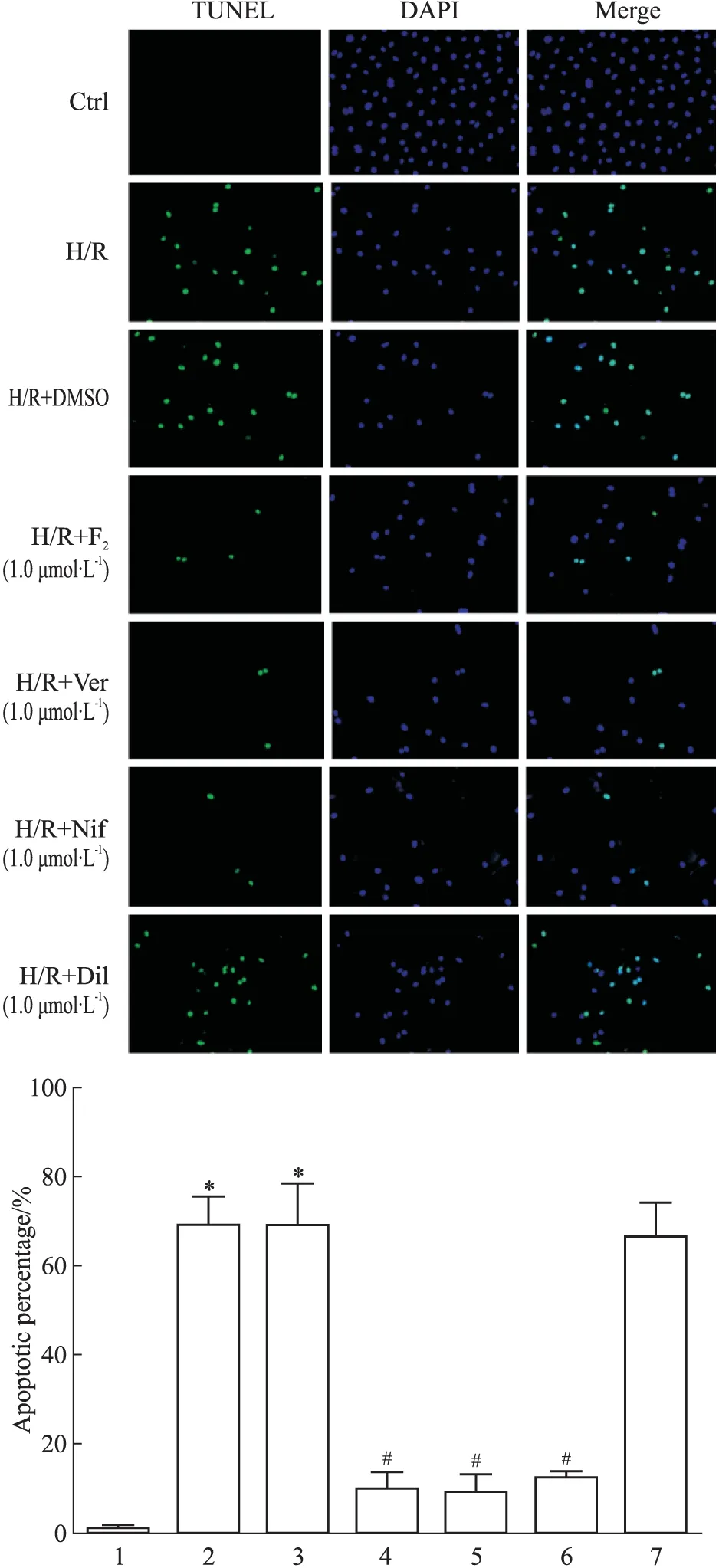
Fig 3 Effect of calcium antagonists on apoptosis induced by H/R(±s,n=3)
1:Ctrl;2:H/R;3:H/R+DMSO;4:H/R+F2(1.0 μmol·L-1);5:H/R+Ver(1.0 μmol·L-1);6:H/R+Nif(1.0 μmol·L-1);7:H/R+Dil(1.0 μmol·L-1).*P<0.05vsCtrl;#P<0.05vsH/R+DMSO
3 讨论
心肌I/R损伤是一个复杂的多因素参与的病理过程,损伤的发生机制包括氧自由基产生、钙超载、白细胞趋化作用、能量代谢障碍和炎症反应等[1-2,13]。缺血前或早期给予钙拮抗剂可以通过对细胞膜L-VDCC的阻断作用,减少胞内的钙离子,减轻细胞内钙超载,减少心肌的不可逆损伤。然而,近年来有学者认为,钙拮抗剂也可能通过作用其它环节而发挥效应,且多年来对于钙拮抗剂减轻I/R损伤的机制报道也并非一致[14-16]。有人认为是通过其负性肌力和负性频率作用,节省能量,改善I/R损伤;也有报道钙拮抗剂具有抗氧自由基和调节NO合酶的作用[17-18]。
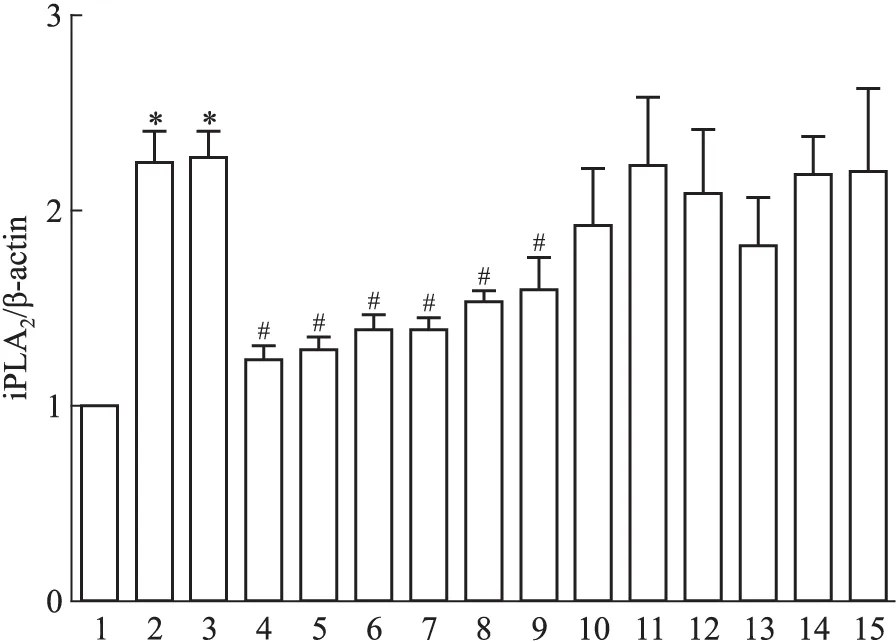
Fig 4 Effect of calcium antagonists on expression of iPLA2 mRNA(±s,n=9)
1:Ctrl;2:H/R;3:H/R+DMSO;4:H/R+F2(10.0 μmol·L-1);5:H/R+F2(1.0 μmol·L-1);6:H/R+F2(0.1 μmol·L-1);7:H/R+Ver(10.0 μmol·L-1);8:H/R+Ver(1.0 μmol·L-1);9:H/R+Ver(0.1 μmol·L-1);10:H/R+Nif(10.0 μmol·L-1);11:H/R+Nif(1.0 μmol·L-1);12:H/R+Nif(0.1 μmol·L-1);13:H/R+Dil(10.0 μmol·L-1);14:H/R+Dil(1.0 μmol·L-1);15:H/R+Dil(0.1 μmol·L-1).*P<0.05vsCtrl;#P<0.05vsH/R+DMSO
研究表明,炎性反应血管高通透性被认为是心肌I/R损伤的中心环节,此过程中内皮细胞功能紊乱是I/R损伤发生的始动环节。内皮细胞缺氧损伤后促进炎症因子的释放,进而引起白细胞聚集、黏附、血管收缩、血栓形成及内皮细胞肿胀造成无复流现象,加重H/R损伤[12],再灌注前给予保护内皮功能的药物可对抗内皮细胞功能紊乱,减少心肌损伤。iPLA2作为磷脂酶超家族的一员,文献报道其在心肌中有相对高的活性。心肌膜由磷脂双分子层构成,能调节细胞生长、信号转导和运输功能。心肌缺血时,心肌膜破损,导致细胞功能紊乱,进一步加重心肌损伤,iPLA2在细胞膜磷脂的维持和修复程度中发挥关键作用。iPLA2对于心肌I/R的病理发展也具有重要的作用,其水解膜磷脂生成AA和LPC产物,两个产物具有多样性的生物效应,介导不同信号通路产生有害反应,参与了一系列炎症、凋亡等反应,从离子通道的调节到对多种信号通路的作用,尤其是在心肌I/R损伤中发挥重要作用。实验室前期研究表明iPLA2参与心肌细胞H/R损伤[11],心肌I/R或细胞H/R情况下,iPLA2高表达,活性增加,所生成的AA和LPC引起细胞损伤,钙拮抗剂对iPLA2这样一个重要的“上游”酶类的调节发挥多方面的效应。钙拮抗剂通过抑制iPLA2高表达,主要是通过对产物AA的产生发挥作用,通过降低心肌I/R情况下AA的产生,从而抑制AA所激发的下游瀑布式炎症效应,保护心肌损伤。基于此,许多学者认为iPLA2很可能成为诸多疾病的药物作用靶点。本实验在前期工作的基础上,探讨在细胞H/R情况下,钙拮抗剂是否通过调控iPLA2异常表达产生抗损伤作用。
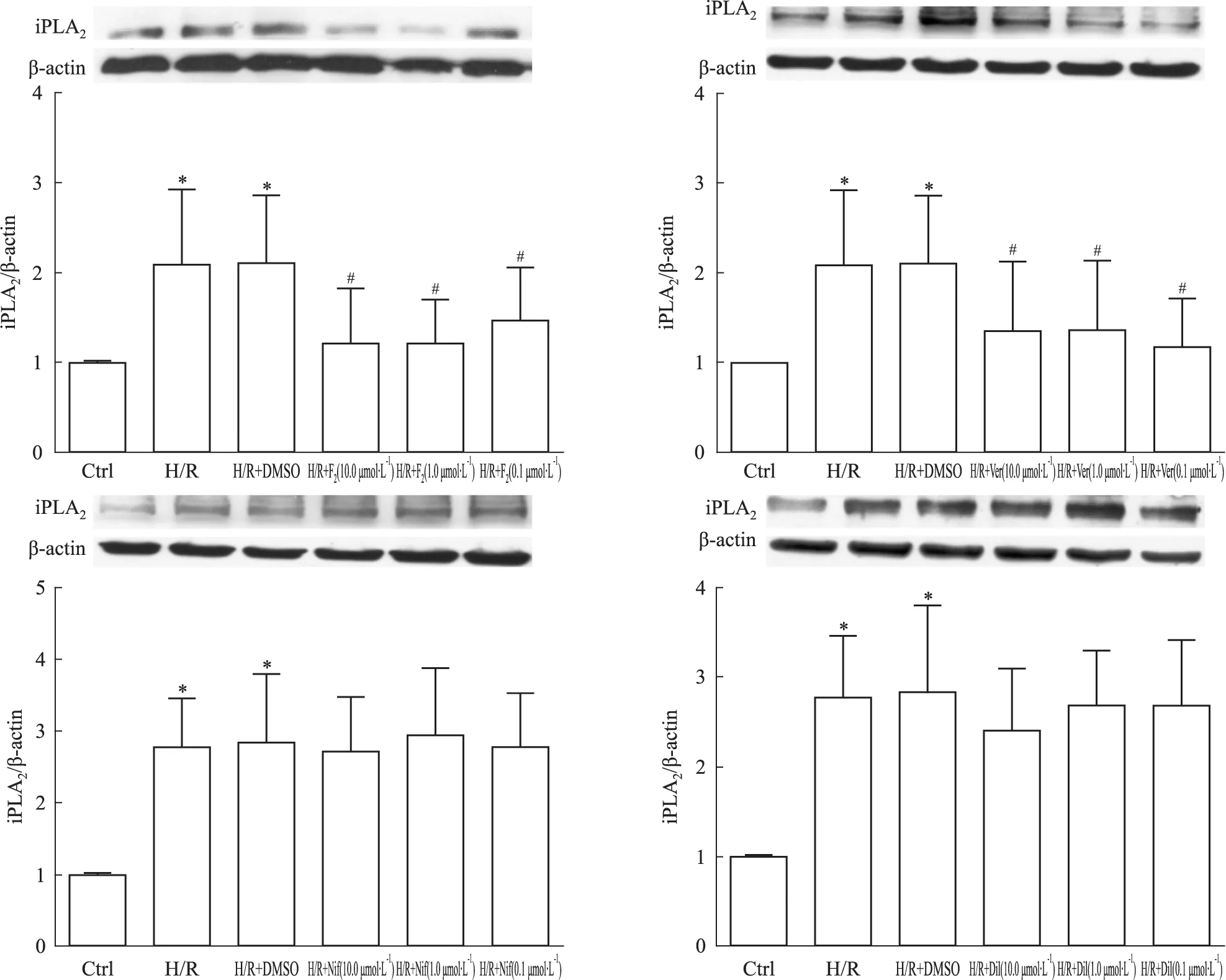
Fig 5 Effect of calcium antagonists on expression of iPLA2 protein(±s,n=3)
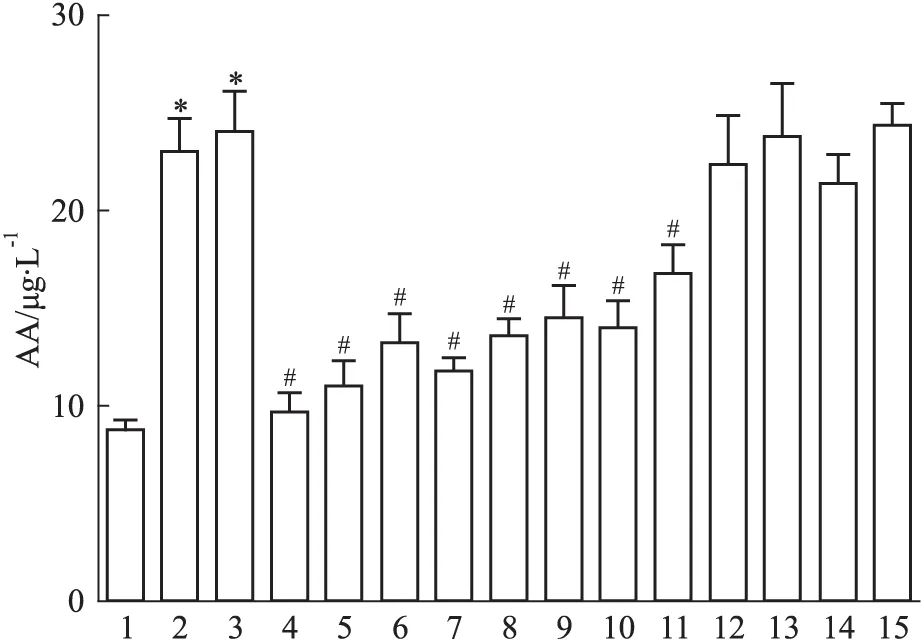
Fig 6 Effect of calcium antagonistson AA induced by H/R(±s,n=5)
1:Ctrl;2:H/R;3:H/R+DMSO;4:H/R+F2(10.0 μmol·L-1);5:H/R+F2(1.0 μmol·L-1);6:H/R+F2(0.1 μmol·L-1);7:H/R+Ver(10.0 μmol·L-1);8:H/R+Ver(1.0 μmol·L-1);9:H/R+Ver(0.1 μmol·L-1);10:H/R+Nif(10.0 μmol·L-1);11:H/R+Nif(1.0 μmol·L-1);12:H/R+Nif(0.1 μmol·L-1);13:H/R+Dil(10.0 μmol·L-1);14:H/R+Dil(1.0 μmol·L-1);15:H/R+Dil(0.1 μmol·L-1).*P<0.05vsCtrl;#P<0.05vsH/R+DMSO
本实验结果提示,0.1~10.0 μmol·L-1的钙拮抗剂F2、Ver及Nif具有抗H/R损伤、保护CMECs的作用,且F2和Ver是通过抑制iPLA2高表达抗H/R损伤的,Nif对iPLA2高表达无作用。Hempel等[19]发现,在无L-VDCC的内皮细胞上,Nif可通过直接抑制PKC转位,减少缺血引起的内皮细胞通透性增加,降低内皮细胞的通透性,从而保护内皮细胞缺血损伤。这些研究都表明[11,19],钙拮抗剂除了能阻断钙通道外,还可能存在非钙通道阻断途径 (如非L-VDCC依赖机制)。至于Dil与其他3种钙拮抗剂的不同作用,仍需进一步探讨。结果表明,F2和Ver量效依赖地降低了iPLA2的表达,提示iPLA2可能是钙拮抗剂F2和Ver抗H/R损伤新的作用靶点,为其临床应用提供了科学依据。
(致谢:本文实验是在汕头大学医学院药理学教研室完成,感谢在实验过程中给予建议与帮助的老师和同学。)
[1] Zhao Z Q, Vinten-Johansen J. Postconditioning: reduction of reperfusion-induced injury[J].CardiovasRes, 2006, 70:200-11.
[2] Xiong J, Xue F S, Yuan Y J, et al. Cholinergic anti-inflammatory pathway: a possible approach to protect against myocardial ischemia reperfusion injury[J].ChinMedJ, 2010, 123(19):2720-6.
[3] Ramanadham S, Ali T, Ashley J W, et al. Calcium-independent phospholipases A2 and their roles in biological processes and diseases[J].JLipidRes, 2015, 56(9):1643-68.
[4] Akiba S, Sato T. Cellular function of calcium-independent phospholipase A2[J].BiolPharmBull, 2004, 27(8):1174-8.
[5] Zachman D K, Chicco A J, Mccune S A, et al. The role of calcium-independent phospholipase A2 in cardiolipin remodeling in the spontaneously hypertensive heart failure rat heart[J].JLipidRes, 2009, 51(3):525-34.
[6] Olson K. Calcium channel antagonists. Poisoning & drug overdose[M]. 6th ed. New York: McGraw Hill, 2011.
[7] 王锦芝, 郑锦鸿, 石刚刚. N-取代苄基氟哌啶醇氯化物的合成及扩血管活性[J]. 中国新药杂志, 2005, 14(4):447-51.
[7] Wang J Z, Zheng J H, Shi G G. Synthesis and vasodilative activities of N substituted benzyl haloperidol chlorides[J].ChinJNewDrugs, 2005, 14(4):447-51.
[8] Zhang Y, Shi G, Zheng J, et al. The protective effects of N-n-butyl haloperidol iodide on myocardial ischemia-reperfusion injury in rats by inhibiting Egr-1 overexpression[J].CellPhysiolBiochem, 2007,20(5):639-48.
[9] Zhou Y, Zhang Y, Gao F, et al. N-n-butyl haloperidol iodide protects cardiac microvascular endothelial cells from hypoxia/reoxygenation injury by down-regulating Egr-1 expression[J].CellPhysiolBiochem, 2010,26(6):839-48.
[10] 周燕琼, 张艳美, 高分飞, 等. 碘化N-正丁基氟哌啶醇对大鼠心脏微血管内皮细胞缺氧复氧损伤保护机制的研究[J]. 中国药理学通报, 2014, 30(2):207-11.
[10] Zhou Y Q, Zhang Y M, Gao F F, et al. N-n-butyl haloperidol iodide protects rat cardiac microvascular endothelial cells from anoxia and reoxygenation injury[J].ChinPharmacolBull, 2014, 30(2):207-11.
[11] 万 星, 石刚刚. 钙非依赖磷脂酶A2参与非L型钙通道开放引起的心肌细胞缺氧复氧损伤[J]. 汕头大学医学院学报, 2013, 26(4):206-13.
[11] Wan X, Shi G G. Calcium-independent phospholipase A2 is involved in cardiomyocyte hypoxia-reoxygenation injury caused by L-type calcium channel-independence opening[J].JShantouUnivMedColl, 2013,26(4):206-13.
[12] Lefer A M, Tsao P S, Lefer D J, Ma X L. Role of endothelial dysfunction in the pathogenesis of reperfusion injury after myocardial ischemia[J].FASEBJ, 1991, 5(7):2029-34.
[13] Dirksen M T, Laarman G J, Simoons M L, Duncker D J. Reperfusion injury in humans: a review of clinical trials on reperfusion injury inhibitory strategies[J].CardiovascRes, 2007,74(3):343-55.
[14] Pérez N G, Piaggio M R, Ennis I L, et al. Phosphodiesterase 5A inhibition induces Na+/H+exchanger blockade and protection against myocardial infarction[J].Hypertension, 2007, 49(5):1095-103.
[15] Maekawa N, Abe J, Shishido T, et al. Inhibiting p90 ribosomal S6 kinase prevents Na+-H+exchanger-mediated cardiac ischemia-reperfusion injury[J].Circulation, 2006,113(21):2516-23.
[16] Huang Z, Shi G, Gao F, et al. Effects of N-n-butyl haloperidol iodide on L-type calcium channels and intracellular free calcium in rat ventricular myocytes[J].BiochemCellBiol, 2007, 85(2):182-8.
[17] Mahfoudh-Boussaid A, Hadj Ayed Tka K, Zaouali M A, et al. Effects of trimetazidine on the Akt/eNOS signaling pathway and oxidative stress in aninvivorat model of renal ischemia-reperfusion[J].RenFail, 2014, 36(9):1436-42.
[18] Zhang Y, Liao H, Zhong S, et al. Effect of N-n-butyl haloperidol iodide on ROS/JNK/Egr-1 signaling in H9c2 cells after hypoxia/reoxygenation[J].SciRep, 2015, 5:11809.
[19] Hempel A, Lindschau C, Maasch C, et al. Calcium antagonists ameliorate ischemia-induced endothelial cell permeability by inhibiting protein kinase C[J].Circulation, 1999, 99(19):2523-9.
Calcium antagonists protect cardiac microvascular endothelial cells against hypoxia/reoxygenation injury through iPLA2
ZHOU Qiao-ling1,WANG Yuan-hang1,LIN Hong1,WANG Bin1,SHI Gang-gang1,ZHENG Fu-chun2
(1.DeptofPharmacology,ShantouUniversityMedicalCollege,2.DeptofPharmacy,theFirstAffiliatedHospitalofShantouUniversityMedicalCollege,Shantou,Guangdong515041,China)
Aim To investigate the effects of classic calcium antagonists verapamil(Ver), nifedipine(Nif), diltiazem(Dil) and the novel calcium antagonistN-n-butyl haloperidol iodide(F2) which was synthesized by our lab by regulating Ca2+-independent phospholipase A2(iPLA2) on hypoxia / reoxygenation(H/R) injury of cardiac microvascular endothelial cells(CMECs) and the mechanisms.Methods The CMECs were isolated from SD neonatal rats. The H/R model was established, then cells were treated with different concentrations of calcium antagonists and F2.The content of LDH in the cell supernatant was measured by colorimetric method. The levels of IL-6 and AA in cell supernatant were measured by ELISA; and late-stage apoptosis was measured by TUNEL. The mRNA and protein expression levels of iPLA2in CMECs were examined by real time-PCR and Western blot analysis.Results Calcium antagonists except Dil decreased the generation of LDH,IL-6 and AA in a dose-dependent manner(P<0.05), and reduced the apoptosis(P<0.05). F2and Ver decreased the mRNA and protein expression of iPLA2in a dose-dependent manner, while there were no such effects for Nif and Dil.Conclusions Calcium antagonists except Dil have protective effects against H/R injury. F2and Ver protect CMECs against H/R injury partly through iPLA2.
calcium antagonist;N-n-butyl haloperidol iodide;Ca2+-independent phospholipase A2;arachidonic acid; cardiac microvascular endothelial cells;hypoxia/reoxygenation
2017-03-22,
2017-04-23
国家自然科学基金-广东联合基金资助项目(No U0932005) ;国家自然科学基金资助项目(No 81473215);广东省科技厅公益研究与能力建设专项资金项目(No 2014A020212290)
周巧玲(1991-),女,硕士,研究方向:心血管药物研发,E-mail:qlchou@163.com; 郑付春(1967-),女,硕士,主任药师,硕士生导师,研究方向:心血管药物研发、药物临床研究,通讯作者,E-mail:zhengfc@stu.edu.cn
时间:2017-7-7 11:04 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170707.1104.032.html
10.3969/j.issn.1001-1978.2017.08.016
A
1001-1978(2017)08-1119-07
R-332;R322.11;R322.12;R542.22;R845.22;R972;R977.3