蛇床子素上调miRNA-107减少APP595/596转基因神经元Aβ的生成
2017-07-25肖洪贺教亚男闫宇辉李红艳杨静娴
肖洪贺,教亚男,闫宇辉,李红艳,杨静娴
(辽宁中医药大学药学院,辽宁 大连 116600)
蛇床子素上调miRNA-107减少APP595/596转基因神经元Aβ的生成
肖洪贺,教亚男,闫宇辉,李红艳,杨静娴
(辽宁中医药大学药学院,辽宁 大连 116600)
目的 考察蛇床子素(osthole,Ost)对转染APP595/596基因的小鼠神经元的保护作用,并探讨其作用机制。方法 原代培养小鼠神经元,转染APP595/596基因构建AD细胞模型;采用CCK-8法检测神经元存活率;试剂盒法检测乳酸脱氢酶(lactic dehydrogenase,LDH)释放量,评价神经元的损伤程度;TUNEL染色法检测神经元凋亡;免疫荧光化学法检测β-淀粉样蛋白(beta-amyloid peptide,Aβ)和β-分泌酶1(β-site APP cleaving enzyme 1,BACE1)的蛋白表达;RT-PCR检测miRNA-107的表达。结果 与模型组比较,Ost干预组神经元的存活率明显升高,LDH释放量明显降低,凋亡率明显降低,Aβ和BACE1的蛋白表达均明显降低,而miRNA-107的表达明显升高。结论 Ost对转染APP595/596基因的小鼠神经元具有良好的保护作用,其机制可能与上调miRNA-107表达,抑制BACE1表达,进而减少Aβ生成有关。
独活;蛇床子素;阿尔茨海默病;神经保护;β-淀粉样蛋白;miRNA-107
阿尔茨海默病(Alzheimer′s disease,AD)是多发于65岁以上人群的神经系统退行性疾病,临床表现为进行性的记忆损伤、认知障碍以及精神行为异常。β-淀粉样蛋白(beta-amyloid peptide,Aβ)沉积形成的老年斑和细胞微管连接蛋白tau的高度磷酸化产生的神经纤维缠结是AD的两大病理特征[1]。Aβ异常产生与沉积可引起tau蛋白磷酸化、递质丢失、神经胶质增生和炎症等复杂的级联反应,引发了神经纤维缠结、神经元丢失和脑组织萎缩等AD病理现象[2-3]。目前治疗AD的药物,如多奈哌齐、加兰他敏等,主要通过调节兴奋性神经递质通路而改善轻、中度AD症状,但不能预防、终止或逆转AD进程,且伴有呕吐、腹泻等胃肠道不良反应[4-6]。因此,研发疗效确切、安全无毒的AD防治药物迫在眉睫。
蛇床子素(osthole,Ost),又名甲基欧芹酚或欧芹酚甲醚,是中药独活的主要活性成分。研究表明,蛇床子素具有改善学习记忆、延缓衰老、抗肿瘤等药理活性[7]。近年来本实验组发现,蛇床子素能改善AD模型细胞损伤[8-9],维持AD神经元突触的结构和功能[10],并能够促进AD神经干细胞向多种神经细胞分化[11-12],提示蛇床子素有可能成为治疗AD的潜在开发药物。但蛇床子素对Aβ的影响及机制尚不明确,故本实验采用APP595/596基因感染小鼠神经元,构建AD细胞模型,探讨蛇床子素是否通过上调miRNA-107,抑制将淀粉样前体蛋白(amyloid precursor protein, APP)剪切成Aβ的β-分泌酶1(β-site APP cleaving enzyme 1,BACE1)的表达,进而减少Aβ的生成,发挥对AD细胞的保护作用。
1 材料
1.1 药品与试剂 蛇床子素,购自中国药品生物制品检定所(纯度≥98.0%,批号:110822-200305);DMEM培养基、胎牛血清、胰蛋白酶-EDTA消化液和青霉素-链霉素均购自Gibco;APP595/596质粒、绿色荧光蛋白(green fluorescein protein,GFP)质粒及慢病毒包装系统(pLP1、pLP2、pLP/VSV-G)由天津医科大学闫亚平教授构建;脂质体2000(Invitrogen公司);DH5α感受态大肠杆菌、无内毒素质粒小提试剂盒(Omega公司);CCK-8试剂盒(Dojindo公司);二甲基亚砜(Amresco公司);乳酸脱氢酶(lactic dehydrogenase,LDH)试剂盒(南京建成公司);cDNA合成试剂盒和PCR Master Mix试剂,购自Fermentas;兔抗人NF-M、APP、Aβ1-42、BACE1一抗(Bioss公司);二抗Cy3标记羊抗兔免疫球蛋白G(Jackson公司)。
1.2 仪器与设备 Ti-S型荧光显微镜(日本尼康)、DIV-86L386超低温冰箱(青岛海尔)、CO2培养箱(NUAIRE,BPN)、酶标仪(深圳迈瑞,MR-96A)、PCR仪(杭州朗基,MG96G)、凝胶成像系统(UVP,GeneGenius)。
1.3 动物 SPF级C57BL/6小鼠,购自辽宁长生生物有限公司,许可证号:SCXK(辽)2015-0001。出生48 h内的新生小鼠用于实验。
2 方法
2.1 蛇床子素溶液的配制 精密称取2.31 mg Ost,溶于50 μL DMSO中,加DMEM稀释至1 mL,制成浓度为10 mmol·L-1的Ost母液,加DMEM稀释至终浓度为50 μmol·L-1的Ost工作液,-20℃冻存备用。
2.2 小鼠皮层神经元的分离与培养 取新生小鼠大脑皮层,剪成糜状,胰酶消化15 min,筛网过滤得到细胞悬液,以6×108·L-1的密度接种于96孔板(经多聚赖氨酸包被过),加入DMEM完全培养基,5% CO2培养箱中培养。接种d 3,培养基替换为含有2.5 μmol·L-1阿糖胞苷的DMEM完全培养基,48 h后更换新的完全培养基。待细胞融合度达70%~80%以上,用于转染实验。
2.3 APP595/596转染神经元构建AD细胞模型 GFP-APP595/596质粒转化DH5α感受态大肠杆菌,接种于LB固体培养基,37℃倒置培养16 h,挑取阳性克隆,置于LB液体培养基中,37℃振荡培养18 h,提取GFP-APP595/596质粒。取GFP或GFP-APP595/596质粒15 μg、pLP1质粒6.5 μg、pLP2质粒2.5 μg、pLP/VSV-G质粒3.5 μg,采用脂质体2000介导转染293T细胞,空白对照组转染GFP质粒。培养24 h后,荧光显微镜下观察,呈现绿色荧光。转染72 h后,分别收集含有病毒的细胞培养液上清,离心,浓缩,检测病毒滴度;浓缩的病毒上清转染神经元,72 h后,采用免疫荧光化学法检测转染情况,RT-PCR检测APP的mRNA表达,Western blot检测APP的蛋白表达。
2.4 实验分组 实验分为正常对照组(转染GFP的神经元,GFP)、模型对照组(转染GFP-APP595/596基因的神经元,APP)和Ost干预组(转染GFP-APP595/596基因的神经元,Ost)。Ost组给予蛇床子素(终浓度为50 μmol·L-1),GFP组和APP组给予等量溶媒,作用24 h后,检测下列指标。
2.5 CCK-8法检测神经元活力 各组细胞药物干预24 h后,每孔加入CCK-8溶液10 μL,37℃孵育4 h后,450 nm下检测吸光度。
2.6 试剂盒法检测神经元LDH释放量 各组细胞药物干预24 h后,离心取上清液,根据试剂盒说明书操作,510 nm下检测各组吸光度,计算LDH的释放量。
2.7 TUNEL染色法检测神经元凋亡 按照TUNEL试剂盒说明书进行操作。各组细胞药物干预24 h后,以1%多聚甲醇固定30 min,0.2%的Triton X-100透化5 min,PBS冲洗,加入PE,37℃孵育1 h,用PBS洗净,DAPI避光染色5 min,置荧光显微镜下观察神经元凋亡情况。用Image J软件进行计数,计算凋亡率。凋亡率/%=红色凋亡细胞数/DAPI阳性细胞数×100%。
2.8 免疫荧光化学法检测Aβ和BACE1蛋白表达 各组细胞进行药物干预24 h后,弃去上清液,以4%多聚甲醛固定30 min,0.1%的Triton X-100透化20 min,加入一抗稀释液(1 ∶100),4℃过夜,再加入Cy3标记的二抗稀释液(1 ∶100)室温避光1 h,用PBS洗净,加入DAPI避光孵育15 min,再洗净加入抗荧光淬灭剂进行封片,倒置荧光显微镜下观察,并用Image J软件对各组细胞中Aβ及BACE1蛋白的荧光强度进行扫描和定量。
2.9 RT-PCR法检测APP和miRNA-107基因表达 试剂盒法提取各组细胞总RNA,按Revert AidTMFirst Strand cDNA Synthesis Kit所示比例配制成RT反应体系,65℃ 5 min;42℃ 60 min,70℃ 5 min,合成cDNA,-80℃冻存备用。进行PCR反应(50 μL体系):按PCR Master Mix Kit所示比例配制成PCR反应体系,样品DNA用量为2.5 μL。反应条件为95℃ 2 min,95℃ 30 s,56℃ 30 s,72℃ 1 min,72℃ 10 min,35个循环后,进行琼脂糖凝胶电泳,Image J进行光密度扫描分析。各引物序列见Tab 1。
3 结果
3.1 APP在转染APP595/596基因的神经元中高表达 经免疫荧光法鉴别,培养的小鼠皮层神经元表达神经细胞标记物神经丝蛋白M(neurofilament M,NF-M)(Fig 1A)。转染APP595/596基因后,在荧光显微镜下观察GFP的表达情况。结果显示,感染了GFP-APP和感染了GFP的神经元都呈现绿色荧光(Fig 1A)。RT-PCR法与Western bolt结果显示,感染了GFP-APP的神经元中,APP呈现高表达(Fig 1B、1C),证明稳定表达APP595/596的转基因神经元构建成功。

Tab 1 Sequences of primers for RT-PCR
F:forward primer,R:reverse primer
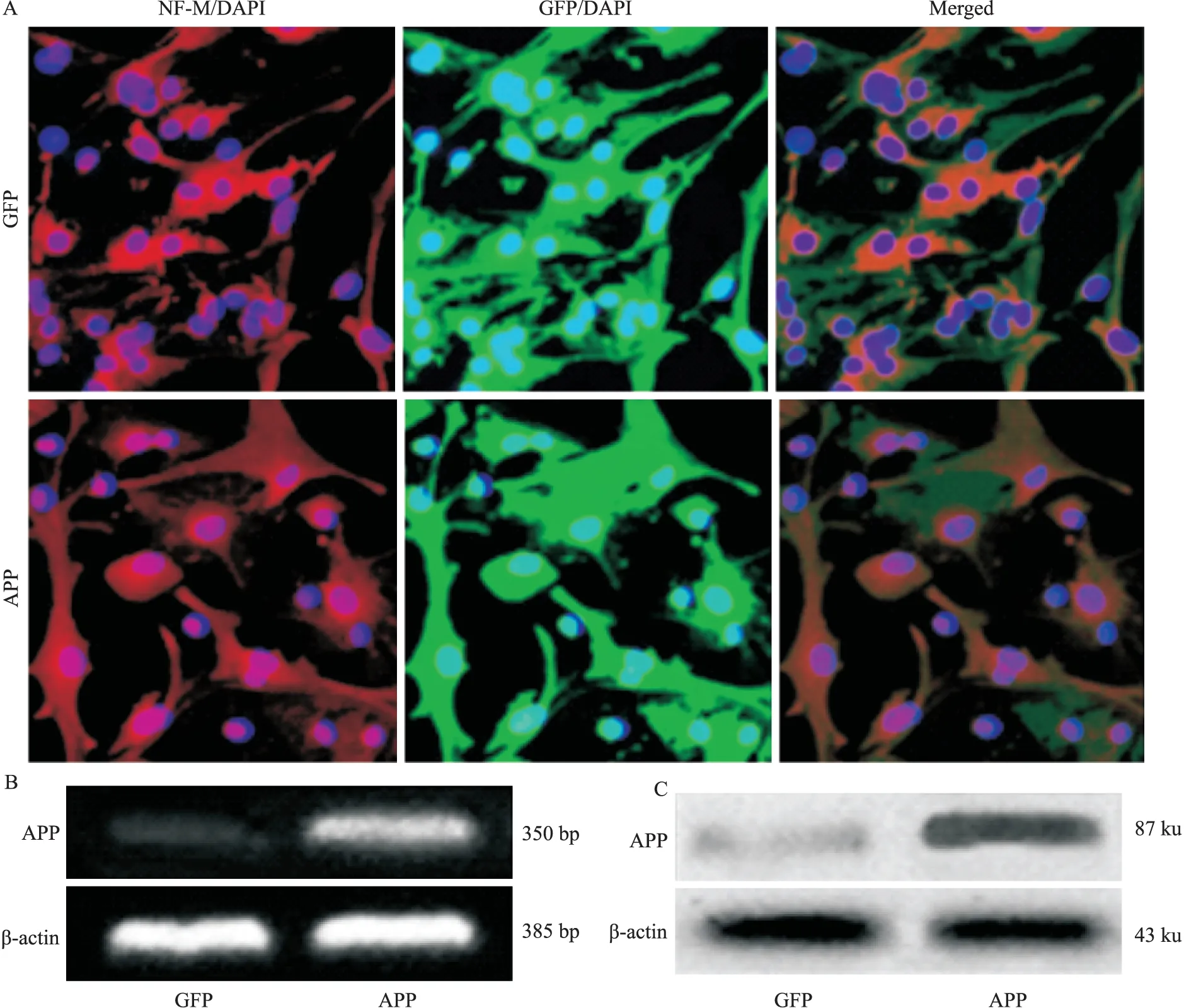
Fig 1 Highly expressed APP in neurons transfected with APP595/596 gene
A:Immunocytochemistry staining. NF-M is short for neurofilament M, NF-M+(Red), GFP+(green); B: The mRNA of APP assessed by RT-PCR; B: The protein of APP assessed by Western blot
3.2 蛇床子素提高转染APP595/596基因的神经元活力 如Fig 2所示,转染APP595/596的神经元存活率为(57.9±4.6)%,明显低于正常对照组(100±4.4)%(P<0.01),而给予Ost(终浓度50 μmol·L-1)后,神经元存活率升高至(79.5±3.6)%,与模型组(57.9±4.6)%比较,差异有显著性(P<0.01),提示Ost能提高APP595/596转基因神经细胞的存活率。

Fig 2 Ost developed viability of neurons transfected with APP595/596 gene(±s,n=3)
##P<0.01vsGFP group;**P<0.01vsAPP group
3.3 蛇床子素降低转染APP595/596基因的神经元LDH释放量 如Fig 3所示,转染APP595/596的神经元LDH的释放量明显升高,与正常对照组比较,差异有显著性(P<0.01),给予50 μmol·L-1的Ost后,LDH水平与模型组比较明显降低(P<0.01)。提示Ost可减少APP595/596转基因神经元的LDH释放量。
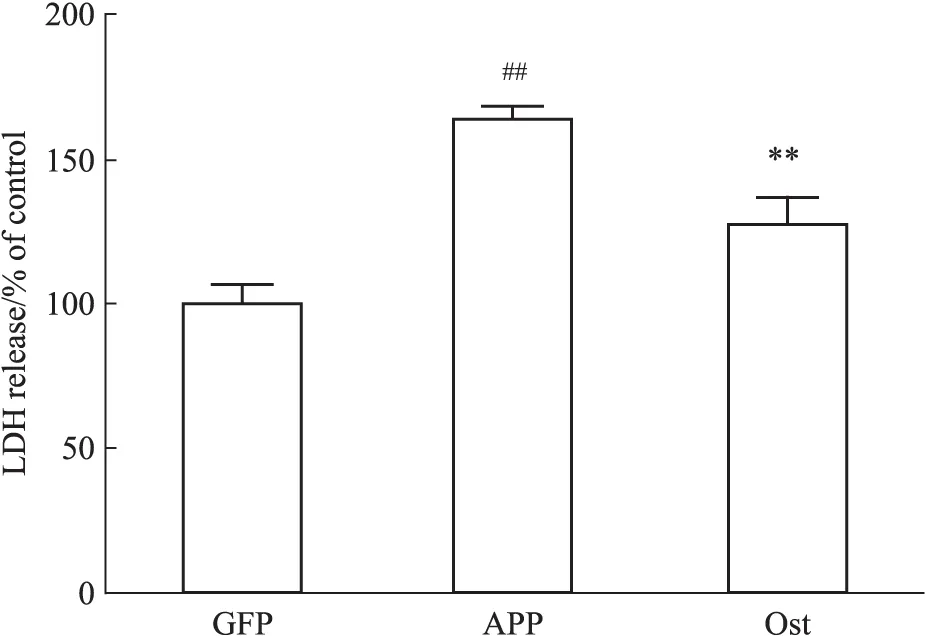
Fig 3 Ost decreased LDH release of neurons transfected with APP595/596 gene(±s,n=3)
##P<0.01vsGFP group;**P<0.01vsAPP group
3.4 蛇床子素抑制转染APP595/596基因的神经元凋亡 如Fig 4所示,转染APP595/596基因的神经元红色斑点明显多于正常对照组(P<0.01),说明模型组神经元发生了凋亡反应;给予Ost后,红色斑点减少,神经元凋亡率降低,与模型组比较,差异有统计学意义(P<0.01)。提示Ost能够抑制APP595/596转基因神经元的凋亡。

Fig 4 Ost inhibited apoptosis of neurons transfected with APP595/596 gene(±s,n=3)
##P<0.01vsGFP group;**P<0.01vsAPP group
3.5 蛇床子素下调转染APP595/596基因的神经元Aβ的蛋白表达 如Fig 5所示,转染APP595/596基因的神经元Aβ的表达明显高于正常对照组(P<0.01);给予Ost后,Aβ的表达明显降低,与模型组比较,差异有显著性(P<0.01)。提示Ost能够抑制Aβ的表达。

Fig 5 Ost reduced expression of Aβ in neurons transfected with APP595/596 gene(±s,n=3)
##P<0.01vsGFP group;**P<0.01vsAPP group
3.6 蛇床子素下调转染APP595/596基因的神经元BACE1的蛋白表达 如Fig 6所示,转染GFP的对照组神经元BACE1的表达较弱,而转染APP595/596基因的模型组BACE1的表达明显增强(P<0.01);给予Ost后,BACE1的表达明显降低,与模型组比较差异有显著性(P<0.01)。提示Ost能够抑制BACE1的表达。
3.7 蛇床子素上调转染APP595/596基因的神经元miRNA-107的表达 如Fig 7所示,模型组与对照组相比,miRNA-107的表达明显降低(P<0.01),给药组miRNA-107的表达明显升高,与模型组比较差异有显著性(P<0.01)。提示Ost能够上调APP595/596转基因神经元中miRNA-107的表达。
4 讨论
AD的Aβ致病假说已被广泛接受,认为Aβ在脑组织中的积聚是各种原因诱发AD的共同通路,也是AD形成和发生的关键因素。研究发现,APP基因595/596位点发生突变,导致细胞及动物脑内具有神经毒性的Aβ分泌量明显升高,表现出与AD患者类似的病理和临床特征,如大脑内局限性Aβ沉积、行为障碍及痴呆症状出现的早晚与年龄相关等[13-15]。本实验采用APP595/596基因转染小鼠皮层神经元,在体外构建AD细胞模型,经RT-PCR及Western blot法鉴定,转基因神经细胞过表达APP595/596基因,说明AD细胞模型制备成功。

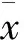
##P<0.01vsGFP group;**P<0.01vsAPP group

Fig 7 Ost inhibited miRNA-107 in neurons transfected with APP595/596 gene(±s,n=3)
##P<0.01vsGFP group;**P<0.01vsAPP group
课题组前期实验[16],考察了终浓度为10、50、100 μmol·L-1的Ost作用24 h,对过表达APP595/596的神经细胞的保护作用,发现50 μmol·L-1作用最佳。本实验选取50 μmol·L-1的Ost进行机制研究。结果显示,Ost能够明显提高神经元存活率,减少LDH的释放,并有效抑制神经元凋亡,说明Ost对转染APP595/596基因的神经元具有良好的保护作用。
BACE1是裂解APP产生Aβ的第一限速酶,AD患者大脑中BACE1的蛋白量和酶活力明显高于正常水平,通过抑制BACE1的活性,可以抑制APP水解生成Aβ,从而减少Aβ淀粉样斑块,改善损伤神经元突触的可塑性,提高学习记忆能力[17-18]。BACE1作为miRNA-107(一种内源性非编码RNA,能够通过靶基因的互补配对,抑制靶蛋白的表达)的靶基因之一,其mRNA的3′UTR区存在miRNA-107的结合位点,两者表达呈负相关[19]。研究表明,上调miRNA-107的表达能够减少Aβ斑块沉积,从而减少脑组织中神经纤维缠结[20]。为进一步研究Ost保护神经元的作用机制,作者分别采用免疫荧光化学法和RT-PCR法,检测转染APP595/596基因的小鼠神经元在给予Ost前后BACE1和miRNA-107的表达情况。实验结果显示,Ost明显降低BACE1的蛋白表达,升高miRNA-107的表达,说明Ost有可能通过提高miRNA-107表达来降低BACE1的蛋白表达,从而抑制了APP向Aβ水解,减少Aβ产生,进而改善细胞损伤,提高细胞活力,减少细胞凋亡和损伤,发挥保护神经细胞的作用。
(致谢:本实验是在辽宁中医药大学药学院杨静娴教授实验室完成,感谢教亚男、李少恒、王玉莹等同学的帮助!)
[1] Wilcock D M,Gharkholonarehe N,Van Nostrand W E,et al. Amyloid reduction by amyloid-beta vaccination also reduces mouse tau pathology and protects from neuron loss in two mouse models of Alzheimer′s disease[J].JNeurosci,2009,29(25): 7957-65.
[2] Tanzi R E,Bertram L. Twenty years of the Alzheimer′s disease amyloid hypothesis: a genetic perspective[J].Cell,2005,120(4): 545-5.
[3] Butterfield D A,Reed T,Newman S F,et al. Roles of amyloid beta-peptide-associated oxidative stress and brain protein modifications in the pathogenesis of Alzheimer′s disease and mild cognitive impairment[J].FreeRadicBiolMed,2007,43(5): 658-77.
[4] Mayeux R,Stern Y. Epidemiology of Alzheimer disease[J].NatRevNeurol,2011,2(8):137-52.
[5] 毕丹蕾, 文 朗, 熊 伟, 等. 阿尔茨海默病的可能药物靶点和临床治疗研究进展[J]. 中国药理学与毒理学杂志, 2015, 29(4): 507-36.
[5] Bi D L, Wen L, Xiong W, et al. Development of potential therapeutic targets of and approaches to Alzheimer′s disease[J].ChinJPharmacolToxicol,2015, 29(4): 507-36.
[6] 李 琳, 王晓良, 彭 英. 抗阿尔茨海默病天然产物及其药理学研究进展[J]. 中国药理学通报, 2016,32(2): 149-55.
[6] Li L, Wang X L, Peng Y. Pharmacological research of natural products in the treatment of Alzheimer′ s disease[J].ChinPharmacolBull, 2016,32(2):149-55.
[7] 郑立卿, 张 力, 董晓华, 等. 蛇床子素的药理作用研究进展[J]. 神经药理学报, 2013,3(6):33-9.
[7] Zheng L Q, Zhang L, Dong X H, et al. A review on the pharmacological effects and mechanismsof osthole[J].ActaNeuropharmacol,2013,3(6):33-9.
[8] Hu Y,Wen Q,Liang W,et al. Osthole reverses beta-amyloid peptide cytotoxicity on neural cells by enhancing cyclic AMP response element-binding protein phosphorylation[J].BiolPharmBull,2013,36(12): 1950-8.
[9] 教亚男, 姚璎珈, 孔 亮, 等. 蛇床子素对转染APP595/596基因的SH-SY5Y细胞的保护作用[J]. 中国病理生理杂志, 2015, 31(11): 2053-8.
[9] Jiao Y N, Yao Y J, Kong L, et al. Protective effect of osthole on SH-SY5Y cells transfected with APP595/596gene[J].ChinJPathophysiol, 2015, 31(11): 2053-8.
[10]Li S,Yan Y,Jiao Y,et al. Neuroprotective effect of osthole on neuron synapses in an Alzheimer′s disease cell model via upregulation of microRNA-9[J].JMolNeurosci,2016,60(1): 71-81.
[11]Kong L,Hu Y,Yao Y,et al. The coumarin derivative osthole stimulates adult neural stem cells, promotes neurogenesis in the hippocampus, and ameliorates cognitive impairment in APP/PS1 transgenic mice[J].BiolPharmBull,2015,38(9):1290-301.
[12]Yao Y,Gao Z,Liang W,et al. Osthole promotes neuronal differentiation and inhibits apoptosis via Wnt/β-catenin signaling in an Alzheimer′s disease model[J].ToxicolApplPharmacol,2015,289(3): 474-81.
[13]Kwok J B,Li Q X,Hallupp M,et al. Novel Leu723Pro amyloid precursor protein mutation increases amyloid beta42(43) peptide levels and induces apoptosis[J].AnnNeurol,2000,47(2): 249-53.
[14]Citron M, Oltersdorf T,Haass C,et al. Mutation of the β-amyloid precursor protein in familial Alzheimer′s disease increases β-protein production[J].Nature,1992,360(6405): 672-4.
[15]Reichwald J,Danner S,Wiederhold K H,et al. Expression of complement system components during aging and amyloid deposition in APP transgenic mice[J].JNeuroinflammation,2009,6:35.
[16]李少恒, 教亚男,姚璎珈, 等. 蛇床子素对感染APP基因的神经元突触的保护作用[J]. 中国药理学通报, 2015,31(10): 1383-8.
[16]Li S H, Jiao Y N, Yao Y J, et al. Neuroprotective effect of osthole on neuron synapses infected APP gene[J].ChinPharmacolBull,2015,31(10): 1383-8.
[17]Brodney M A,Barreiro G,Ogilvie K,et al. Spirocyclic sulfamides as β-secretase 1(BACE-1) inhibitors for the treatment of Alzheimer′s disease: utilization of structure based drug design, watermap, and CNS penetration studies to identify centrally efficacious inhibitors[J].JMedChem,2012,55(21): 9224-39.
[18]Kimura R,Devi L,Ohno M. Partial reduction of BACE1 improves synaptic plasticity, recent and remote memories in Alzheimer′s disease transgenic mice[J].JNeurochem,2010,113(1): 248-61.
[19]Wang W X,Rajeev B W,Stromberg A J,et al. The expression of microRNA miR-107 decreases early in Alzheimer′s disease and may accelerate disease progression through regulation of beta-site amyloid precursor protein-cleaving enzyme 1[J].JNeurosci,2008,28(5): 1213-23.
[20]Nelson P T, Wang W X. MiR-107 is reduced in Alzheimer′s disease brain neocortex: validation study[J].JAlzheimersDis,2010,21(1): 75-9.
Osthole reduced Aβ synthesis by up-regulating miRNA-107 in neurons transfected with APP595/596gene
XIAO Hong-he,JIAO Ya-nan,YAN Yu-hui,LI Hong-yan,YANG Jing-xian
(SchoolofPharmacy,LiaoningUniversityofTraditionalChineseMedicine,DalianLiaoning116600,China)
Aim To investigate the neuroprotective effects of osthole (Ost) on the primary cultured cortical neurons transfected with APP595/596gene and its underlying mechanism. Methods Neonatal mouse cortical neurons were transfected with APP595/596gene to establish AD cell models for the further study. Then, the cell viability was detected by CCK-8 assay, and the leakage of lactate dehydrogenase (LDH) was assayed by LDH kit to evaluate the injury degree. Transferase-mediated nick end labeling (TUNEL) was used to evaluate the cell apoptosis. The expression of β-amyloid peptide (Aβ) and β-site APP cleaving enzyme 1(BACE1) was measured by immunofluorescence, while the miRNA-107 was measured by RT-PCR. Results Compared to model group, Ost could significantly improve the neurons viability, decrease the LDH release and prevent the apoptosis. Ost also inhibited the expression of Aβ and BACE1 at protein level, while enhanced the expression of miRNA-107 at gene level. Conclusion Ost plays a neuroprotective role in neurons transfected with APP595/596gene in part through up-regulating miRNA-107.
AngelicaePubescentisRadix; osthole; Alzheimer’s disease; neuroprotection; beta-amyloid peptide; miRNA-107
2017-04-11,
2017-05-19
国家自然科学基金资助项目(No 81173580);辽宁省自然科学基金项目(No 201102144);沈阳市科技专项资金(No F11-264-1-42);辽宁省高等学校优秀人才支持计划(5组191号)
肖洪贺(1989-),男,硕士,助理实验师,研究方向:中药物质基础和作用机制,E-mail: xiaohh89@163.com; 杨静娴(1963-),女,博士,教授,博士生导师,研究方向:神经药理学,通讯作者,E-mail: jingxianyang@yahoo.com
时间:2017-7-7 11:04 网络出版地址:http://kns.cnki.net/kcms/detail/34.1086.R.20170707.1104.018.html
10.3969/j.issn.1001-1978.2017.08.009
A
1001-1978(2017)08-1079-07
R-332;R284.1;R329.25;R338.1;R745.702.2;R977.6