17β-雌二醇对绝经妇女牙槽成骨细胞生物活性的影响
2017-07-25宋立婷朱东望李佳珊吴陈炫蒋少云
宋立婷 朱东望 李佳珊 吴陈炫 蒋少云
17β-雌二醇对绝经妇女牙槽成骨细胞生物活性的影响
宋立婷 朱东望 李佳珊 吴陈炫 蒋少云
目的:本研究旨在观察雌激素对绝经妇女牙槽成骨细胞细胞增殖和活性、成骨分化、骨保护素(osteoprotegerin)和核因子κB受体(receptor activator of nuclear factor kappa B ligand,RANKL)的影响,为绝经妇女的牙周和种植治疗提供参考。方法:经患者知情同意,收集女性志愿者(年龄63-72岁)的牙槽骨,进行体外培养,获得牙槽成骨细胞。用不同剂量的17β-雌二醇(0.01nM、0.1nM和1nM)处理后,通过MTT和细胞计数、碱性磷酸酶活性、实时定量聚合酶链反应、von Kossa实验和酶联免疫吸附实验分别检测绝经妇女牙槽成骨细胞的增殖和活性、成骨分化、OPG和RANKL表达水平。结果:17β-雌二醇处理后,绝经妇女牙槽成骨细胞的细胞增殖和活性、碱性磷酸酶活性、骨钙素水平和矿化能力都明显增高,且具有17β-雌二醇浓度依赖性。同时,随17β-雌二醇剂量的增加,OPG表达升高,而RANKL的水平下降,OPG/RANKL比值明显升高。结论:17β-雌二醇可以增强绝经妇女牙槽成骨细胞的增殖和活性、促进成骨、改善牙槽骨再生的微环境,为绝经妇女的牙周骨再生治疗提供了重要参考。
牙槽骨;成骨细胞;17β-雌二醇;绝经
在正常情况下骨组织的形成和吸收处于一种平衡状态,是成骨细胞、破骨细胞、激素、细胞因子和生长因子等多种因素调节的结果。年龄相关的骨丧失是由于随着年龄的增长,这种平衡因成骨细胞的增殖、分化、活性以及寿命降低,破骨细胞的活性增强所打破[1,2]。研究表明老年人颅骨以及胸椎、腰椎椎体的成骨细胞的细胞增殖和成骨潜能都有下降[3-5]。同时,骨微环境中存在着多种影响骨祖细胞聚集和分化的因素,比如激素,与绝经妇女骨质疏松的发生密切相关。根据以前的研究,与绝经前相比,血清17β-雌二醇在绝经期间降低85-90%[6]。在动物模型中,卵巢切除后干骺端松质骨可减少73%[7]。而且雌激素可抑制成骨细胞、T细胞和B淋巴细胞产生核因子κB受体激动剂(receptor activator of nuclear factor kappa B ligand,RANKL)[8,9],促进成骨细胞的骨保护素(osteoprotegerin,OPG)的产生[10,11],导致RANKL/OPG比例改变,有利于骨吸收。
在我们前期研究中,已经证明了绝经妇女牙槽骨成骨细胞发生年龄相关的变化[1],其增殖,分化和矿化能力明显低于年轻成年妇女牙槽成骨细胞。同时,绝经妇女的雌激素水平明显降低。因而,本研究旨在探究雌激素是否可以克服绝经妇女牙槽骨成骨细胞的年龄相关变化,从而为这类人群的牙科临床治疗提供参考。
1.材料和方法
1.1 研究对象 经天津医科大学研究伦理委员会批准,经患者知情同意,对就诊于口腔颌面外科且需手术患者(如牙槽骨修整术等)收取少许废弃的牙槽骨。纳入研究的患者为非吸烟者,身体基本健康以及收集牙槽骨的部位没有炎症和肿瘤。共需收集5个绝经妇女牙槽骨(年龄63-72岁)。
1.2 细胞培养 获得的牙槽骨样本立即浸在无菌的Hank’s平衡盐溶液(Gibco,美国)中清洗。将其分别置于60mm培养皿(Corning Costar,美国)中,加入α-MEM培养基(含2mmol/m l L-谷氨酰胺、10%胎牛血清、100U/m l青霉素G、100mg/m l硫酸链霉素和0.25mg/m l两性霉素B) (Gibco,美国)。在细胞达到80%汇合时传代。第2-3代细胞用于实验。将细胞分成四组,分别用17β-雌二醇(0nM,0.01nM,0.1nM,1nM)(Sigma,美国)处理。灭活胎牛血清以消除其中的成分对实验的影响。
1.3 细胞活力 将细胞以4×104/m l的密度接种于96孔板(Corning Costar,美国)中,每个样样本设置六个副孔。将0.5mg/m l 3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(3-(4,5-dimethy l thiazol-2-y l)-2,5-dipheny ltetrazolium brom ide,MTT)(Sigma,美国)分别在1、3、5和7天加入到细胞中。37℃下培养4h。吸出上层液体,加入150μl二甲基亚砜(Sigma,美国),使结晶物充分溶解,在酶联免疫检测仪OD570nm测量各孔的吸光值。
1.4 细胞生长的测定 将细胞以2×104个细胞/孔的密度接种在24孔培养板中(Corning Inc,美国)中。24h后,用17β-雌二醇(0nM,0.01nM,0.1nM和1nM)处理细胞。每组设置四个重复孔。在1、3、5和7天的时候,用含有0.05%胰蛋白酶及0.02%EDTA的PBS收集细胞后,用Z2TMCou l t e r Coun t e r®细胞和粒子计数器(Be c kman Coulter,美国)进行计数。
1.5 碱性磷酸酶活性检测 在成骨分化培养基(α-MEM 培养基,50mmol/m l抗坏血酸,10nmol/m l地塞米松和10mmol/m l β-甘油磷酸酯)中培养。每组都设置三个重复孔。细胞生长7天后,收集细胞并用PBS洗涤两次,然后加入1% Triton X-100置于4℃裂解细胞。从每个裂解物中取出等分样本,加入r-硝基苯酚磷酸盐的2-氨基 -2-甲基 -1-丙醇缓冲液(Sigma,美国),37℃避光孵育1h,加入0.5N NaOH终止反应。通过分光光度计(Bio-tek,美国)读405nm处的吸光度。碱性磷酸酶活性通过细胞蛋白含量均化后,表示为OD值/h.mg蛋白。
1.6 逆转录和实时聚合酶链反应分析 将6孔板(Corning,美国)的细胞用不同剂量17β-雌二醇处理14天后,使用Trizol试剂(Invitrogen,美国)提取总RNA,然后根据试剂盒说明书使用SuperScriptTMIII第一链合成系统(Invitrogen,美国)逆转录成cDNA。使用SYBR®Prem ix实时PCR试剂盒(Invitrogen,美国)对骨钙素(osteocalcin,OCN)的m RNA表达进行实时聚合酶链反应。基因特异性引物是:OCN上游:ATGAGAGCCC TCACACTCCTCG,下游:GTCAGCCAACTC GTCACAGTCC;内参GAPDH上游:GCACCG TCAAGGCTGAGAAC,下游:ATGGTGGTGA AGACGCCAGT。扩增条件如下:预变性95℃5m in,变性95℃变性30s,退火58℃30s及延伸72℃30秒40个循环。
1.7 酶联免疫吸附实验 收取上述培养的上清液,根据试剂盒说明书(Bender Medsystem,美国)检测RANKL和OPG。将每个样本加入指定的孔中各50μl并用盖板盖好。室温孵育3h,将孔洗涤3次。然后,将底物加入孔中。避光室温10m in后,加入终止溶液终止反应。分光光度计(Bio-tek,美国)在450nm波长测定每个孔的吸光度值。
1.8 细胞矿化能力检测 使用Von Kossa测定法评估细胞的矿化能力。每组设6个副孔,用10mg/m l硝酸银溶液(Sigm a,美国)覆盖固定细胞,UV光下照射1h。漂洗后,加入50mg/m l硫代硫酸钠溶液(Sigma,美国)2m in,然后再次洗涤。磷酸盐沉积物染成黑色。选择每个孔中的四个视野计数染色的结节,结果用平均每孔染色结节数表示。
1.9 统计分析 每个实验至少重复两次。数据以平均值±标准差表示。用SAS V 8进行方差分析检验数据,P<0.05认为统计学意义。
2.结果
2.1 17β-雌二醇对绝经妇女牙槽成骨细胞增殖和活性的影响 随着体外培养时间延长,各组细胞增殖和活性逐渐增加。与空白对照相比,17β-雌二醇处理后绝经妇女牙槽成骨细胞的增殖和活性显著增加(P<0.05),呈现出17β-雌二醇浓度依赖性(如图1、图2)。
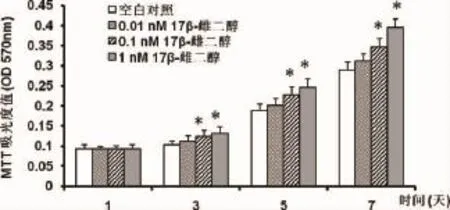
图1 MTT测定17β-雌二醇处理后绝经妇女牙槽骨成骨细胞的细胞活性结果表示为平均值±标准差
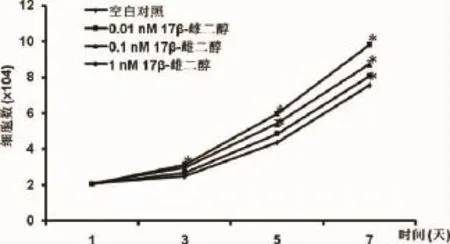
图2 计数细胞测定17β-雌二醇处理后绝经妇女牙槽骨成骨细胞的细胞增殖结果表示为平均值±标准差
2.2 17β-雌二醇对绝经妇女牙槽成骨细胞成骨分化的影响 17β-雌二醇对绝经妇女牙槽成骨细胞中ALP活性的影响结果显示:17β-雌二醇可以增加绝经妇女牙槽成骨细胞的ALP活性(P<0.05)(如图3)。同时,随着17β-雌二醇浓度的增加,ALP活性明显增加。
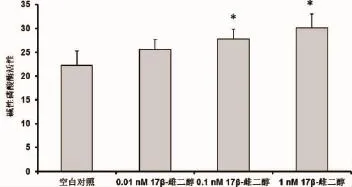
图3 17β-雌二醇处理后绝经妇女牙槽骨成骨细胞的碱性磷酸酶活性结果表示为平均值±标准差
17β-雌二醇可以增加绝经妇女牙槽成骨细胞中骨钙素m RNA水平(P<0.05),且具有浓度依赖性(如图4)。
此外,检测17β-雌二醇对绝经妇女牙槽成骨细胞矿化的影响显示:所有组中的绝经妇女牙槽成骨细胞可形成矿化结节。与对照组相比,0.01nM 17β-雌二醇对绝经妇女牙槽成骨细胞矿化能力无显著影响,然而,0.1nM和1nM 17β-雌二醇则可明显提高绝经妇女牙槽成骨细胞的矿化能力(P<0.05)(如图5)。

图5 Von kossa测定17β-雌二醇处理后绝经妇女牙槽骨成骨细胞的矿化结节数结果表示为平均值±标准差
2.3 17β-雌二醇对绝经妇女牙槽成骨细胞的OPG和RANKL的影响 与对照相比,17β-雌二醇可以刺激绝经妇女牙槽成骨细胞中OPG表达升高(P<0.05)(见图6,空白对照:108.33±15.42pg/m l;0.01nM 17β-雌二醇:118.26±10.16pg/m l;0.1nM 17β-雌二醇:134.22±13.76pg/m l;1nM 17β-雌二醇:157.66±12.34 pg/m l),但使RANKL表达降低(P<0.05)且具有浓度依赖性(见图7,空白对照:76.41±8.22 pg/m l;0.01nM 17β-雌二醇:70.88±7.56 pg/m l;0.1nM 17β-雌二醇:65.32±5.44 pg/m l;1nM 17β-雌二醇:60.01±6.33pg/m l)。绝经妇女牙槽成骨细胞经17β-雌二醇处理后,OPG/RANKL的比值增加(空白对照:1.42±0.10;0.01nM 17β-雌二醇:1.67±0.10;0.1nM 17β-雌二醇:2.05±0.13;1nM 17β-雌二醇:2.63±0.15)。此外,随着17β-雌二醇浓度的增加,OPG/RANKL比值增加越明显(见图8)。
3.讨论
口腔健康是维护人体健康以及生命质量的重要组成部分,晚年的幸福更加需要维护口腔健康[12]。据我们之前的一项调研发现,老年人牙周炎患病率高且严重,口腔卫生保健认知也不足,但大多都有意愿接受口腔卫生教育和检查及治疗[13]。因此这激发我们应更加关注老人牙周健康,提出针对他们特点的有效治疗方法。
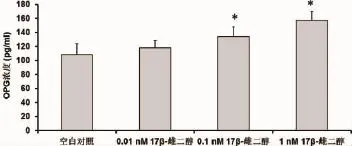
图6 酶联免疫吸附测定17β-雌二醇处理后绝经妇女牙槽骨成骨细胞OPG水平结果表示为平均值±标准差
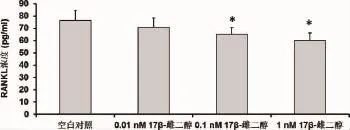
图7 酶联免疫吸附测定17β-雌二醇处理后绝经妇女牙槽骨成骨细胞的RANKL水平结果表示为平均值±标准差
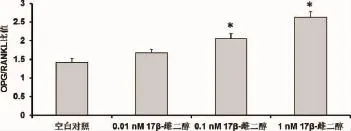
图8 17β-雌二醇处理后绝经妇女牙槽骨成骨细胞的OPG/RANKL比值结果表示为平均值±标准差
由于年龄的增长,妇女骨质疏松症或者其他骨流失疾病的发病率也增加。绝经后妇女的雌激素水平显着下降,这与骨质疏松症的发病有密切关系[14]。在一些研究中发现,雌激素或激素替代物可用来防止骨的丢失[15]。我们以前的研究发现,与年轻成年女性相比,老年妇女的AOBs寿命短,细胞活力低,ALP活性降低,骨形成能力也下降[1]。因此我们猜想绝经后妇女的雌激素缺乏可能在这些变化中起重要作用。
雌激素可以通过降低成骨细胞凋亡[16]以及体内和体外抑制成骨细胞中的糖皮质激素诱导的细胞凋亡来增加成骨细胞的寿命[17]。我们的研究结果显示雌激素可以增强绝经妇女牙槽成骨细胞的细胞活性和细胞增殖,这与其他研究结果一致[16,17]。绝经妇女牙槽成骨细胞的增殖能力下降与绝经后的雌激素减少有关。
雌激素可以促进骨髓间充质干细胞向成骨细胞分化。卵巢切除的小鼠,雌激素的终生治疗可完全阻止老龄小鼠胫骨骨干皮质骨矿化密度以及厚度的降低[18]。经皮给药高剂量雌激素后的老年妇女证实:雌激素可以刺激骨骼生长终止后的骨形成[19]。在我们的研究中,数据显示,雌激素可以克服绝经妇女牙槽成骨细胞的碱性磷酸酶活性下降、骨钙素的产生以及矿化能力的降低,这说明了绝经后妇女的雌激素缺乏导致的绝经妇女牙槽成骨细胞的年龄相关变化类似于其他骨骼骨中的成骨细胞。
碱性磷酸酶作为一种膜结合酶,在矿化过程中参与了羟基磷灰石晶体沉积的过程。骨钙素在成骨细胞分化的晚期表达,与矿化有关。随着年龄的增长,女性骨髓表达碱性磷酸酶的集落形成单位的数量明显减少[20]。此外,从我们以前的数据可知,绝经妇女牙槽成骨细胞中的碱性磷酸酶活性降低[1]。目前的数据显示,雌激素增加了碱性磷酸酶和骨钙素的水平,可以一定程度上解释用雌激素治疗后绝经妇女牙槽成骨细胞矿化增加的机制。
雌激素可改变骨形成的微环境。RANKL通常由骨髓基质/成骨细胞、T淋巴细胞和B淋巴细胞表达,可导致破骨细胞的聚集、活性增加以及破骨细胞凋亡减少[8,9]。OPG由成骨细胞产生和分泌,可中和RANKL在骨微环境中的功能。OPG/ RANKL比率决定骨形成或吸收的方向:OPG/ RANKL比例增加会导致骨形成,否则发生骨吸收。因此,我们检测了17β-雌二醇处理后OPG、RNAKL和OPG/RANKL比例的变化。如其它的研究所述[8-11],我们的数据表明17β-雌二醇可以增加OPG的表达,抑制RANKL的表达,OPG/ RANKL比值增加。因此,老年妇女的雌激素缺乏导致了OPG/RANKL比例的改变,有利于骨吸收,终将导致骨质疏松。同样雌激素的缺乏不利于牙槽骨的再生。我们的研究显示:雌激素替代物可能有助于牙周的治疗,例如在老年妇女的骨再生和骨植入中应用,但这仍需要进一步探索。
4.结论
17β-雌二醇不仅可以增强绝经妇女牙槽成骨细胞的细胞增殖、成骨分化和矿化能力,而且可以提高绝经妇女牙槽成骨细胞的OPG/RANKL比例,为绝经妇女牙周骨再生治疗提供重要的参考。
[1] Jiang SY,Shu R,Xie YF,et al.Age-related changes in biological characteristics of hum an alveolar osteob lasts[J].Cell Prolif,2010,43(5):464-470
[2] Zhang W,Ou G,Ham rick M,et al.Age-related changes in the osteogenic differentiation potential of m ouse bone m arrow strom al cells[J].J Bone M iner Res,2008,23(7):1118-1128
[3] de Pollak C,A rnaud E,Renier D,et al.Age-related changes in bone formation,osteob lastic cell proliferation,and differentiation during postnatal osteogenesis in human calvaria[J]. J Cell Biochem,1997,64(1):128-139
[4] D'Ippolito G,Sch iller PC,Ricordi C,et al.Age-related osteogenic potential of mesenchym al stromal stem cells from hum an vertebral bone m arrow[J].J Bone M iner Res,1999, 14(7):1115-1122
[5] Mueller SM,Glow acki J.Age-related decline in the osteogenic potential of human bone marrow cells cu ltured in th ree-dim ensional collagen sponges[J].J Cell Biochem,2001,82(4): 583-590
[6] Khosla S,A tkinson EJ,Melton LJ,et al.Effects of age and estrogen status on serum parathy roid hormone levels and biochem ical markers of bone turnover in w omen:a population-based study[J].J Clin Endocrinol Metab,1997,82(5): 1522-1527
[7] Baldock PA,Need AG,Moore RJ,et al.Discordance betw een bone turnover and bone loss:effects of aging and ovariectomy in the rat[J].J Bone M iner Res,1999,14(8): 1442-1448
[8] Clow es JA,Riggs BL,Khosla S.The role of the imm une system in the pathophysiology of osteoporosis[J].Imm unol Rev,2005,208:207-227
[9] Eghbali-Fatourech i G,Khosla S,Sanyal A,et al.Role of RANK ligand in mediating increased bone resorption in early postmenopausal w om en[J].J Clin Invest,2003,111(8): 1221-1230
[10]Hofbauer LC,Khosla S,Dunstan CR,et al.Estrogen stim ulates gene expression and protein production of osteoprotegerin in hum an osteob lastic cells[J].Endocrinology,1999,140 (9):4367-4370
[11]Khosla S,A tkinson EJ,Dunstan CR,et al.Effect of estrogen versus testosterone on circulating osteoprotegerin and other cy tokine levels in normal elderly men[J].J Clin Endocrinol Metab,2002,87(4):1550-1554
[12]刘洪臣,储冰峰.口腔健康是老年人全身健康的基础[J].中华老年口腔医学杂志,2013,11(3):129-131
[13]李 阳,曹雅婷,邓嘉胤,等.社区老年人牙周状况的认知调查及需求分析[J].中华老年口腔医学杂志,2016,14(4):203-207
[14]Stenderup K,Justesen J,Clausen C,et al.Aging is associated w ith decreased max im al life span and accelerated senescence of bone marrow strom al cells[J].Bone,2003,33(6):919-926
[15]Riggs BL,Khosla S,Melton LJ.Sex steroids and the construction and conservation of the adult skeleton[J].Endocr Rev,2002,23(3):279-302
[16]Genant HK,Cann CE,Ettinger B,et al.Quantitative computed tomography of vertebral spongiosa:a sensitive method for detecting early bone loss after oophorectomy[J].Annals of Internal Medicine,1982,97(5):3-8
[17]Gohel A,M cCarthy MB,Gronow icz G.Estrogen prevents g lucocorticoid-induced apoptosis in osteoblasts in vivo and in vitro[J].Endocrinology,1999,140(11):5339-5347
[18]Syed FA,Modder UI,Roforth M,et al.Effects of ch ronic estrogen treatm ent on modu lating age-related bone loss in female m ice[J].J Bone M iner Res,2010,25(11):2438-2446
[19]Lindsay R,Hart DM,A itken JM,et al.Long-term p revention of postm enopausal osteoporosis by oestrogen.Evidence for an increased bone m ass after delayed onset of oestrogen treatm ent[J].Lancet,1976,1(7968):1038-1041
[20]Luvizuto ER,Dias SM,Queiroz TP,et al.Osteocalcin immunolabeling during the alveolar healing process in ovariectom ized rats treated w ith estrogen or ralox ifene[J].Bone, 2010,46(4):1021-1029
The effects of 17β-estradiol on the biological activity of alveolar osteoblasts in postmenopausal women
SONG Li-ting,ZHU Dong-wang,LI Jia-shan,WU Chen-xuan,JIANG Shao-yun
(Department of Periodontology, Hospital of Stomatology,School of Dentistry,Tianjin Medical University,Tianjin 300070,China)
Objective:This study was to observe the biological characteristics of alveolar osteoblasts in postmenopausal women after 17β-estradiol treatment,in order to elucidate the function of estrogen onalveolar osteoblasts in postmenopausal women.Methods:Alveolar osteoblasts from postmenopausal women donors(aged 63-72 years)were cultured in vitro. A fter treated w ith 17β-estradiol(0.01 nM,0.1 nM,1 nM),alveolar osteoblasts in postmenopausal women were evaluated the proliferation and viability,osteogenic differentiation,osteoprotegerin(OPG)and receptor activator of nuclear factor kappa B ligand(RANKL)levels by using MTT and cell grow th assay,alkaline phosphatase assay,real-time polymerase chain reaction,von Kossa assay and enzyme-linked immunosorbent assay.Results:A fter treated w ith 17β-estradiol, alveolar osteoblasts in postmenopausal women showed obvious higher ability of cell proliferation and viability,alkaline phosphatase,osteocalcin and m ineralization,which increased in 17β-estradiol concentration-dependent manner.Meanwhile, the level of OPG increased and the level of RANKL decreased in 17β-estradiol dose-dependent manner,resulting in OPG/RANKL ratio increase.Conclusions:17β-estradiol could not only enhance osteoblasts proliferation and viability, osteogenic differentiation,but also improve the m icroenvironment of alveolar bone regeneration from postmenopausal women,which provides important information for bone regeneration of periodontal treatment in postmenopausal women.
alveolar bone;ssteoblasts;17β-estradiol;postmenopausal
R781.4
A
1672-2973(2017)03-0175-06
2017-01-26)
宋立婷 天津医科大学口腔医院牙周科 硕士生 天津 300070
朱东望 天津医科大学口腔医院口腔颌面外科 副主任医师 天津 300070
李佳珊 天津医科大学口腔医院牙周科 硕士生 天津 300070
吴陈炫 天津医科大学口腔医院牙周科 主治医师 天津 300070
蒋少云 通讯作者 天津医科大学口腔医院牙周科 主任医师 教授 天津 300070
