低氧激活HIF-1α对人牙周膜成纤维细胞增殖与凋亡的影响*
2017-07-25庞静雯吴亚霖庄秀妹
庞静雯 吴亚霖 徐 婷 庄秀妹
低氧激活HIF-1α对人牙周膜成纤维细胞增殖与凋亡的影响*
庞静雯 吴亚霖 徐 婷 庄秀妹
目的:初步探讨低氧环境对人牙周膜成纤维细胞(periodontal ligament cells,PDLCs)增殖与凋亡的影响,以及低氧诱导因子-1α(hypoxia inducible factor-1α,H IF-1α)在该过程中的作用。方法:体外常氧条件和低氧(1%O2)条件下培养PDLCs,采用四甲基偶氮唑盐(MTT)法检测低氧诱导前后PDLCs生长速度的差异;流式细胞术比较PDLCs凋亡水平的变化。W estern免疫印迹和实时定量PCR检测H IF-1α的表达水平。通过小干扰RNA(H IF1α-Si)转染PDLCs,检测低氧诱导下H IF-1α水平、细胞活性以及细胞凋亡水平的变化。结果:人PDLCs在低氧环境中培养48h后细胞活性显著抑制,凋亡水平增高,H IF-1α在蛋白和mRNA水平均显著升高。小干扰RNA(siRNA)转染PDLCs并于低氧下培养后HIF-1α表达明显降低,同时细胞活性增加、细胞凋亡显著下降。结论:低氧能通过上调H IF-1α表达抑制PDLCs增殖并促进其凋亡。
人牙周膜成纤维细胞;低氧;增殖与凋亡;低氧诱导因子-1α
慢性牙周炎是人类常见的口腔疾病,可造成牙松动、移位,最终导致牙丧失。牙周膜成纤维细胞(periodontal ligament cells,PDLCs)是牙周韧带中的主要功能细胞,参与合成基质、胶原、弹力纤维和糖蛋白,并通过吸收胶原吞噬异物控制牙周膜的体内平衡及完整结构,使牙周膜功能状态良好[1]。PDLCs数量减少或结构破坏均可导致牙周支持组织损伤,诱导或加重牙周组织疾病[2]。
近年来许多学者发现,厌氧菌、咬合创伤、吸烟以及炎症本身均能造成牙周微环境的局部缺血与低氧状态[3]。氯化钴化学模拟的低氧可抑制人PDLCs增殖并促进其凋亡[2]。低氧诱导因子-1α(Hypox ia inducible factor-1α,H IF-1α)作为最主要的低氧应答调控因子,在调节氧诱导的基因表达中具有关键作用[4]。牙周炎患者的牙周组织中H IF-1α表达水平相较于正常人显著升高[5]。目前,低氧是否通过H IF-1α调控PDLCs的增殖与凋亡尚不明确。因此,本研究利用低氧培养箱培养的方法比较常氧环境和低氧(1%O2)环境对PDLCs细胞增殖及凋亡的影响,通过小干扰RNA敲低技术探讨H IF-1α在该过程中的作用。
1.材料与方法
1.1 主要试剂及仪器 胰酶、FBS、DMEM培养基(Gibco公司,美国)。小鼠抗人H IF-1α、GAPDH单克隆抗体、HRP标记的山羊抗小鼠二抗(Proteintech公司,美国);反转录试剂盒、荧光定量PCR试剂盒(Takara公司,日本);四甲基偶氮唑盐(MTT)(Sigma-A ldrich公司,美国);细胞凋亡试剂盒(联科生物,中国);其余化学试剂为国产分析纯产品。常氧组CO2细胞培养箱(5%CO2) (Thermo,美国),低氧组CO2细胞培养箱(5%CO2、1%O2)为英国New Brunsw ick生产的GALAXY 48R型号CO2培养箱。
1.2 PDLCs的原代培养 选择15-22岁患者因正畸需要拔出的前磨牙,拔出时牙根完整,且无牙周、牙体、牙髓、根尖病变,取得患者知情同意。具体方法如下[6,7]:去除根端血迹,刮取根中1/3牙周膜组织,采用组织块法以含20%胎牛血清(FBS)、1∶100双抗的DMEM培养基原代培养PDLCs。约第6天细胞生长达80%,胰酶消化传代,后继续于含10%FBS、1∶100双抗的DMEM培养基中培养,取前5代PDLCs用于实验。
1.3 四甲基偶氮唑盐(MTT)细胞活性检测 将PDLCs以5×103个/孔接种于96孔板中,按实验分组及时间梯度分别置于常氧或低氧(1%O2)培养箱培养,按时间点每孔加入20μL MTT溶液继续培养4h,去除培养液,每孔加入150μL DMSO后置于摇床上低速振荡10 m in,使结晶物充分溶解。在酶联免疫检测仪OD 490nm处测量各孔的吸光值。该实验重复三次。
1.4 细胞凋亡实验 收集经低氧及siRNA处理后PDLCs上清液及细胞,PBS洗2次,用1× binding buffer调整细胞浓度为1×106-7个/m L,取200μL细胞悬液,加入5μL Annexin V-APC后避光孵育15m in,再加入10μL PI,混匀后上机检测。
1.5 W estern免疫印迹 分别按分组收集经低氧及siRNA处理后PDLCs的裂解蛋白进行抽提并定量。取等量总蛋白于沸水中煮7 m in,以8% SDS-PAGE电泳分离后,将凝胶上的蛋白经转至PVDF膜上,用5%脱脂奶粉2h,分别加入一抗4℃孵育过夜,之后转入HRP标记的二抗室温孵育2 h,ECL化学发光显影扫描。
1.6 实时定量PCR 收集的细胞用Trizol裂解细胞,提取总RNA,紫外分光光度计测量RNA含量。取1μg RNA合成cDNA,按Takara公司Quant SYBR Green PCR kit试剂操作说明进行扩增。应用Primer Prem ier 5.0软件设计Real-time PCR引物,H IF-1α引物序列为:Forw ard 5’-GTGCCACATCATCACCATA-3’,Reverse 5’-CAAAGCGACAGATAACACG-3’。内参GAPDH序列为:Forw ard 5’-ACCCAGAAGACTGTGGA TGG-3’,Reverse 5’-CTGGACTGGACGGCAGA TCT-3’。按公式计算求得各样品基因相对表达量。对照组基因相对表达量为1。
1.7 细胞转染 H IF1α-siRNA、NC-siRNA均购自上海吉玛生物科技公司,H IF1α-Si1靶序列为5’-CTGATGACCAGCAACTTGA-3’,H IF1α-Si2靶序列为:5’-GGAAATGAGAGAAATGCT TAC-3’,NC-siRNA靶序列为:5’-AATTCTC CGAACGTGTCACGT-3’。
根据说明在六孔板中使用 Lipofectam ine RNA iMAX Transfection Reagent转染PDLCs,并设计阴性对照siRNA为NC-Si组,终浓度为50nM,培养48h,提取蛋白、RNA并进行后续研究。
1.8 统计学处理 数据以表示。各实验至少重复3次,采用SPSS13.0软件包分析结果。对两组实验数据进行校正t检验,若P<0.05则差异被视为有统计学意义。
2.结果
2.1 低氧抑制PDLCs增殖 分别比较常氧和低氧(1%O2)状态下PDLCs培养12h、24h、48h和72h后增殖情况,MTT结果显示和常氧组相比,PDLCs低氧培养12h与24h后光密度值略有升高,说明短时间内低氧刺激可能促进PDLCs增殖,然而结果不具统计学差异(12 h组:t=0.574,P= 0.597;2 4h组:t=0.479,P=0.657)。于低氧继续培养至48h和72h,低氧组PDLCs光密度值较常氧组显著下降,结果具统计学差异(48h组:t=2.900,P=0.044;72h组:t=6.187,P=0.004),说明较长时间后低氧抑制PDLCs增殖(图1)。

图1 MTT法检测不同时间点低氧对人PDLCs细胞活性的影响(*:P<0.05,与同一时间点低氧组与常氧组比较)
2.2 低氧促进PDLCs凋亡 分别收集常氧和低氧状态下培养48 h后PDLCs进行流式细胞凋亡检测,结果显示:相比常氧组,PDLCs经低氧培养48h后凋亡细胞数目明显增加,差异具有统计学意义(t=9.219,P=0.001),说明低氧促进PDLCs凋亡(图2)。
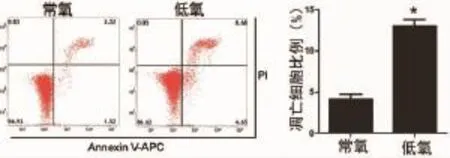
图2 流式细胞凋亡检测低氧对人PDLCs细胞凋亡的影响(*:P<0.05)
2.3 低氧促进PDLCs中H IF-1α表达 进一步探讨低氧抑制PDLCs增殖及促进其凋亡的可能机制,Western免疫印迹证实PDLCs在低氧状态下培养48h后较常氧组中H IF-1α表达显著上调(灰度值:常氧组(84.53±8.58);低氧组(178.33± 10.03);t=9.683,P<0.001);同时实时定量PCR也在mRNA水平进一步证实低氧状态下PDLCs中H IF-1α表达上升3.84倍(t=8.488,P<0.001),提示H IF-1α可能与低氧抑制PDLCs增殖及促进其凋亡相关(图3)。

图3 低氧培养48 h后PDLCs中H IF-1α蛋白和mRNA水平变化(*:P<0.05)
2.4 敲低H IF-1α后可逆转低氧对PDLCs增殖的抑制作用及凋亡的促进作用 为了进一步证实H IF-1α在低氧抑制PDLCs增殖及促进其凋亡中的重要作用,通过小干扰 RNA(siRNA)转染H IF1α-siRNA到PDLCs中敲低H IF-1α表达。W estern免疫印迹证实PDLCs中H IF1α-Si转染组相比于阴性对照NC-Si组H IF-1α表达显著下降;实时定量PCR进一步也在mRNA水平证实H IF1α-Si1、Si2组较NC-Si组H IF-1α表达分别下降 65.67%(t=8.662,P=0.002)与 66.67%(t= 7.357,P=0.002)(图4)。
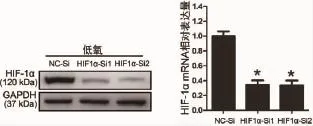
图4 敲低H IF1α后低氧下PDLCs中H IF-1α蛋白和m RNA水平变化(*:P<0.05,与NC-Si组比较)
将各组细胞继续在低氧培养箱中培养48h,MTT检测发现H IF1α-Si1、Si2组中PDLCs光密度值较NC-Si组分别升高2.52倍(t=8.757,P= 0.001)与2.49倍(t=8.228,P<0.001),差异具有统计学意义,说明敲低H IF-1α后可逆转低氧对PDLCs增殖的抑制作用(图5)。流式细胞凋亡检测结果显示,相比NC-Si组,H IF1α-Si1、Si2组中PDLCs经低氧培养48 h后凋亡细胞数目分别减少46.43%(t=5.224,P=0.006)与 41.53%(t=5.434,P=0.006),具有统计学差异,说明敲低H IF-1α后可逆转低氧对PDLCs凋亡的促进作用(图6)。
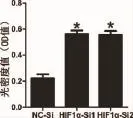
图5 敲低H IF1α后低氧对PDLCs细胞活性的影响(*:P<0.05,与NC-Si组比较)

图6 敲低H IF1α后低氧对PDLCs细胞凋亡的影响(*:P<0.05,与NC-Si组比较)
3.讨论
PDLCs是牙周结缔组织的主要间质细胞,在牙周组织的形成、再生以及维持牙周膜组织的完整中起着关键作用。PDLCs增殖、凋亡和分裂是牙周组织破坏和重建的重要病理生理过程[8]。牙周疾病治疗的理想目标是牙周组织再生,组织再生的基础包括牙周膜细胞数量的增加和活力、分化能力的增强[9]。因此,探讨影响PDLCs增殖与凋亡的因素以及有效的干预方法对于慢性牙周炎的防治具有重要意义。
慢性牙周炎患者的牙周组织毒物质堆积、毛细血管供血不足等因素易造成牙周微环境的局部低氧[10]。低氧及炎症可诱导局部细胞和组织通过血管内皮生长因子表达增高、无氧代谢等途径增加局部氧供给和减少氧消耗,使之产生适应性调节反应[10,11]。然而,慢性牙周炎患者长时间的低氧牙周微环境导致PDLCs数量减少和结构破坏,引起牙周支持组织损伤,诱导或加重牙周组织疾病[12]。本研究中PDLCs在低氧(1%O2)条件下培养12h、24h后较常氧组并未减少,甚至稍有增加;然而继续培养至48h、72h时发现显著抑制了细胞增殖,活力下降、凋亡增加。说明低氧时间越长导致细胞存活率逐渐降低,据此我们推测长时间低氧环境是导致慢性牙周炎进展的重要原因。
目前实验性低氧方法主要包括低氧培养箱培养细胞、加入铁螯合剂的化学方法两种[13]。Song等[2]通过在细胞培养液中加入铁的螯合剂氯化钴阻断氧信号的转导,模拟低氧信号传给细胞,并证实氯化钴化学模拟的低氧可抑制人PDLCs增殖并促进其凋亡。本研究利用低氧培养箱培养PDLCs,低氧培养箱相对于普通培养箱单一的CO2注入通道多了一个外接空气通道,通过软件程序设定所需O2浓度,结合这一个外接通道持续注入N2以排除多余O2,培养箱内O2浓度可达到精度±0.1%。因此,该实验因素更单一、更可控,同样证实了低氧对人PDLCs增殖的抑制作用与凋亡的促进作用,同时低氧促进H IF-1α高表达。此外,该方法更有利于小干扰RNA(H IF1α-Si)转染后对PDLCs细胞活性及凋亡水平变化的检测。
H IF-1α是一个广泛存在于哺乳动物细胞内的低氧应答调控因子,可通过调节氧诱导基因的表达维持低氧下细胞存活和组织中的氧稳态[14]。除了保护性反应,H IF-1α在不同细胞与不同实验条件下表现出抗凋亡或凋亡作用,特别在严重或长时间低氧时,H IF-1α可诱导促凋亡基因的表达[3,15]。本研究中低氧抑制PDLCs增殖并促进其凋亡时伴随H IF-1α表达上升,小干扰RNA(H IF1α-Si)敲低H IF-1α表达后可逆转低氧对PDLCs增殖的抑制作用及凋亡的促进作用,从正反两个方面说明了低氧状态下H IF-1α对PDLCs的促凋亡作用。有研究发现H IF-1α和Caspase3表达之间存在相关性,牙周炎的组织破坏以Caspases介导的凋亡为特征[16]。也有研究发现低氧可以通过H IF-1α介导的BNIP蛋白和m TOR促进细胞发生自吞噬并促进细胞凋亡[2]。因此,H IF-1α介导低氧促PDLCs凋亡与牙周炎进展的具体信号通路及机制需进一步探讨。
综上,本研究在PDLCs中证实低氧能抑制PDLCs增殖并促进其凋亡,敲低H IF-1α表达是逆转低氧对PDLCs增殖抑制及凋亡促进的关键。牙周低氧微环境促进牙周炎进展,H IF-1α是低氧影响牙周组织的重要调控因子,如何克服牙周局部低氧环境以及靶向降低细胞H IF-1α表达药物的研制应用将是今后研究的重点。
[1] 李 松,宋忠臣,束 蓉.低氧及低氧诱导因子-1与牙周炎[J].牙体牙髓牙周病学杂志,2013(11):729-733
[2] Song Z C,Zhou W,Shu R,et al.Hypox ia induces apoptosis and autophagic cell death in hum an periodontal ligam ent cellsth rough H IF-1alpha pathw ay[J].Cell Prolif,2012,45(3): 239-248
[3] Li J P,Li F Y,Xu A,et al.Lipopolysaccharide and hypox ia-induced H IF-1 activation in human gingival fibrob lasts [J].J Periodontol,2012,83(6):816-824
[4]Takedachi M,Iyama M,Saw ada K,et al.Hypoxia-inducible factor-1alpha inhibits interleukin-6 and-8 production in gingival epithelial cells during hypox ia[J].J Periodontal Res, 2017,52(1):127-134
[5] Ng K T,Li J P,Ng K M,et al.Expression of hypox ia-inducib le factor-1alpha in human periodontal tissue[J].J Periodontol,2011,82(1):136-141
[6]王 珺,欧 龙,罗 芸,等.茶多酚对脂多糖诱导人牙周膜成纤维细胞凋亡及炎症因子的影响[J].中华老年口腔医学杂志,2015(2):80-84
[7]汤楚华,施生根,牛忠英,等.压力作用时间对人牙周膜成纤维细胞合成TGF-β1的影响[J].口腔颌面修复学杂志,2011(3): 153-155
[8]余立强,刘洪臣,吴 霞,等.人牙周膜成纤维细胞对甲硝唑摄取机制的研究[J].中华老年口腔医学杂志,2009(2):71-75
[9] Aukkarasongsup P,Haruyam a N,Matsumoto T,et al.Periostin inhibits hypox ia-induced apoptosis in hum an periodontal ligam ent cells via TGF-beta signaling[Z].2013,441:126-132
[10]Amem iya H,Matsuzaka K,Kokubu E,et al.Cellular responses of rat periodontal ligam ent cells under hypox ia and re-oxygenation conditions in vitro[J].J Periodontal Res, 2008,43(3):322-327
[11]Li L,Han M X,Li S,et al.Hypox ia regulates the proliferation and osteogenic differentiation of human periodontal ligament cells under cyclic tensile stress via m itogen-activated protein kinase pathw ays[J].J Periodontol,2014,85(3):498-508
[12]Zhang H Y,Liu R,Xing Y J,et al.Effects of hypox ia on the proliferation,m ineralization and u ltrastructure of hum an periodontal ligament fibroblasts in vitro[J].Exp Ther Med, 2013,6(6):1553-1559
[13]董家辰,宋忠臣,束 蓉,等.低氧对牙周膜成纤维细胞增殖和成骨分化的影响[J].上海口腔医学,2014(4):397-401
[14]Motohira H,Hayashi J,Tatsum i J,et al.H ypox ia and reoxygenation augm ent bone-resorbing factor production from human periodontal ligament cells[J].J Periodontol,2007,78 (9):1803-1809
[15]Yu X J,Xiao C J,Du YM,et al.Effect of hypox ia on the exp ression of RANKL/OPG in human periodontal ligament cells in vitro[J].Int J Clin Exp Pathol,2015,8(10):12929-12935
[16]闫瑞欣,陈 丹,闫 奇,等.缺氧环境对牙周膜成纤维细胞增殖及凋亡的影响[J].北京口腔医学,2016(3):146-149
Effect of hypoxic condition on proliferation and apoptosis of human periodontal ligament cells via hypoxia inducible factor-1α
PANG Jing-wen,WUYa-lin,XU Ting,ZHUANGXiu-mei
(Guangzhou Haizhu DistrictHospitalofStomatology,Guangzhou 510220,China)
Objective:To investigate the effect of hypoxia on proliferation and apoptosis in human periodontal ligament cells(PDLCs),and the role of HIF-1α in this process.M ethods:PDLCs were cultured under hypoxia(1%O2)or normoxia. MTT was used to detect cell viability of PDLCs treat w ith or w ithout hypoxia.Effect of hypoxia on apoptosis of PDLCs was detected by Annexin V-APC on a flow cytometer.Western blot and qRT-PCR were used to detect expression of HIF-1α at protein and mRNA level respectively.HIF-1(HIF1)was transfected into PDLCs by small interfering RNA.HIF-1α,cell viability,as well as apoptosis,were furthered detected in PDLCs.Results:In the hypoxic environment,the activity of PDLCs was significantly inhibited after 48 h of culture.The level of apoptosis was increased,and the levels of HIF-1 protein and mRNA were significantly increased A fter knocking down of HIF-1α w ith siRNA,HIF-1α was significantly downregulated in PDLCs under hypoxia,as well as increased cell viability but decreased apoptosis.Conclusion:Hypoxia inhibits proliferation and promotes apoptosis of PDLCs via upregulated HIF-1α.
Periodontal ligament cells;Hypoxia;Proliferation and apoptosis;Hypoxia inducible factor-1α
R781.4
A
1672-2973(2017)03-0170-05
2016-12-21)
国家自然科学基金青年基金项目(项目编号:81600899)
庞静雯 广州市海珠区口腔医院 硕士生 主治医师广东 510220
吴亚霖 广州市海珠区口腔医院 硕士生 医师 广东510220
徐 婷 广州市海珠区口腔医院 硕士生 主治医师广东 510220
庄秀妹 通讯作者 中山大学附属孙逸仙纪念医院口腔科硕士生 主治医师 广东 510220
