番茄胞嘧啶甲基转移酶同源基因SlMET1功能研究
2017-07-24曹徐绿唐晓凤刘永胜合肥工业大学食品科学与工程学院安徽合肥230009
曹徐绿, 唐晓凤, 苗 敏, 刘永胜(合肥工业大学 食品科学与工程学院,安徽 合肥 230009)
番茄胞嘧啶甲基转移酶同源基因SlMET1功能研究
曹徐绿, 唐晓凤, 苗 敏, 刘永胜
(合肥工业大学 食品科学与工程学院,安徽 合肥 230009)
真核生物中,DNA甲基化作为表观遗传学修饰的重要手段之一,影响了植物的大量生长发育过程。文章通过生物信息学分析确定番茄中的胞嘧啶甲基转移酶同源基因(SlMET1)并对其进行进化关系的分析;利用聚合酶链式反应(polymerase chain reaction,PCR)技术从番茄cDNA中扩增出胞嘧啶甲基转移酶同源基因(SlMET1)全长,构建SlMET1与绿色荧光蛋白融合表达载体,通过在烟草瞬时表达系统,对其进行亚细胞定位;实时定量PCR分析SlMET1基因在番茄不同组织中的表达模式;同时,构建SlMET1与HA标签蛋白融合表达载体,通过免疫共沉淀分析其与DDB1的相互关系。研究结果表明:SlMET1基因在番茄各个时期和组织中都有表达,其中,叶片和花中表达量较高,在果实的变色期和红果时期表达量较低;通过绿色荧光融合蛋白载体的表达,确定SlMET1基因只在番茄细胞核中表达;通过免疫共沉淀分析确定SlMET1和DDB1之间存在相互作用。该研究为研究DDB1以表观遗传学的方式调控植物生长发育过程奠定了理论基础。
SlMET1基因;过量表达;转基因番茄;聚合酶链式反应(PCR);亚细胞定位;免疫共沉淀
表观遗传学是指基因表达发生可遗传的变化,但是基因的DNA序列不发生变化。基因调节的表观遗传学修饰包括组蛋白修饰、DNA甲基化、ATP依赖的染色质重构、组蛋白变异体的替代以及非编码RNA的调节。DNA 甲基化是指在DNA甲基化转移酶的作用下,在基因组CpG 二核苷酸的胞嘧啶第5位碳 (C5) 共价结合一个甲基基团。在多细胞真核生物中,DNA甲基化是表观遗传学上影响大量生物学过程的转录抑制机制之一,如发育、肿瘤发生等[1-3]。在动物中最初发现DNA甲基化发生在CG序列位点,后来在植物中DNA甲基化发生在CG、CHG和CHH序列位点上(H为A或C或T)[1,4]。
拟南芥中至少有3类胞嘧啶甲基转移酶,它们在蛋白结构和功能上不同。MET1家族是老鼠Dnmt1 甲基转移酶的同系物,它的主要功能是维持CG序列位点甲基转移酶活性,而且也在起始甲基化上起作用[5]。CMT3 甲基转移酶是植物中所独有的,它主要对异染色质上的DNA进行甲基化[6],主要维持CHG序列位点的甲基化。剩余的一类甲基转移酶 (DRM) 类似于人类的Dnmt3甲基转移酶,是假定的起始甲基转移酶以及维持CHH序列位点的甲基化[6]。
SlMET1 由N端调节结构域和C端催化结构域组成,N端结构域包含一些假定的信号基序,如核定位、BAH结构域(bromo-adjacent homology domain)、锌指和丝氨酸富集区域[7]。拟南芥中,met1和ddm1突变体会影响CG甲基化的维持,从而导致严重、多变的发育缺陷,表明DNA甲基化能影响许多发育过程中的基因。例如met1突变体引起FWA转录因子过量表达,导致显性的、可遗传的迟开花表型[8-10]。烟草中,NtMET1在细胞分裂时期与Ran GTP酶共定位于染色质附近,表明其在有丝分裂过程中扮演着重要的作用[7]。
紫外损伤DNA结合蛋白(DDB1)最初是作为紫外损伤DNA的核因子被发现[11],近年来的研究表明,DDB1能与CUL4形成E3连接酶复合体参与许多生理和发育过程,如转录、细胞周期、细胞死亡[12-13]、光形态建成[14]、ABA信号途径[15]、开花时间[16]等。目前还发现CUL4-DDB1 E3连接酶复合体参与表观遗传学修饰。在红面包菌中,CUL4-DDB1 E3连接酶可以调节组蛋白甲基化和DNA甲基化[17]。本课题组以及前人的研究也发现,DDB1以表观遗传学方式调控细胞分裂、果实发育以及叶片光合色素的代谢合成[18-19]。但是DDB1参与表观遗传学的机制仍然不清楚,为了探讨DNA甲基化与DDB1协同调控植物生长发育途径中的生理生化过程,通过番茄数据库(Sol Genomics Network,SGN)找到与拟南芥胞嘧啶甲基转移酶MET1同源性较高的序列,即番茄SlMET1。本研究将番茄SlMET1作为研究对象,通过生物信息学分析、基因表达方式、亚细胞定位等相关分子生物学分析,对SlMET1的基本性质以及进化关系进行分析,观察其细胞定位,同时阐明了SlMET1与DDB1的相互作用,对进一步深入了解SlMET1或DNA甲基化在植物发育过程中所起的作用以及DDB1参与调控表观遗传学修饰的机制具有重要的意义。
1 材料与方法
野生型番茄(SolanumlycopersicumMill.CV.Ailsa Craig)由美国康奈尔大学Thompson 植物研究所提供;野生型烟草(Nicotianabenthamiana)由美国爱达荷大学Fangming Xiao 教授提供;大肠杆菌(E.Coli)菌株、根癌农杆菌(A.tumefaciens)菌株EHA105 和GV2260 以及植物瞬时表达载体pBTEX 和荧光表达载体pART27-GFP 由合肥工业大学食品科学与工程学院保存[20]。中间载体pEASY-Blunt、Taq 酶、限制性内切酶、高保真DNA聚合酶、T4连接酶、反转录试剂盒购于Transgen 公司;TRIZOL 购自Invitrogen 公司;引物合成和测序由上海捷瑞生物技术有限公司完成;HA、Flag抗体购于Roche公司。
1.1SlMET1基因的生物信息学分析
在美国国立生物技术信息中心(National Center for Biotechnology Information,NCBI)数据库中比对出与拟南芥MET1蛋白序列高度同源的番茄蛋白质序列,命名为SlMET1。利用生物信息学工具分析该基因可能的功能结构域及其进化关系。搜索番茄SlMET1基因编码的蛋白质序列在10种其他物种中的同源序列,包括拟南芥(Arabidopsisthaliana,GenBank登录号NP-199727.1)、甜橙(Citrussinensis,GenBank登录号NP-001275841.1)、胡萝卜(Daucuscarota,GenBank登录号AAC39355.1)、巨桉(Eucalyptusgrandis,GenBank登录号KCW54050.1)、烟草(Nicotianasylvestris,GenBank登录号NP-001289530.1)、胡杨(Populuseuphratica,GenBank登录号XP-011005572.1)、蓖麻(Ricinuscommunis,GenBank登录号XP-002518029.1)、芝麻(Sesamumindicum,GenBank登录号XP-011092241.1)、可可(Theobromacacao,GenBank登录号XP-007048602.1)、葡萄(Vitisvinifera,GenBank登录号IXP-002267200.1),通过ClustalX 1.81进行多重序列比对;使用MEGA 5.0软件,采用邻接法(neighbor-joining,NJ)绘制系统发育树。
1.2SlMET1基因全长的克隆
根据番茄中SlMET1基因的序列(GenBank:登录号NM 001247819.1)和植物表达载体pBI121的多克隆位点,利用Prime primer 5.0软件设计特异全长扩增的外侧引物SlMET1-F1/R1 和带有相应酶切位点和保护碱基的内侧引物SlMET1 F2/R2,见表1所列。

表1 用于PCR扩增的寡核苷酸引物
第1轮聚合酶链式反应(polymerase chain reaction,PCR)以反转录获得的cDNA的第1链为模板,外侧引物作为引物进行扩增。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min 30 s,31个循环;72 ℃ 5 min;第2轮PCR用内侧引物进行扩增,模板则为第1轮PCR的产物。PCR反应条件:94 ℃ 5 min;94 ℃ 30 s,60 ℃ 30 s,72 ℃ 2 min 30 s,31个循环;72 ℃ 5 min。用1% 的琼脂糖电泳进行检测,得到带特异性酶切位点的目的基因(4 680 bp)。将PCR产物与pEASY-Blunt载体连接,对连接产物进行大肠杆菌(DH5α)转化,挑单克隆后进行PCR鉴定和双酶切鉴定,然后进行测序。测序结果用DNAMAN软件进行分析。最后,将测序正确的重组质粒进行限制性内切酶的酶切反应,将目的片段SlMET1回收。
1.3 SlMET1绿色荧光蛋白表达载体的构建
根据SlMET1基因的核苷酸序列设计含有KpnⅠ和EcoRⅠ酶切位点的引物SlMET1-GFP-F 和SlMET1-GFP-R,扩增SlMET1基因片段(不含终止密码子TAG)。目的基因片段、pART27-GFP载体和pBTEX-HA载体分别经限制性内切酶KpnⅠ和EcoRⅠ酶切,回收目的基因和载体片段,经T4连接酶连接后转化至大肠杆菌感受态DH5a,培养筛选出抗性菌落,提取质粒并酶切鉴定后,送出测序;从而得到与绿色荧光蛋白融合表达的植物表达载体pART27-SlMET1-GFP和烟草瞬时表达载体pBTEX-SlMET1-HA。
1.4 亚细胞定位
将已构建好的SlMET1绿色荧光蛋白表达载体和绿色荧光蛋白空载体通过冻融法转入农杆菌GV2260中,培养后所得抗性克隆经PCR鉴定为阳性,保存阳性克隆供后续实验使用。
[21] 将携带有pART27-SlMET1-GFP质粒和pART27-GFP 质粒的农杆菌于28 ℃培养过夜,转接后再培养6~8 h,诱导农杆菌并28 ℃ 培养12 h。将稀释为OD=0.6 菌液注射在4周大的烟草叶片上进行瞬时表达,48 h后,取注射叶片部分的表皮在激光共聚焦显微镜(OLYMPUS FV1000-IX81)下进行观察。
1.5 野生型植物SlMET1基因表达模式分析
为了研究番茄SlMET1基因表达的组织差异性,分别采摘野生型根、茎、叶、花和不同时期的果皮(授粉后7、14、35 d、变色期、成熟期),用Trizol法提取番茄总RNA,反转录合成cDNA。以番茄Ubiquitin3(UBI3,GenBank 登录号X58253)为内参基因,扩增引物为UBI3-RT-F,UBI3-RT-R;SlMET1基因的扩增引物为SlMET1-RT-F、SlMET1-RT-R(详见表1)。反应参数为:95 ℃ 30 s;95 ℃ 5 s,60 ℃ 35 s,95 ℃ 15 s,60 ℃ 1 min。每个样品有3个重复,反应在StepOne Real-Time PCR仪中完成。
1.6 免疫共沉淀
将已构建好的SlMET1瞬时表达载体通过冻融法转入农杆菌GV2260中,培养后所得抗性克隆经PCR鉴定为阳性,保存阳性克隆供后续实验使用。
pBTEX-SlMET1-HA质粒、pBTEX-DDB1-Flag 质粒和pBTEX-GFP-Flag的农杆菌28 ℃培养过夜,然后转接后再培养6~8 h,诱导农杆菌并28 ℃ 培养12 h。将稀释为OD=0.6 菌液注射在4周大的烟草叶片上进行瞬时表达,48 h后,取注射叶片部分在液氮中研磨,加入蛋白提取液;13 000 r/min离心10 min,吸取上清液于一新EP管中;测定蛋白质量浓度,以等量的蛋白量加入等量标签抗体;4 ℃旋转结合2 h;加入Protein G亲和层析珠子,4 ℃旋转结合1 h;用裂解液冲洗珠子3次;加入SDS上样缓冲液,煮沸5 min;离心后取上清进行SDS-PAGE电泳,转膜并分别用HA和Flag抗体进行显影。
2 结果与分析
2.1SlMET1基因的生物信息学分析结果
本文根据已公布的番茄SlMET1序列,对其可能的功能结构域进行分析,结果如图1所示。
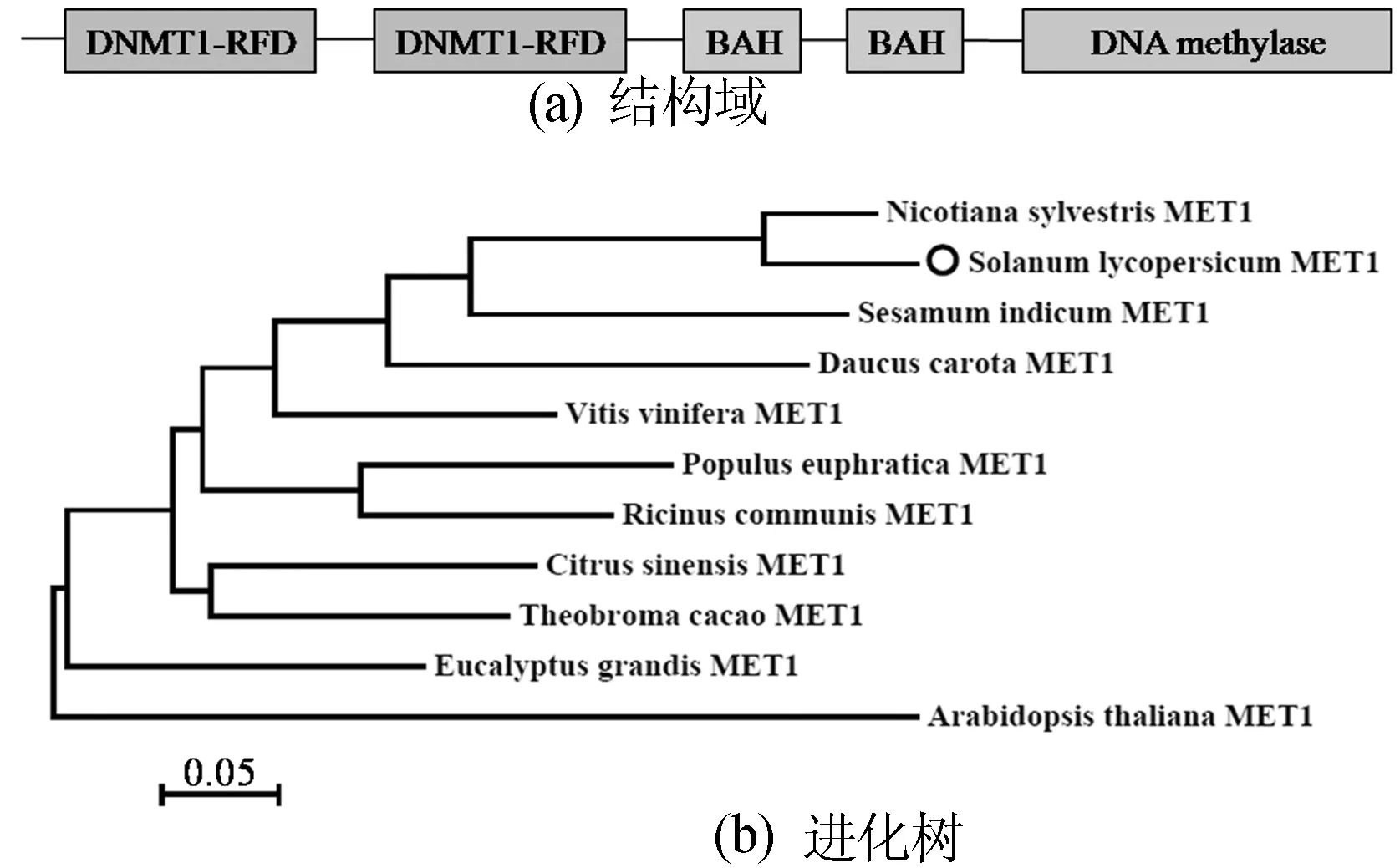
图1 番茄SlMET1基因的生物信息学分析
SlMET1由5个功能结构域组成,分别为2个胞嘧啶甲基转移酶结构域(DNMT-RFD)、2个与DNA甲基化相关的BAH结构域和1个胞嘧啶甲基化酶结构域(DNA methylase),由此可推断,本文的SlMET1为番茄中与DNA甲基化相关的甲基转移酶(Methyltransferase)。结合GenBank中已公布的包括拟南芥、甜橙、胡萝卜、巨桉、烟草、胡杨、蓖麻、芝麻、可可、葡萄等在内的植物相应序列,使用ClustalX 1.8 和 MEGA 5.0软件,依据邻位相连法构建进化树。结果显示番茄MET1与烟草的亲缘关系最近,与拟南芥最远。
2.2SlMET1基因扩增及测序分析
以野生型番茄cDNA为模板,SlMET1-F和SlMET1-R为引物进行PCR扩增,通过琼脂糖凝胶电泳检测,结果如图1所示,由图1可知,所得特异性基因片段的大小与预期的SlMET1基因一致。通过测序比对证实,该基因片段即为番茄中的SlMET1基因。
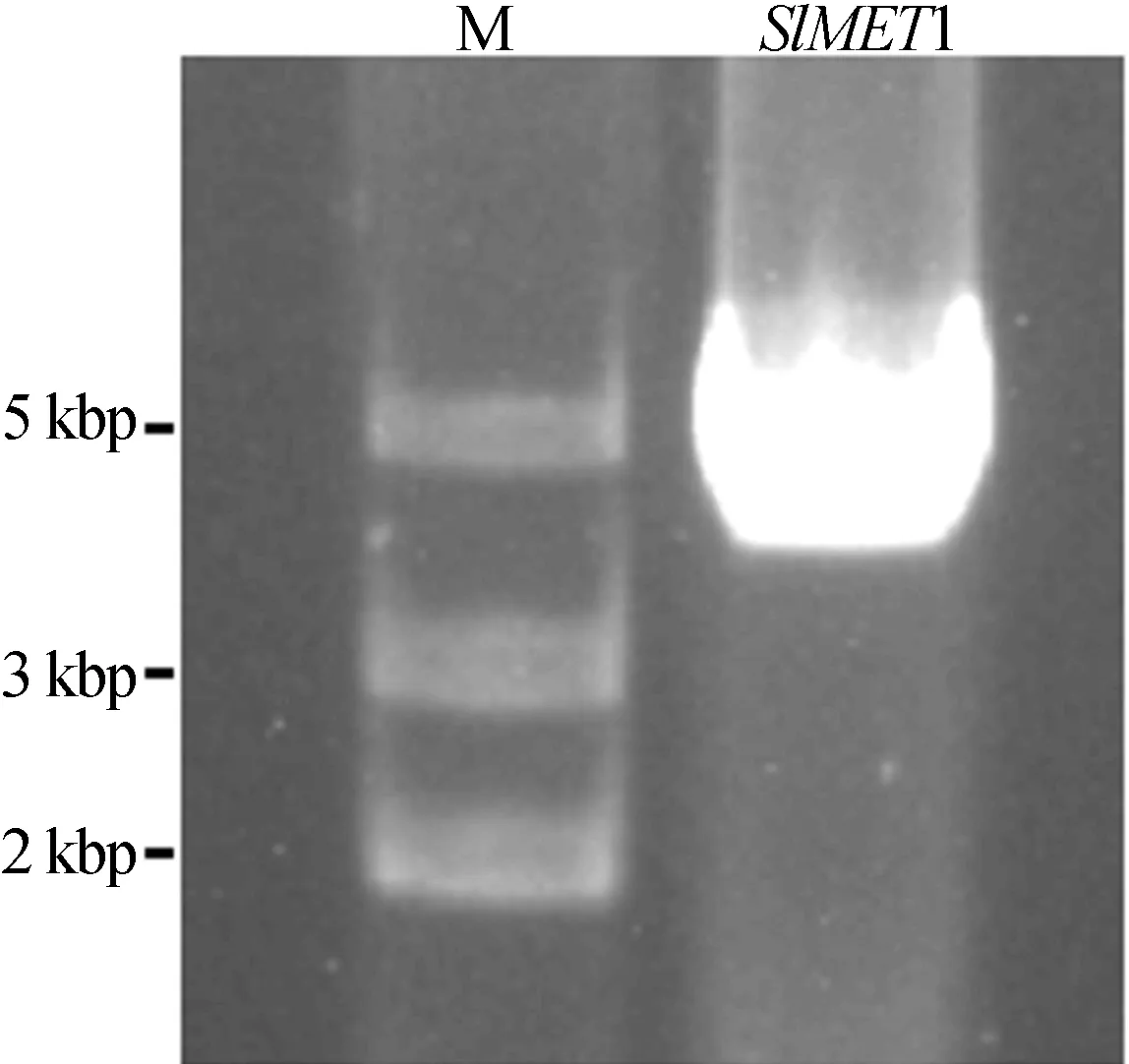
M.DNA marker DL 2000图2 SlMET1基因的PCR扩增
2.3 绿色荧光蛋白及植物表达载体鉴定
利用限制性内切酶EcoRⅠ和SalⅠ双酶切pBTEX-SlMET1-HA,另外利用KpnⅠ和EcoRⅠ双酶切pART27-SlMET1-GFP表达载体,得到预期大小的SlMET1基因片段,如图3所示。从而确定SlMET1基因已经连接到载体pBTEX和pART27-GFP 中。
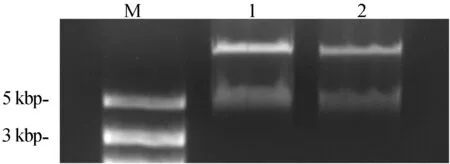
1.EcoRⅠ和Sal Ⅰ双酶切 2.KpmⅠ和EcoR Ⅰ双酶切图3 pBTEX-SlMET1载体和PART27-SlMET1-GFP酶切鉴定图
2.4SlMET1基因表达模式分析
提取野生型番茄的各个组织(根、茎、叶、花)和不同发育时期的果皮(授粉后14、35 d、变色期和成熟期)中的总RNA,反转录成cDNA 后,用实时定量PCR的方法测定不同组织中SlMET1基因的表达情况,如图4所示。图4中,IG1为绿果(授粉后7 d);IG2为绿果(授粉后14 d);MG为成熟绿果(授粉后35 d);Br为变色期;RR为红果;Rt为根;Stem为茎;L为叶;F为花。结果表明,SlMET1基因在番茄各个组织和果实不同发育时期均有表达,其中,叶片和花中表达量最高。该研究结果表明,该基因可能参与了叶片和花的发育过程。

图4 SlMET1基因的表达模式分析
2.5 SlMET1蛋白表达的亚细胞定位分析
构建pART27-SlMET1-GFP 融合蛋白载体,通过GV2260农杆菌注射介导,将构建好的载体在烟草中进行瞬时表达。48 h后,取被注射的叶片区域的表皮细胞在激光共聚焦显微镜下进行绿色荧光的观察,同时,用DAPI对细胞核进行染色,从而确定细胞核位置,如图5所示。
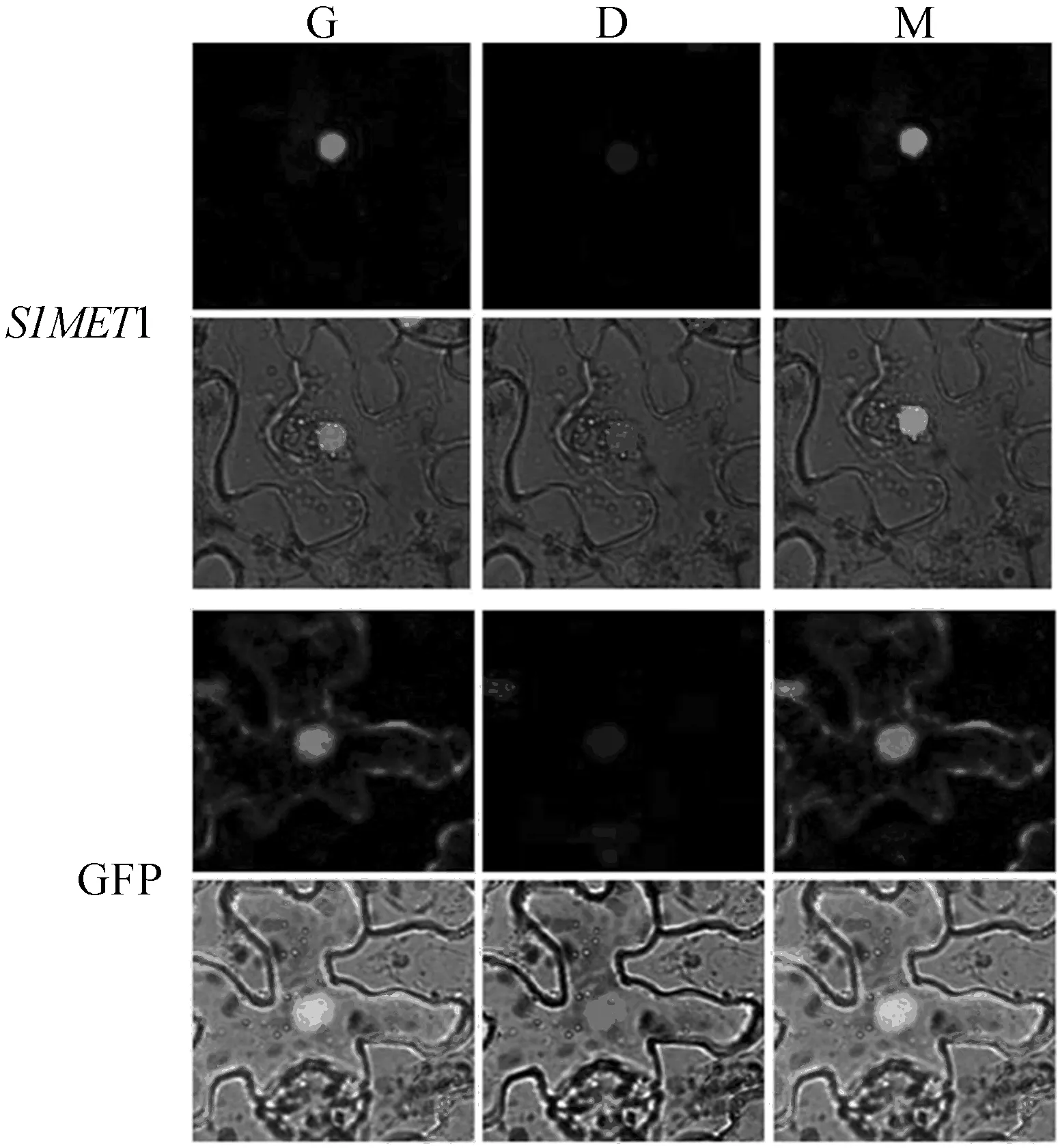
图5 番茄SlMET1蛋白的亚细胞定位
图5中,G为绿色荧光;D为DAPI (4,6-diamidino-2-phenylindole); M为绿色荧光与DAPI的蓝色荧光相互重叠。
2.6 SlMET1与番茄DDB1的相互关系
已有报道表明,CUL4-DDB1 E3连接酶复合体对DNA甲基化有着至关重要的作用[14],猜想SlMET1作为番茄中一种重要的DNA甲基转移酶也会被DDB1构成的E3连接酶复合体所影响。因此利用烟草瞬时表达系统和免疫共沉淀技术分析SlMET1与DDB1的相互关系,结果发现SlMET1和DDB1之间存在相互作用,如图6所示。说明这2个蛋白质可能存在于一个复合体中,协同调控番茄的生长发育过程。
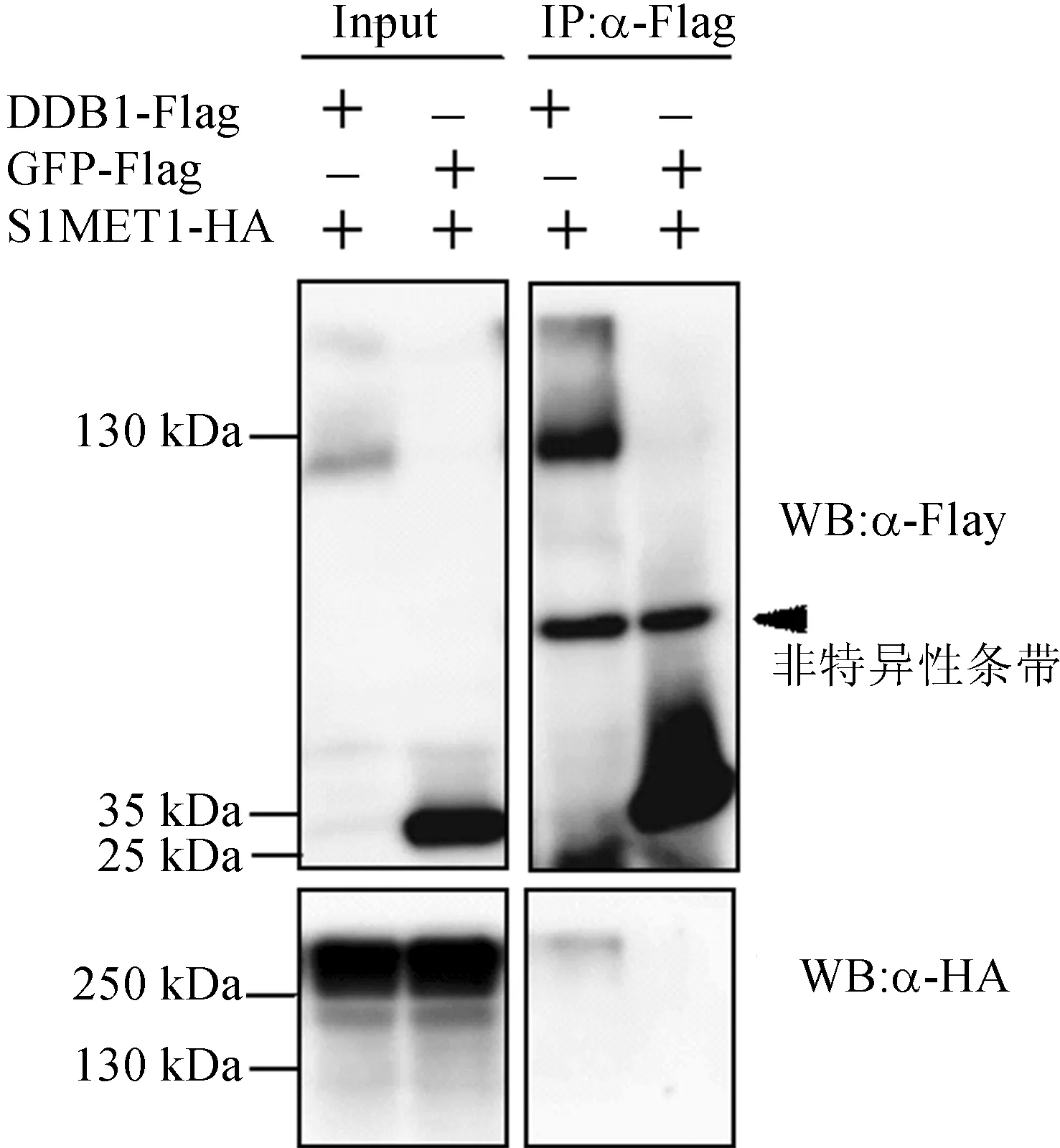
图6 番茄SlMET1蛋白与DDB1蛋白的相互作用
3 讨 论
DNA甲基化是基因组DNA的一种主要的表观遗传修饰形式[22],它影响着许多的分子机理,比如转录、修复和重组[23]。同时,DNA甲基化对于植物的生长发育、基因组结构和进化也起着至关重要的作用[24]。MET1(DNA METHYLT-RANSFERASE 1)作为一种DNA甲基转移酶,也参与和影响着植物细胞中的各种生理生化过程。本研究获得目的基因SlMET1,构建绿色荧光表达载体,确定SlMET1在植物细胞中的表达位置在细胞核内。分析SlMET1在番茄不同组织中的表达差异情况,发现SlMET1在叶子和花中表达量最高,而且在果实的各个发育时期,表达量也有明显的变化。
红面包菌中,CUL4-DDB1 E3连接酶可以调节组蛋白甲基化和DNA甲基化[11]。本课题组以及前人的研究也发现,DDB1以表观遗传学方式调控细胞分裂、果实发育以及叶片光合色素的代谢合成,本研究通过免疫共沉淀分析证明了SlMET1与DDB1存在相互作用,说明这2个蛋白质可能存在于一个复合体中,协同调控番茄的生长发育过程,为后续进一步研究SlMET1作为胞嘧啶甲基转移酶在番茄生长发育过程中的作用提供基础。同时也表明DDB1可能通过影响DNA甲基转移酶来调控表观遗传学修饰,从而影响植物的生长发育过程,为揭示DDB1参与表观遗传学修饰的作用机制提供了理论基础。
[参 考 文 献]
[1] GOLL M G,BESTOR T H.Eukaryotic cytosine methyltransferases[J].Annual Reviews of Biochemistry,2005,74:481-514.
[2] HENDERSON I R,JACOBSEN S E.Epigenetic inheritance in plants[J].Nature,2007,447:418-424
[3] KLOSE R J,BIRD A P.Genomic DNA methylation:the mark and its mediators[J].Trends in Biochemical Science,2006,31(2):89-97.
[4] CHAN S W,HENDERSON I R,JACOBSEN S E.Gardening the genome:DNA methylation inArabidopsisthaliana[J].Nature Reviews Genetics,2005,6(5):351-360.
[5] BARTEE L,MALAGNAC F,BENDER J.Arabidopsiscmt3 chromomethylase mutations block non-CG methylation and silencing of an endogenous gene[J].Genes & Development,2001,15(14):1753-1758.
[6] LAW J A,JACOBSEN S E.Establishing maintaining and modifying DNA methylation patterns in plants and animals[J].Nature Reviews Genetics,2010,11(3):204-220.
[7] KIM H J,YANO A,WADA Y,et al.Properties of a tobacco DNA methyltransferase,NtMET1 and its involvement in chromatin movement during cell division[J].Annals of Botany,2007,99(5):845-856.
[8] SAZE H,SCHEID O M,PASZKOWSKI J.Maintenance of CpG methylation is essential for epigenetic inheritance during plant gametogenesis[J].Nature Genetics,2003,34(1):65-69.
[9] KANKEL M W,RAMSEY D E,STOKES T L,et al.ArabidopsisMET1 cytosine methyltransferase mutants[J].Genetics,2003,163(3):1109-1122.
[10] SOPPE W J,JACOBSEN S E,ALONSO-BLANCO C,et al.The late flowering phenotype offwamutants is caused by gain-of-function epigenetic alleles of a homeodomain gene[J].Molecular Cell,2000,6(4):791-802.
[11] CHU G,CHANG E.Xeroderma pigmentosum group E cells lack a nuclear factor that binds to damaged DNA[J].Science,1988,242:564-567.
[12] PETROSKI M D,DESHAIES R J.Function and regulation of cullin-RING ubiquitin ligases[J].Nature Review Molecular Cell Biology,2005,6(1):9-20.
[13] O’CONNEL B C,HARPER J W.Ubiquitin proteasome system (UPS):what can chromatin do for you[J].Current Opinion Cell Biology,2007,19(2):206-214.
[14] CHEN H D,HUANG X,GUSMAROLI G,et al.ArabidopsisCULLIN4-damaged DNA binding protein 1 interacts with CONSTITUTIVELY PHOTOMORPHOGENIC1-SUPPRESSOR OF PHYA complexes to regulate photomorphogenesis and flowering time[J].Plant Cell,2010,22(1):108-123.
[15] LEE J H,YOON H J,TERZAGHI W,et al.DWA1 and DWA2,twoArabidopsisDWD protein components of CUL4-based E3 ligases,act together as negative regulators in ABA signal transduction[J].Plant Cell,2010,22(6):1716-1732.
[16] PAZHOUHANDEH M,MOLINIER J,BERR A,et al.MSI4/FVE interacts with CUL4-DDB1 and a PRC2-like complex to control epigenetic regulation of flowering time inArabidopsis[J].Proceedings of the National Academy of Sciences of USA,2011,108(8):3430-3435.
[17] XU H,WANG J,HU Q,et al.DCAF26,an adaptor protein of Cul4-based E3,is essential for DNA methylation inNeurosporacrassa[J].PLoS Genetics,2010,6(9):e1001132.
[18] LIU J,TANG X,GAO L,et al.A role of tomato UV-damaged DNA binding protein 1 (DDB1) in organ size control via an epigenetic manner[J].PLoS ONE,2012,7(8):e42621.
[19] TANG X,LIU J,HUANG S,et al.Roles of UV-damaged DNA binding protein 1 (DDB1) in epigenetically modifying multiple traits of agronomic importance in tomato[J].Plant Signal Behavior,2012,7(12):1529-1532.
[20] 周昂,牛向丽,刘永胜.猕猴桃AcGLK2a基因过表达载体的构建及在番茄中的遗传转化[J].合肥工业大学学报(自然科学版),2015,38(2):246-249.
[21] ZHU Y Y,HUANG S X,MIAO M,et al.Genome-wide identification,sequence characterization,and protein-protein interaction properties of DDB1 (damaged DNA binding protein-1)-binding WD40-repeat family members inSolanumlycopersicum[J].Planta,2015,241(6):1337-1350.[22] WU C,MORRIS J R.Genes,genetics and epigenetics:a correspondence[J].Science,2001,293:1103-1105.
[23] BIRD A.DNA methylation patterns and epigenetic memory[J].Genes & Development,2002,16(1):6-21.
[24] ZHANG M S,KIMATU J N,XU K Z,et al.DNA cytosine methylation in plant development[J].Genetic Genomics,2010,37(1):1-12.
(责任编辑 闫杏丽)
Cloning and functional analysis ofSlMET1 gene in tomato
DNA methylation is one of the vital epigenetic modifications in eukaryote, which affects the developmental process of the plant. This paper identified the sequence of the tomatoSlMET1 through the bioinformatic analysis. The full-length cDNA sequence ofSlMET1 gene was cloned by polymerase chain reaction(PCR). The GFP fusion expression vector ofSlMET1 gene was constructed and transiently expressed on the Nicotiana benthamiana leaves to find out its subcellular localization. The level of expression of theSlMET1 among the different tissue of tomato was analyzed by realtime qRT-PCR. In addition,SlMET1 was cloned into pBTEX with HA tag, which was used to test the interaction betweenSlMET1 and DDB1 by the co-immunoprecipitation. The results indicated that expression ofSlMET1 was higher in leaves and flowers and lower in fruit that was in mature green(MG) and ripe red(RR) stage. Meanwhile,SlMET1 proteins were located on the nucleus in the plant cell. And the co-immunoprecipitation showed that theSlMET1 interacted with the DDB1. The study can lay the theoretical foundation for the research on regulating plant growth and development with DDB1 by epigenetics modification.
SlMET1 gene; over-expression; transgenic tomato; polymerase chain reaction(PCR); subcellular localization; co-immunoprecipitation
2016-01-26;
2016-04-18
国家自然科学基金资助项目(31471157)
曹徐绿(1990-),男,重庆市人,合肥工业大学硕士生; 刘永胜(1964-),男,重庆市人,博士,合肥工业大学教授,博士生导师.
10.3969/j.issn.1003-5060.2017.06.021
S641.203
A
1003-5060(2017)06-0829-06
