一步法合成埃洛石/碳纳米复合材料及其吸附性能研究
2017-07-24吴雪平汤瑛召代建建张清心张先龙合肥工业大学化学与化工学院安徽合肥230009
吴雪平, 汤瑛召, 代建建, 张清心, 张先龙(合肥工业大学 化学与化工学院,安徽 合肥 230009)
一步法合成埃洛石/碳纳米复合材料及其吸附性能研究
吴雪平, 汤瑛召, 代建建, 张清心, 张先龙
(合肥工业大学 化学与化工学院,安徽 合肥 230009)
文章以壳聚糖为碳源,ZnCl2为活化剂,一步法制备埃洛石/碳纳米复合材料,并采用傅里叶变换红外光谱仪(Fourier transform infrared spectroscopy,FTIR)、透射电子显微镜(transmission electron microscope,TEM),X射线衍射仪(X-ray diffraction,XRD)和BET比表面积分析仪对材料结构进行了表征,探讨了埃洛石/碳对苯甲酰甲酸的吸附行为和机理。研究表明:苯甲酰甲酸在埃洛石/碳上的最大吸附容量高达95 mg/g,相比于未改性埃洛石其值提高了近10倍,埃洛石/碳对苯甲酰甲酸的吸附行为符合Langmuir模型;苯甲酰甲酸在埃洛石/碳表面上的吸附速率较快,在30 min时即可达到吸附平衡,并符合准二级吸附动力学模型;在298 ~318 K范围内,计算出了热力学参数ΔGΘ、ΔHΘ和ΔSΘ的值,ΔGΘ和ΔHΘ均为负值,表明该吸附过程是自发、放热过程。
一步活化法;埃洛石/碳;纳米复合材料;苯甲酰甲酸;吸附
0 引 言
苯甲酰甲酸(benzoylformic acid)属α-酮酸,是一种常见的精细有机合成中间体,可用来合成多种药物,但对眼睛、皮肤及呼吸系统具有刺激性从而导致各种疾病。由于有机合成转化率的限制,具有毒性的苯甲酰甲酸直接排放会导致水体污染,然而关于苯甲酰甲酸废水处理的文献报道很少。传统除去废水中溶解性有机物的主要方法有吸附法、混凝法和膜滤法等,其中混凝法对水溶性高的有机酸的去除率较低,膜滤法成本较高且有膜污染问题,吸附法是深度处理废水的一种简单有效的方法[1],因其能耗低、使用方便、效果好等优点被广泛应用。
常见的吸附剂主要有活性炭、大孔吸附树脂等,虽然其吸附量较大,但成本较高,再生困难,在实际应用中有一定限制。埃洛石是自然界中一种具有硅氧四面体、铝氧八面体结构的黏土矿物,天然纳米管状结构赋予其一定的吸附能力。以埃洛石为吸附剂,298 K对培氟沙星[2]、孔雀石绿[3]、中性红[4]的最大吸附容量(qm)分别为38、45、55 mg/g。然而,由于黏土矿物的天然亲水性[5],纳米黏土矿物对有机污染物的吸附能力受到限制,对黏土矿物进行有机改性提高其对有机污染物的吸附能力一度成为研究的热点。
在前期工作中[6-7],以葡萄糖、纤维素为碳源,基于埃洛石等天然黏土矿物的一维纳米模板的诱导合成,低温水热法制备了凹凸棒石/碳等纳米复合材料。相比于天然黏土,表面负载碳的改性黏土对有机污染物苯酚、亚甲基蓝等的吸附能力均有明显提高,但水热改性方法耗时较长(12~48 h),负载的化学官能团单一,而且产物的比表面仍有进一步提高的空间[8]。壳聚糖是自然界中广泛存在的甲壳素脱乙酰化的产物,其天然高分子结构中含有大量的活性基团(如羟基和氨基)。热处理壳聚糖可以发生脱羟基作用获得氨基和含碳官能团[9]。
本文以ZnCl2为活化剂,壳聚糖和埃洛石为前驱体,快速一步活化制备埃洛石/碳纳米复合材料,研究了苯甲酰甲酸在埃洛石/碳上的吸附行为和机理,通过吸附等温线、吸附热力学和吸附动力学阐明了埃洛石/碳对苯甲酰甲酸的吸附作用机制,并考察了产物对苯甲酰甲酸的吸附性能。
1 实验部分
1.1 试剂与仪器
1.1.1 实验试剂
埃洛石(郑州金阳光陶瓷有限公司)过200目筛,其X射线衍射(X-ray diffraction,XRD)图谱如图1a所示,样品在2θ为11.8°、20.0°、24.7°、35.0°、54.5°、62.5°处具有明显的埃洛石的特征峰(JCPDS 29-1487),傅里叶变换红外光谱(Fourier transform-infrared spectroscopy,FTIR)图谱如图1b所示,样品在波数为536、1 032、1 093、3 618、3 696 cm-1处有分别对应于Al—O—Si、Si—O、(Mg—Al)—O、Si—OH伸缩振动和Al—OH的特征吸收峰[10],在1 641 cm-1处有水中的—OH吸收峰。盐酸、氯化锌、壳聚糖和苯甲酰甲酸均为分析纯试剂(国药集团化学试剂有限公司)。
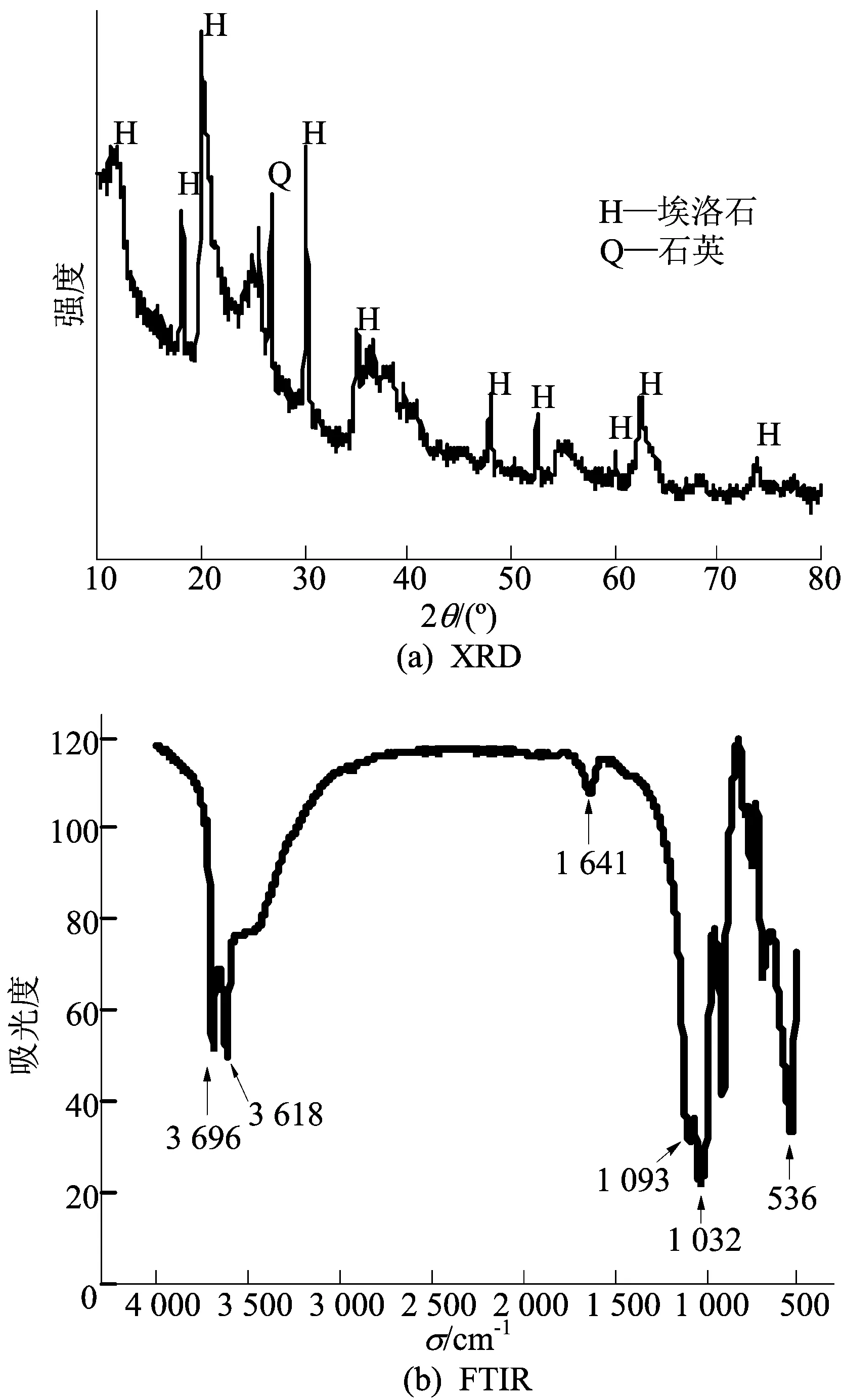
图1 埃洛石的XRD图谱和FTIR图谱
1.1.2 实验仪器
GSL-1400X型真空管式高温烧结炉(合肥科晶材料技术有限公司);DHG-90361A型电热恒温鼓风干燥箱(上海精宏实验设备有限公司);HC-2066型高速离心机(安徽中科中佳科学仪器有限公司);HZ-82A/SHA-CA型数显恒温水浴振荡器(江苏金坛市环宇科学仪器厂)。
1.2 材料制备
将一定量的ZnCl2溶于蒸馏水,用胶头滴管逐滴加入10 mol/L HCl至白色絮状沉淀刚好消失为止。加入2 g埃洛石和4 g壳聚糖,搅拌6 h得到均匀悬浮液。将悬浮液置于恒温干燥箱中,60 ℃烘干后得到的产物置于管式炉内,在设定温度、N2气氛下(200 mL/min)活化一定时间。将得到的产物研磨成粉末状置于烧杯中,先后用1.2 mol/L盐酸和60 ℃蒸馏水反复洗涤直至中性,100 ℃烘干即得最终产物埃洛石/碳,置于干燥器中保存备用。
1.3 材料表征
采用紫外分光光度计(UV-2401PC,日本SHIMADZU公司)测定苯甲酰甲酸最大吸光度;采用BET比表面积测试仪(NOVA 2200e,美国Quantachrome仪器制造公司)测定材料比表面积和孔径分析;采用傅里叶红外光谱仪(Nicolet 67,美国Thermo公司)和X-射线衍射仪(D/MAX2500V,日本Rigaku公司)分析材料结构;采用透射电子显微镜(transmission electron microscope,TEM)(JEM-2100F,日本电子制造公司)观察材料形貌特征。
1.4 吸附试验
1.4.1 吸附平衡曲线
准确称取0.05 g吸附剂于250 mL碘量瓶中,加入100 mL初始质量浓度为100 mg/L的苯甲酰甲酸溶液。298 K下于恒温水浴振荡器中以200 r/min的速率振荡24 h。而后静置,8 000 r/min高速离心、过滤,用紫外分光光度法测定上清液中苯甲酰甲酸溶液的质量浓度。在最大波长处(252 nm)测得其吸光度,通过标准曲线法得到平衡质量浓度,平行做3个样品,取其平均值,脱除率的计算公式为:
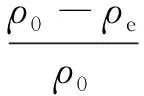
(1)
其中,η为脱除率;ρ0为初始质量浓度;ρe为吸附后的质量浓度。
1.4.2 吸附等温线
准确称取0.05 g吸附剂置于250 mL碘量瓶中,加入100 mL初始质量浓度(ρ0) 0~250 mg/L的苯甲酰甲酸溶液,在298 K下,200 r/min恒温水浴振荡24 h。然后8 000 r/min高速离心、过滤,用紫外分光光度法测其上清液中苯甲酰甲酸的质量浓度ρe,平衡吸附量qe的计算公式为:

(2)
其中,qe为平衡吸附量;V为吸附质溶液体积;m为吸附质质量。
1.4.3 吸附动力学
准确称取0.01 g吸附剂置于碘量瓶中,加入一定质量浓度和体积的苯甲酰甲酸溶液,298 K下于恒温水浴振荡器中以200 r/min的速率振荡,间隔一定时间取样。用紫外分光光度法检测一定时间t的质量浓度ρt,计算得到qt为:

(3)
其中,ρt为对应时间t时苯甲酰甲酸的质量浓度;V为吸附质溶液体积;m为吸附质质量。
1.4.4 吸附热力学
准确称取0.05 g吸附剂置于250 mL碘量瓶中,加入100 mL初始质量浓度(ρ0) 0~250 mg/L的苯甲酰甲酸溶液,在298、308、318 K温度条件下,200 r/min恒温水浴振荡24 h。然后8 000 r/min高速离心、过滤,用紫外分光光度法测其上清液中苯甲酰甲酸的质量浓度ρe,根据(2)式计算平衡吸附量qe。做出3种温度下吸附等温线,根据Van′t Hoff方程计算等量吸附焓。
2 结果与讨论
2.1 正交试验
采用正交试验法,考察制备条件对吸附剂性能的影响,确定吸附剂制备的最优条件。本试验选取活化过程中对产物吸附性能有较大影响的因素浸渍比(A)、活化时间(B)和活化温度(C),各个因素各取3个水平,设计3因素、3水平的正交试验,以一步法制备的吸附剂对苯甲酰甲酸的平衡吸附量作为筛选试验条件的依据。试验设计与吸附结果见表1所列,不同制备条件下得到的样品吸附性能有所不同。ki为任意列上水平号为i时所对应的试验结果之和,Ki为其平均值,R为平均值极差,计算结果见表2所列,因为RA>RB>RC,所以影响吸附性能最大的因素是壳聚糖与ZnCl2浸渍比,其次是活化温度和时间。通过正交试验结果可知,制备材料的最佳条件为浸渍比5∶2、活化温度500 ℃、活化时间1.5 h,此时吸附剂对苯甲酰甲酸的吸附性能最好,平衡吸附量为71 mg/g,与未改性埃洛石对苯甲酰甲酸的平衡吸附量7 mg/g相比,吸附性能提高了10倍。
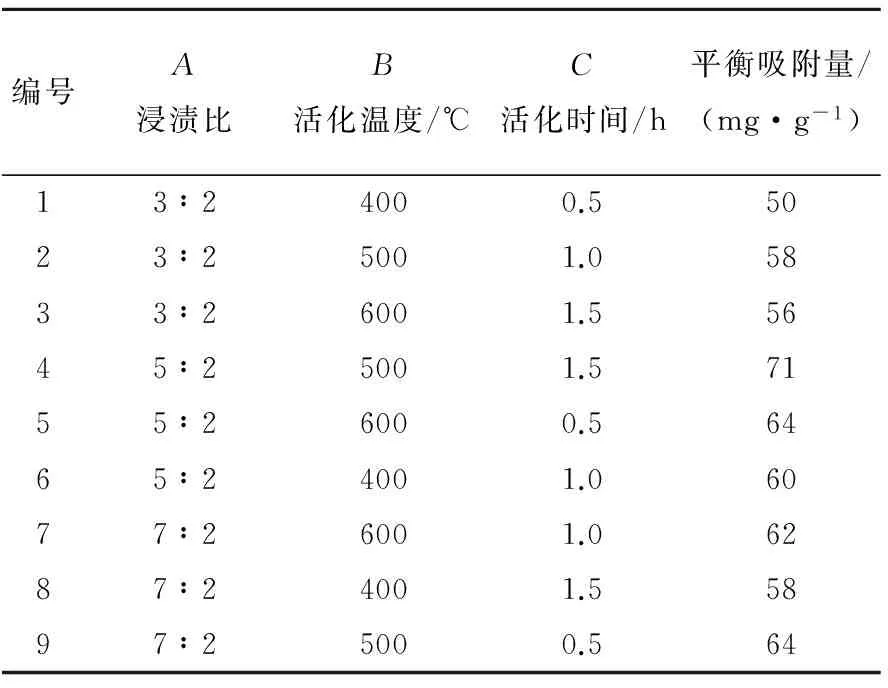
表1 正交试验设计表
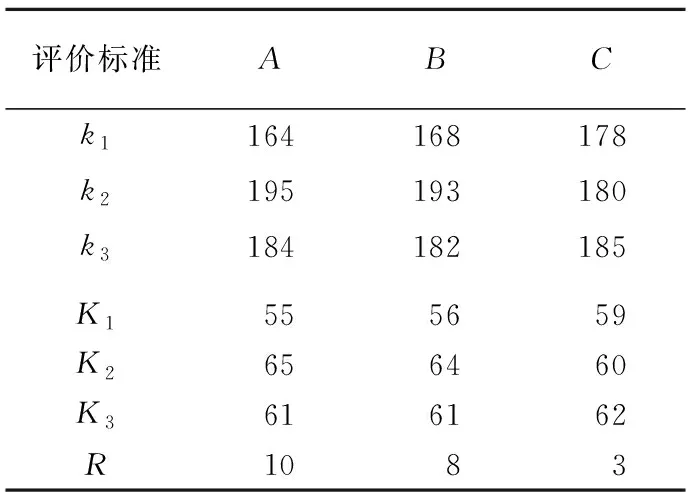
表2 正交试验结果计算表
2.2 结构表征
埃洛石和壳聚糖在上述最优条件下一步活化后产物的XRD图谱如图2a所示。埃洛石与壳聚糖在500 ℃经氯化锌活化后,埃洛石原有的特征衍射峰几乎全部消失,说明其晶体结构已被破坏,并形成无定形的化合物;同时在20°~30°范围内出现一个新的宽峰,该宽峰的出现是由于壳聚糖在加热活化过程中产生的无定形碳所致[9]。埃洛石/碳的FTIR谱图如图2b所示。埃落石和壳聚糖经ZnCl2高温活化后,原本埃洛石中3 696、618 cm-1处对应于Si—OH伸缩振动和Al—OH的特征吸收峰消失,说明在500 ℃时因结构水的脱除,埃洛石的结构被破坏。同时 C=O弯曲振动峰(793、1 699 cm-1)[11],N—H2弯曲振动峰(1 577 cm-1),C—H2伸缩振动峰(2 930 cm-1)和C—N伸缩振动峰(3 425 cm-1)[8]等新的吸收峰的出现,说明壳聚糖经过脱羟基作用后形成了含氮官能团和含碳官能团[9]。将埃洛石和埃洛石/碳对苯甲酰甲酸的平衡吸附量进行比较可知,壳聚糖与埃落石的复合明显有利于苯甲酰甲酸的吸附,这是由于负载到埃洛石上的碳表面的羰基供体可以与苯甲酰甲酸上作为电子受体的苯环结合,且碳的π键可以与苯环上的π键发生作用[12-13],同时负载到埃洛石上的氨基可与苯甲酰甲酸上的羧基发生反应。
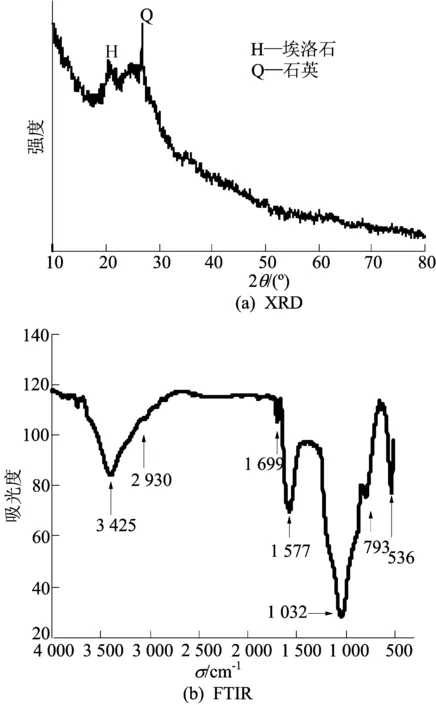
图2 埃洛石/碳的XRD图谱和FTIR图谱
埃洛石与埃洛石/碳的TEM照片如图3所示。由图3a可知,埃洛石明显具有纳米管状结构,内径为10~30 nm,外径为50~100 nm,管长为0.5~1.0 μm,管与管之间分散较好。由图3b可知,壳聚糖与埃洛石活化处理后,埃洛石中明显有新的物相存在,根据上述分析,该物相为壳聚糖碳化所生成的碳。管面(Ⅰ区域)、管壁(Ⅱ处)和穿透管壁(Ⅲ处)3处区域的EDS能谱分析结果见表3所列,由表3可知,未改性的埃洛石中无C元素的存在,含有Si、Al、O等元素,埃洛石内表面上含有较多Al,以Al—O—Si结合存在;外表面含有较多Si,存在 Si—O—Si键[10]。壳聚糖活化后的埃洛石中除Si、Al、O等元素外,还有22 %碳的存在(i区域),说明壳聚糖碳化为碳负载于埃洛石表面。图3d中无明显管状结构的ii处及边缘iii处能谱分析均显示较高的碳摩尔分数,分别为59 %和89 %,说明壳聚糖碳化后所形成的碳将埃洛石纳米管包裹形成埃落石/碳复合材料[9]。

图3 埃洛石与埃洛石/碳TEM照片
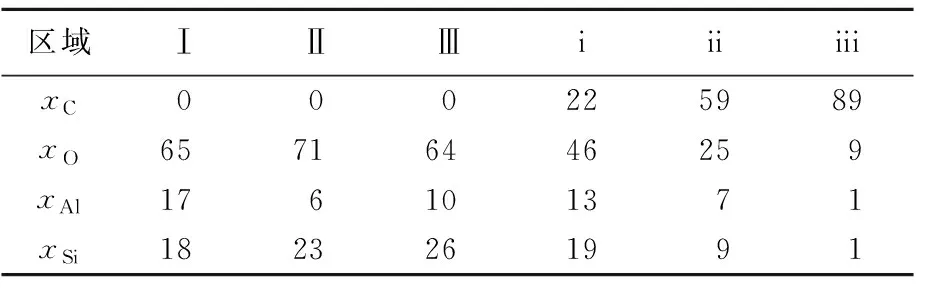
表3 EDS能谱分析结果
埃洛石与埃洛石/碳的BET比表面积分析结果如图4所示。埃洛石的比表面积为55 m2/g,平衡吸附量为7 mg/L;埃洛石/碳样品的比表面积为1 146 m2/g,平衡吸附量为71 mg/L,较大的比表面积可以提供更多的结合位点,提高吸附效率。图4是两者的N2吸脱附曲线,埃洛石的吸附类型是Ⅱ型,有一个H3型滞后回环(参照IUPAC分类),在稍大的压力下发生毛细凝聚现象,说明埃洛石中有一些较大的介孔,这是由于埃洛石本身无序的堆叠造成的[10]。埃洛石/碳样品N2吸脱附类型是Ⅳ型,有一个H4型的滞后回环,证明样品中有微孔的存在,这是壳聚糖在埃洛石表面碳化形成多孔碳及埃洛石本身脱除结构水所致[14]。通过BET比表面积分析得出,埃洛石中的孔主要是介孔,平均孔径为15.5 nm,孔体积为0.291 cm3/g;而埃洛石/碳的平均孔径为3.172 nm,孔体积为0.156 cm3/g,以超纳米尺寸存在,由于溶剂的空间位阻效应,埃洛石/碳中的微孔更有利于分子尺寸更匹配的有机分子的吸附[15]。
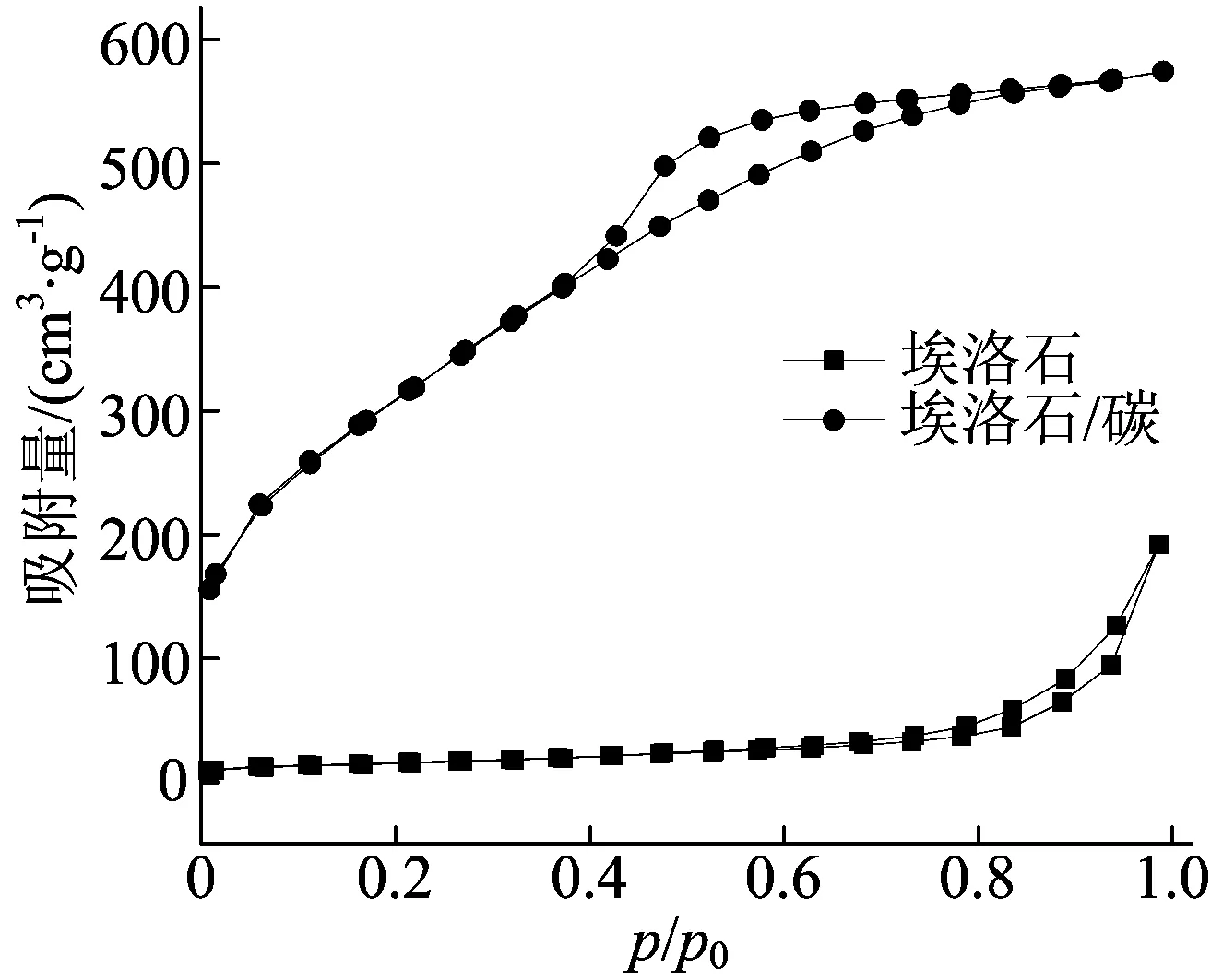
图4 埃洛石与埃洛石/碳的N2吸脱附曲线
2.3 吸附等温线
不同温度下苯甲酰甲酸在埃洛石/碳上的吸附等温线如图5a所示。吸附等温线表明,升高温度不利于埃洛石/碳对苯甲酰甲酸的吸附。
埃洛石/碳的吸附通过Langmuir和Freundlich吸附等温线拟合,其方程如下。
Langumir 吸附方程为:
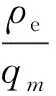
(4)
Freundlich方程为:
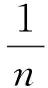
(5)
其中,ρe为苯甲酰甲酸平衡质量浓度;qe为吸附剂埃洛石/碳的平衡吸附量;qm为吸附剂的最大吸附容量;KL为Langmuir吸附常数;KF为Freundlich常数;n为多相性常数,表示吸附强度。
拟合曲线如图5所示,其参数见表4所列。

图5 苯甲酰甲酸吸附等温线、Langmuir及Freundlich方程线性拟合
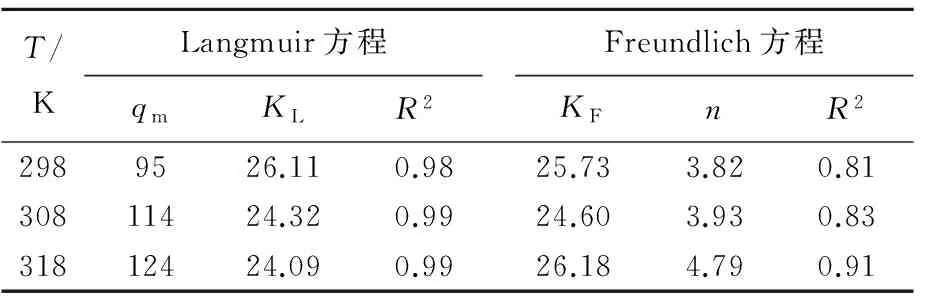
表4 等温线拟合相关参数
根据相关系数判断(R2>0.98),埃洛石/碳对苯甲酰甲酸的吸附更符合Langmuir模型,即苯甲酰甲酸在没有其他任何结合力的作用下,通过单分子层吸附,均匀地吸附在埃洛石/碳上[16]。298 K时,埃洛石/碳对苯甲酰甲酸的最大吸附容量(qm)为95 mg/g,约为埃洛石(10 mg/g)的10倍。很明显,壳聚糖对埃洛石的有机改性起了很大的作用,提高了埃洛石/碳对苯甲酰甲酸的吸附能力。
2.4 吸附动力学
分别用准一级动力学方程和准二级动力学方程对埃洛石及埃洛石/碳对苯甲酰甲酸的吸附进行拟合,方程如下。
准一级动力学方程为:
qt=qe(1-ek1t)
(6)
准二级动力学方程为:
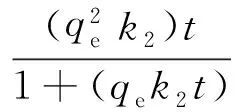
(7)
其中,qe和qt分别为苯甲酰甲酸在平衡时和t时的吸附量;k1为准一级动力学速率常数;k2为准二级动力学速率常数。
埃洛石及埃洛石/碳对苯甲酰甲酸的吸附动力学的研究结果如图6所示。
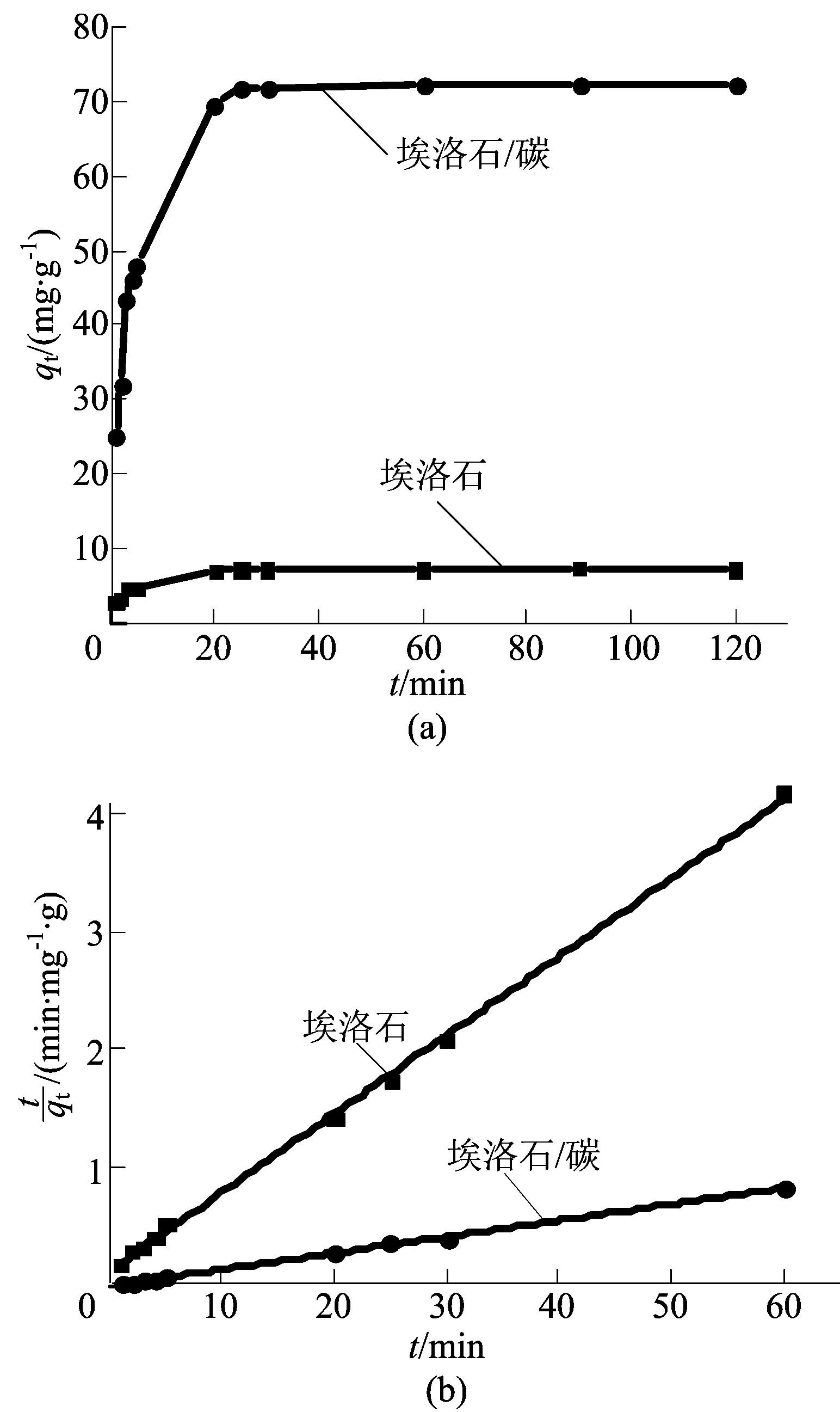
图6 样品的吸附平衡曲线及准二级动力学方程的线性拟合
由图6a可知,随着时间的延长,吸附量相应增加,并且在30 min即可以达到吸附平衡,吸附速率很快。相同时间下,埃洛石/碳对苯甲酰甲酸的吸附量、吸附速率远高于埃洛石,说明有机改性使埃洛石表面增加了许多新的结合位点,使其对苯甲酰甲酸的吸附性能较高。两者对苯甲酰甲酸的吸附动力学拟合如图6b所示,拟合参数见表5所列。根据相关系数R2值判断,埃洛石及埃洛石/碳对苯甲酰甲酸的吸附更适合用准二级动力学方程拟合,吸附速率受控于埃洛石/碳的孔结构和粒径。
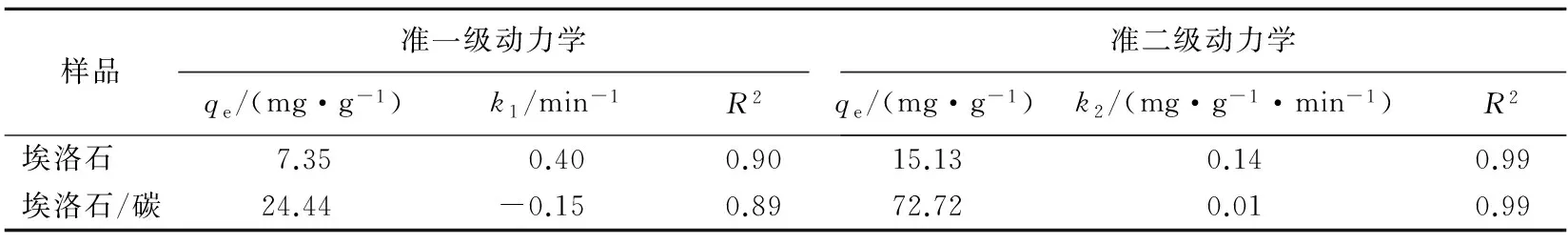
表5 动力学拟合相关参数
2.5 吸附热力学
热力学参数,如吉布斯自由能(ΔGΘ),焓(ΔHΘ)和熵(ΔSΘ),可以通过Van′t Hoff方程求得:
ΔGΘ=-RTlnKL
(8)
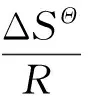
(9)
其中,R为通用气体常数;KL为Langmuir常数;T为绝对温度;ΔSΘ和ΔHΘ分别通过截距和斜率计算得到,见表6所列。
通过表6数据可知,ΔGΘ为负值,表明该反应为自发反应。通常情况下,ΔGΘ的数值为-20~0 kJ/mol时,吸附过程的作用力为范德华力,吸附是物理吸附,在-80~-400 kJ/mol之间,作用力则为化学键,此时吸附是化学吸附[17]。本实验结果证明了埃洛石/碳对苯甲酰甲酸的吸附是物理吸附过程。ΔHΘ的值为负数说明该吸附过程是放热的,ΔSΘ为正数则说明反应为熵增反应,固液界面处混乱度增加,苯甲酰甲酸和埃洛石/碳之间的引力增强。

表6 埃洛石/碳吸附苯甲酰甲酸的热力学参数
3 结 论
本文以埃洛石和壳聚糖为原料,以ZnCl2为活化剂,通过一步法快速活化,对埃洛石进行有机改性,成功获得埃洛石/碳纳米复合材料。通过正交试验获得最优制备条件,该条件下制备的吸附剂对苯甲酰甲酸的最大吸附容量为95 mg/g,相比于其在埃落石上的最大吸附容量10 mg/g提高了约10倍。影响吸附过程的主要因素为埃洛石/碳表面增加的含碳官能团及氨基官能团与苯甲酰甲酸之间的相互作用,以及吸附剂与吸附质之间受分子尺寸和孔径影响的空间位阻作用。埃洛石/碳对苯甲酰甲酸的吸附过程符合Langmuir单层吸附模型和准二级动力学方程,是自发、放热的吸附过程。埃洛石/碳纳米复合材料是一种快速有效脱除苯甲酰甲酸的新型吸附剂,在污水处理方面具有很广阔的应用前景。
[1] APUL O G,KARANFIL T.Adsorption of synthetic organic contaminants by carbon nanotubes:a critical review[J].Water Research,2015,68:34-55.
[2] ZHANG C L,CUI S J,WANG Y.Adsorption removal of pefloxacin from water by halloysite nanotubes[J].Journal of Industrial and Engineering Chemistry,2015,23:12-15.
[3] KIANI G,DOSTALIi M,ROSTMI A,et al.Adsorption studies on the removal of Malachite Green from aqueous solutions onto halloysite nanotubes[J].Applied Clay Science,2011,54(1):34-39.
[4] LUO P,ZHAO Y,ZHANG B,et al.Study on the adsorption of Neutral Red from aqueous solution onto halloysite nanotubes[J].Water Research,2010,44(44):1489-1497.
[6] WU X P,GAO P,ZHANG X L,et al.Synthesis of clay/carbon adsorbent through hydrothermal carbonization of cellulose on palygorskite[J].Applied Clay Science,2014,95(3):60-66.
[7] WU X P,XU Y Q,ZHANG X L,et al.Adsorption of low-concentration methylene blue onto a palygorskite/carbon composite[J].New Carbon Materials,2015,30(1):71-78.
[8] ZHANG X L,CHENG L P,WU X P,et al.Activated carbon coated palygorskite as adsorbent by activation and its adsorption for methylene blue[J].J Environ Sci (China),2015,33(7):97-105.
[9] ZHOU Q,GAO Q,LUO W,et al.One-step synthesis of amino-functionalized attapulgite clay nanoparticles adsorbent by hydrothermal carbonization of chitosan for removal of methylene blue from wastewater[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2015,470:248-257.
[10] YUAN P,SOUTHON P D,LIU Z,et al.Functionalization of halloysite clay nanotubes by grafting with γ-aminopropyltriethoxysilane[J].The Journal of Physical Chemistry C,2008,112(40):15742-15751.
[11] LI M,LI W,LIU S.Hydrothermal synthesis,characterization,and KOH activation of carbon spheres from glucose[J].Carbohydrate Research,2011,346(8):999-1004.
[12] SING K S.Reporting physisorption data for gas/solid systems with special reference to the determination of surface area and porosity (recommendations 1984)[J].Pure and applied chemistry,1985,57(11):603-619.
[13] LIU Q S,ZHENG T,WANG P,et al.Adsorption isotherm,kinetic and mechanism studies of some substituted phenols on activated carbon fibers[J].Chemical Engineering Journal,2010,157(2/3):348-356.
[14] ZHANG A B,PAN L,ZHANG H Y,et al.Effects of acid treatment on the physico-chemical and pore characteristics of halloysite[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2012,396(7):182-188.
[15] LI X,XIAO W,HE G,et al.Pore size and surface area control of MgO nanostructures using a surfactant-templated hydrothermal process:high adsorption capability to azo dyes[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects,2012,408(16):79-86.
[16] BHATTACHARYYA K G,GUPTA S S.Influence of acid activation on adsorption of Ni(Ⅱ) and Cu(Ⅱ) on kaolinite and montmorillonite:kinetic and thermodynamic study[J].Chemical Engineering Journal,2008,136(1):1-13.
[17] YARI M,RAHABI M,MORADI O,et al.Kinetics of the adsorption of Pb(Ⅱ) ions from aqueous solutions by graphene oxide and thiol functionalized graphene oxide[J].Journal of Molecular Liquids,2015,209:50-57.
(责任编辑 闫杏丽)
Preparation of halloysite/carbon nanocomposites via one-step carbonization-activation method and its adsorption properties
WU Xueping, TANG Yingzhao, DAI Jianjian, ZHANG Qingxin, ZHANG Xianlong
(School of Chemistry and Chemical Engineering, Hefei University of Technology, Hefei 230009, China)
The halloysite/carbon nanocomposites were prepared via one-step activation using chitosan as carbon precursor and ZnCl2as activating agent. The obtained composite was characterized by Fourier transform infrared spectroscopy(FTIR), transmission electron microscope(TEM), X-ray diffraction(XRD) and Brunauer-Emmett-Teller(BET) analysis. The halloysite/carbon nanocomposites were used as an adsorbent for the adsorption of benzoylformic acid from aqueous solution. The adsorption thermodynamics and kinetics for benzoylformic acid were investigated. The equilibrium sorption evaluation of benzoylformic acid was conformed and fitted well to Langmuir adsorption isotherm models and the calculated maximum adsorption capacity(qm) for benzoylformic acid on halloysite/carbon was 95 mg/g which was 10 folds of the qmof the unmodified halloysite, indicating that the introduction of chitosan moiety had greatly increased the adsorption efficiency. The kinetic study illustrated that the adsorption of benzoylformic acid onto halloysite/carbon nanocomposites was fast because the adsorption equilibrium reached within 30 min, and the adsorption process followed a pseudo-second order model(R2>0.99). The calculated thermodynamics parameters ΔGΘ, ΔHΘand ΔSΘshowed that the adsorption of benzoylformic acid onto halloysite/carbon nanocomposites was an endothermic, spontaneous and entropy process from 298 K to 318 K.
one-step activation; halloysite/carbon; nanocomposites; benzoylformic acid; adsorption
2016-01-06;
2016-02-01
安徽省科技攻关资助项目(J2014AKKG0002)
吴雪平(1978-),女,安徽池州人,博士,合肥工业大学副教授,硕士生导师.
10.3969/j.issn.1003-5060.2017.06.019
X522
A
1003-5060(2017)06-0814-08
