超声波对肌原纤维蛋白热诱导凝胶化学作用力与保水性的影响
2017-07-24王静宇杨玉玲康大成汤晓智张兴马云倪文溪
王静宇,杨玉玲,康大成,汤晓智,张兴,马云,倪文溪
(1南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心/江苏高校粮油质量安全控制及深加工重点实验室,南京 210023;2南京农业大学食品科技学院/江苏省肉类生产与加工质量安全控制协同创新中心,南京 210095)
超声波对肌原纤维蛋白热诱导凝胶化学作用力与保水性的影响
王静宇1,杨玉玲1,康大成2,汤晓智1,张兴1,马云1,倪文溪1
(1南京财经大学食品科学与工程学院/江苏省现代粮食流通与安全协同创新中心/江苏高校粮油质量安全控制及深加工重点实验室,南京 210023;2南京农业大学食品科技学院/江苏省肉类生产与加工质量安全控制协同创新中心,南京 210095)
【目的】研究超声波对肌原纤维蛋白凝胶化学作用力与保水性的影响,并探讨化学作用力与保水性之间的内在联系。【方法】取活AA鸡屠宰,提取肌原纤维蛋白(myofibrillar proteins,MP),用不同超声时间处理MP并制成热诱导凝胶,运用凝胶中总巯基含量的变化来反应二硫键的形成;凝胶的表面疏水性S0和Zeta电位值来表征疏水作用力和静电斥力;用拉曼光谱的I850/I830比值大小反映凝胶氢键的变化;凝胶保水性用高速离心机测定。【结果】超声波处理0—6 min时,MP凝胶的总巯基含量随时间的增加而减少,活性巯基含量显著增加;处理6—15 min时,MP凝胶的总巯基以及活性巯基均随时间延长而显著减少,而对MP原料进行同样处理时,处理时间在0—6 min内,MP总巯基和活性巯基变化趋势与MP凝胶相同;超过9 min后,活性巯基和总巯基没有显著变化,且二者含量逐渐接近。表明短时间超声波处理促进了MP分子内部巯基转变成二硫键,长时间超声波处理和加热成胶的共同作用促进了活性巯基转变成二硫键。MP凝胶的表面疏水性先随超声时间延长从1 194.1显著上升到1 489.5(6 min),随后逐渐降至1 230.8,表明超声波产生的空穴效应能够使MP分子内部疏水基团暴露到分子表面,但超过6 min后,增加的蛋白表面疏水性又被包裹在凝胶网络中。MP凝胶的Zeta电位绝对值随超声时间的增加从6.03显著增加到7.68(P<0.05),超过6 min后显著减少,表明超声波处理使MP分子逐渐展开,蛋白质分子间静电作用增强,但过度展开后对其形成凝胶的静电作用力不利。适度的超声时间(0—6 min)使MP凝胶的归一化强度I850/I830比值从0.9805增加至1.023(P<0.05),表明MP与水分子形成的“蛋白-水分子”氢键增多,6 min过后比值减少,蛋白与水分子之间的氢键减弱;超声波处理0—6 min后的MP凝胶保水性从47.5899%快速升至72.9855%(6 min)(P<0.05),之后随时间延长,凝胶的保水性减少至44.356%。相关性分析结果表明,保水性与总巯基的相关性不大(P>0.05),与活性巯基显著相关(P<0.05),与表面疏水性、电位绝对值和氢键都极显著相关(P<0.01)。【结论】超声波显著影响肌原纤维蛋白凝胶化学作用力与保水性;疏水作用力、静电斥力和氢键是决定保水性的主要作用力,而二硫键次之;超声波处理时间为6 min时为最优条件,在此条件下,凝胶的疏水作用力、氢键和静电斥力均达到最大,致使凝胶网络结构均匀致密,能最大限度的保留水分。
肌原纤维蛋白凝胶;二硫键;疏水作用力;静电斥力;氢键;保水性
0 引言
【研究意义】超声波作为一种快速、高效并且可靠的新兴技术,已经在食品加工行业得到广泛的应用[1-2],其所形成的空化效应能够产生高能量的作用力,包括剪切力、冲击波和湍流作用,因此可以改变蛋白分子的功能特性[3]。保水性是肌原纤维蛋白(MP)热诱导凝胶最重要的功能特性之一[4]。而MP热诱导凝胶的功能特性(比如凝胶保水性)主要取决于化学作用力[5]。因此,研究超声波对MP热诱导凝胶的保水性与作用力关系的影响,探究保水性与化学作用力之间的关系以及最优超声波处理条件,不仅可以为超声波处理在肌肉肉糜凝胶制品中的应用提供技术参数和理论依据,而且对提高肉制品品质也具有重要意义。【前人研究进展】JAMBRAK等[6]指出超声能够增加大豆蛋白的表面疏水性。LI等[7]发现超声波能够改变PSE(pale, soft and exudative)肉的功能特性,进而改善凝胶的微观结构以及流变特性。HU等[8]通过对大豆分离蛋白进行超声波处理,发现其二硫键、表面疏水性、保水性都有增加。GULSEREN等[3]研究表明超声作用乳清蛋白能够显著提高其溶解性并将其流变性改为剪切稀化流体。同时ZISU等[9]采用频率为20 KHz,功率为400 W的超声波能够降低酪蛋白和乳清蛋白的粘性,增加其凝胶性。超声波处理MP可以促进其溶解,进而可以提高肉制品的保水性、嫩度等功能特性[10-11]。ZHANG等[5]用拉曼光谱法测定了鸡胸肉蛋白分子间的氢键。【本研究切入点】目前,国内外尚未见超声波对肌原纤维蛋白凝胶中化学作用力与保水性共同影响的报道,也未见超声波处理下保水性与化学作用力之间关系的报道,而开展此方面的研究能为超声波处理在糜类肉制品中的应用提供参考。【拟解决的关键问题】通过控制超声波处理条件处理MP,制成热诱导凝胶后,研究超声波处理时间对MP凝胶中化学作用力(二硫键、疏水作用力、静电斥力和氢键)、凝胶保水性以及凝胶超微结构的影响,探讨超声波处理条件下对MP凝胶作用力与保水性之间的内在关系,寻找出最优的超声处理条件。
1 材料与方法
试验于2016年3—8月在南京财经大学粮油质量检测工程技术研究中心进行。
1.1 主要材料与试剂
重2.6 kg左右的活AA(Arbor Acres)鸡30只,其中公鸡和母鸡各15只,购于南京青龙山养鸡场,屠宰后取鸡胸肉,于-18℃下储存,一个月内使用。牛血清蛋白(Bovine SerumAlbumin,BSA)购于国药集团化学试剂有限公司,其他化学试剂均为分析纯。
1.2 主要仪器与设备
JY92-IIN超声波细胞粉碎机,宁波新芝生物科技股份有限公司;DS-1高速组织捣碎机,上海标本模型厂;PHS-3C型pH计,上海精密科学仪器有限公司;Avanti J-26XP高效冷冻离心机,美国Beckman Coulter公司;NMI20-Analyst低场核磁共振仪,上海纽迈电子科技有限公司;U-3900紫外分光光度仪,日本日立公司;F-7000荧光光谱仪,日本日立公司;Zeta电位分析仪(Zetasizer Malvern Nano ZS90),英国马尔文公司; LABRAM 800型激光拉曼光谱仪,法国Jobin Yvon公司;日本TM 3000扫描电镜,日本日立公司。
1.3 试验方法
1.3.1 肌原纤维蛋白的提取 鸡胸肉于4℃下解冻20 min,剔除结缔组织和脂肪,切碎后称取40 g用于提取鸡胸肉肌原纤维蛋白,蛋白提取和浓度测定方法参考杨玉玲等[12],4℃下保存。
1.3.2 MP的超声波处理以及凝胶的制备 将MP用磷酸盐缓冲液(10 mmol·L-1KH2PO4、0.6 mol·L-1KCI,pH 6.0)溶解,分别稀释至质量浓度40、30和0.5 mg·mL-1的MP溶液,取20 mL该溶液于50 mL离心管中,并将其放在装有碎冰的烧杯中,一起置于超声波细胞破碎仪中(超声探头为频率20 KHz,直径6 mm的钛金属探头),设置超声时间为0、3、6、9、12和15 min(工作时间和间歇时间分别为1 s和3 s),超声功率设为240 W,加碎冰控制样品温度为4—8℃,处理后的样品于0—4℃冰箱内储存备用,处理方法参照ZHAO等[13],且稍做改动。
超声波处理后的样品置于水浴锅中从20℃程序升温至65℃(1℃·min-1)制成凝胶,保温20 min,取出,冷却至室温,凝胶在4℃下保存9—16 h,制备30 mg·mL-1不同超声波处理的MP凝胶用于保水性、低场核磁共振测试和凝胶微观结构的测定,0.5 mg·mL-1MP凝胶用于巯基、表面疏水性和Zeta电位的测定,40 mg·mL-1MP凝胶用于拉曼光谱测定氢键。
1.3.3 巯基含量的测试 采用LIU等[14]的方法测定MP及MP凝胶样品的总巯基和活性巯基含量。总巯基含量的测定:取0.5 mg·mL-1MP样品0.5 mL,加入到4.5 mL的缓冲液中(8 mol·L-1尿素、0.01 mol·L-1EDTA、0.1 mol·L-1KH2PO4,pH 6.0),再加入100 µL Ellman试剂(0.01 mol·L-1DTNB、0.01 mol·L-1KH2PO4,pH 6.0),旋涡震荡1 min,充分混合,静置25 min,于412 nm下测定吸光值,消光系数为13 600 M-1·cm-1;活性巯基含量的测定:取0.5 mg·mL-1MP样品0.5 mL,加入到4.5 mL的缓冲液中(0.01 mol·L-1EDTA、0.1 mol·L-1KH2PO4,pH 6.0),再加入100 µL Ellman试剂(0.01 mol·L-1DTNB、0.01 mol·L-1KH2PO4,pH 6.0),旋涡震荡1 min,充分混合,静置25 min,于412 nm下测定吸光值,消光系数为13 600 M-1·cm-1。
1.3.4 疏水作用力的测定 取0.5 mg·mL-1MP及MP凝胶样品,稀释成一系列浓度(0.5 mg·mL-1、0.25 mg·mL-1、0.125 mg·mL-1、0.0625 mg·mL-1)。每个浓度取5 mL,加入25 µL缓冲液(8 mmol·L-1ANS、0.1 mol·L-1KH2PO4,pH 6.0),混匀,黑暗中静置20 min后用于测定表面疏水性。荧光分光光度计的激发波长为374 nm,发射波长为485 nm。以荧光强度对蛋白浓度作曲线,曲线初始阶段的斜率即为蛋白质的表面疏水性指标(S0-ANS)。
1.3.5 静电斥力的测定 将0.5 mg·mL-1MP及MP凝胶样品注入Zeta电位皿后,加塞,进行电位测试。测试参数:散射角90°,平衡时间60 s,测试温度25℃。
1.3.6 氢键的测定 将制备好的40 mg·mL-1凝胶样品置于载玻片上,调节好焦距后直接用激光拉曼光谱仪进行测量,测试参数:激光出射功率10 mM;激发波长514.5 nm;显微物镜50倍长焦距;狭缝200 µm;积分时间30 s;光栅600。I850/I830比值可以反映酪氨酸残基苯环上-OH是与溶剂水分子生成氢键(“暴露”式)还是与蛋白质分子其他基团(如-COOH)生成氢键(“包埋”式)。公式:N包埋+N暴露=1,0.5 N包埋+ 1.25 N暴露=I850/I830,因此,可以计算出酪氨酸残基“埋藏”式和“暴露”式的摩尔分数[15]。
1.3.7 保水性的测定 保水性(water holding capacity,WHC)通过KOCHER等[16]的离心法测定。将制备好的凝胶称重后于4℃下10 000×g离心10 min,去除上清液。记录空离心管的重量以及离心后离心管与凝胶的总重量。每个样品重复3次。WHC(%)=(W2-W)/(W1-W)×100。式中,W为离心管质量;W2为离心后质量;W1为离心前质量。
1.3.8 水分子弛豫特性 采用低场核磁共振法测定。将2 mL MP凝胶放入直径15 mm的核磁管中,之后放入核磁共振分析仪,进行低场核磁共振(low-field nuclear magnetic resonance,LF-NMR)测试。测试条件:质子共振频率为19 MHz,磁场强度为(0.5±0.08)T,测量温度为32℃,90°脉宽13 µs,180°脉宽25 µs,回波次数12 000,等待时间1 500 ms,采样频率200 KHz,模拟增益20 db,累加次数为4次。自旋-自旋弛豫时间T2用CPMG序列进行测量[17-18]。T2b、T21和T22是3种水分的弛豫时间,PT2b、PT21和PT22是相应的峰面积百分比,即各水分的百分比。PT2b反映的是与大分子物质紧密结合的水分[19],PT21反映的是束缚在凝胶网络里的水分,PT22反映的是凝胶中的自由水[20]。
1.3.9 微观结构的测定 MP凝胶的微观结构用扫描电镜(scanning electron microscopy,SEM)测定,将制备的凝胶切成5 mm厚的小块,用3%的戊二醛固定2 h,然后用缓冲液(0.1 mol·L-1KH2PO4,pH 6.0)清洗1 h,再进行不同梯度的乙醇脱水(50%、70%、 90%、95%和100%),每次30 min, 再用叔丁醇置换3次,-20℃预冻2 d,-70℃冷冻干燥72 h,喷金镀膜后用SEM观察微观结构,加速电压15 kV。
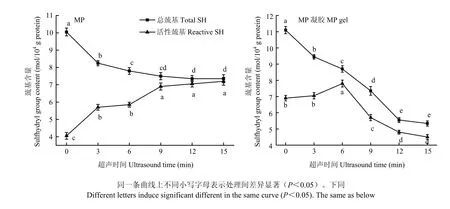
图1 超声波处理对肌原纤维蛋白和肌原纤维蛋白凝胶巯基含量的影响Fig. 1 Effect of ultrasound treatment on sulfhydryl group content of MP and MP gel
1.3.10 统计分析 用SPSS17.0软件相关性分析和方差分析,若方差分析效应显著则用Duncan multiple range test进行多重比较(P<0.05)。
2 结果
2.1 巯基含量
如图1所示,在0—6 min内,MP总巯基的含量随着超声时间的增加而显著减少(P<0.05),活性巯基显著增加;超声时间超过6 min后,二者变化趋势逐渐变缓;超过9 min后活性巯基和总巯基均没有显著变化。总巯基含量指暴露在蛋白表面和埋藏在蛋白分子内的巯基,而活性巯基指暴露在蛋白分子表面的巯基[21]。总巯基含量减少代表二硫键的生成[10]。由此可见,超声波处理破坏了蛋白的结构,随超声波处理时间延长,蛋白分子逐渐展开,内部巯基逐渐暴露,使活性巯基含量达到最大并促进MP分子内部的巯基形成二硫键。
与MP原料总巯基含量相比,MP热诱导凝胶的总巯基含量随超声时间延长而显著降低,活性巯基含量随超声时间的增加呈先上升后下降,在处理6 min时活性巯基含量最高,这说明加热成胶过程为二硫键的形成提供了充分能量,促使活性巯基也生成了二硫键,并且超声波处理时间越长,在加热过程中活性巯基越容易转变成二硫键。这可能是因为长时间超声波处理为活性巯基提供了更多能量,使之处于高能状态,从而降低了活性巯基转变成二硫键的活化能。
2.2 疏水作用力
如图2所示, 超声波处理3 min后,MP样品的表面疏水性急剧增加(P<0.05),表明在超声处理之前,很多疏水基团都包埋在蛋白分子内部,超声波的空穴效应以及微束流能够将这些基团暴露出来。与MP样品表面疏水性对比可知,MP热诱导凝胶表面疏水性更大,在0—6 min,随超声波处理时间增加,MP凝胶表面疏水性急剧增加(P<0.05),且6 min 时表面疏水性最大为1 489.5。超过6 min后开始急剧下降,最终趋于平缓。说明随着超声波处理时间延长,蛋白质展开程度增加,疏水基团逐渐暴露,但超过6 min后增加的蛋白表面疏水性并没有转化成热诱导凝胶的疏水作用力,而是又被包裹在凝胶网络中。
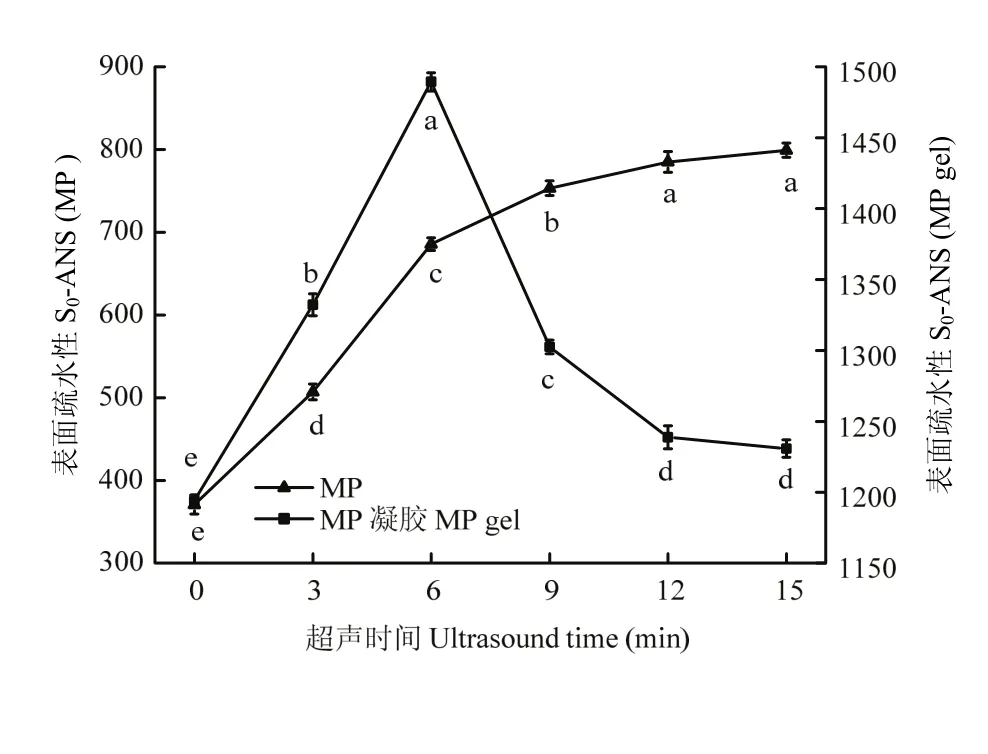
图2 超声波处理对肌原纤维蛋白和肌原纤维蛋白凝胶表面疏水性影响Fig. 2 Effect of ultrasound treatment on surface hydrophobicity of MP and MP gel
2.3 静电斥力
如图3所示,MP的电位全是负值,说明蛋白表面负电荷要比正电荷多,净电荷为负电荷。超声波处理后MP的Zeta电位绝对值逐渐增大,表明蛋白质所带负电荷逐渐增加,蛋白质展开程度增加。经超声波热处理凝胶化后,MP凝胶Zeta电位的绝对值先从6.03 mV(0 min)迅速增加到7.67 mV(6 min)后又急剧降至6.13 mV(15 min),而且在处理6 min之前,MP凝胶的电位绝对值显著高于MP的电位值。因此,超声时间处理不足6 min时,MP分子的适度展开能提高凝胶的静电斥力,但过度展开导致其热诱导凝胶的静电斥力迅速降低。
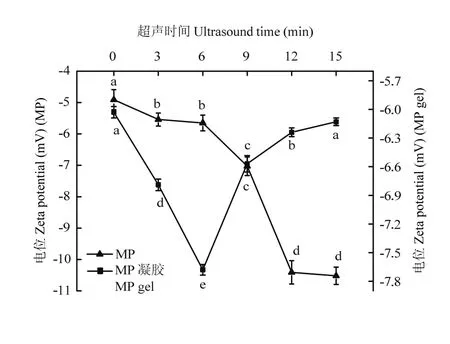
图3 超声波处理对肌原纤维蛋白和肌原纤维蛋白凝胶Zeta电位的影响Fig. 3 Effect of ultrasound treatment on zeta potential of MP and MP gel
2.4 氢键
对I850/I830结果利用1.3.6中的公式进行计算得表1,N暴露呈现先上升后下降的趋势,N暴露从0.6406(0 min)增加到0.6973(6 min),说明蛋白分子上的酪氨酸酚羟基暴露增加,即在水环境中与水分子形成更多的氢键。而N包埋从0.34(9 min)增加到0.3427(15 min),表明越来越多的酪氨酸酚羟基被包埋在蛋白质的疏水微环境中,与其他蛋白质分子形成的氢键更多。由此可以看出超声波处理时间为6 min时MP凝胶分子与水分子形成的氢键最多。
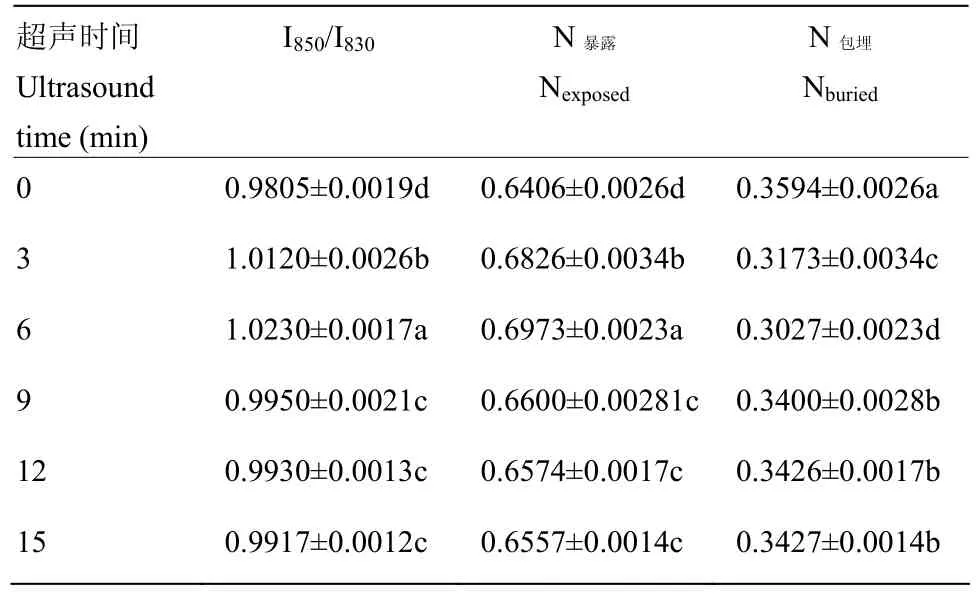
表1 超声处理对MP凝胶“暴露”式和“埋藏”式酪氨酸残基摩尔分数的影响Table 1 Effect of ultrasound treatment on molar fractions ofexposed and buried tyrosine residues of MP gel
2.5 保水性
随着超声时间的增加,MP凝胶的保水性从47.5899%(0 min)快速升至72.9855%(6 min),而后快速降到49.4235%(9 min),再逐渐降至44.356%(15 min)(图4-A),这表明短时间超声波处理(0—6 min)可以显著增强凝胶的保水性,并且处理6 min时的凝胶具有最高保水性,较长时间超声波处理(6—15 min)会降低凝胶的保水性。这一变化趋势与凝胶的疏水作用力、静电斥力、氢键的变化趋势一致(图2、图3和表1中的凝胶部分)。
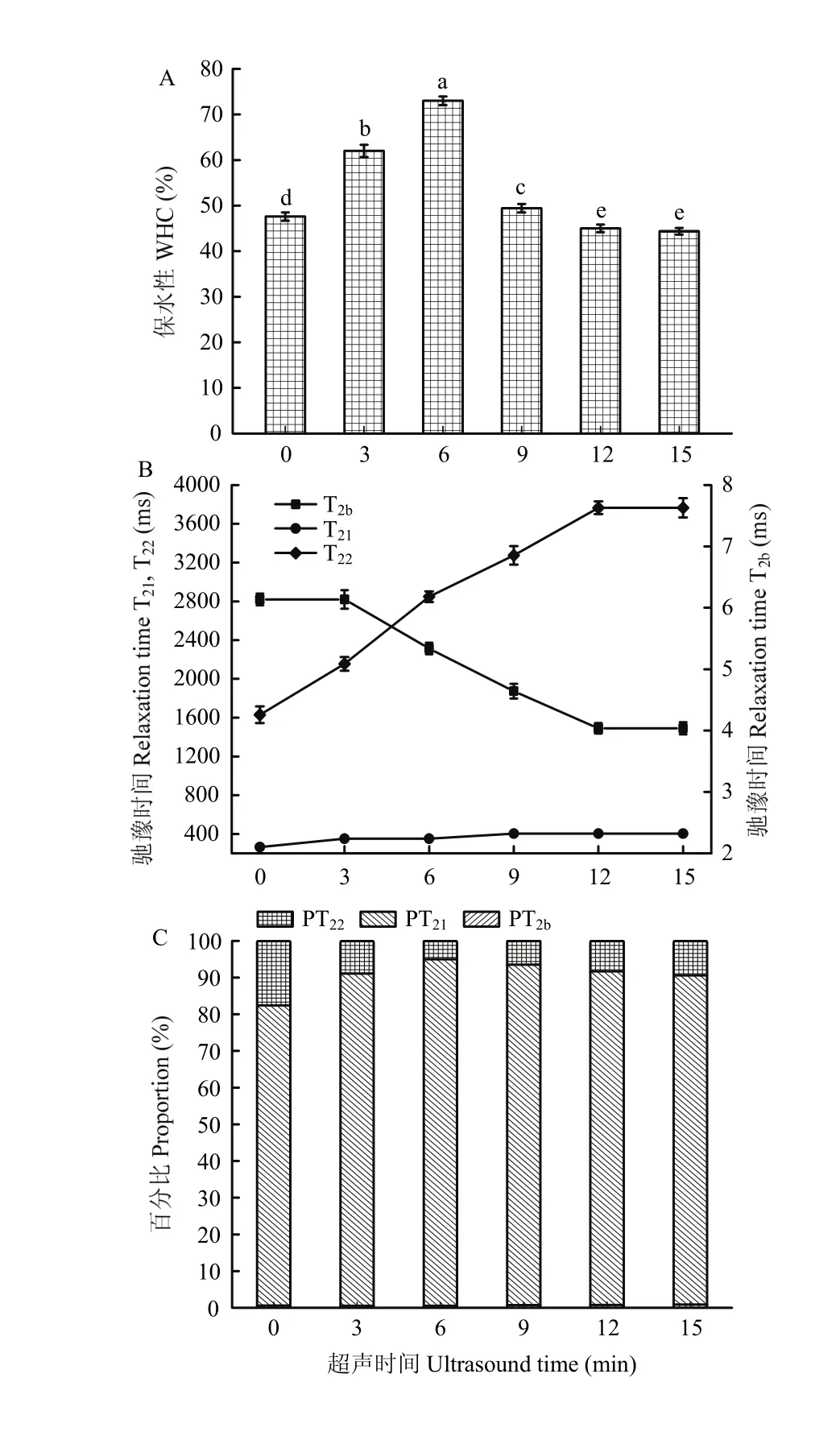
图4 超声波处理对肌原纤维蛋白凝胶保水性(A)、各水分驰豫时间(B)和各水分比例(C)的影响Fig. 4 Effect of ultrasound treatment on water holding capacity (WHC) (A), relaxation time of T2b, T21, T22(B) and proportions of different kinds of water (C) of MP gel
如图4-B所示,超声波热处理MP后使结合水(T2b)显著下降(P<0.01),说明超声波处理后形成凝胶的这部分水结合的更加紧密,水分子的移动性降低。束缚水(T21)的变化不是很明显(P>0.05),而自由水(T22)显著增加(P<0.01),说明自由水的移动性更强。图4-C为这3种水分各占的百分比,随着超声时间的增加,结合水(PT2b)的比例从0.611%(0 min)增至0.86%(15 min),表明更多的水分子与蛋白质结合,但因为其占总峰面积的百分比很小(不足1%),因此,保水性的变化与此成分关系不大。束缚水(PT21)从81.7796%(0 min)增至94.484%(6 min),之后又降至89.739%(15 min),表明短时间超声波处理(≤6 min)会使更多的水分被束缚在凝胶网络中,可能凝胶保水性的改善为这部分水。自由水(PT22)从18.1593%(0 min)降至5.4637%(6 min),之后又升至10.175%(15 min),表明更多的自由水留在了凝胶网络里,而超声处理6 min以后,自由水又逐渐增加,可能是由于长时间的超声波处理破坏了均匀的凝胶网络结构。
2.6 相关性分析
由表2可知,MP凝胶的保水性与总巯基的相关性不大(P>0.05),与活性巯基显著相关(P<0.05),相关系数为0.835,因此二硫键对凝胶保水性的影响可能比较复杂,需要进一步的分析才能正确判断。保水性与表面疏水性、电位绝对值和氢键之间均呈极显著相关(P<0.01),相关系数分别为0.938、0.954、0.926,表明疏水相互作用、静电相互作用和氢键是决定凝胶保水性的主要作用力。
2.7 微观结构
超声波处理后的MP凝胶空间结构与未处理的样品相比,结构变得更加致密均匀,网孔更小(图5)。经过超声3 min处理后,网络凝胶结构变化不是很多,但是较未处理的凝胶相比,网孔变小,初步有了较好的凝胶。6 min处理后的凝胶网络细腻,孔径小且分布均匀,呈现蜂窝状胶束,蛋白分子间的相互作用达到较好的平衡。当超声时间达到9 min及以上时,均匀的凝胶结构遭到破坏,凝胶网孔变大,且不均匀,蛋白质凝胶网络结构变得粗糙。
3 讨论
凝胶形成是蛋白质分子内部邻近肽链之间引力和斥力平衡的结果,斥力由蛋白表面净电荷提供,而引力是由疏水作用力、氢键等共同提供的。共价键二硫键在MP凝胶中的作用说法不一。SMYTH等[22]认为肌球蛋白凝胶网络形成交联的作用力是巯基受热作用形成的二硫键。WANG等[23]给出了不同的观点,认为二硫键形成不是凝胶形成的前提,仅仅增加网络中多肽的平均分子量,增加链的长度。在研究二硫键时,一般用总巯基含量减少表示二硫键的形成。ZHANG等[10]指出超声波能够使水分子解离出高活性的自由基(H2O→·H+·OH),进而反应生成的过氧化氢很容易把蛋白质中的巯基氧化成二硫键,总巯基减少。FEMANDEZ-DIAZ等[24]指出脉冲电场能够使卵清蛋白分子打开,从而使内部的巯基暴露出来。还有文献指出超声波能够使活性巯基增多[25-26]。这些变化趋势与本试验MP原料的巯基变化趋势一致。本试验中MP热诱导凝胶的总巯基含量随超声时间的增加而减少,而活性巯基先增加后减小。通过与MP原料的指标相比较,发现超声波处理破坏了蛋白的结构,使蛋白分子展开并暴露出更多的活性巯基,并促进了MP分子内部巯基转变成二硫键。但以往的文献都不能解释在超声波处理超过6 min后,随处理时间延长,活性巯基在原料中一直含量较高,但在凝胶中逐渐降低的现象。对任意一个化学反应而言,影响化学反应速度的因素取决于3个因子,即扩散因子、碰撞频率因子和活化能,超声波作用提高了MP分子的扩散性和碰撞频率,但MP的活性巯基并没有转化成二硫键。因此,本研究认为,这种现象的发生是因为长时间超声波处理为活性巯基提供了更多能量,使其处于高能
状态,而降低了活性巯基转变成二硫键的活化能;同时在热诱导凝胶形成的过程中,蛋白质分子链相互靠近,高能态的活性巯基在热的作用下转变成蛋白质链间的二硫键,因此,长时间强超声波处理与加热共同作用促使MP分子间二硫键的形成。
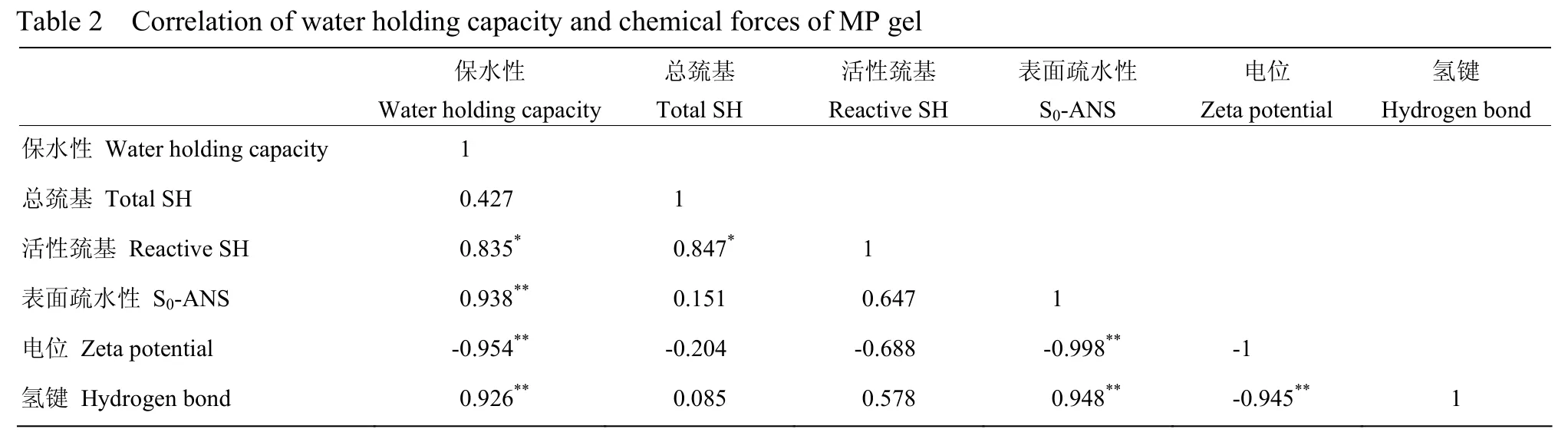
表2 保水性与MP凝胶化学作用力之间的相关性

图5 超声波处理对肌原纤维蛋白凝胶微观结构的影响(电镜照片2000倍)Fig. 5 Effect of ultrasound treatment on microstructure (SEM micrographs at 2000×) of MP gel
疏水作用力、静电作用力和氢键为凝胶中的非共价键作用力。目前几乎没有关于超声波处理对MP凝胶非共价键作用力影响的报道。疏水作用力可以用其表面疏水性来衡量,后者能反映蛋白质分子微观构象的变化[27]。并可以用荧光分光光度法进行测定[28]。Zeta电位是带电颗粒表面剪切层的电位,可用于描述蛋白颗粒之间的静电斥力[29-30]。HANAOR等[31]认为Zeta电位高的胶粒之间是静电稳定的,容易形成稳定的分散体系。拉曼光谱可用于检测蛋白质凝胶中的氢键,它是基于酪氨酸残基上含有羟基,是形成氢键的重要基团,酪氨酸残基在850 cm-1和830 cm-1附近的两个谱峰,是对取代苯环呼吸振动和面外呼吸振动之间的费米共振产生的,其I850/I830比值的变化情况可以反映MP凝胶中氢键变化[5]。本试验中,原料MP的表面疏水性和Zeta电位值均随处理时间延长逐渐增加到最大值。而经短时间超声波处理(≤6 min)MP形成的热诱导凝胶的表面疏水性、Zeta电位值和I850/I830归一化强度都随超声时间延长逐渐增加,并都在6 min时达到最大值,之后又都逐渐下降。这是由于超声波处理能够破坏蛋白聚集体,并使蛋白质分子链逐渐展开,暴露更多的疏水基团、带电基团和羟基等极性基团,因此,MP原料的这些指标随处理时间增强而增加,短时间超声波处理的MP热诱导凝胶的疏水作用力、静电斥力和氢键也因此逐渐增加。长时间处理的MP在加热形成凝胶的过程中,有大量的链间二硫键形成,限制了蛋白质分子链的伸展和有序排列,导致其各种功能基团被包埋在蛋白质颗粒和凝胶网络内部,因此,随处理时间延长,凝胶的各种非共价键作用力均逐渐减弱。HU等[8]指出大豆分离蛋白经超声波处理后,表面疏水性也显著提高,这与MP原料的变化趋势一致。
保水性是凝胶性质中的一种重要性质。离心法是测定凝胶保水性的常用方法,然而高速离心会破坏凝胶的网络结构,所测得的保水值不能很好的反映出凝胶在完好状态下的保水性。而低场核磁共振是一种无损的、非侵入式的测量高含水量样品水分分布状态和移动性的工具[32]。所以能够在不破坏凝胶结构的情况下测定凝胶中各种水的可移动性及各水分的比例,能够较好地反映凝胶保水性[33-34]。凝胶中结合水(PT2b)面积均小于总峰面积的1%,其所占比例随超声时间延长而增加是因为MP表面的电荷增加及其分子中极性基团增多。凝胶网络中束缚水(PT21)的比例最多,占总水分的80%以上,束缚水比例随超声时间增大的改变趋势与离心法测定的保水性变化趋势一致,表明凝胶中所保留的水分大多是束缚水。PEARCE等[35]认为PT21的提高意味着MP外部水的增加,肉的保水性增加。
凝胶保水性的大小受其作用力影响。PUOLANNE等[4]指出蛋白质凝胶中水分的保持,主要依靠水和蛋白质之间的电荷相互作用、氢键以及毛细管作用。而KOHYAMA等[36]指出在热诱导凝胶形成过程中,疏水作用力能形成更好的蛋白-蛋白聚集物,从而能够促进形成均一、致密结构的凝胶,最终凝胶的保水性得到提高。OFFER等[37]指出在高静电斥力条件下,蛋白质结构变得松散、均匀,并且净电荷增加意味着能结合水分子的氢键结合位点增加,从而使更多的水保留在凝胶中。本研究表明,MP凝胶的疏水作用力、静电斥力以及氢键都与保水性极显著相关。保水性增加原因之一是,随着超声时间增加,蛋白质展开、形成这些作用力的疏水基团、带电基团和极性基团等均逐渐暴露,这些基团分别通过疏水水合、偶极-离子、偶极-偶极3种形式与水分子发生作用,使凝胶中结合水含量增加,其中水与蛋白质中COO-等带电基团的作用强度最大、水与-OH等极性基团的作用次之,非极性基团通过疏水水合作用固定的水分子最弱。另外的一个重要原因是,短时间的超声处理使维持MP凝胶网状结构的静电斥力与疏水作用力和氢键等引力在更高的水平上达到平衡,凝胶的网状结构更加均匀、致密、牢固,使更多的水分束缚在凝胶的网络中,导致凝胶中的束缚水急剧增加。保水性降低是因为当蛋白分子表面净相同电荷较少时,蛋白分子间的静电斥力降低,分子间相互接近并发生絮凝,形成的凝胶网络结构中网孔变大,无法容纳更多的水分;同时由于蛋白质分子所带的负电荷减少,蛋白质与水分子间通过偶极-离子作用结合的水分子显著减少。典型的实例是,在6 min时,MP凝胶的非共价键作用力最大,凝胶的网状结构也最均匀、致密、呈蜂窝状,此时保水性也是最好的。SHARP等[38]指出呈现“蜂窝”状结构的凝胶网络,可以容纳更多的水分。长时间超声处理结果也可以同样解释。本研究还发现,超声波处理通过改变MP凝胶中分子间二硫键的含量影响凝胶的保水性,超声时间延长,凝胶中分子间二硫键增加(即活性巯基减少)导致凝胶的保水性下降。
4 结论
短时间超声波处理(0—6 min)促进肌原纤维蛋白分子适度展开,显著提高凝胶的疏水作用力和静电斥力,并使凝胶中肌原纤维蛋白与水分子形成的氢键增多,凝胶的保水性逐渐增加。肌原纤维蛋白凝胶的疏水作用力、静电斥力以及氢键都与保水性极显著相关,超声波处理时间为6 min时,凝胶的疏水作用力、氢键和静电斥力均达到最大,凝胶中的引力和斥力在最高的水平上达到平衡,致使凝胶网络结构均匀致密,能最大限度的保留水分。肌原纤维蛋白凝胶的保水性与与活性巯基显著相关,说明超声波处理通过改变肌原纤维蛋白凝胶中分子间二硫键的含量影响凝胶的保水性,但其影响力比疏水相互作用、静电相互作用和氢键要小。
[1] CHANDRAPALA J, OLIVER C, KENTISH S, ASHOKKUMAR M. Ultrasonics in food processing. Ultrasonics Sonochemistry, 2012, 19(5): 975-983.
[2] JAMBRAK A R, LELAS V, MASON T J, KRESIC G, BADANJAK M. Physical properties of ultrasound treated soy proteins. Journal of Food Engineering, 2009, 93(4): 386-393.
[3] GULSEREN I, GUZEY D, BRUCE B D, JOCHEN W. Structural and functional changes in ultrasonicated bovine serum albumin solutions. Ultrasonics Sonochemistry, 2007, 14(2): 173-183.
[4] PUOLANNE E, HALONEN M. Theoretical aspects of water-holding in meat. Meat Science, 2010, 86(1): 151-165.
[5] ZHANG Z Y, YANG Y L, TANG X, CHEN Y, YOU Y. Chemical forces and water holding capacity study of heat-induced myofibrillar protein gel as affected by high pressure. Food Chemistry, 2015, 188: 111-118.
[6] JAMBRAK A R, MASON T J, LELAS V, LARYSA P, ZORAN H. Effect of ultrasound treatment on particle size and molecular weight of whey proteins. Journal of Food Engineering, 2014, 121: 15-23.
[7] LI K, KANG Z L, ZOU Y F, XU X L, ZHOU G H. Effect of ultrasound treatment on functional properties of reduced-salt chicken breast meat batter. Journal of Food Science and Technology, 2015, 52(5): 2622-2633.
[8] HU H, WU J H, EUNICE C Y, CHAN L, ZHU L, ZHANG F, XU X Y, FAN G, WANG L F, HUANG C J, PAN S Y. Effects of ultrasound on structural and physical properties of soy protein isolate (SPI) dispersions. Food Hydrocolloids, 2013, 30(2): 647-655.
[9] ZISU B, BHASKARACHARYA R, KENTISH S, MUTHUPANDIAN A . Ultrasonic processing of dairy systems in large scale reactors. Ultrasonics Sonochemistry, 2010, 17(6): 1075-1081.
[10] ZHANG Z Y, REGENSTEIN J M, ZHOU P, YANG Y L. Effects of high intensity ultrasound modification on physicochemical property and water in myofibrillar protein gel. Ultrasonics Sonochemistry, 2017, 34: 960-967.
[11] MCCLEMENTS D J. Advances in the application of ultrasound in food analysis and processing. Trends in Food Science & Technology, 1995, 6(9): 293-299.
[12] 杨玉玲, 游远, 彭晓蓓 陈银基. 加热对鸡胸肉肌原纤维蛋白结构与凝胶特性的影响. 中国农业科学, 2014, 47(10): 2013-2020.
YANG Y L, YOU Y, PENG X B, CHEN Y J. Influence of heating on structure and gel properties of myofibrillar proteins from chicken breast muscle. Scientia Agricultura Sinica, 2014, 47(10): 2013-2020. (in Chinese)
[13] ZHAO Y Y, WANG P, ZOU Y F, LI K, KANG Z L, XU X L, ZHOU G H. Effect of pre-emulsification of plant lipid treated by pulsed ultrasound on the functional properties of chicken breast myofibrillar protein composite gel. Food Research International, 2014, 58: 98-104.
[14] LIU R, ZHAO S M, XIE B J, XIONG S B. Contribution of protein conformation and intermolecular bonds to fish and pork gelation properties. Food Hydrocolloids, 2011, 25(5): 898-906.
[15] ZHANG Z Y, YANG Y L, TANG X Z, CHEN Y J, YOU Y. Effects of ionic strength on chemical forces and functional properties of heat-induced myofibrillar protein gel. Food Science and Technology Research, 2015, 21(4): 597-605.
[16] KOCHER P N, FOEGEDING E A. Microcentrifuge-based method for measuring water-holding of protein gels. Journal of Food Science, 1993, 58(5): 1040-1046.
[17] CARR H Y, PURCELL E M. Effects of diffusion on free precession in nuclear magnetic resonance experiments. Physical Review, 1954, 94(3): 630.
[18] MEIBOOM S, GILL D. Modified spin-echo method for measuring nuclear relaxation times. Review of Scientific Instruments, 1958, 29(8): 688-691.
[19] OFFER G, KNIGHT P, JEACOCKE R, ALMOND R, COUSINS T, ELSEY J, PARSONS N, SHARP A, STARR R, PURSLOW P. The structural basis of the water-holding, appearance and toughness of meat and meat products. Food Structure, 1989, 8(1): 17.
[20] HAN M Y, WANG P, XU X L, ZHOU G H. Low-field NMR study of heat-induced gelation of pork myofibrillar proteins and its relationshipwith microstructural characteristics. Food Research International, 2014, 62: 1175-1182.
[21] HAMADA M, ISHIZAKI S, NAGAI T. Variation of SH content and kamaboko-gel forming ability of shark muscle protein by electrolysis. Journal of Shimonoseki University of Fisheries, 1994, 42: 131-135.
[22] SMYTH A B, SMITH D M, O'NEILL E. Disulfide bonds influence the Heat-induced gel properties of chicken breast muscle myosin. Journal of Food Science, 1998, 63(4): 584-587.
[23] WANG S F, SMYTH A B, SMITH D M. Gelation properties of myosin: role of subfragments and actin in macromlecular interactions in food technology. American Chemical Society, 1996: 650.
[24] FEMANDEZ-DIAZ M D, BARSOTTI L, DUMAY E, CHEFTEL J C. Effects of pulsed electric fields on ovalbumin solutions and dialyzed egg white. Journal of Agricultural and Food Chemistry, 2000, 48(6): 2332-2339.
[25] ARZENI C, MARTINEZ K, ZEMA P, ARIAS A, PEREZ O E, PILOSOF A M R. Comparative study of high intensity ultrasound effects on food proteins functionality. Journal of Food Engineering, 2012, 108(3): 463-472.
[26] CAMPBEL L J, GU X, DEWAR S J, EUSTON S R. Effects of heat treatment and glucono-δ-lactone-induced acidification on characteristics of soy protein isolate. Food Hydrocolloids, 2009, 23(2): 344-351.
[27] SANTE-LHOUTELLIER V, AUBRY L, GATELLIER P. Effect of oxidation on in vitro digestibility of skeletal muscle myofibrillar proteins. Journal of Agricultural and Food Chemistry, 2007, 55(13): 5343-5348.
[28] ZHANG Z Y, YANG Y L, ZHOU P, ZHANG X, WANG J Y. Effects of high pressure modification on conformation and gelation properties of myofibrillar protein. Food Chemistry, 2017, 217: 678-686.
[29] HUNTER R J. Zeta Potential in Colloid Science: Principles and Applications. New York/London: Academic Press, 2013.
[30] RUNKANA V, SOMASUNDARAN P, KAPUR P C. Mathematical modeling of polymer-induced flocculation by charge neutralization. Journal of Colloid and Interface Science, 2004, 270(2): 347-358.
[31] HANAOR D, MICHELAZZI M, LEONELLI C, SORRELL C C. The effects of carboxylic acids on the aqueous dispersion and electrophoretic deposition of ZrO 2. Journal of the European Ceramic Society, 2012, 32(1): 235-244.
[32] BERTRAM H C, ERSEN H J. Applications of NMR in meat science. Annual Reports on NMR Spectroscopy, 2004, 53: 157-202.
[33] RUAN R R, CHEN P L. Water in Foods and Biological Materials. CRC Press, 1998.
[34] YASUI T, ISHIOROSHI M, NAKANO H, SAMEJIMA K. Changes in shear modulus, ultrastructure and spin-spin relaxation times of water associated with heat-induced gelation of myosin. Journal of Food Science, 1979, 44(4): 1201-1204.
[35] PEARCE K L, ROSENVOLD K, ANDERSEN H J, HOPKINS D L. Water distribution and mobility in meat during the conversion of muscle to meat and ageing and the impacts on fresh meat quality attributes-A review. Meat Science, 2011, 89(2): 111-124.
[36] KOHYAMA K, SANO Y, DOI E. Rheological characteristics and gelation mechanism of tofu (soybean curd). Journal of Agricultural and Food Chemistry, 1995, 43(7): 1808-1812.
[37] OFFER G, TRINICK J. On the mechanism of water holding in meat: the swelling and shrinking of myofibrils. Meat Science, 1983, 8(4): 245-281.
[38] SHARP A, OFFER G. The mechanism of formation of gels from myosin molecules. Journal of the Science of Food and Agriculture, 1992, 58(1): 63-73.
Effects of Ultrasound on Chemical Forces and Water Holding Capacity Study of Heat-Induced Myofibrillar Protein Gel
WANG JingYu1, YANG YuLing1, KANG DaCheng2, TANG XiaoZhi1, ZHANG Xing1, MA Yun1, NI WenXi1
(1College of Food Science and Engineering/Collaborative Innovation Center for Modern Grain Circulation and Safety/Key Laboratory of Grains and Oils Quality Control and Processing, Nanjing University of Finance and Economics, Nanjing 210023;2College of Food Science and Technology, Nanjing Agricultural University/Collaborative Innovation Center for Meat Production and Processing, Quality and Safety Control, Nanjing 210095 )
myofibrillar protein gel; disulfide bond ; hydrophobic force ; electrostatic repulsion; hydrogen bond; water holding capacity; microstructure
2016-10-31;接受日期:2017-02-10
国家自然科学基金(31371798)、江苏省高校优势学科建设工程资助项目
联系方式:王静宇,E-mail:jimixy8072@yeah.net。通信作者杨玉玲,E-mail:yulingy@sina.com
Abstract: 【Objective】 The influences of ultrasound on chemical forces and water holding capacity of myofibrillar protein (MP) gel were studied. The relationship between MP gel chemical forces and WHC was revealed.【Method】AA type broilers were slaughtered. The MP was extracted from breast muscle. The MP solution and heat induced gel in different ultrasound times were prepared. Total sulfhydryl group (SH) content changes of gel were used to reflect the formation of disulfide bond. Surface hydrophobicity and Zeta potential value of the gel were employed to present the hydrophobic interaction and electrostatic repulsion, respectively. The ratio of I850/I830was used to show the hydrogen bonding changes of gel. Water holding capacity (WHC) of MP gel was calculated by high-speed centrifuge.【Result】As the ultrasonic time (UT) increased (0-6 min), the total SH contents of the MP gel decreased and reactive SH content significantly increased, at stronger UT (6-15 min), the total SH and reactive SH contents all decreased. At short time (0-6 min), the changing trends of MP and MP gel about the total SH and reactive SH content were the same, while the total SH and reactive SH contents of MP all had no significant changes (P>0.05) over 6 min, suggesting that UT promoted internal SH of MP into disulfide bond for shorter time, and UT and heating gel for longer time work together to promote reactive SH into disulfide bond. Surface hydrophobicity of MP gels increased from 1 194.1 to 1 489.5 (P<0.05) and decreased from 1 489.5 to 1 230.8 at last, for the cavitation phenomenon induced by UT could bring the hydrophobic regions into the surface, while at UT>6 min, the hydrophobic group was wrapped in the gel network. Zeta potential value of the gel changed from 6.03 to 7.68(P<0.05)(0-6 min), and then decreased over 6 min, which showed that ultrasonic wave made protein molecular chain unfolding, negatively charged by exposure, resulting in the stronger electrostatic repulsion, while excessive expansion of MP molecules were not conducive to the electrostatic force of the gel. After moderate UT (0-6 min), the normalized intensity of I850/I830ratio increased from 0.9805 to 1.023 (P<0.05), which indicated that more phenolic hydroxyl groups of tyrosine were exposed to the aqueous environment, generating hydrogen bonds with water molecules, while the ratio decreased at UT>6 min, hydrogen bonds between water molecules and protein were weaken. At UT ≤6 min, the WHC of samples increased sharply from 47.5899% to 72.9855% (6 min) (P<0.05), while at 9 min and above, WHC dropped gradually to 44.356%. Results of the correlation analysis showed that WHC of MP gel was unrelated to total SH content (P>0.05) and was significantly related to reactive SH content (P<0.05) and had a significantly correlation with Zeta potential absolute value, the surface hydrophobicity and hydrogen bonding (P<0.01).【Conclusion】Ultrasound has significant impacts on both chemical forces and water holding capacity of the MP gel. Hydrophobic force, electrostatic repulsion and hydrogen bonding play important roles in holding water in MP gels, disulfide bonds not. Thus a value of 6 min is the optimum time for the water holding capacity of MP gel, under this condition, hydrophobic force, hydrogen bonding and electrostatic repulsion of the gel are maximum, resulting in the gel network structure of uniform density, and retaining water at best.
