平欧杂种榛实时荧光定量PCR内参基因的筛选与体系建立
2017-07-24杨丹李清王贵禧马庆华朱利泉
杨丹,李清,王贵禧,马庆华,朱利泉
(1西南大学农学与生物科技学院,重庆 400716;2中国林业科学研究院林业研究所/国家林业局林木培育实验室/林木遗传育种国家重点实验室,北京 100091)
平欧杂种榛实时荧光定量PCR内参基因的筛选与体系建立
杨丹1,李清2,王贵禧2,马庆华2,朱利泉1
(1西南大学农学与生物科技学院,重庆 400716;2中国林业科学研究院林业研究所/国家林业局林木培育实验室/林木遗传育种国家重点实验室,北京 100091)
【目的】构建中国榛属植物主要栽培种平欧杂种榛实时荧光定量PCR内参基因的筛选体系,并筛选稳定的内参基因,为榛属植物的基因表达分析提供内参基因,进而为其植物资源利用和创新育种研究提供理论基础。【方法】利用课题组前期对平欧杂种榛不同亲和性授粉、授粉后不同时间的雌蕊转录组测序数据,结合相关文献搜索,共选取12个候选内参基因;以平欧杂种榛主栽品种‘达维’的盛花期雌蕊、未伸长期雄花序、幼嫩叶片、花粉、一年生枝形成层、嫩茎、根尖、根蘖等8个不同组织器官为研究材料;通过反转录PCR初筛,实时荧光定量PCR检测表达量,并利用geNorm、NormFinder、BestKeeper、Delta Ct程序和RefFinder在线网站评价内参基因的稳定性。【结果】反转录PCR初筛表明,12个候选内参基因引物的特异性良好,ChaSTP5和ChaTF在不同组织器官材料中表达存在明显差异,其余候选内参基因在8个组织中均有表达。实时荧光定量PCR的表达谱分析表明,Ch18S rRNA的表达量最高,ChaSTP5表达量最低,其余10个候选内参基因均为中等表达量;ChaSTP5和ChaTF的稳定性最差,其余10个候选内参基因的稳定性处于中等水平。geNorm、NormFinder、BestKeeper和Delta Ct的结果表明,ChaActin均排名第一,为最稳定的内参基因,Ch18S rRNA的排名均在前五,而其他候选内参基因在不同程序分析结果中的排名存在差异。稳定性综合分析表明,ChaActin和Ch18S rRNA的稳定性良好,即在8个不同组织器官中表达量均一且在4个稳定性分析程序中均排名靠前,适合作为内参基因;geNorm程序的变异系数分析则表明,选取6个内参基因便可对RT-qPCR的数据进行精准的标准化处理;相关性分析表明,4个程序均在0.01水平上呈现显著的相关性,NormFinder和Delta Ct程序的相关性最高,Delta Ct与BestKeeper的相关性最低。【结论】建立了平欧杂种榛实时荧光定量PCR内参基因的筛选体系:以反转录PCR初筛引物,荧光定量PCR分析引物特性及基因表达,4个程序单独评价引物稳定性,RefFinder综合分析选出最适稳定内参基因,并选出榛属植物8个不同组织器官中最为稳定的2个内参基因ChaActin和Ch18S rRNA。
平欧杂种榛;实时荧光定量PCR;内参基因;稳定性;体系建立
0 引言
【研究意义】榛子为桦木科(Betulaceae)榛属(Corylus)植物,是世界四大坚果之一。全世界榛属植物约有25种[1],主要分布于亚洲、欧洲及北美洲,其中商业化栽培的只有欧洲榛(C. avellana L.)的一些品种[2];中国原产的榛属植物分为8个种和2个变种,广泛分布于中国的20余个省区,栽培种为通过平榛(C. heterophylla Fisch.)和欧洲榛种间杂交获得的平欧杂种榛(C. heterophylla Fisch. × C. avellana L.)的若干品种[3]。上述榛属植物资源丰富,在树体特征、坚果性状、抗逆性,以及自交不亲和特性等方面存在丰富的变异类型,大量特异性状基因亟待挖掘和利用。目前,针对东部榛疫病(Eastern Filbert Blight)的欧洲榛抗性育种[4-5],针对抗寒性的中国平榛与欧洲榛的种间杂交[6-7],以及针对榛属植物孢子体自交不亲和特性开展的S位点基因研究[8-10],是世界榛子育种领域研究的热点问题。随着研究的深入,分子生物学技术将成为榛属植物资源利用和育种创新方面重要的研究手段,将在特异性状基因挖掘和分子辅助育种工作中发挥精准、高效的研究优势,具有重要的研究意义。【前人研究进展】实时荧光定量PCR(quantitative real-time PCR,RT-qPCR)是基因克隆工作的重要组成部分,指在反应体系中引入荧光染料或带荧光标记探针的一种改良型PCR,其具有耗时短、高灵敏度、重复性强、样品需要量少等优点[11-13],被广泛的用于基因表达与转录分析。RT-qPCR是以cDNA为模板,初始的RNA质量、产量、反转录效率和扩增效率等均会影响基因表达分析结果的准确性[14],目前,常用引入内参基因进行标准化处理的方式来减弱误差[15]。理想的内参基因是在各种条件下均能稳定表达[11],因此,在前期研究中一般选取Tubulin(微管蛋白基因),Actin(肌动蛋白基因),GAPDH(3-磷酸甘油醛脱氢酶基因),18S rRNA等管家基因(House-keeping Gene)作为内参基因。越来越多的研究证明[16-20]:管家基因在一般情况下可以稳定表达,但在一些特殊的生命活动中或试验处理条件下其表达出现了不稳定性。因此,筛选出适合的稳定的内参基因,成为了实时荧光定量PCR的关键性问题,常用的内参基因筛选方法有:geNorm[21]、Normfinder[22]、BestKeeper[19]和Delta Ct[23]。【本研究切入点】目前,关于平欧杂种榛的相关分子机理研究日益增多,国内外还没有关于系统性筛选适合平欧杂种榛实时荧光定量PCR内参基因的相关报道,而利用实时荧光定量PCR分析其相关基因的表达时,则是未经实验验证和筛选,直接引用其他物种基因作为内参基因[24]。随着实时荧光定量PCR技术成熟和成本逐渐降低,筛选获取适合平欧杂种榛自身的稳定内参基因变得尤为重要。使用稳定、合适的内参基因,才能够更加准确计算出基因的表达情况。【拟解决的关键问题】运用反转录PCR和实时荧光定量PCR技术,分析12个候选内参基因在平欧杂种榛不同组织器官中的稳定性,并筛选出稳定的内参基因,以期构建其荧光定量PCR内参基因的筛选体系,为后期平欧杂种榛相关的基因表达研究提供基础。
1 材料与方法
试验于2015年1月至2016年8月在中国林业科学研究院林木遗传育种国家重点实验室进行。
1.1 试验材料
本研究选用平欧杂种榛主栽品种‘达维’(育种代号84-254)作为材料,所有样品采自中国林业科学研究院玉泉山榛子实验基地。根据榛属植物的植物学特性并参阅其他相似研究,试验选用了8个不同的组织部位(表1)。2015年1月,随机采集‘达维’的一年生枝条200条,分成两份(其中一份去雄),置于0—2℃冷库中保湿存放。2015年3月,于25℃温室中隔离水培:去雄的一份,待雌花开放后,收集雌蕊;另一份待雄花序拉长后收集花粉,装在带有棉塞的玻璃瓶中,置于-80℃冰箱中备用。其余组织样品依据榛子的植物学特性,分别在田间取样。所用样品均经液氮速冻后,存放于-80℃冰箱备用。
表1 研究材料Table 1 Samples
1.2 候选内参基因的选取和引物设计
利用笔者课题组前期对平欧杂种榛不同亲和性授粉、授粉后不同时间雌蕊的转录组测序数据(暂未公布),以FDR值(False Discovery Rate)小于0.01和表达量Log2比率值介于-1和1之间为筛选标准,选出表达稳定的序列作为候选内参基因;此外,通过Blast获得actin、ubiquitin、18S ribosomal RNA、alpha tubulin、beta-tubulin、elongation factor 1-alpha和GAPDH这7种常用传统内参基因的同源序列,通过上述筛选方法获取候选内参基因;根据榛属相关文献[24-26],收集其所使用的内参基因及其引物。
利用在线引物设计程序Primer 3.0(http://bioinfo. ut.ee/primer3-0.4.0/)设计RT-qPCR引物,参数设置:引物Tm值为58—62℃,扩增片段长度范围为150—200 bp,引物长度范围为19—21 nt,GC含量范围为45%—55%,其他为默认设置参数;并运用NCBI Blast验证引物的特异性。
1.3 RNA提取和cDNA合成
采用改良后的CTAB法提取总RNA,取部分RNA溶液经过1%的琼脂糖凝胶电泳和微量分光光度计Nanodrop 8000进行检测,分析其完整性与浓度。
每个样品取1 μg RNA使用BIO-ROD公司的iScript™ cDNA合成试剂盒进行20 μL体系的反应。反应程序:25℃,5 min→42℃,30 min→85℃,5 min于PCR仪上完成。所得cDNA溶液(20 μL)稀释5倍,保存于-20℃冰箱,用于后续试验。
1.4 反转录PCR
使用2×TSINGKE Master Mix(北京擎科新业生物技术有限公司),于Veriti 96 well Thermal cycler PCR仪进行反应。反应体系见表2;反应程序:94℃预变性3 min;94℃变性30 s,56℃退火30 s,72℃延伸30 s,循环35次;72℃彻底延伸7 min;保存于4℃。取5 μL PCR产物进行1.5%的琼脂糖凝胶电泳检查。
1.5 荧光定量PCR
采用SYBR Green染料法,利用iTaqTM Universal SYBR®Green Supermix(BIO-RAD,USA)于C1000 Touch TM Thermal cycler PCR仪上进行反应。每个反应设置3次技术重复且每组引物设置一个阴性对照。反应体系如表3所示;PCR扩增反应程序(两步法扩增):95℃预变性,3 min→(95℃变性,5 s→ 56℃退火+延伸,30 s)循环40次;溶解曲线反应程序:65℃升温至95℃,以0.5℃递增,恒温5 s。

表2 RT-PCR反应体系Table 2 The reaction system of RT-PCR

表3 RT-qPCR反应体系Table 3 The reaction system of RT-qPCR
1.6 引物评价
取等量不同组织部位样品的cDNA模板,混合后依次稀释5个梯度,每个梯度稀释5倍,其浓度分别表示为55、54、53、52、51、50倍,作为模板,并参照1.5中的方法进行荧光定量PCR试验。利用PCR仪自带的计算软件(CFX Manager 3.1),根据Cq(quantification cycle)值建立线性回归方程,绘制标准曲线,得到斜率k和线性相关系数R2,并求得扩增效率E(E=10-1/K-1);并收集溶解曲线。
1.7 数据分析
采用Microsoft Excel 2010对原始Cq值进行统计学分析;使用qBase软件获得候选内参基因的Q值(Q=ECqmin-Cqsample;E代表扩增效率,Cq min代表基因在一组样品中最小的Cq值,Cq sample代表基因在一组样品中各样品的Cq值)。
利用程序geNorm、Normfider、Bestkeeper和Delta Ct法分析候选内参基因在8个样品中的稳定性;运用线网站RefFinder(http://fulxie.0fees.us/?type=reference& ckattempt=1&i=1)进行综合评价。根据geNorm、NormFinder、BestKeeper和Delta Ct计算12个候选内参基因的稳定性值,利用SPSS软件获取其皮尔逊相关系数。
利用Microsoft Excel 2010和Origin 9.0软件处理数据,绘制图表。
2 结果
2.1 候选内参基因的确定及其引物特异性和扩增效率分析
在转录组数据中,以FDR值小于0.01和表达量Log2比率值介于-1和1之间为筛选标准,选出稳定表达的3个作为候选内参基因(表4)。7个传统内参基因的同源序列中,18S rRNA和TUB在转录组中同源序列的表达存在差异,说明不适合作为内参基因,最终选出5个作为候选内参基因(表4)。
软件设计的8对特异性引物和文献收集4对特异引物(表5),合计12对引物。12对引物的扩增效率E在86.3%—121.6%,而R2值均大于0.98(0.982—0.997),说明其线性回归方程可信[27]。

表4 候选内参基因Table 4 Description of candidate reference genes

表5 候选内参基因引物Table 5 Primers of candidate reference genes
RT-PCR(reverse transcription PCR,反转录PCR)产物的琼脂糖电泳(图1)表明,12对引物均为单一条带,说明其特异性良好(AtActin电泳图存在一条较低的条带,经阴性对照组比较,发现其应该为引物二聚体,较高条带为特异性扩增的单一条带);而基因ChaSTP5和ChaTF的表达存在明显差异,初步判断这两个基因不适合内参基因。12个候选内参基因引物的RT-qPCR溶解曲线(图2)均为单一峰,也表明12个引物的特异性良好。
2.2 候选内参基因表达谱
根据RT-qPCR的结果,分析了12个候选内参基因在8个样品中的Cq值分布情况(图3)。12个候选内参基因的Cq值介于32.09—16.02,波动范围较大。Cq值与其表达量成反比,因此,Ch18S rRNA的表达量最高(16.02—20.55),ChaSTP5表达量最低(25.34—32.09),其余10个候选内参基因均为中等表达量。
通过Excel分析每个候选内参基因在所有样品中Cq值的平均数(mean),标准差(standard deviation,SD)和变异系数(co-variance,CV)如表6所示。根据变异系数,可初步判断12个候选内参基因的稳定性:ChaTF(9.92%)稳定性最差,而VvActin(4.31%)和ChaActin(4.66%)则较稳定;其余候选内参基因的稳定性处于中等水平。

图1 12个候选内参基因的RT-PCR琼脂糖电泳图Fig. 1 Agarose gel of RT-PCR products of 12 candidate reference genes

表6 候选内参基因Cq值分析Table 6 Analysis of the Cq values of candidate reference genes
2.3 候选内参基因稳定性分析
geNorm程序是根据计算所得的M值来表示候选基因表达稳定性,M值越小的候选基因稳定性越好。本研究中,geNorm程序的分析结果表明,ChaActin的M值最低,其稳定性最好,适合作为内参基因;其次,VvActin、ChaEF1-α和Ch18S rRNA的排名比较靠前,也可作为候选内参基因;而ChaSTP5和ChaTF的M值高排名靠后,不适合作为备选的内参基因(表7)。
此外,geNorm程序会根据变异系数(pairwise variation)来评估适合作为标准化处理所需内参基因的数目,默认变异系数(Vn/Vn+1)小于0.15时,所需最优内参基因数即为n个。但本研究的变异系数分析(图4)的值均大于0.15,根据图4中变异系数变化趋势,认为V6/V7(0.189)已经属于较低值,即选取6个内参基因进行精准的数据标准化处理。
NomFinder程序则是根据候选基因的表达稳定值(stability value,SV),选出稳定性最好的基因。SV值越小,候选基因越稳定,反之亦然。本研究NormFinder分析结果表明,ChaActin的SV值最小,最为稳定,这与geNorm中结果一致;其次稳定性较好的为VvActin、ChaTUA、ChaEF1-α和Ch18S rRNA;最不稳定的还是ChaSTP5和ChaTF(表7)。
导入Ct值,BestKeeper程序能计算获得候选内参基因在所有样品中Ct值的标准差(SD),变异系数(CV)和基因间相关系数(r)等值。由于程序限制仅可同时分析10个候选内参基因的稳定性,根据BestKeeper分析结果的SD排名(表7)可知:ChaActin依然是最为稳定的内参基因;其次稳定性较好的为ChaUBQ14、VvActin和Ch18S rRNA;AtActin的稳定性最差,不建议作为内参基因使用。
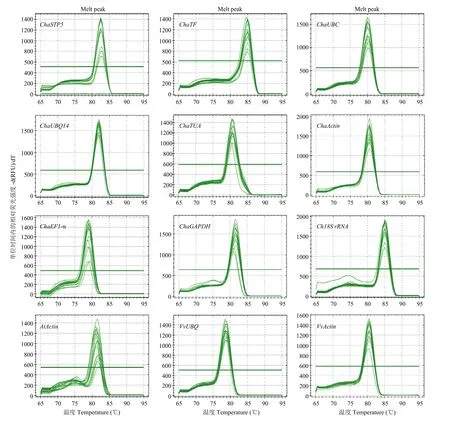
图2 12个候选内参基因的溶解曲线Fig. 2 The melting curves of 12 candidate reference genes
Delta Ct法,通过Ct值计算候选内参基因的平均标准差(Mean SD),以此评价其稳定性,其值越小内参基因越稳定。本研究中Delta Ct法分析结果表明,稳定性最好的是ChaActin、VvActin和Ch18S rRNA;ChaSTP5和ChaTF的SD最高,不适合作为内参基因(表7)。
2.4 候选内参基因综合评价
RefFinder在线网站包括了2.3中4种内参基因稳定性评价程序,并能对其分析结果进行评价给出综合排名。RefFinder综合排名(表8)表明,ChaActin和VvActin排名靠前,说明Actin适合作为榛属植物不同组织器官分析时的内参基因,ChaActin位列第一,说明根据榛属自身基因设计的引物更为合适;Ch18S rRNA则紧靠Actin之后,也是较为稳定的候选内参基因,而根据2.3可知Ch18S rRNA在4个不同的稳定性程序分析结果中排名均在前五之中;而ChaSTP5和ChaTF基因的综合排名靠后,这与前面稳定性分析结果相一致,说明其最不适合作为内参基因。一般选取双内参基因更能对荧光定量结果进行较为准确的标准化处理,综合分析可知ChaActin和Ch18S rRNA可选取为最适的双内参基因。

表7 候选内参基因稳定性排名Table 7 The stability ranking of candidate reference genes

表8 稳定性的综合排名Table 8 The comprehensive ranking of stability
利用4种程序的排名稳定性值的皮尔逊相关系数(pearson correlation coefficient,r)分析其相关性(表9):4个程序均在0.01水平上显著相关,且相关系数均高于0.9;NormFinder和Delta Ct的相关性最高(r=0.994),其次为geNorm和NormFinder;而geNorm和Delta Ct与BestKeeper的相关性较低。

表9 程序的相关性分析Table 9 Correlation analysis of program
3 讨论
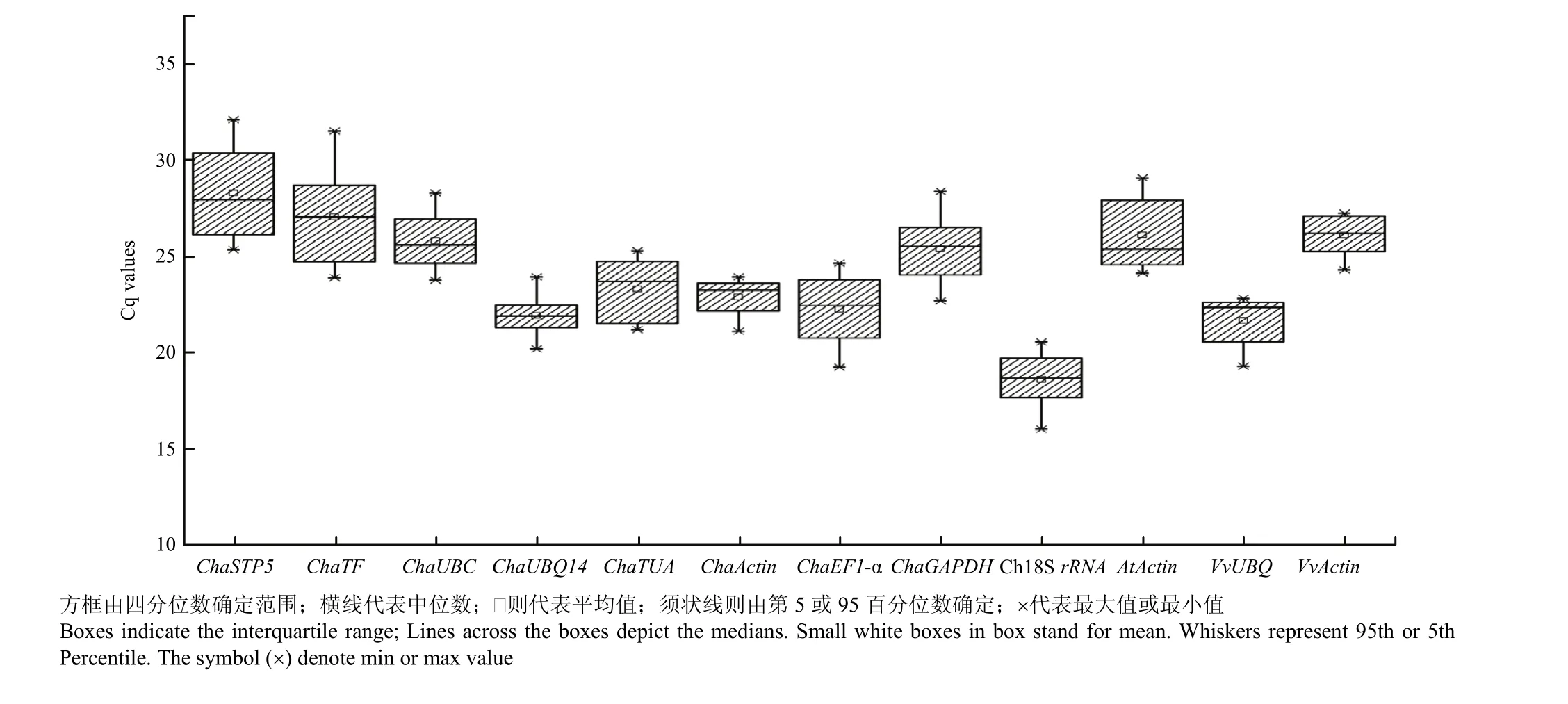
图3 12个候选内参基因在8个样品中的Cq值分布Fig. 3 Ct values of 12 candidate reference genes in 8 samples

图4 变异系数分析Fig .4 Pairwise variation (V) calculated by geNorm
筛选合适的稳定内参基因是实现通过实时荧光定量PCR技术分析基因表达情况的先决条件,本研究根据笔者课题组前期转录组测序数据及前人相关研究,筛选出2个最适的稳定内参基因ChaActin和Ch18S rRNA。而戴超等[28]的研究证明,18S rRNA、Actin和Ubiquitin 3个基因适合作为白桦半定量PCR的内参基因;陈新[25]的研究证明,半定量PCR中Actin也适合作为平榛的内参基因,这均与本研究结果相一致,说明Actin在桦木科中表达稳定,适合作为内参基因。此外,这两个基因在其他物种中也是常用的内参基因,如:蒋婷婷等[29]研究中,Actin适合作为换锦花(Lycoris sprengeri)不同组织和不同花期以及石蒜属(Lycoris)不同杂交种鳞茎的内参基因;李冉等[30]研究表明在水稻(Oryza sativa)中稻纵卷叶螟(Cnaphalocrocis medinalis Guenee)处理后Actin的表达最稳定;苏晓娟等[31]认为Actin和18S rRNA等基因适合作为毛果杨(Populus trichocarpa)不同组织以及锌胁迫下的组培苗表达分析的内参基因;张岗等[32]则以EF-1α/18S rRNA为内参基因分析铁皮石斛(Dendrobium officinale)FPS的组织表达情况;KIM等[33]认为水稻逆境胁迫中18S rRNA表达稳定性最高。
本研究发现,根据材料本身转录组测序数据设计的基因引物比直接引用其他材料引物的稳定性更好,如ChaActin的稳定性明显优于AtActin,说明根据材料基因序列设计特异引物效果更好。前人研究也证明利用转录组等基因表达数据库可以快速筛选获得理想的内参基因:SANG等[34]利用转录组数据筛选出了适合分析超积累型东南景天(Hyperaccumulating Sedum alfredii Hance)的内参基因UBC9和TUB;朱友银等[35]利用转录组数据筛选出适合作为中国樱桃(Prunus pseudocerasus)低温响应和盐碱胁迫处理的内参基因GAPDH,以及ABA处理和花芽休眠解除过程中的内参基因ACTB和UBCE;而刘洪峰等[36]利用转录组数据筛选出适合牡丹(Paeonia ostii)的新型内参基因PUF1639、MBF1A、PP2CFP和RPS9。综上说明,利用转录组和基因芯片等基因表达数据库能够更加高效、快速的筛选出合适的内参基因。
本研究在构建内参基因筛选体系时发现,通过反转录PCR能够快速剔除在分析材料中表达明显不稳定的基因,实现对候选内参基因的初步筛选,节约试验时间和经费;相关性分析表明4个程序排名显著相关,其中NormFinder和DeltaCt的相关性最高,与GUO等[37]的研究结果相一致。此外,geNorm程序可以根据配对变异(pairwise variation)V值,来确定理想候选内参基因个数[21]。程序默认Vn/Vn+1小于0.15,则没有必要再引入第n+1个基因,反之则需引入新的内参基因。本研究所用的材料为不同组织器官,其跨度本身较大,这可能是导致变异系数分析中其值均高于0.15的原因,而蒋婷婷等[29]也提到可能由于材料跨度过大会导致变异系数分析值均高于0.15。此外,程序本身也说明0.15并不是一个苛刻的限制,根据试验情况,其值可进行相应的调整。但是为了筛选出适合于不同组织材料的内参基因应该选取更多的候选基因进行表达稳定性分析,获取最为合适的内参基因,以达到数据标准化分析的要求。本研究中12个候选内参基因在4种不同程序中的稳定性排名存在一定的差异,这应该是由于程序设计的原理不同而导致,在筛选内参基因时应该用4个程序同时进行分析,从而选出最适的稳定内参基因,这样结果的可靠性更高;而RefFinder在线网站能快速的对原始Ct值进行分析得出综合排名,由于其计算过程中未考虑到引物扩增效率,其分析结果可能存在一定误差,建议与4个程序单独计算的结果进行比较分析。
4 结论
本研究利用geNorm、Normfider、Bestkeeper和 Delta Ct法以及在线网站RefFinder,分析了12个候选内参基因在榛属植物8个不同组织器官中的表达稳定性,筛选出2个最适的稳定内参基因ChaActin和Ch18S rRNA;并构建了平欧杂种榛内参基因的筛选体系:反转录PCR初筛引物,荧光定量PCR分析引物特性及基因表达,4个程序(geNorm、Normfider、Bestkeeper、和Delta Ct法)分别评价引物稳定性,RefFinder综合分析选出最适的稳定内参基因。研究结果为榛属植物实时荧光定量PCR内参基因的筛选与分析提供了研究基础,也为其相关基因的组织表达分析提供了可参考的稳定内参基因。
[1] BASSIL N V, BOTTA R, MEHLENBACHER S A. Microsatellite markers in hazelnut: isolation, characterization, and cross-species amplification. Journal of the American Society for Horticultural Science, 2005, 130(4): 543-549.
[2] MEHLENBACHER S A. Genetic resources for hazelnut: state of the art and future perspectives. Acta Horticulturae, 2009, 845(1): 33-38.
[3] 梁维坚. 中国果树科学与实践. 榛. 西安: 陕西科学技术出版社, 2015.
LIANG W J. The Science and Practice of Pomology in China Hazelnut. Xi’an: Shaanxi Science and Technology Press, 2015. (in Chinese)
[4] MEHLENBACHER S A, BROWN R N, DAVIS J W, CHEN H, BASSIL N V, SMITH D C, KUBISIAK T L. RAPD markers linked to eastern filbert blight resistance in Corylus avellana. Theoretical and Applied Genetics, 2004, 108(4): 651-656.
[5] SATHUVALLI V R, MEHLENBACHER S A. A hazelnut BAC library for map-based cloning of a disease resistance gene. Acta Horticulturae, 2009, 845(1):191-194
[6] CHEN X, ZHANG J, LIU Q Z, GUO W, ZHAO T T, MA Q H, WANG G X. Transcriptome sequencing and identification of cold tolerance genes in hardy Corylus species (C. heterophylla Fisch.) floral buds. PLoS One, 2014, 9(9): e108604.
[7] ZHAO T T, ZHANG J, LIANG L S, MA Q H, CHEN X, ZONG J W, WANG G X. Expression and functional analysis of WRKY transcription factors in Chinese wild hazel, Corylus heterophylla Fisch. PLoS One, 2015, 10(8): e0135315.
[8] MA Q H, WANG G X, LIANG W J, CHEN X, LIANG L S, ZHAO T T. Progresses on the Compatibility in Corylus (Hazelnuts): A Review. Journal of Forestry Research, 2013, 24(3): 397-402.
[9] MEHLENBACHER S A, SMITH D C. Self-compatible seedlings ofthe Cutleaf hazelnut. HortScience, 2006, 41(2): 482-483.
[10] MARINONI D T, BELTRAMO C, AKKAK A, DESTEFANIS M L, BOCCACCI P, BOTTA R. Gene expression and sporophytic self-incompatibility in hazelnut. Acta Horticulturae, 2009, 845: 227-231.
[11] BUSTIN S A. Quantification of mRNA using real-time reverse transcription PCR (RT-PCR): trends and problems. Journal of Molecular Endocrinology, 2002, 29(1): 23-39.
[12] GACHON C, MINGAM A, CHARRIER B. Real-time PCR: what relevance to plant studies? Journal of Experimental Botany, 2004, 55(42): 1445-1454.
[13] BUSTIN S A. Quantitative real-time RT-PCR-a perspective. Journal of molecular endocrinology, 2005, 34(3): 597-601.
[14] PFAFFL M W. A new mathematical model for relative quantification in Real-time RT-PCR. Nucleic Acids Research, 2001, 29(9): e45.
[15] HUGGETT J, DHEDA K, BUSTIN S, ZUMLA A. Real-time RT-PCR normalisation; strategies and considerations. Genes and Immunity, 2005, 6(4): 279-284.
[16] RUBIE C, KEMPF K, HANS J, SU T, TILTON B, GEORG T, BRITTNER B, LUDWIG B, SCHILLING M. Housekeeping gene variability in normal and cancerous colorectal, pancreatic, esophageal, gastric and hepatic tissues. Molecular and Cellular Probes, 2005, 19(2): 101-109.
[17] HONG H Y, SEO P J, YANG M S, XIANG F N, PARK C M. Exploring valid reference genes for gene expression studies in Brachypodium distachyon by real-time PCR. BMC Plant Biology, 2008, 8(1): 112.
[18] GUTIERREZ L, MAURIAT M, GUÉNIN S, PELLOUX J, LEFEBVRE J F, LOUVET R, RUSTERUCCI C, MORITZ T, GUERINEAU F, BELLINI C, VAN W O. The lack of a systematic validation of reference genes: A serious pitfall undervalued in reverse transcription-polymerase chain reaction (RT-PCR) analysis in plants. Plant Biotechnology Journal, 2008, 6(6): 609-618.
[19] ANDERSEN C L, JENSEN J L, ORNTOFT T F. Normalization of Real-time quantitative reverse transcription-PCR data: A model-based variance estimation approach to identify genes suited for normalization, applied to bladder and colon cancer data sets. Cancer Research, 2004, 64(15): 5245-5250.
[20] KOZERA B, RAPACZ M. Reference genes in real-time PCR. Journal of Applied Genetics, 2013, 54(4): 391-406.
[21] VANDESOMPELE J, DE P K, PATTYN F, POPPE B, VAN R N, DE P A, SPELEMAN F. Accurate normalization of Real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biology, 2002, 3(7): research0034.1-11.
[22] PFAFFL M W, TICHOPAD A, PRGOMET C, NEUVIANS T P. Determination of stable housekeeping genes, differentially regulated target genes and sample integrity: Best Keeper-Excel-based tool using pair-wise correlations. Biotechnology Letters, 2004, 26(6): 509-515.
[23] SILVER N, BEST S, JIANG J, THEIN S L. Selection of housekeeping genes for gene expression studies in human reticulocytes using real-time PCR. BMC Molecular Biology, 2006, 7(1): 33.
[24] 孟晓庆. 榛子成花基因的克隆及其表达特性分析[D]. 北京: 北京林业大学, 2003.
MENG X Q. Isolation and expression analysis of floral genes in hazelnut [D]. Beijing: Beijing Forestry University, 2003. (in Chinese)
[25] 陈新. 榛子花芽转录组文库的Solexa测序及冷调节基因的表达谱分析[D]. 北京: 中国林业科学研究院, 2011.
CHEN X. De Novo characterization of hazelnut floral bud transcriptome using solexa sequencing and expression profiling analysis of cold-regulated genes [D]. Beijing: China Academy of Forestry, 2011. (in Chinese)
[26] BELTRAMO C, TORELLO M D, PERRONE I, BOTTA R. Isolation of a gene encoding for a class III peroxidase in female flower of Corylus avellana L. Molecular Biology Reports, 2012, 39(4): 4997-5008.
[27] FENG H, HUANG X, ZHANG Q, WEI G, WANG X, KANG Z. Selection of suitable inner reference genes for relative quantification expression of micro RNA in wheat. Plant Physiology and Biochemistry, 2012, 51:116-122.
[28] 戴超, 刘雪梅, 周菲. 白桦基因表达半定量RT-PCR中内参基因的选择. 经济林研究, 2011, 29(1): 34-39.
DAI C, LIU X M, ZHOU F. Selection of internal control genes in semi-quantitative RT-PCR in Betula platyphylla. Nonwood Forest Research, 2012, 29(1): 34-39. (in Chinese)
[29] 蒋婷婷, 高燕会, 童再康. 石蒜属植物实时荧光定量 PCR 内参基因的选择. 园艺学报, 2015, 42(6): 1129-1138.
JIANG T T, GAO Y H, TONG Z K. Selection of reference genes for quantitative Real-time PCR in Lycoris. Acta Horticulturae Sinica, 2015, 42(6): 1129-1138. (in Chinese)
[30] 李冉, 李建彩, 周国鑫, 娄永根. 水稻虫害诱导相关基因实时定量PCR中内参基因的选择. 植物学报, 2013, 48 (2): 184-191.
LI R, LI J C, ZHOU G X, LOU Y G. Validation of rice candidate reference genes for herbivore-induced quantitative Real-time PCR analysis. Chinese Bulletin of Botany, 2013, 48(2): 184-191. (in Chinese)
[31] 苏晓娟, 樊保国, 袁丽钗, 崔秀娜, 卢善发. 实时荧光定量PCR分析中毛果杨内参基因的筛选和验证. 植物学报, 2013, 48(5): 507-518.
SU X J, FAN B G, YUAN L C, CUI X N, LU S F. Selection and validation of reference genes for quantitative RT-PCR analysis of gene expression in Populus trichocarpa. Bulletin of Botany, 2013, 48(5): 507-518. (in Chinese)
[32] 张岗, 赵明明, 张大为, 郭顺星. 铁皮石斛实时定量PCR内参基因的筛选. 中国药学杂志, 2013, 48(19): 1664-1668.
ZHANG G, ZHAO M M, ZHANG D W, GUO S X. Reference gene selection for Real-time quantitative PCR analysis of Dendrobium officinale. Chinese Pharmaceutical Journal, 2013, 48(19): 1664-1668. (in Chinese)
[33] KIM B R, NAM H Y, KIM S U, KIM S I, CHANG Y J. Normalization of reverse transcription quantitative-PCR with housekeeping genes in rice. Biotechnology Letter, 2003, 25(21): 1869-1872.
[34] SANG J, HAN X J, LIU M Y, QIAO G R, JIANG J, ZHUO R Y. Selection and validation of reference genes for real-time quantitative PCR in hyperaccumulating ecotype of Sedum alfredii under different heavy metals stresses. PLoS One, 2013, 8(12): e82927.
[35] 朱友银, 王月, 张弘, 邵姁, 李永强, 郭卫东. 中国樱桃实时定量PCR(qRT-PCR)内参基因的筛选与鉴. 农业生物技术学报, 2015, 23(5): 690-700.
ZHU Y Y, WANG Y, ZHANG H, SHAO X, LI Y Q, GUO W D. Selection and characterization of reliable reference genes in chinese cherry (Prunus pseudocerasus) using quantitative real time PCR (qRT-PCR). Journal of Agricultural Biotechnology, 2015, 23(5): 690-700. (in Chinese)
[36] 刘洪峰, 高乐旋, 胡永红. 牡丹不同发育阶段种子和花瓣组织实时荧光定量PCR中内参基因的挖掘与筛选. 农业生物技术学报, 2015, 23(12): 1639-1648.
LIU H F, GAO L X, HU Y H. Reference genes discovery and selection for quantitative real-time PCR in tree peony seed and petal tissue of different development stages. Journal of Agricultural Biotechnology, 2015, 23(12): 1639-1648. (in Chinese)
[37] GUO J L, LING H, WU Q B, XU L P, QUE Y X. The choice of reference genes for assessing gene expression in sugarcane under salinity and drought stresses. Scientific Reports, 2014, 4: 7042.
(责任编辑 赵伶俐)
Reference Genes Selection and System Establishment for Real-Time qPCR Analysis in Ping’ou Hybrid Hazelnut (C. heterophylla Fisch. × C. avellana L.)
YANG Dan1, LI Qing2, WANG GuiXi2, MA QingHua2, ZHU LiQuan1
(1College of Agronomy and Biotechnology, Southwest University, Chongqing 400716;2Research Institute of Forestry, Chinese Academy of Forestry/Key Laboratory of Forestry Silviculture of State Forestry Administration/State Key Laboratory of Tree Genetics and Breeding, Beijing 100091)
【Objective】 The objective of this article is to construct a reference gene screening system of real-time qPCR inPing’ou hybrid hazelnut (C. heterophylla Fisch × C. avellana L, main cultivars of Corylus in China) for gene expression analysis, and provide a theoretical basis for the study of plant resource utilization and innovative breeding. 【Method】 Eight candidate genes were selected from the transcriptome sequencing data of the non-pollination, compatible pollination and incompatible pollination stigma of Ping’ou hybrid hazelnut in authors’ previous study. Four candidate genes were selected from related articles. Eight different tissues or organs, such as the blooming styles, the catkins before elongation, the young leaves, the pollen, the cambium of annual branch, the green stem, the root tip and the sucker of the main cultivar of Ping’ou hybrid hazelnut ‘Dawei’ were used as the samples in reverse transcriptional PCR and real-time qPCR experiments. The expression stability of twelve candidate reference genes was analyzed by geNorm, NormFinder, BestKeeper, Delta Ct and RefFinder programs. 【Result】 Reverse transcriptional PCR showed that the amplification of twelve primers was specific, there were significant differences in the expression of ChaSTP5 and ChaTF in different materials, and the remaining candidate reference genes were expressed in eight tissues. Real-time qPCR showed that the expression of Ch18S rRNA was at the highest level and ChaSTP5 was at the lowest level, and the remaining ten candidate reference genes belong to moderate expression. As for the stability of the candidate genes, ChaSTP5 and ChaTF were the least stable, and the stability of the remaining ten candidate genes was at a moderate level. The results of geNorm, NormFinder, BestKeeper and Delta Ct showed that ChaActin was the most stable reference gene and Ch18S rRNA ranked in the top five, while the ranking of other candidate reference genes was different. The stability analysis indicated that ChaActin and Ch18S rRNA are suitable as reference genes. The pairwise variation (V) calculated by geNorm showed that six reference genes could accurately normalize the date of real-time qPCR. There was a significant correlation between the four programs at 0.01 level, and the correlation between NormFinder and Delta Ct was the highest, Delta Ct and BestKeeper was the lowest. 【Conclusion】 The reference gene screening system for real-time qPCR in Ping’ou hybrid hazelnut was set up including four main steps: primers were screened first by reverse transcriptional PCR, real-time qPCR analysis was based on primer properties and gene expression, primer stability was evaluated using four programs (geNorm, NormFinder, BestKeeper, Delta Ct) and the optimal stable reference gene was selected by the comprehensive analysis of RefFinder. As for the reference genes selection, ChaActin and Ch18S rRNA were ranked as the most stable reference genes in 8 samples.
Ping’ou hybrid hazelnut (C. heterophylla Fisch. × C. avellana L.); quantitative real-time PCR; reference gene; stability; system establishment
2016-10-19;接受日期:2017-02-23
国家自然科学基金(31500560)、中国林科院基本科研业务费专项经费(CAFYBB2016QB002)
联系方式:杨丹,E-mail:1508066790@qq.com。通信作者马庆华,Tel:010-62888537;E-mail:mqhmary@sina.com。通信作者朱利泉,Tel:023-68250794;E-mail:zhuliquan@swu.edu.cn
