直肠腔内超声对肛瘘术后愈合情况的评估
2017-07-24熊芳熊蕾蕾沈远韦兰
熊芳,熊蕾蕾,沈远,韦兰
北京市二龙路医院 超声科,北京100010
直肠腔内超声对肛瘘术后愈合情况的评估
熊芳,熊蕾蕾,沈远,韦兰
北京市二龙路医院 超声科,北京100010
目的 观察肛瘘手术后3个月后肛管手术区域超声图像变化,对肛瘘术后愈合情况进行评估。方法 对2015年1月~12月期间,在我院手术治疗的141例肛瘘患者术后3个月时肛管手术区域的直肠腔内超声检查图像进行超声评分,包括手术区域回声改变、边界清晰程度、形态转变和厚度的变化,超声评分为0~2分的为有瘢痕化趋势,超声评分3~4分的为有复发趋势。评价结果与术后6个月时患者复诊的愈合情况进行对照分析。结果 超声评价为瘢痕化趋势的0~2分组与评价为复发趋势的3~4分组,两组患者超声判断预后的准确性差异显著,χ2=55.726,P=0.001,差异具有统计学意义,提示超声对0~2分组的术后3个月愈后评估准确度高,准确率100%,而对3~4分组的术后3个月愈后评估准确度相对低,准确率为58.3%。结论 直肠腔内超声操作简单,价格低,无创,患者易耐受,对肛瘘术后愈合良好的情况可以作出准确的分析评价,可以作为肛瘘术后评价的影像学方法。
直肠腔内超声;肛瘘;手术;瘢痕;愈合
引言
肛瘘是肛肠外科常见病与多发病,每年正常人群中的发病率为万分之一,中青年好发。手术是肛瘘的主要治疗方法,直肠腔内超声检查简单,快速,患者的耐受性良好,是肛瘘术前评估有效的影像学方法。它对瘘管的形态、范围、内口定位以及是否存在慢性脓腔有很高的识别度,为肛肠外科医生制定手术方案提供可靠依据。术后愈合瘢痕化与复发感染是手术治疗的两种结局,肛瘘术后肛管局部正常组织结构消失,由瘢痕组织替代,瘢痕组织与感染复发的超声图像既有相似之处又存在差异,超声是否能早期识别术后愈合与复发目前还缺乏进一步的研究。本研究对肛瘘手术区域术后3个月的超声图像改变进行分析,评估术后愈合的情况,对肛瘘术后愈合状态早期评价,以期达到临床早期干预,减轻不良预后。
1 资料与方法
1.1 临床资料
自2015年1月~2015年12月期间我院以肛瘘收住院准备行手术治疗的患者141例,排除克罗恩病和肛门狭窄的患者。其中,男性130例,女性11例,年龄最大者77岁,最小者10岁,平均(41.09±12.30)岁。141例肛瘘患者进行Parks分型[1]:括约肌间瘘100例,经括约肌瘘22例,括约肌上瘘19例。
1.2 仪器与方法
采用丹麦BK公司2202 Pro型彩色多普勒超声诊断仪,2050三维直肠腔内超声探头,探头频率9~12 MHz。
术前及术后3个月分别进行直肠腔内超声检查。检查前无需肠道准备,患者左侧卧位,常规肛门视诊及指诊。将套有探头保护套的2050三维直肠腔内探头缓缓置于患者肛管腔内,显示肛管及肛周组织结构后,调节探头聚焦深度,使病变位于扫查区域内,获取肛管三维立体图像,对图像作轴向面及纵向切面的分析识别。
术前超声检查记录肛瘘Parks分型,定位瘘道范围及内口位置,术后3个月超声检查记录手术区域图像较术前的变化,包括回声、边界、形态和厚度的改变,并对图像变化进行赋分:回声增强(0分)/回声无变化(1分); 边界不清晰(0分)/边界清晰(1分);“纠集征”阳性(0分)/“纠集征”阴性(1分);厚度变薄(0分)/厚度无变薄(1分)。统计患者术后超声评分并评估,0~2分:瘢痕化趋势;3~4分:复发趋势。
1.3 统计学分析
所有数据采用SPSS 17.0统计软件进行分析。采用χ2检验比较超声评分为0~2分提示愈合与3~4分提示复发的两组数据与术后6个月时的痊愈与复发例数结果进行对比分析。P<0.05为差异有统计学意义。
2 结果
术后3个月超声评估:0分116例;1分9例;2分4例;3分8例;4分4例。术后6个月随访136例愈合(图1~2),5例复发(图3),见表1。
超声评价为愈合的0~2分组与评价为复发趋势的3~4分组,这两组患者超声判断预后的准确性差异显著,χ2=55.726,P=0.001,差异具有统计学意义。提示超声对术后愈合良好的判断与临床诊断相比较准确度高,而术后复发判断的准确度相对低,见表2。
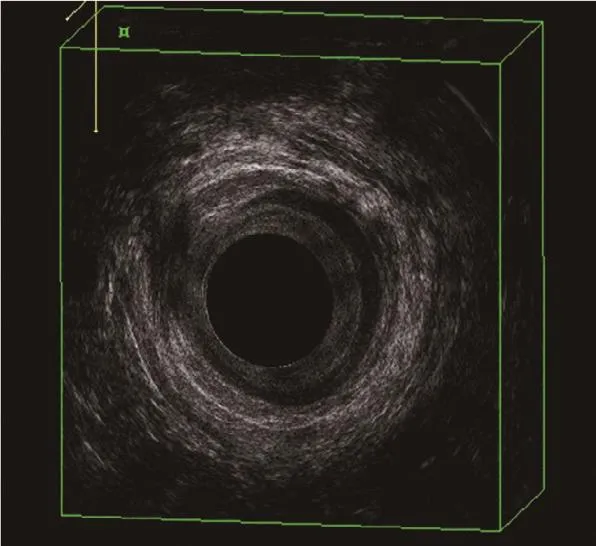
图1 肛瘘术后愈合,“纠集征”表现

图2 肛瘘术后愈合,瘢痕回声增强,手术区域变薄
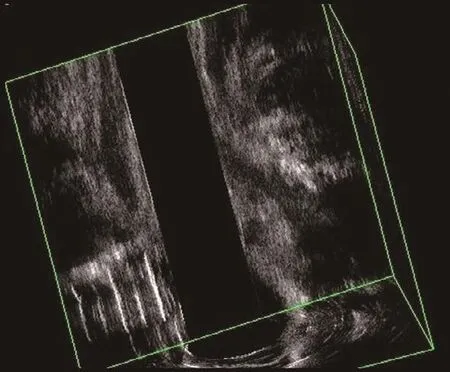
图3 肛瘘术后复发,回声无变化,手术区域无变薄

表1 术后3个月超声评分与术后6个月愈后结果 (例)
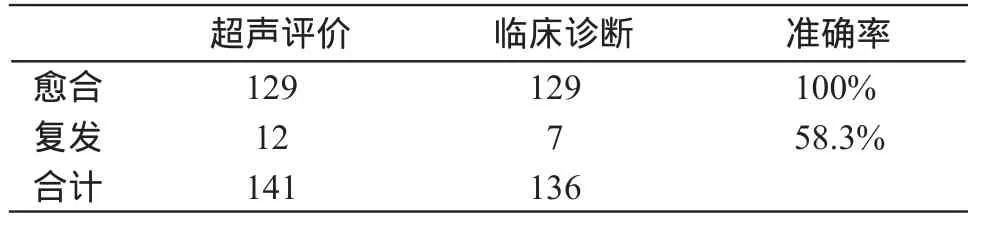
表2 超声评价与手术愈后的准确率 (例)
3 讨论
肛瘘是肛肠外科的常见病多发病,是由于多种病因导致的肛管直肠与肛周皮肤相通的一种异常通道,病因包括了肛腺感染、结核、创伤、艾滋病、放疗、异物和克罗恩病等。目前肛瘘的影像学检查中,MRI通过可以获取多平面的肛周软组织成像的能力,成为评估肛肠疾病的理想选择[2],尤其是肛门腔内线圈可以达到最佳图像,在肛瘘的诊断上有很高的准确性。由于活动性瘘管内含有脓液及肉芽组织,因此在T2加权像或短时间反转恢复序列(Short Time Inversion Recovery,STIR)序列显示为高信号,瘢痕在T1和T2成像上与STIR序列一样也都表现为低信号,瘘管与瘢痕可以通过磁共振成像来鉴别,在肛瘘的诊断上有很高的准确性,常作为肛瘘和并发症的首选诊断技术[3-4],但昂贵的费用和稀有的医疗资源使其在肛瘘的诊断与鉴别中未能得到普遍应用。
直肠腔内超声检查简单、方便、耐受性好、患者易于接受,在区分急慢性化脓性疾病、评估括约肌结构的完整性等方面具有重要价值,已成为直结肠外科医生首选的诊断检查手段。它提供的证据可以帮助肛肠外科医生正确选择治疗方案、及时评价治疗的效果,减少术后复发[5]。直肠腔内超声对瘘管的形态、范围、内口定位以及是否存在慢性脓腔有很高的识别度,是一种有效的影像学检查手段[6]。随着超声技术的发展,有更多种类的腔内探头可以应用于检查,高频线阵腔内探头、端扫式凸阵腔内探头和三维直肠腔内探头在诊断中发挥着独特的作用。高频线阵直肠腔内探头可以帮助超声医师清晰的观察肛管肠壁的肌肉层次,判断瘘道的解剖间隙,辨别内口的细微差异,是否存在粘膜下瘘道。端扫式凸阵腔内探头既可以应用在肛管直肠腔内也可以经会阴部扫查,扩大检查范围,避免远离肛管的病变被遗漏。三维直肠腔内超声可以呈现一个三维立体图像,同时观察冠状面、矢状面、轴向面及各种斜切面,缩短诊断时间,获取丰富诊断信息。三维超声可显示瘘与肛门括约肌的关系,尤其是在诊断高位复杂肛瘘的路径走行和分支方面,可以呈现瘘道的空间立体图像,比二维超声具有更高的诊断准确率[7]。三维直肠腔内超声联合过氧化氢增强造影的应用对于瘘管路径的追踪,解剖形态描述,内口的精确定位以及对术后瘢痕与残腔的鉴别均有着与腔内MRI相似的诊断准确率[8-9]。
手术是治疗肛瘘的主要方法,原则是清除瘘管,保留括约肌功能[10-11]。肛瘘的诊断及疗效标准中,痊愈指症状消失,肛瘘愈合,无效指经治疗后肛瘘未愈。远期疗效标准为随访2~3年,原部位未见复发为远期治愈。如果不能在清除感染灶和保护肛门括约肌功能之间找到平衡点,就有可能造成肛瘘复发或肛门节制功能下降的不良后果[12-14]。由于手术操作中未识别内口、瘘管残留、感染灶清除不彻底以及引流不畅等诸多原因所导致的手术区域再次感染,造成术后复发,肛瘘复发率大约在0~18%[6],对于肛瘘术后复发的好发时间还没有明确的临床资料统计,一般发生在术后1年内,大部分集中在术后6个月内。
肛瘘手术治疗过程中的疼痛会给患者带来不良的治疗体会[15],因此,患者对手术的复发具有较强烈的恐惧感,愈合过程中的疼痛、坠张、出现分泌物等不适感受都会给患者造成心理负担。术后愈合不良或者肛瘘复发,临床诊断的主要依据是脓肿形成或破溃,在没有明确感染症状出现时,指诊会受到手术瘢痕的影响,难以感知炎性病灶与增厚瘢痕的差异,在早期通过指诊很难做出明确诊断,可能遗漏最佳治疗时机,及早控制清除感染。早期准确辨别术后瘢痕与复发,可以消除患者的紧张情绪,对下一步的诊断方案具有指导意义。
手术是一种创伤,创伤愈合的过程可以分为3个阶段:① 局部炎症反应期,溶解清除坏死组织和渗出物,一般持续3~6 d;② 肉芽组织增生期,结缔组织细胞和血管内皮细胞游动增殖,形成肉芽组织,持续2~3周;③ 塑形期,新生结缔组织基质沉积和新生组织改建,开始于伤后2~3周,最长可持续2年左右。手术区域从发生新生组织改建,肉芽组织由增生到逐渐纤维化、软化等病理变化结果。在瘢痕增生的不同阶段,超声影像也会呈现不同的表现:术后早期的低回声区随时间推移逐渐增强,轴向切面可见手术区域与周围组织穿插融合,呈现“纠集征”,以及手术区域厚度逐渐变薄等超声表现。
本组病例中,对141例术后3个月手术区域超声图像的回声、边界、形态和厚度的改变进行了观察,大多数病例出现了回声增强,边界不清晰,“纠集征”和手术区域逐渐变薄的超声表现。术后6个月临床随访结果证实:超声评分为0~2分的129例病例术后均创面愈合良好,手术痊愈,超声可以对术后愈合良好的病例进行准确的评估。
与上述表现相反,术后超声评分为3~4分的12例病例全部或部分的超声表现为回声无变化,边界清晰,无“纠集征”及无变薄。术后6个月临床随访,12例中的5例复发,7例愈合。4例评分4分的病例均复发,8例评分3分的病例中1例复发,7例愈合。超声对术后复发的评价中3分病例的准确率较低,可能与这部分患者塑形期阶段肉芽组织纤维化及瘢痕软化的时间偏长有关,也可能与患者愈合过程中一些不确定的因素有关,如年龄、身体状况、饮食结构、患者治疗的依从性等,这些干扰因素可能会影像超声早期评价术后复发的准确性,可以通过延长超声评估的时程,增加评估次数的方式达到提高评估准确性的目的。
4 结论
在大多数研究中,肛瘘的诊断大多是以外科手术所见作为金标准,但随着影像技术的发展,高频超声探头可以发现术中难以寻找到的微小感染灶,便于术前制定适宜的治疗方案,有利于对病灶的追踪观察,同时也为肛瘘术后愈合与早期复发的鉴别诊断提供了有力支持。肛瘘术后超声典型的图像表现使得在愈合良好的判断上与临床诊断比较准确度高,可以对术后愈合良好做出准确的评价。
[1] Ozkavukcu E,Haliloglu N,Erden A.Frequencies of perianal fistula types using two classification systems[J].Jpn J Radiol,2011,29(5):293-300.
[2] Myles J,Joseph CV,Ravi PK.Magnetic Resonance Imaging in the Management of Anal Fistula and Anorectal Sepsis[J].Clin Colon Rectal Surg,2008,21:213-219.
[3] Vanbeckevoort DL,Bielen D,Vanslembrouck R,et al.Magnetic resonance imaging of perianal fi stulas[J].Magn Reson Imaging Clin N Am,2014,22(1):113-123.
[4] De Miguel Criado J,Del Salto LG,Rivas PF,et al.MR imaging evaluation of perianal fi stulas: spectrum of imaging features[J]. Radiographics,2012,32(1):175-194.
[5] Milone M,Pesce G,Leongito M,et al.Role of endoanal ultrasonography in reducing anal fistula recurrence[J].Chir Ital, 2009,61(4):461-465.
[6] Duminda S,Dharmabandhu N.Samarasekera comparison of preoperative endoanal ultrasonography with intraoperative fi ndings for fi stula in ano[J].World J Surg,2010,34:1123-1127.
[7] Xue Y,Ding S,Ding Y,et al.Comparison of two-dimensional ultrasound and three-dimensional endoanal ultrasound in the diagnosis of perianal fistula[J].Chin J Gastrointest Surg,2014,17(12):1187-1189.
[8] Yung K,Young JP.Three-dimensional endoanal ultrasonographic assessment of an anal fistula with and without H2O2enhancement[J].World J Gastroenterol,2009,15(38):4810-4815. [9] Visscher AP,Felt-Bersma RJ.Endoanal ultrasound in perianal fi stulae and abscesses[J].Ultrasound Q,2015,31(2):130-137.
[10] Abou-Zeid,Ahmed A.Anal fistula: intraoperative difficulties and unexpected findings[J].World J Gastroenterol,2011, 17(28):3272-3276.
[11] Dudukgian H,Abcarian H.Why do we have so much trouble treating anal fistula[J].World J Gastroenterol,2011,17(28): 3292-3296.
[12] Old fi eld F,Gilbert T,Skaife P.Is modern management of fi stulain-ano acceptable[J].Br J Hosp Med,2016,77(7):388-393.
[13] Raslan SM,Aladwani M,Alsanea N.Evaluation of the cutting seton as a method of treatment for perianal fi stula[J].Ann Saudi Med,2016,36(3):210-215.
[14] Cadeddu F,Salis F,Lisi G,et al.Complex anal fi stula remains a challenge for colorectal surgeon[J].Int J Colorectal Dis,2015, 30(5):595-603.
[15] Garg P,Garg M.PERFACT procedure: a new concept to treat highly complex anal fistula[J].World J Gastroenterol,2015, 21(13):4020-4029.
本文编辑 袁隽玲
Evaluation of Postoperative Healing of Anal Fistula with Endoanal Ultrasounds
X I O N G F a n g, X I O N G L e i-l e i, S H E N Y u a n, WE I L a n
Department of Ultrasonography, Beijing Er Long Lu Hospital, Beijing 100010, China
O b j e c t i v e This paper aimed to observe anal fistula ultrasound image in the postoperative 3 months to evaluate healing of anal fistula. Me t h o d s From January 2015 to December 2015, the postoperative after 3 months echo anal ultrasound images of 141 patients with anal fi stula were analyzed and scored, including changes of echo, boundary, shape and thickness. The score of ultrasound was 0~2 points, had a trend of scar, grade 3~4 points had a relapse tendency. The evaluation results were subsequently compared with follow-up visits after postoperative 6 months. R e s u l t s The ultrasonic evaluation for scarring trend of 0~2 group and evaluation for relapse tendency of 3~4 group, the two groups of ultrasonic prognosis had significant difference, χ2=55.726, P=0.001, 0~2 group had high accuracy, and for 3~4 group accuracy was relatively low. C o n c l u s i o n Echo anal ultrasound can provide accurate analysis and evaluation on postoperative good health for anal fi stula.
echo anal ultrasound; anal fi stula; operation; heal
R657.1;R445.1
A
10.3969/j.issn.1674-1633.2017.07.012
1674-1633(2017)07-0041-03
2016-10-14
2016-12-16
作者邮箱:xiongfangdr@sina.com
