HIV-1中和抗体2G12真核表达载体的构建及活性检测
2017-07-24王晓菲贾润清周玉柏管永军曾毅
王晓菲 贾润清 周玉柏 管永军 曾毅
100124 北京工业大学生命科学与生物工程学院药物研究所(王晓菲、贾润清、周玉柏、管永军、曾毅);100052 北京,中国疾病预防控制中心病毒病预防控制所 传染病预防控制国家重点实验(曾毅)
·论著·
HIV-1中和抗体2G12真核表达载体的构建及活性检测
王晓菲 贾润清 周玉柏 管永军 曾毅
100124 北京工业大学生命科学与生物工程学院药物研究所(王晓菲、贾润清、周玉柏、管永军、曾毅);100052 北京,中国疾病预防控制中心病毒病预防控制所 传染病预防控制国家重点实验(曾毅)
目的 构建HIV-1中和抗体全基因共表达真核质粒载体,观察其在293T细胞中的表达并检测其活性。方法 合成HIV-1中和抗体2G12 轻链可变区(VL)和重链可变区(VH),与含人IgG轻、重链恒定区的载体分别连接,构建出完整的2G12轻链和重链的载体,通过PCR扩增与连接将2G12轻、重链全长构建到真核表达载体pVR中,同时将内部核糖体进入位点(Internal ribosome entry site, IRES)插入到此载体中构建双基因表达系统,重组质粒转染293T细胞进行瞬时表达,ELISA检测抗体表达效果,通过结合实验及中和实验检测细胞上清的结合活性和中和活性。结果 获得可表达人IgG的重组双基因真核表达载体,转染后上清的抗体表达量为6.43 μg/ml,并且抗体保留了原来的结合活性和中和活性。结论 所构建的载体可表达具有较好的结合活性和中和活性的抗体,本研究为真核表达载体表达人HIV中和抗体全基因方面提供了可选择的平台。
Fund programs: National Science and Technology Major Project of China(2012ZX10001005)
多数HIV感染者生活在发展中国家,且近年来发病率呈上升趋势,严重威胁人类健康[1]。近年来,许多研究者报道获得HIV治疗性中和抗体[2,3]。本研究使用的中和抗体2G12识别的表位是gp120表面结构保守的低聚甘露糖[4],是碳水化合物特异性中和抗体。2G12具有较广泛的中和能力,中和效力生理学浓度≤25 μg/ml。抗体晶体结构分析发现,其两个Fab形成了一个VH区交联互换的二聚体,是与gp120结合的主要方式。
DNA疫苗在1998年第一次被用于艾滋病临床治疗,本实验所使用的DNA载体pVR在临床使用上安全性较高,而且pVR载体在国内已被批准用于HIV疫苗临床应用。本研究旨在探索表达人IgG的双基因表达载体的构建,将普通启动子换成内部核糖体进入位点(Internal ribosome entry site, IRES)序列,将构建好的质粒载体转染293T细胞检测其表达情况,期望改造后的抗体能够保持原有的结合活性和中和活性,为以后探索多载体联合使用奠定一定的实验基础,以期能够设计出在体内安全并且高效表达中和抗体的疫苗,达到对HIV感染者治疗的目的。

表1 扩增目的基因和Linker的引物序列
1 材料与方法
1.1 材料 中和抗体2G12的VH、VK由大连宝生物工程有限公司合成(GenBank参考序列号:FJ444042), 所需引物由北京六合通生物技术有限公司合成。293T细胞和DH5α感受态均保存于本室,HIV假病毒由本室采用转染293T细胞方式获得。限制性内切酶均购自美国New England Biolabs公司。Goat anti-Human kappa IgG、Goat anti-Human lambda IgG、Goat anti-Human IgG-Fc HRP购自北京中杉金桥生物技术有限公司。
1.2 2G12-pVR/LIH的构建AgeI、SalI-HF酶切PMD19T/2G12-VH、基于PBR322的克隆载体AbVec-hIgG1;AgeI、BsiWI酶切PMD19T/2G12-VK、基于PBR322的克隆载体AbVec-IgKappa,构建重组质粒AbVec-2G12-H、AbVec-2G12-L。PCR扩增AbVec-2G12-Lc(712 bp)、AbVec-2G12-Hc(1 425 bp)、IRES(622 bp)序列,扩增产物分别经胶回收,转化DH5α感受态,挑取单克隆,提取质粒并进行PCR酶切鉴定及测序鉴定,对鉴定正确的质粒进行酶切,胶回收。构建pVR/Linker45,将合成的Linker45与pVR空载体连接。上述胶回收的片段分别与pVR/Linker45连接,转化挑取单克隆,提取质粒并进行PCR酶切鉴定及测序鉴定,最终获得2G12-pVR/LIH载体。引物设计如表1:
1.3 2G12-pVR/LIH重组载体的表达 提前24 h将状态良好的293T细胞接种于T175细胞培养瓶中,同时设置平行实验,采用5% CO2、37 ℃条件培养细胞,培养基为10% FBS的DMEM,至细胞密度达80%~90%;2G12-pVR/LIH重组质粒转染293T细胞,转染试剂为FuGENE HD(瑞士Roche公司),分别在转染后48 h、76 h、96 h、120 h取少量细胞上清进行ELISA检测。培养120 h后收集细胞上清进行纯化,离心后用0.22 μm滤器进行过滤,用1 mmol/L Tris调节上清pH值至8.0,采用Nab(tm) protein A 柱(美国Thermo公司)亲和纯化获得2G12抗体。
1.4 2G12抗体分子的Western blot鉴定 将纯化的抗体使用4%~20%的预制胶进行非还原SDS-PAGE电泳(120 V, 1 h),阴性对照为pVR空载体,电泳结束后,使用半干电转仪将抗体转印至硝酸纤维素膜,5%脱脂奶4 ℃封闭过夜,以Goat Anti-Human IgG-AP为二抗(1∶500稀释),室温孵育2 h,TBST洗膜,进行Western blot实验,检测抗体分子大小。
1.5 ELISA检测2G12抗体表达及结合活性 抗体表达检测方法,以Goat anti-Human kappa和Goat anti-Human lambda包被酶标板,使用浓度为2 μg/ml,50 μl/孔,4 ℃过夜,洗板,洗液为PBST(含0.05% Tween的PBS,pH 7.5)。每孔加5%脱脂奶200 μl,置37 ℃温箱封闭2 h,洗板。加入PBS稀释的细胞上清及标准品,37 ℃放置1 h,洗板5遍。加入 1∶7500 稀释的二抗Goat anti-Human IgG-Fc HRP,50 μl/孔,37 ℃孵育1 h,洗板,避光显色,终止液终止显色反应,450/630 nm波长检测吸光度。
抗体结合活性检测,采用终浓度为100 ng/孔的D7324抗体(爱尔兰Aalto Bio Reagent公司)包被酶标板,4 ℃过夜,洗板,脱脂奶封闭 2 h,洗板,加入gp120,孵育1 h,洗板,加入细胞上清孵育1 h,洗板,加入二抗孵育1 h,洗板,显色,检测吸光度值。
1.6 HIV微量中和实验 96孔细胞培养板中加入稀释到50 μg/ml的2G12抗体,25 μl/孔,加入稀释好的假病毒,25 μl/孔,同时设置细胞对照组和病毒对照组,各组均设置3孔平行对照孔,阴性对照为含10% FBS的DMEM。37 ℃孵育1 h后加入TZM-bl细胞,细胞用DMAE-Dextran调整到浓度为2×105/ml,每孔加入50 μl细胞,37 ℃培养48 h,裂解细胞,Bright-Glo Luciferase Assay System(美国Promega公司)检测荧光素酶活性(Relative luminescence units, RLU)。
2 结果
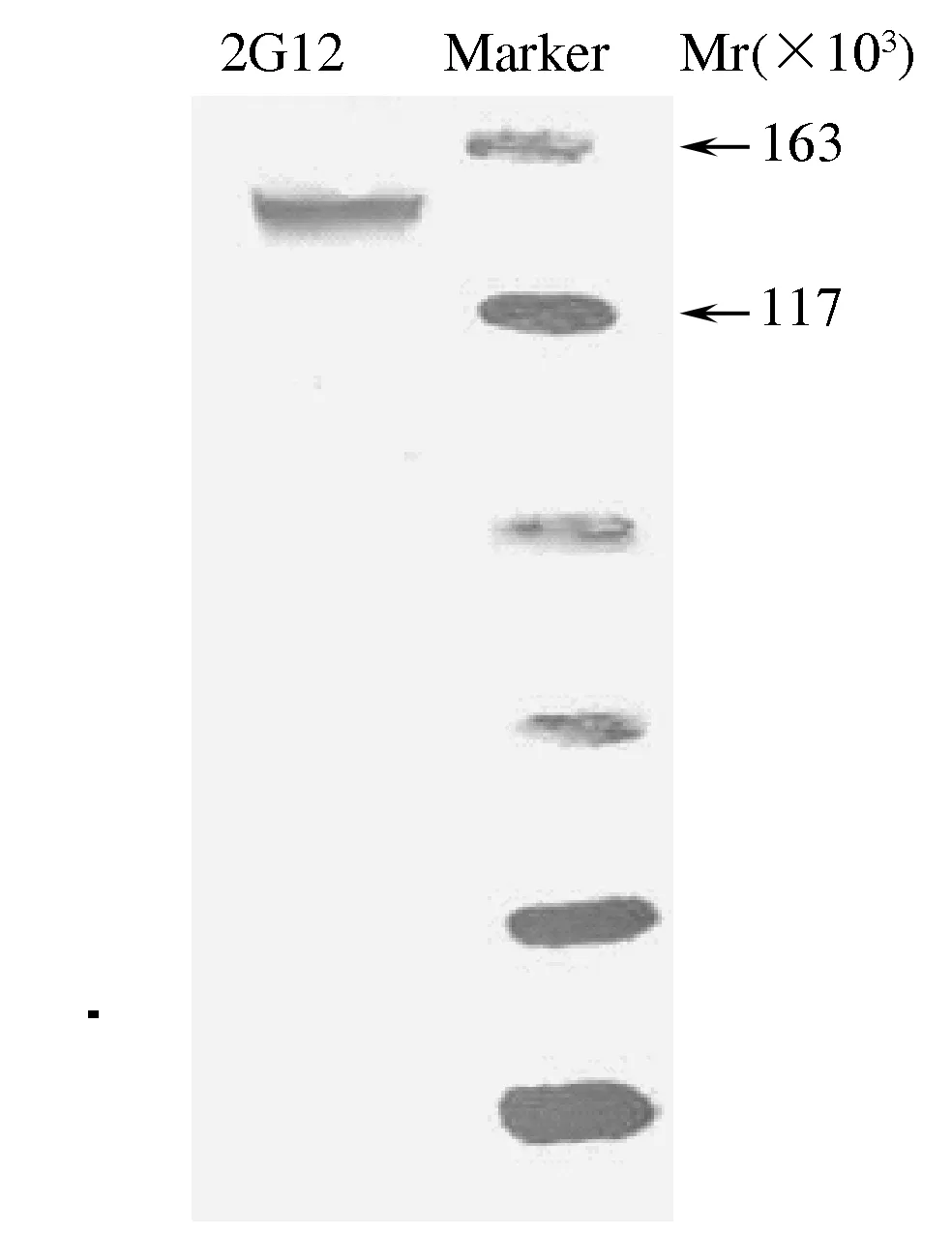
图1 Western blot 鉴定抗体2G12∶2G12-pVR/LIHFig.1 Identification of antibody by Western blot
2.1 2G12抗体分子的Western blot鉴定 对所获得的抗体进行Western blot分析,结果显示,2G12泳道可见相对分子质量为150×103左右的条带,与预期相符,且未见其他明显杂带,对照组泳道在相应位置未见明显条带,表明构建的2G12-pVR/LIH质粒可以有效表达2G12全基因抗体,见图1。2.2 重组质粒转染293T细胞系的表达 2G12-pVR/LIH重组质粒转染293T细胞,48 h、72 h、96 h、120 h分别取上清做ELISA检测表达情况,结果显示随时间的增加,抗体的表达量逐渐上升,48 h检测抗体表达量较低,72 h检测抗体表达量为4.56 μg/ml,到120 h检测抗体的表达量达到6.43 μg/ml。对表达的抗体进行纯化后获得浓度为101 μg/ml的抗体。
2.3 2G12抗体结合活性检测 取转染后的细胞上清以捕获ELISA检测抗体的结合活性,结果表明不同稀释浓度的细胞上清与gp120均可有效结合,抗体在0.6 μg/ml左右达到结合的高峰,在0.02 μg/ml时结合活性很弱,且结合活性与抗体浓度呈正相关,见图2。
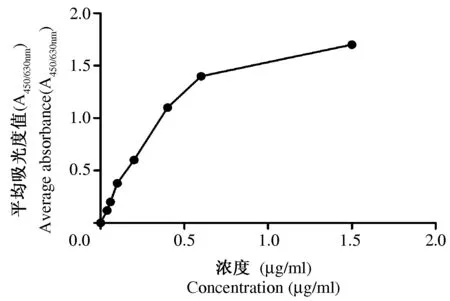
图2 抗体结合能力检测Fig.2 Detection of antibody binding capacity
2.4 表达2G12抗体中和活性的检测 采用纯化后的单克隆抗体2G12分别与4种不同亚型的9种HIV假病毒(包括CRF07-BC亚型S19-15和22-5,CRF08-BC亚型GX75-20和189-52,B亚型QH0692.42、SF162和TR0.11,C亚型Du422.1和ZM53M.PB12)在TZM-bl 细胞中进行中和活性检测,对CRF07-BC亚型S19-15和B亚型SF162的IC50分别是0.83 μg/ml和3.15 μg/ml,对其他7种假病毒株的IC50都大于25 μg/ml,结果显示表达的抗体对 CRF07-BC 亚型假病毒 S19-15 和B亚型假病毒 SF162 有中和活性。
3 讨论
在HIV的感染过程中,机体产生的针对HIV的中和抗体可以通过中和游离的病毒颗粒起到抗病毒作用,同时也可以作用于被HIV感染的细胞,从而达到控制HIV感染的目的。近年来,随着对HIV-1包膜糖蛋白结构认识的逐渐深入,以及动物实验被动免疫的研究,中和抗体在控制HIV-1感染方面的作用越来越清楚,在动物实验及临床试验中也都表现出了良好的效果,特别是Caskey等[5]报道的一类叫做3BNC117的HIV抗体,I期临床试验结果显示该抗体具有非常好的病毒中和活性,部分受试者一周内病毒载量下降到最低水平,证明中和抗体治疗是有效的治疗方法。随着中和抗体的研究越来越深入,如何使中和抗体在体内获得安全高效的表达,从而达到部分或完全中和体内病毒的目的,一直是中和抗体研究非常重要的问题。同一载体上同时表达两个或者多个外源基因在生物学领域中具有广泛的应用价值,通过在双基因之间插入IRES序列构建合适的载体从而获得两个或者多个外源基因的高效转移与表达。IRES序列源于某些病毒和细胞的 mRNA 5′ 端的一段非翻译区[6]。在上游启动子的控制下,IRES 序列能和与之相连的基因进行同时转录。本研究探索通过IRES原件的引入尝试构建表达2G12的双基因表达载体获得成功。
本研究通过构建双基因表达载体成功的表达了2G12,表达产物通过中和活性实验检测其活性与已公布数据相近[7],保持了原有的生物活性,目前国内尚未有采用引入IRES原件表达HIV中和抗体双基因的文献报道,这可以为以后构建表达人IgG的双基因表达载体奠定一定的实验基础。本实验所使用的DNA载体pVR的抗性基因是卡那霉素,在临床使用比较安全,并且能够防止抗性基因整合到人基因组中而产生抗生素的耐药性,pVR载体在国内已被批准用于HIV疫苗的临床应用。本研究中选择DNA载体作为表达中和抗体的工具主要原因是其免疫原性低的特点,在探索载体联合使用方面具有非常重要的意义,后期本课题组将继续探索表达人IgG的双基因表达策略,以期能够获得外源基因在体内的高效持续表达。
[1] Fauci A S. 25 years of HIV[J]. Nature, 2008, 453:289-290. doi: 10.1038/453289a(2008).
[2] Pejchal R, Doores KJ, Walker LM, et al. A potent and broad neutralizing antibody recognizes and penetrates the HIV glycan shield[J]. Science, 2011, 334(6059):1097-1103. doi: 10.1126/science.1213256.
[3] Wu X, Yang ZY, Li Y, et al. Rational design of envelope identifies broadly neutralizing human monoclonal antibodies to HIV-1[J]. Science, 2010, 329(5993):856-861. doi: 10.1126/science.1187659.
[4] Buchacher A, Predl R, Strutzenberger K, et al. Generation of human monoclonal antibodies against HIV-1 proteins; electro fusion and Epstein-Ban virus transformation for peripheral blood lymphocyte immortalization[J]. AIDS Res Hum Retroviruses, 1994, 10(4):359-369. doi: 10.1089/aid.1994.10.359.
[5] Caskey M, Klein F, Lorenzi JC, et al. Viraemia suppressed in HIV-1 infected humansby broadly neutralizing antibody 3BNC117[J]. Nature, 2015, 522(7557):487-491. doi: 10.1038/nature14411.
[6] Hellen CU, Sarnow P. Internal ribosome entry sites in eukaryotic mRNA molecules[J].Genes Dev, 2001, 15(13): 1593-1612. doi: 10.1101/gad.891101.
[7] Karpenko LI, Scherbakova NS, Chikaev AN, et al. Polyepitope protein incorporated the HIV-1 mimotope recognized by monoclonal antibody 2G12[J]. Mol Immunol, 2012, 50(4):193-199. doi: 10.1016/j.molimm.2012.01.003.
(本文编辑:吕新军)
Construction of HIV-1 broadly neutralizing antibody gene eukaryotic expression vector and detection of its biological function
Wang Xiaofei, Jia Runqing, Zhou Yubai, Guan Yongjun, Zeng Yi
Institute of Materia Medica,College of Life Science and Bioengineering,Beijing University of Technology, Beijing 100124, China(Wang XF, Jia RQ, Zhou YB, Guan YJ, Zeng Y); State Key Laboratory for Infectious Disease Prevention and Control, National Institute for Viral Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 100052, China(Zeng Y)
Jia Runqing, Email:nmjrq520@163.com;Guan Yongjun, Email: guanyj12@gmail.com;Zeng Yi, Email:zengyicdc@sina.com
Objective To construct a recombinant double gene co-expressing plasmid of HIV-1 broadly neutralizing antibody and to detect its expression in 293T cell line. Methods HIV-1 neutralizing antibody 2G12 variable region of light chain (VL) and heavy chain (VH) was synthesized, and ligated with vectors containing human IgG constant regions of light and heavy chain to construct a complete 2G12 light and heavy Chain. The VL and VH of 2G12 and IRES were cloned into eukaryotic expression vector pVR by PCR amplification and then the recombinant plasmid was transfected into 293T cells. Expression of the antibody in cell supernatant was detected by ELISA. Binding and neutralizing activity of the cell supernatant were tested by ELISA and micro-neutralization assays. Results The recombinant double gene eukaryotic expression vector which can express human IgG was constructed successfully. The expression level of the supernatant was 6.43 μg/ml, and the antibody retained the binding and neutralizing activity. ConclusionsThe constructed vector can express the antibody with binding and neutralizing activity, this study provides a good platform for the expression of human HIV neutralizing antibody in the eukaryotic expression vector.
HIV; Neutralizing antibody; DNA vector
贾润清,Email:nmjrq520@163.com;管永军,Email: guanyj12@gmail.com;曾毅,Email:zengyicdc@sina.com
10.3760/cma.j.issn.1003-9279.2017.03.004
HIV;中和抗体;DNA载体
国家科技重大专项(2012ZX10001005)
2016-11-01)
猜你喜欢
——一道江苏高考题的奥秘解读和拓展
