pVR-IL15基因佐剂对表达HBsAg重组病毒免疫效果的影响
2017-07-24潘瑞何兵陈国敏毕胜利曾毅
潘瑞 何兵 陈国敏 毕胜利 曾毅
102206 北京,中国疾病预防控制中心病毒病预防控制所 传染病预防控制国家重点实验室
·论著·
pVR-IL15基因佐剂对表达HBsAg重组病毒免疫效果的影响
潘瑞 何兵 陈国敏 毕胜利 曾毅
102206 北京,中国疾病预防控制中心病毒病预防控制所 传染病预防控制国家重点实验室
目的 探索pVR-IL15基因佐剂在表达HBsAg病毒治疗型疫苗的不同免疫策略中对免疫应答的影响。方法 采用了携带乙肝病毒S基因片段的DNA、重组Ankara痘病毒和重组腺病毒序贯免疫策略免疫BALB/c小鼠,在序贯免疫策略的基础上联合pVR-IL15免疫。用ELISA和IFN-γ ELISPOT方法检测不同免疫组别中小鼠的细胞免疫和体液免疫反应强度。结果 联合pVR-IL15免疫组的体液免疫应答水平和细胞免疫应答水平均显著高于无联合pVR-IL15免疫组,差异具有统计学意义。结论 pVR-IL15基因佐剂能够增强表达HBsAg重组病毒诱导的小鼠免疫应答。
据WHO统计,截至2016年6月约有2.4亿人长期感染HBV(HBsAg持续阳性至少6个月)。治疗型疫苗通过诱导机体产生有效的免疫应答,可打破慢性乙肝患者的免疫耐受,清除体内病毒,从而达到治疗的目的。佐剂可增强疫苗抗原特异性免疫应答、增强抗体效应和增加抗体反应的持续时间。IL15(Interleukin-15)是美国国立卫生研究院(NIH)指导审查的最有前途的肿瘤治疗药物,是自然杀伤细胞(NK)、自然杀伤T细胞(NKT)和CD44hi记忆型CD8T细胞生存的必需因子[1]。重组痘病毒载体疫苗和重组腺病毒载体疫苗虽然具有很强的免疫原性,但其诱导的免疫应答不足以对机体产生保护效果。因此,本研究采用重组pVR-S质粒、重组痘病毒rMVA-S和重组腺病毒rAdv-S组成不同的联合免疫,既弥补了单独免疫的不足,又可诱导机体产生有保护效应的免疫应答。
1 材料与方法
1.1 材料 乙型肝炎表面抗体ELISA检测试剂盒购自北京万泰生物药业有限公司,HRP标记的羊抗小鼠IgG购自北京中山金桥生物科技有限公司,小鼠IFN-γ ELISPOT试剂盒购自Mabtech公司,特异性免疫刺激肽PL-11、WY-8和VL-8由北京朝日和源生物技术有限公司合成。pVR-S、rAdv-S和rMVA-S由病毒病预防控制所曾毅院士实验室构建;pVR-IL15由北京工业大学李莉莉博士惠赠。体重约17.5~21 g的4~6周龄清洁级雌性BALB/c小鼠,购自中国食品药品检定研究院,饲养于中国疾病预防控制中心职业卫生与中毒控制所清洁级动物实验室。
1.2 实验方法
1.2.1 小鼠免疫:将小鼠随机分为5组,每组5只。基因导入仪电击肌注,质粒pVR、pVR-S和pVR-IL15的免疫剂量分别为100 μl(1μg/μl)/只。rMVA-S和rAdv-S的免疫方式为皮下注射,rMVA-S的免疫剂量为100 μl/只(1.2×108PFU),重组腺病毒rAdv-S的免疫剂量为100 μl/只(8×108TCID50/100 μl)。PBS组皮下注射1×PBS,100 μl/只。各组小鼠在末次免疫后一周,摘除眼球取血,分离血清,保存-80 ℃备用。采用颈椎脱臼法处死小鼠,分离脾淋巴细胞。各组别小鼠免疫策略见图1。
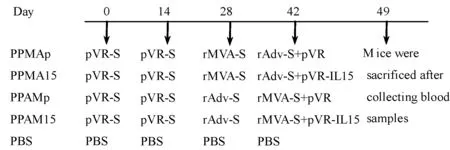
图1 免疫策略Fig.1 Immunization strategies
1.2.2 免疫小鼠血清中HBsAg抗体检测:使用乙肝表面抗体ELISA检测试剂盒,在相应孔中分别加入梯度稀释的待测小鼠血清及对照样品各100 μl,按照试剂盒说明书操作。临界值=阴性对照孔均值×2.1。
1.2.3 小鼠特异性细胞免疫应答检测:使用Mabtech公司的ELISPOT试剂盒检测免疫小鼠的特异性细胞免疫反应。实验方法按照试剂盒说明书操作,阴性对照孔加入与刺激物等体积的1640培养液,每孔终体积为100 μl,空白孔加入100 μl的1640培养液,37 ℃,5%CO2培养箱培养42 h。碱性磷酸酶显色后,使用AID ELISPOT Reader Systems自动读取斑点形成数(Spot forming cell,SFC),换算成1×106个脾细胞形成的斑点数(SFC/106)。
1.3 统计学方法 采用SAS9.3及GraphPad prism 5软件处理实验数据,多组样本均数的比较首先采用正态性检验,符合正态分布的采用方差分析,多组间两两比较采用Bonferroni法,不符合正态分布的采用Kruskal-wallis秩和检验。小鼠血清中多次免疫及免疫时间效应的影响采用重复测量资料方差分析。
2 结果
2.1 免疫小鼠血清中HBsAg抗体滴度 ELISA检测末次免疫后血清抗体滴度,结果显示各组间HBsAg抗体滴度分布不符合正态分布,采用Wilcoxon检验各组间的差异有统计学意义(χ2=19.57P=0.0006)。免疫小鼠血清中抗HBsAg抗体检测结果显示,在rAdv-S和rMVA-S联合免疫中,两种重组病毒的免疫顺序对诱导小鼠产生抗体的水平无影响。使用pVR-IL15加强免疫组的小鼠血清中HBsAg抗体滴度显著高于未加强免疫的小鼠组(见图2)。
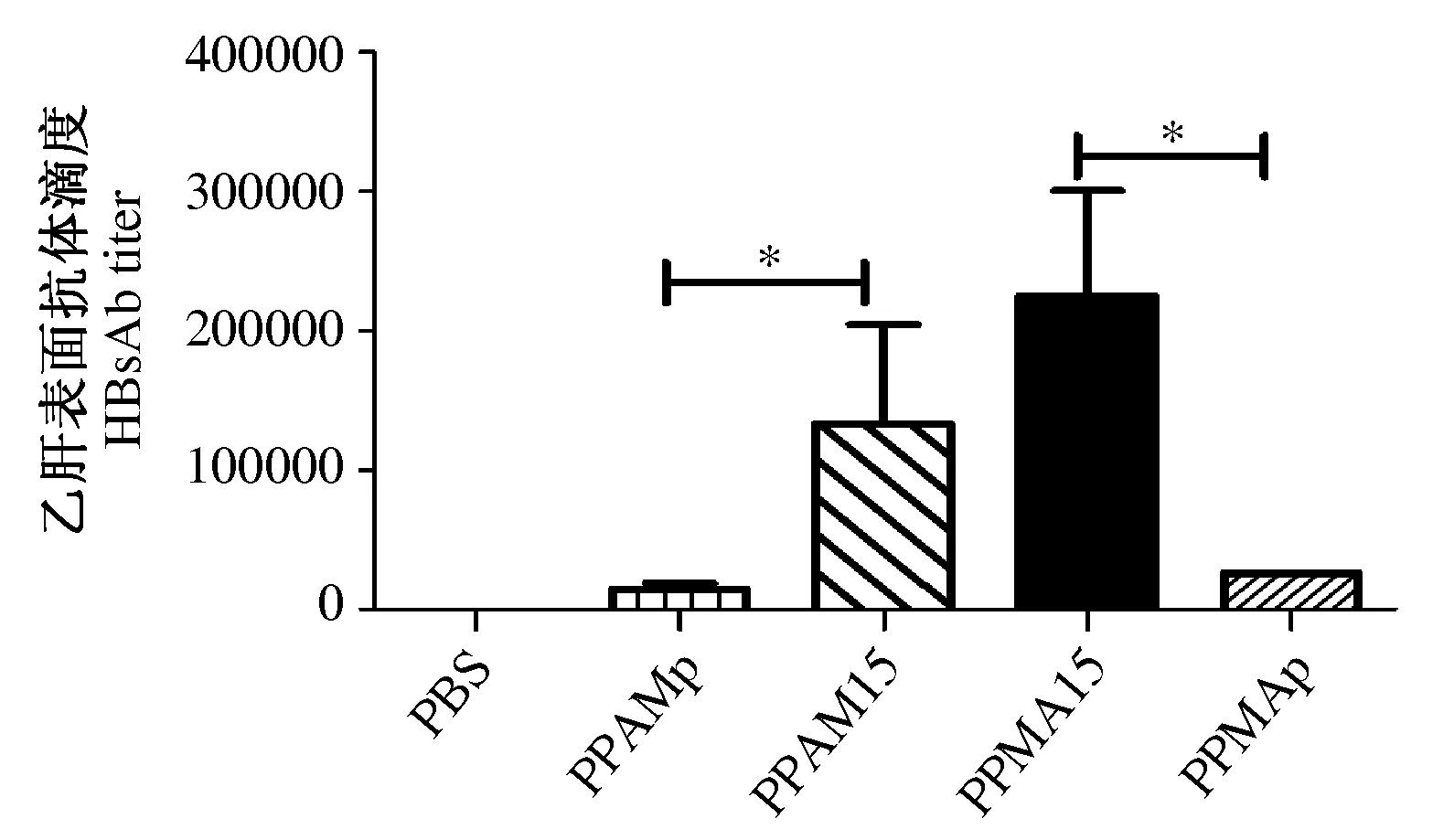
图2 免疫小鼠特异性抗体水平Fig.2 Specific antibody level in immunized mice
2.2 免疫小鼠特异性细胞免疫反应 使用IFN-γ ELISPOT检测不同免疫策略诱导的小鼠特异性细胞免疫应答水平。结果显示各组间的SFC数值呈正态分布且各组方差齐(χ2=1.79P=0.6168),采用方差分析显示各组间的差异有统计学意义(F=6.62P=0.0059)。小鼠特异性细胞免疫应答检测结果显示,加强pVR-IL15免疫的小鼠组的特异性细胞免疫应答水平高于加强pVR免疫组。rAdv-S和rMVA-S的先后免疫顺序对诱导的特异性细胞免疫应答水平无影响(见图3)。
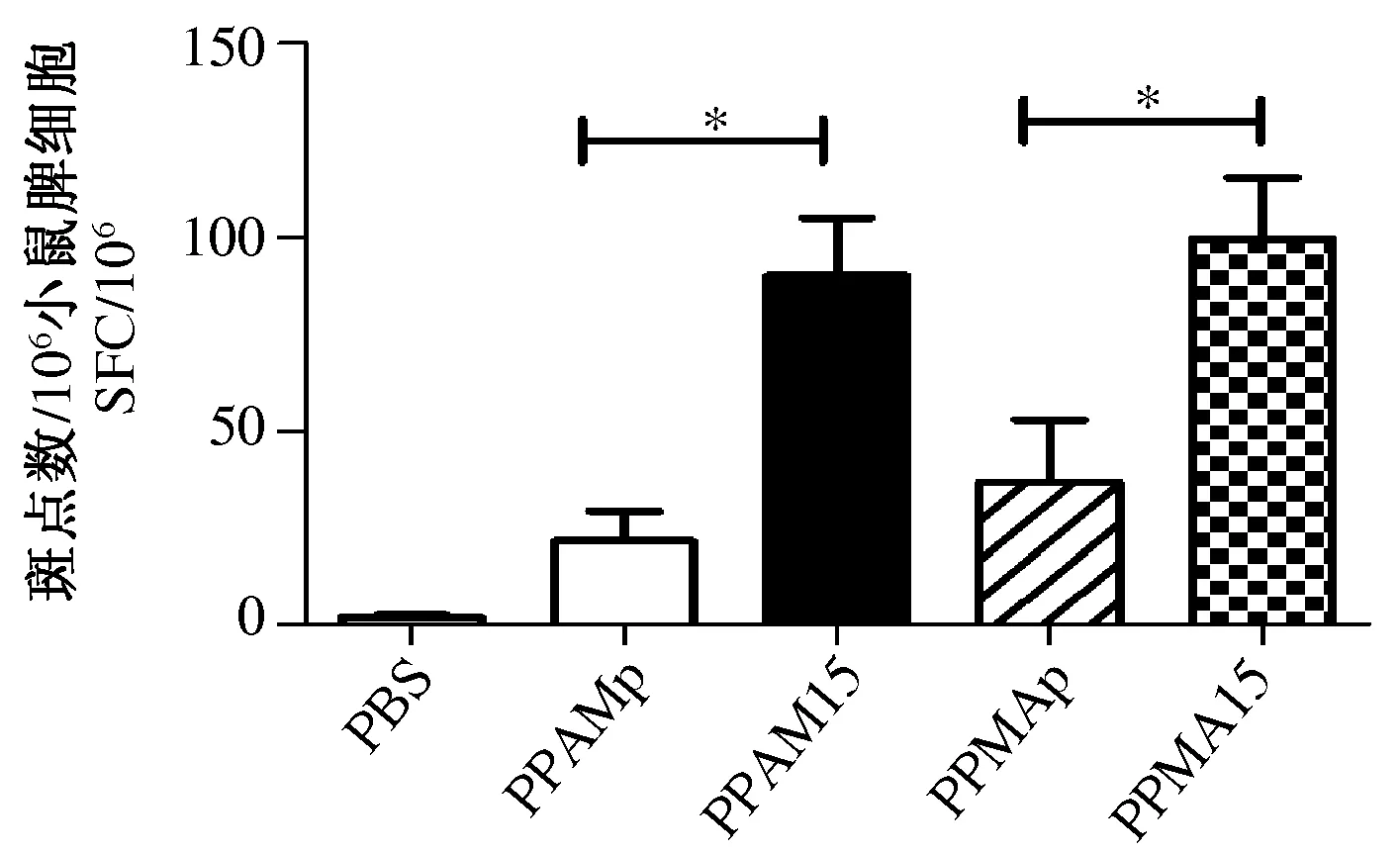
图3 免疫小鼠细胞免疫应答Fig.3 Cellular immune response of immunized mice
3 讨论
HBV感染控制失败主要与T细胞功能紊乱有关。有研究表明IFN-α和IL15联合使用不仅能够诱导抗体免疫应答,减少肝脏中HBV载量,而且还可以提高特异性CD8+细胞的免疫力[2]。在病毒感染的不同阶段,T细胞功能的可塑性有助于调整抗病毒免疫。在急性和慢性HBV感染期中,HBV特异性T细胞的多功能分析显示,HBV特异性T细胞能够产生中性粒细胞趋化因子CXCL-8,而IL15和IL7是产生CXCL-8 T细胞增殖过程中必须的细胞因子[3]。有学者发现,加强免疫表达IL15的重组质粒,可延长表达HBcAg DNA疫苗诱导的CD8T细胞的寿命[4]。IL15可以显著增加自体全细胞肿瘤疫苗诱导的细胞免疫和体液免疫,通过促进NK细胞和CD8+T细胞的活化,增强抗肿瘤免疫反应[5]。IL15也是一种调节固有免疫和适应性免疫的多效性细胞因子,这提示IL15可能在HBV免疫反应的调节中起着重要的作用[6]。本研究结果表明pVR-IL15基因佐剂能够增强表达HBsAg重组病毒诱导的小鼠免疫应答,与前述文献结果相一致。在免疫两次pVR-S的基础上,再分别免疫rMVA-S和rAdv-S,所诱导的免疫应答水平无统计学差异,表明免疫应答水平与免疫rMVA-S和rAdv-S的顺序无关。有研究在联合免疫表达HIV-1结构基因实验中发现,所有实验组3种疫苗联合免疫可诱导类似的细胞免疫应答水平,与免疫顺序没有关系[7]。
有研究者发现,小剂量皮内接种乙型肝炎疫苗能够产生有效的免疫反应[8]。在婴幼儿和学龄前儿童中,皮内注射3次低剂量重组乙型肝炎疫苗诱导的抗-HBs反应与肌注三次标准剂量疫苗的免疫效果相当[9]。而且皮下有丰富的郎格汉氏细胞,能够捕捉抗原及变应原,形成抗原肽MHCⅡ类复合物,有利于抗原呈递。为提高疫苗的免疫原性,本研究中重组病毒的免疫方式为腹股沟皮下注射。
综上所述,在联合免疫重组腺病毒和重组痘病毒中,两种病毒的免疫顺序对所诱导的体液免疫和细胞免疫应答水平无影响,加强免疫pVR-IL15小鼠组所诱导的体液免疫和细胞免疫应答水平均高于未加强免疫的小鼠组。在今后的研究中,可进一步优化实验方案,提高免疫效果。
[1] Wu J. IL-15 Agonists: The cancer cure cytokine [J]. J Mol Genet Med, 2013, 7 (4): 85-87. doi: 10.4172/1747-0862.1000085.
[2] Di Scala M, Otano I, Gil-Farina I, et al. Complementary effects of interleukin-15 and alpha interferon induce immunity in hepatitis B virus transgenic mice [J]. J Virol, 2016, 90 (19): 8563-8574. doi: 10.1128/JVI. 01030-16.
[3] Gehring AJ, Koh S, Chia A, et al. Licensing virus-specific T cells to secrete the neutrophil attracting chemokine CXCL-8 during hepatitis B virus infection [J]. PLoS One, 2011, 6 (8): e23330. doi: 10.1371/journal. pone. 0023330.
[4] Zhang W, Dong SF, Sun SH, et al. Coimmunization with IL-15 plasmid enhances the longevity of CD8 T cells induced by DNA encoding hepatitis B virus core antigen [J]. World J Gastroenterol, 2006, 12 (29): 4727-4735. doi: 10.3748/WJG. v12. i29.4727.
[5] Kim PS, Kwilas AR, Xu W, et al. IL-15 superagonist/IL-15RαSushi-Fc fusion complex (IL-15SA/IL-15RαSu-Fc; ALT-803) markedly enhances specific subpopulations of NK and memory CD8+ T cells, and mediates potent anti-tumor activity against murine breast and colon carcinomas [J]. Oncotarget, 2016, 7 (13): 16130-16145. doi: 10.18632/oncotarget. 7470.
[6] Bobbala D, Kandhi R, Chen X, et al. Interleukin-15 deficiency promotes the development of T-cell acute lymphoblastic leukemia in non-obese diabetes mice with severe combined immunodeficiency [J]. Leukemia, 2016, 30 (8):1749-1752. doi: 10.1038/leu. 2016.28.
[7] Ratto-Kim S, Currier JR, Cox JH, et al. Heterologous prime-boost regimens using rAd35 and rMVA vectors elicit stronger cellular immune responses to HIV proteins than homologous regimens [J]. PLoS One, 2012, 7 (9): e45840. doi: 10.1371/journal. pone. 0045840.
[8] Henderson EA, Louie TJ, Ramotar K, et al. Comparison of higher-dose intradermal hepatitis B vaccination to standard intramuscular vaccination of healthcare workers [J]. Infect Control Hosp Epidemiol, 2000, 21 (4): 264-269. doi: 10.1086/501756.
[9] Egemen A, Aksit S, Kurugol Z, et al. Low-dose intradermal versus intramuscular administration of recombinant hepatitis B vaccine:A comparison of immunogenicity in infants and preschool children [J]. Vaccine, 1998, 16 (16): 1511-1515. doi: 10.1016/S0264-410X(98)80006-6.
(本文编辑:吕新军)
The influence of pVR-IL15 gene adjuvant on immunization with recombinant viruses expressing HBsAg
Pan Rui, He Bing, Chen Guomin, Bi Shengli, Zeng Yi
State Key Laboratory for Infectious Disease Control and Prevention, Institute for Viral Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
Chen Guomin, Email: guominch2013@163.com; Zeng Yi, Email: zengyi@sina.com
Objective To explore the influence of pVR-IL15 gene adjuvant on the immune responses of different immunization strategies. Methods The sequential immunization strategies were used in BALB/c mice with a DNA vaccine, recombinant modified vaccinia virus Ankara and recombinant adenovirus expressing HBsAg respectively and combined with a gene adjuvant pVR-IL15. Cellular and humoral immune responses were evaluated by IFN-γ enzyme-linked immunospot assay (ELISPOT) and enzyme-linked immunosorbent assay (ELISA), respectively. Results The levels of humoral and cellular immune responses in the immune groups combined with pVR-IL15 were significantly higher than those of the non-combined with pVR-IL15. Conclusions The pVR-IL15 gene adjuvant can enhance the immune responses induced by the recombinant viruses expressing HBsAg.
pVR-IL15; Gene adjuvant; Recombinant virus
陈国敏,Email:guominch2013@163.com;曾毅,Email:zengyicdc@sina.com
10.3760/cma.j.issn.1003-9279.2017.03.003
pVR-IL15;基因佐剂;重组病毒
2017-01-09)
