MicroRNA在山楂酸诱导A549细胞凋亡中的作用研究
2017-07-20白雪,李慧,张月,彭扬,何平
白 雪,李 慧,张 月,彭 扬,何 平
MicroRNA在山楂酸诱导A549细胞凋亡中的作用研究
白 雪,李 慧,张 月,彭 扬,何 平*
目的 探讨MicroRNA在山楂酸诱导肺癌细胞A549凋亡过程中发挥的生物学作用。方法 将人的肺癌细胞系A549经过山楂酸干预,并提取处理后A549细胞的总RNA,通过AFFX miRNA表达谱芯片,检测山楂酸作用前后A549细胞中miRNA表达差异情况。通过生物信息学,分析预测miRNA作用的靶蛋白。结果 山楂酸作用前后肺癌细胞A549中59个miRNA表达差异显著,其中23个miRNA的表达上调,36个miRNA的表达下调。生物信息学分析预测,由miRNA调控的细胞增殖相关靶蛋白400余个,细胞凋亡相关靶蛋白300余个,其中XIAP是miR-630下游调控的靶蛋白。结论 山楂酸可能通过调控miRNA的表达发挥对A549细胞的抑制作用。
肺癌;MicroRNA;山楂酸
0 引言
微小RNA(microRNA,miRNA)是一类内源性非编码小分子单链RNA,具有高度的物种保守性[1]。目前,有1 000多种miRNA已被命名,尽管在人类基因组中所占比例极小,但miRNA调控着人体内超过1/3的基因表达[2]。miRNA在转录后调控基因表达时起负性调节作用,其主要的调控方式是通过与目标mRNA结合进而抑制其翻译或使其降解,达到干扰靶mRNA翻译,从而调控靶mRNA基因的表达,在细胞周期的各个阶段,包括肿瘤细胞的增殖、分化、侵袭、转移、凋亡中起重要作用[3-5]。
中草药单体多从天然植物中提取,与西药化疗药物相比毒副作用小,已成为近年来抗肿瘤药物研究的热点[6-9]。山楂酸是从油橄榄、红枣、山楂等植物中提取出来的天然有机化合物单体,已有研究表明,山楂酸对某些肿瘤细胞有较强的抗肿瘤活性[10]。目前,对于中药抗肿瘤的机制,主要是关于编码蛋白表达调控的研究,而非编码miRNA表达调控的研究较少。近年来已有研究显示,在中药抗肿瘤的过程中,miRNA可能作为癌基因或抑癌基因参与其中。中药作用后,作为抑癌基因的miRNA表达增加,可通过促进其靶基因(原癌基因)降解或抑制靶基因(原癌基因)的翻译来下调原癌基因的表达,从而实现中药抗肿瘤的作用;同样,作为癌基因的miRNA表达减少,亦可通过对其靶基因(抑癌基因)翻译后水平的负调控作用来上调抑癌基因的表达,进而达到抗肿瘤的目的[11]。这些为深入研究中药抗肿瘤机制开辟了新的方向。
本实验拟通过AFFX miRNA表达谱芯片筛选山楂酸作用于A549细胞前后miRNA的表达变化。通过生物信息学分析预测,筛选出miRNA所调控的细胞增殖相关靶蛋白及细胞凋亡相关靶蛋白,在miRNA水平研究山楂酸抑制A549细胞的作用机制。
1 材料与方法
1.1 材料、试剂及仪器 人肺癌细胞系A549购于美国典型培养物保藏中心(American Type Culture Collection,ATCC),RPMI-1640培养基购于Gibco公司,胎牛血清购于天津索莱宝生物工程有限公司,胰蛋白酶购于以色列Biological Industries公司,Trizol购于大连宝生物工程公司,离心机购于德国Eppendorf公司,超净工作台(SW-CJ-1FD型)购于蚌埠净化设备厂,倒置显微镜(Olympus CKX31)购于日本奥林巴斯公司。
1.2 方法
1.2.1 细胞培养 人肺癌A549细胞用10%胎牛血清的RPMI1640培养基置于37 ℃、饱和湿度、5%二氧化碳的培养箱中培养。细胞呈单层贴壁生长状态,取对数生长期细胞用于实验,将细胞浓度调整为0.5-1×106/mL。接种细胞后培养过夜,当细胞进入对数生长期后,开始进行药物干预。
1.2.2 miRNA表达差异检测方法 AFFX miRNA表达谱芯片检测山楂酸作用前后A549细胞中miRNA表达差异。①细胞处理:将对数生长期细胞接种于75 cm2培养瓶中培养过夜,并加入终浓度为18 μg/mL的山楂酸溶液,采用等量RPMI-1640的培养基作为阴性对照,置于37 ℃、饱和湿度、5%二氧化碳的培养箱中培养24 h。②细胞总RNA提取:样品经过PBS缓冲液漂洗后,加入1 mL Trizol溶液,室温静置5 min。加200 μL氯仿于混合液中,将混合液进行离心,加入异丙醇(体积比为1∶1),充分混匀后离心(4 ℃,12 000 r/min,30 s),弃上清,获取总RNA。③样本RNA处理:取1 μg样本总RNA,加入500 μL 1 mmol Tris Cl,1 μL ATP mix充分混匀并置于冰上。添加2 μL RNA Spike Control Oligos,5 μL Poly(A) Tailing Mix,轻弹管壁数次使其充分混匀,快速离心(5 s)收集溶液于管底,37 ℃温育15 min。④生物素标记MicroRNA:添加4 μL 5X FlashTag Ligation Mix Biotin,2 μL T4 DNA Ligase于上述体系,并于25 ℃温育30 min。添加2.5 μL Stop Solution终止反应,瞬时离心(5 s),收集溶液于管底,置于冰上。⑤芯片杂交和扫描:取出芯片并使芯片温度平衡至室温,将杂交液加入到标记好的miRNA体系中瞬时离心(5 s),收集溶液于管底,99 ℃温育5 min,45 ℃温育5 min。混合液于离心机最大转速离心5 min,除去杂交混合液中的不溶性物质。芯片中注入100 μL杂交液并放置于杂交炉中,48 ℃、60 r/min旋转杂交16 h。杂交结束后吸弃杂交液,加入100 μL Array Holding Buffer,将芯片进行清洗染色,最后进行扫描。
1.3 结果分析 对miRNA的差异表达进行筛选:在实验中检测结果显示变化方向和程度一致。靶基因预测:使用3种预测方法分析miRNA的靶基因。具体预测算法为:targetScan,picTar,miRanda。将所有的靶基因进行GO(Gene Ontology)功能注释分析,然后将分别与细胞增殖和凋亡的基因筛选出来,整理成列表形式。
2 结果
2.1 山楂酸作用于A549细胞前后miRNA的表达变化 AFFX miRNA表达谱芯片筛选山楂酸作用于A549细胞前后miRNA的表达变化,软件分析结果发现,59个miRNA表达差异显著(10倍以上改变),其中23个miRNA的表达上调,36个miRNA的表达下调。见表1。

表1 部分筛查表达差异的miRNA
2.2 miRNA靶基因预测 生物信息学分析结果表明,由上述miRNA调控的细胞增殖相关靶蛋白400余个,细胞凋亡相关靶蛋白300余个,其中XIAP是miR-630下游调控的靶蛋白(见表2)。
3 讨论
miRNA最早是由Lee在线虫体内发现的,后期科学家们证实,其在哺乳动物体内亦广泛存在,通过调控基因表达参与了多种生物功能的调节。其主要作用方式是在翻译后水平调控靶基因的表达,具体机制为通过与靶mRNA 的3′UT互补配对,从而促进靶mRNA 的降解或抑制其翻译[12-13]。研究表明,miRNA几乎参与了肿瘤发生、发展的各个阶段,具有癌基因或抑癌基因双重作用[14-15]。增强或抑制抑癌基因性或癌基因性miRNA的表达,可以抑制肿瘤细胞的增殖和侵袭。目前已经有超过40种miRNA被证实与肺癌有关,如Let-7、miR-13、miR-34、miR-145及miR-126等[16-19],它们通过在肺癌细胞中表达上调或下调,调节转录后翻译,发挥其癌基因或抑癌基因作用,影响肺癌的发展进程。
miRNA是基因表达的关键调节分子,在肿瘤细胞的增殖、凋亡中起重要的调控作用。miRNA及其调控对象,都可能成为药物作用靶点。目前的研究发现,一些药物能改变肿瘤细胞miRNA的表达,其表达的变化可能与药物抗肿瘤作用相关[20-21]。miRNA可能作为抗肿瘤药物作用靶点,为抗肿瘤药物的开发提供新的策略和思路。目前在miRNA分子水平研究中药治疗肿瘤作用机制的报道较少,有待于进一步探索和发现。
本实验通过AFFX miRNA表达谱芯片筛选山楂酸作用于A549细胞前后miRNA的表达变化,发现包括miR-630在内的59个miRNAs表达有显著差异(差异改变均大于10倍),其中23个miRNA表达上调,36个miRNA表达下调。生物信息学分析预测,由上述miRNA调控的细胞增殖相关靶蛋白400余个,细胞凋亡相关靶蛋白300余个,其中XIAP是miR-630下游调控的靶蛋白。有研究表明,miR-630参与调节顺铂诱导肺癌A549细胞死亡,顺铂作用后伴随miR-630表达升高[23]。通过上述文献结合生物信息学软件分析,我们初步判定miR-630表达上调可能参与了调控山楂酸诱导A549细胞凋亡过程。
本实验结果表明,山楂酸可能通过调控miRNA的表达发挥对A549细胞的抑制作用。本研究初步探讨了miRNA在山楂酸抑制肺腺癌系A549细胞中的作用,为中药抗肿瘤的机制研究提供了新的方向和理论依据,为进一步在山楂酸抑制肺癌A549细胞miRNA调控水平的深入研究奠定了基础。
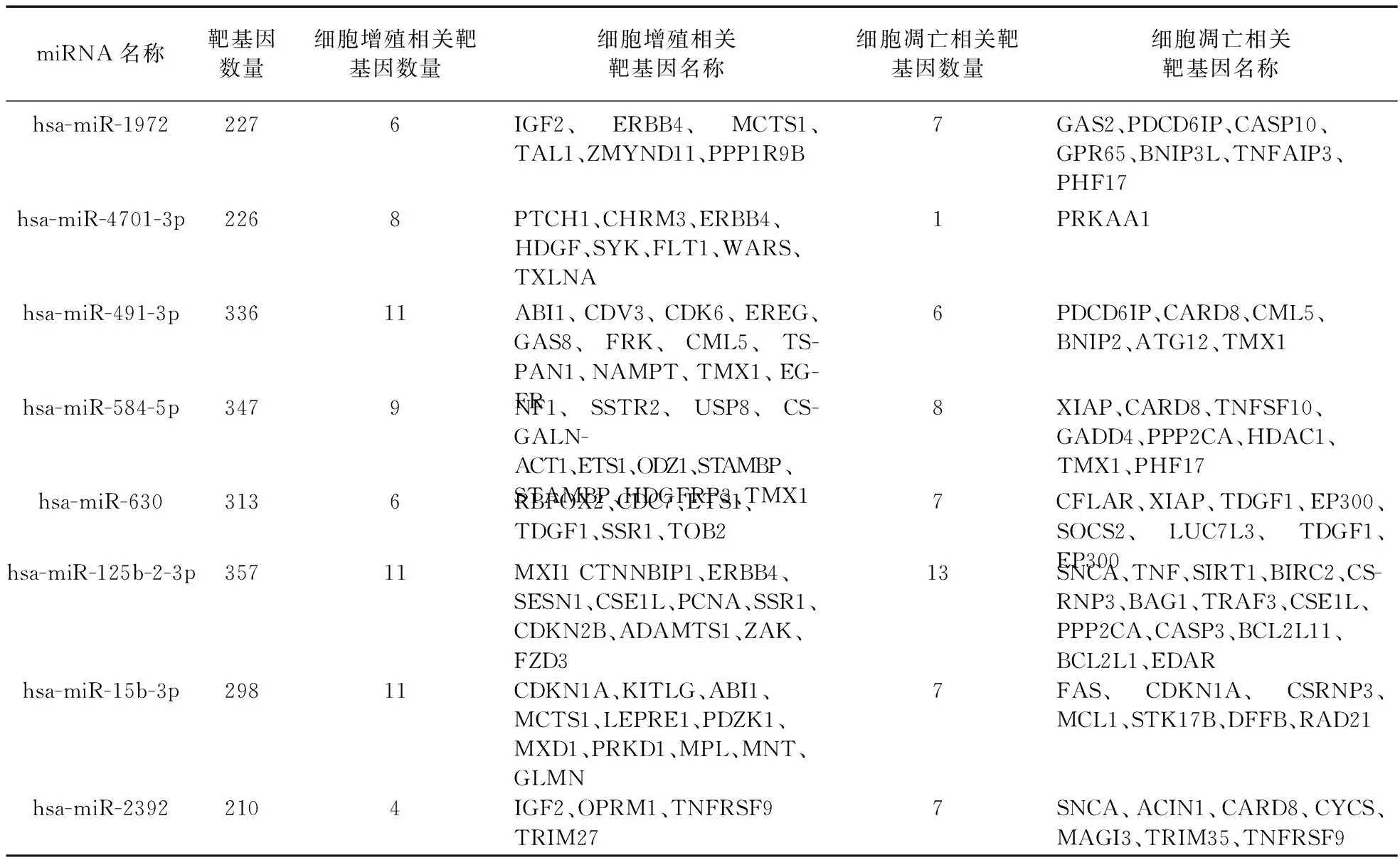
表2 部分miRNA靶基因预测
[1] Jevsinek SD,Godnic I,Zorc M,et al.Genome-wide in silico screening for microRNA genetic variability in livestock species[J].Anim Genet,2013,44(6): 669-677.
[2] Koufaris C.Human and primate-specific microRNAs in cancer:evolution,and significance in comparison with more distantly-related research models:the great potential of evolutionary young microRNA in cancer research[J].Bioessays,2016,38(3):286-294.
[3] Zhang R,Li F,Wang W,et al.The effect of antisense inhibitor of miRNA 106b approximately 25 on the proliferation,invasion,migration,and apoptosis of gastric cancer cell[J].Tumour Biol,2016,37(8):10507-10515.
[4] Fan SJ,Li HB,Cui G,et al.miRNA-149* promotes cell proliferation and suppresses apoptosis by mediating JunB in T-cell acute lymphoblastic leukemia[J].Leuk Res,2016,41:62-70.
[5] Lu K,Wang J,Song Y,et al.miRNA-24-3p promotes cell proliferation and inhibits apoptosis in human breast cancer by targeting p27Kip1[J].Oncol Rep,2015,34(2): 995-1002.
[6] Xu J,Song Z,Guo Q,et al.Synergistic effect and molecular mechanisms of traditional Chinese medicine on regulating tumor microenvironment and cancer cells[J].Biomed Res Int,2016,2016:1490738.
[7] Guo Q,Li J, Lin H.Effect and molecular mechanisms of traditional Chinese medicine on regulating tumor lmmunosuppressive microenvironment[J].Biomed Res Int,2015,2015:261620.
[8] Wang YJ,Li Q,Li YJ,et al.Current status of traditional Chinese medicine on reversing tumor multi-drug resistance[J].Zhongguo Zhong Yao Za Zhi,2014,39(24): 4693-4698.
[9] Liu M, Jia LQ.Preliminary clinical experience of Prof.Li Pei-wen in treating complications of tumor by external treatment of traditional Chinese medicine[J].Zhongguo Zhong Xi Yi Jie He Za Zhi,2014,34(11):1390-1391.
[10]Li C,Yang Z,Zhai C,et al.Maslinic acid potentiates the anti-tumor activity of tumor necrosis factor alpha by inhibiting NF-kappaB signaling pathway[J].Mol Cancer,2010,9:73.
[11]Wang XY,Song JY,Xie CX,et al.RNA-Seq and genuine traditional Chinese medicine[J].Yao Xue Xue Bao,2014,49(12):1650-1657.
[12]Stankevicius V,Vasauskas G,Bulotiene D,et al.Gene and miRNA expression signature of Lewis lung carcinoma LLC1 cells in extracellular matrix enriched microenvironment[J].BMC Cancer,2016,16(1): 789.
[13]Zhang W,Le TD,Liu L,et al.Predicting miRNA targets by integrating gene regulatory knowledge with expression profiles[J].PLoS One,2016,11(4):e0152860.
[14]Mito JK,Min HD,Ma Y,et al.Oncogene-dependent control of miRNA biogenesis and metastatic progression in a model of undifferentiated pleomorphic sarcoma[J].J Pathol,2013,229(1): 132-140.
[15]Wang X,Zhao J,Huang J,et al.The regulatory roles of miRNA and methylation on oncogene and tumor suppressor gene expression in pancreatic cancer cells[J].Biochem Biophys Res Commun,2012,425(1): 51-57.
[16]Osada H,Takahashi T,Takahashi.Let-7 and miR-17-92:small-sized major players in lung cancer development[J].Cancer Sci,2011,102(1): 9-17.
[17]Xue X,Liu Y,Wang Y,et al.MiR-21 and MiR-155 promote non-small cell lung cancer progression by downregulating SOCS1,SOCS6,and PTEN[J].Oncotarget,2016,7(51):84508-84519.
[18]Kim YH,Lee WK,Lee EB,et al.Combined effect of metastasis-related microRNA,miR-34 and miR-124 family,methylation on prognosis of non-small-cell lung cancer[J].Clin Lung Cancer,2017,18(1):e13-e20.
[19]Stahlhut C,Slack FJ.Slack,combinatorial action of microRNAs let-7 and miR-34 effectively synergizes with erlotinib to suppress non-small cell lung cancer cell proliferation[J].Cell Cycle,2015,14(13): 2171-2180.
[20]Avci CB,Harman E,Dodurga Y,et al.Therapeutic potential of an anti-diabetic drug,metformin:alteration of miRNA expression in prostate cancer cells[J].Asian Pac J Cancer Prev,2013,14(2):765-768.
[21]Cao JX,Lu Y,Qi JJ,et al.MiR-630 inhibits proliferation by targeting CDC7 kinase,but maintains the apoptotic balance by targeting multiple modulators in human lung cancer A549 cells[J].Cell Death Dis,2014,5:1426.
Effect of microRNA on apoptosis induced by maslinic acid in lung cancer cell line A 549
BAI Xue,LI Hui,ZHANG Yue,PENG Yang,HE Ping*
(Shengjing Hospital of China Medical University,Shenyang 110004,China)
Objective To investigate the biological effect of microRNA on apoptosis induced by maslinic acid in lung cancer cell line A549.Methods A549 cells were treated with maslinic acid and the total RNA was extracted.Expression pattern of microRNA was examined in A549 cells treated with maslinic acid using AFFX miRNA expression microarray.Target proteins were predicted using bioinformatic methods.Results Totally 59 miRNAs were involved in the inhibition effect of maslinic acid on lung cancer cell,of which 23 miRNAs were significantly up-regulated and 36 miRNAs were down-regulated.Bioinformatic analysis predicted that miRNA regulated more than 400 proliferation-related target proteins and more than 300 apoptosis-related target proteins.XIAP is one of target proteins regulated by miR-630.Conclusion Maslinic acid may inhibit A549 cells growth through the regulatory effect of miRNA expression.
Lung cancer;MicroRNA;Maslinic acid
2016-12-23
中国医科大学附属盛京医院,沈阳 110004
*通信作者
10.14053/j.cnki.ppcr.201705004
