气相色谱法测定田七痛经胶囊中冰片的含量
2017-07-20朱殿龙胡景莲
朱殿龙,梁 云,孙 楠,胡景莲
(大连市药品检验所中药室,辽宁 大连 116021)
气相色谱法测定田七痛经胶囊中冰片的含量
朱殿龙*,梁 云,孙 楠,胡景莲
(大连市药品检验所中药室,辽宁 大连 116021)
目的:建立田七痛经胶囊中冰片的含量测定方法。方法:经乙酸乙酯提取后,采用气相色谱法测定田七痛经胶囊中冰片的含量。结果:冰片在0.049 86~0.747 90 mg/ml范围内线性关系良好,平均加样回收率为101%,RSD为1.9%(n=9)。结论:本方法重复性良好,可用于田七痛经胶囊中冰片的含量测定,但还需进一步制定合理的含量限度以进行质量控制。
田七痛经胶囊; 冰片; 质量评价; 气相色谱法
田七痛经胶囊由三七、五灵脂、蒲黄、延胡索、川芎、木香、小茴香、冰片组成,具有通调气血、止痛调经之功效,常用于经期腹痛及因寒所致的月经失调,但方中冰片的作用机制尚不完全清楚[1-3]。冰片是中药组方中常用的配伍成分,常作为“佐使药”或“引经药”,效用独特[4-5]。目前,其商品种类较多[6-8],且会在制剂及体内发生转化[9-10],故应控制其质量。田七痛经胶囊被收载于卫生部颁标准[11]和国家食品药品监督管理局单页标准中,但冰片的含量测定项目未被收载,故无法准确控制冰片的质量。气相色谱法测定冰片含量分为内标法和外标法[12-13]。本研究结合冰片原料市场情况,采用外标法建立了田七痛经胶囊中冰片(合成龙脑)的含量测定方法,为质量标准的修订提供了依据。
1 材料
1.1 仪器
Agilent 7890B气相色谱系统(美国安捷伦公司);LabSolutions工作站(日本岛津公司)。
1.2 药品与试剂
冰片对照品(批号:110743—200905,含量为98.0%)购自中国药品生物制品检定研究院。其余试剂均来自国药集团化学试剂有限公司,且均为分析纯;水为超纯水。田七痛经胶囊的来源及编号见表1。
2 方法与结果
2.1 色谱条件
色谱柱为以聚乙二醇为固定液的毛细管色谱柱(30 m×0.53 mm,固定液膜厚1 μm);检测器为氢火焰离子化检测器;程序初始温度145 ℃,保持2 min,以2 ℃/min的速度升温至155 ℃,不保持,以10 ℃/min的速度升温至180 ℃,保持1.5 min;进样口温度220 ℃;检测器温度250 ℃;载气为氮气,体积流量为3.0 ml/min;进样量为1 μl;分流比为10∶1;定量方法为外标法。
2.2 溶液的制备
2.2.1 对照品溶液:精密称取冰片对照品50 mg,置于50 ml容量瓶中,加乙酸乙酯使溶解并稀释至刻度,摇匀,制成1 mg/ml的对照品贮备液。精密量取对照品贮备液5 ml,置于10 ml容量瓶中,加乙酸乙酯稀释至刻度,摇匀,即得。
2.2.2 供试品溶液:取装量差异项下内容物,混匀,取约0.5 g,精密称定,精密加入乙酸乙酯10 ml,称定质量,超声处理10 min,用乙酸乙酯补足减失质量,摇匀,过滤,即得。
2.2.3 阴性样品溶液:取不含冰片的阴性样品,按“2.2.2”项下方法处理,即得。
2.3 专属性试验
分别精密吸取“2.2”项下对照品溶液、供试品溶液和阴性样品溶液各1 μl,注入气相色谱,按“2.1”项下条件进样分析,记录色谱图。结果表明,相邻色谱峰分离度良好,阴性样品无干扰,见图1。

表1 田七痛经胶囊的来源及编号

A.对照品溶液;B.供试品溶液;C.阴性样品溶液;1.冰片A.reference solution; B.test solution; C.negative sample solution; 1. Borneol图1 气相色谱图Fig 1 Gas chromatography
2.4 线性关系试验
精密吸取“2.2.1”项下对照品储备液各0.5、1、2、3、5、7.5 ml,分别置于10 ml容量瓶中,加乙酸乙酯稀释至刻度,摇匀,即得一系列对照品溶液。分别精密吸取对照品溶液1 μl,注入气相色谱仪,按“2.1”项下色谱条件进样测定,记录峰面积。以峰面积为纵坐标(Y),以对照品浓度为横坐标(X),线性回归方程为Y=10 481 291.32X-20 557.51(r=0.999 9)。结果表明,冰片质量浓度在0.049 86~0.747 90 mg/ml范围内与峰面积的线性关系良好。
2.5 精密度试验
精密吸取“2.2.1”项下对照品溶液1 μl,按“2.1”项下色谱条件进样测定,连续进样6次,记录峰面积。结果冰片峰面积的RSD为0.6%,表明仪器精密度良好。
2.6 重复性试验
取同一批样品(样品编号:6-7)6份,按“2.2.2”项下方法制备成供试品溶液,再按“2.1”项下色谱条件进样测定。冰片含量的RSD为1.6%,表明本方法的重复性良好。
2.7 稳定性试验
取样品(样品编号:6-7),按“2.2.2”项下方法制备成供试品溶液,于室温下(25 ℃)放置0、2、4、12、24 h时进样测定,记录峰面积。冰片峰面积的RSD为0.6%,表明供试品溶液在24 h内稳定性良好。
2.8 加样回收率试验
取已知含量的样品(样品编号:6-7,冰片含量8.4 mg/g)内容物约0.25 g,精密称定,共9份,分别加入对照品溶液(0.992 9 mg/ml)1.2、2.5、3.8 ml,再按“2.2.2”项下方法处理,得低、中、高加样供试品溶液各3份,按“2.1”项下色谱条件进样测定,见表2。

表2 加样回收率试验结果(n=9)Tab 2 Recovery test results(n=9)
2.9 检出限
精密量取对照品溶液(0.992 9 mg/ml)1 ml,置于200 ml容量瓶中,加乙酸乙酯稀释至刻度,摇匀,精密量取5 ml,置于10 ml容量瓶中,加乙酸乙酯稀释至刻度,摇匀,作为检出限测定溶液。结果表明,检出限为2.482 μg,见图2。
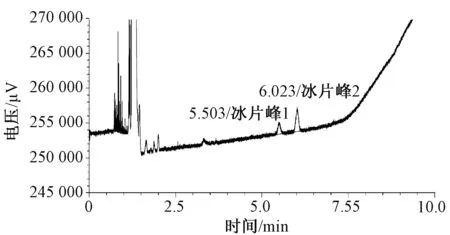
图2 检出限测定色谱图Fig 2 Limit determination chromatogram
2.10 不同厂家田七痛经胶囊中冰片含量
取20个厂家103批样品,分别按照“2.2.2”项下方法制备成供试品溶液,再按“2.1”项下色谱条件进样测定并计算含量。结果表明,样品中冰片含量为1.2~7.9 mg/粒,服从正态分布,最大值与最小值差额达到6.7 mg/粒,均值为3.8 mg/粒,其中3.2~4.5 mg/粒者有70批,占68%,若限度为不低于3.0 mg/粒,合格率约为70%,见图3。处方中冰片投药量较少且易挥发,在与大量中药粉末充分混合均匀过程中,势必会造成损失,加上装量差异,按照理论值80%(4.0 mg/粒)为限度进行统计,冰片含量<4.0 mg/粒者56批,占54%,含量为4.0~5.0 mg/粒者36批,占35%,含量>5.0 mg/粒者11批,占11%,见图4。则限度为≥4.0 mg/粒时,合格率仅为54%,形势不容乐观。对于批次较多的9个厂家样品含量结果进行离散分析,见图5。多数厂家样品含量结果比较集中,质量比较稳定,但是大部分样品冰片损失较多;个别厂家大于处方量投料,样品结果比较分散,质量控制有待完善。

图3 103批田七痛经胶囊中冰片含量的正态分布图Fig 3 Normal quantie plot of borneol in 103 batches of Tianqitongjing capsules
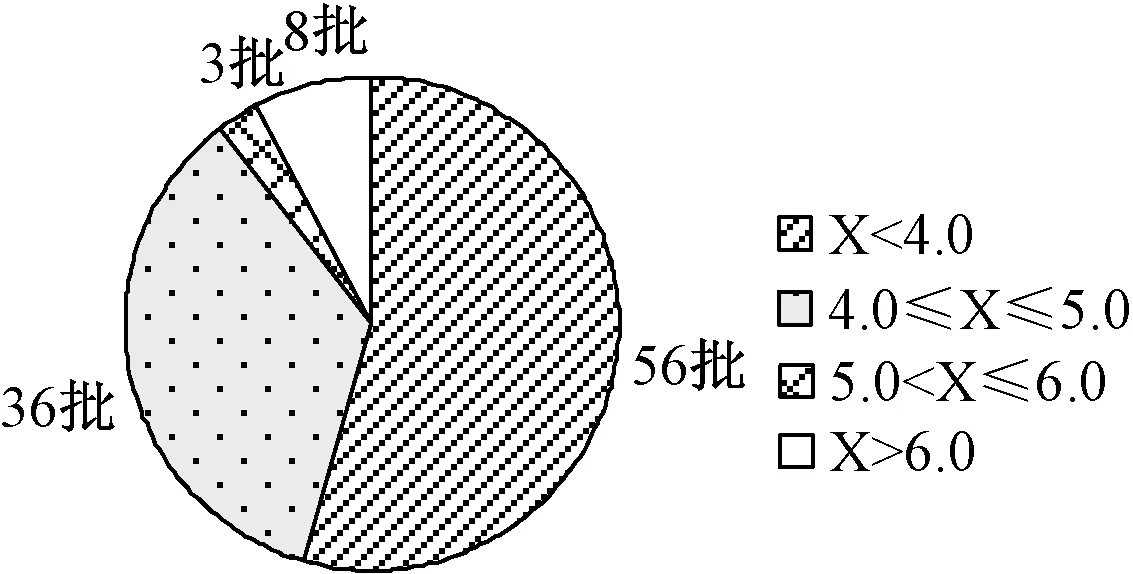
图4 103批田七痛经胶囊中冰片含量的结果分布Fig 4 Content distribution of borneol in 103 batches of Tianqitongjing capsules

图5 不同厂家田七痛经胶囊中冰片含量的结果分布Fig 5 Content distribution of borneol from different manufacturers
3 讨论
根据《中华人民共和国药典:一部》(2015年版)[14]中“冰片”项下规定,成人日用量为0.15~0.30 g,入丸散用,含龙脑(C10H18O)不得低于55.0%。田七痛经胶囊的最大日用量为15粒,按处方量计算冰片的含量理论值为5.0 mg/粒[11],冰片最大日用量为0.075 g,按处方投料无损失情况下达不到规定的用法与用量。但冰片作为具有独特作用的配伍药,不能简单以其单味用量衡量制剂用量。冰片易挥发,投药量少,产品含量普遍低,含量均匀程度可能也会受到影响。田七痛经胶囊中冰片能否有效发挥作用,从样品测定结果和用法与用量的规定来看,有必要进一步开展相关研究,探索冰片的作用机制,完善制剂工艺,确定合理的含量限度,制定有效地质量控制标准。
[1]滕毅,杨海玲.冰片在药代动力学方面的研究进展[J].中国临床药理学与治疗学,2015,20(4):469-475.
[2]刘磊刚.冰片的药理研究与临床应用[J].中国药物经济学,2014(2):26-27.
[3]曲柏超.浅谈冰片的药理研究与临床应用[J].中国药物经济学,2012(2):30-31.
[4]吴娟,谢晋,张群林,等.中药引经理论的现代研究进展和思路[J].中国中药杂志,2016,41(13):2428-2434.
[5]黄燕琼,秦华珍,谭喜梅,等.冰片药性特点探讨[J].南京中医药大学学报,2015,31(3):220-222.
[6]李建民,胡世霞,李华擎.中药冰片的商品种类及其历史源流[J].中国现代中药,2013,15(6):531-534.
[7]王中洋,庞玉新,杨全,等.中药冰片资源及生产加工现状[J].中国现代中药,2014,16(9):780-784.
[8]李海艳,杨全,庞玉新,等.天然冰片、冰片和艾片的鉴别[J].中国医院用药评价与分析,2016,16(2):186-189.
[9]路艳丽,耿兴超,汪巨峰,等.冰片的安全性评价研究现状[J].中国新药杂志,2016,25(6):645-649,658.
[10] 孔凯丽.冰片降解试验[J].中国医药指南,2014,12(6):47-48.
[11] 中华人民共和国卫生部药典委员会.中华人民共和国卫生部药品标准中药成方制剂第十册[S].北京:人民卫生出版社,1995:38.
[12] 丁宁,王栋,何轶,等.冠脉宁片中樟脑的限量检查及冰片的含量测定研究[J].中国药学杂志,2015,50(4):310-313.
[13] 彭善贵,文永盛.气相色谱法测定甘桔冰梅片中冰片含量[J].中国药师,2012,15(4):578-579.
[14] 国家药典委员会.中华人民共和国药典:一部[S].2015年版.北京:中国医药科技出版社,2015:146.
Content of Borneol in Tianqitongjing Capsules by Gas Chromatography
ZHU Dianlong, LIANG Yun, SUN Nan, HU Jinglian
(Dept.of Traditional Chinese Medicine, Dalian Institute for Drug Control, Liaoning Dalian 116021, China)
OBJECTIVE:To establish a method for content determination of borneol in Tianqitongjing capsules. METHODS: The samples were extracted with ethyl acetate and the content of borneol in samples was determined by gas chromatography. RESULTS: The linearity of borneol in the range of 0.049 86 mg/ml-0.747 90 mg/ml was satisfactory. The average recovery of borneol was 101% andRSDwas 1.9% (n=9). CONCLUSIONS: This method has good repeatability, which can be used for content determination of Tianqitongjing capsules, yet further rational content limit are supposed to be formulated for quality control.
Tianqitongjing capsules; Borneol; Quality control; Gas chromatography
R927.2
A
1672-2124(2017)05-0664-04
2017-01-10)
*主管中药师。研究方向:中药鉴定。E-mail:zhudianlong@126.com
DOI 10.14009/j.issn.1672-2124.2017.05.033
