玉米芯水热预处理对纤维素结构的影响
2017-07-19张莉王征舒思韬郭晓亚
张莉,王征,舒思韬,郭晓亚
(上海大学环境与化学工程学院,上海 200444)
玉米芯水热预处理对纤维素结构的影响
张莉,王征,舒思韬,郭晓亚
(上海大学环境与化学工程学院,上海 200444)
针对预处理成本高、会产生二次污染、后续提纯除杂步骤复杂等问题,在水热预处理条件下添加干冰作为辅助介质,研究了操作条件(温度、处理时间和干冰添加量)对玉米芯中纤维素的解聚行为以及木质素脱除率的影响关系,并采用傅里叶转换红外线光谱分析仪(Fourier transform infrared spectroscopy,FTIR)和X射线衍射(X-ray diffraction,XRD)进行分析,得到了纤维素结构在预处理过程中的变化规律,对优化预处理工艺有重要的理论指导意义.研究结果表明:当温度超过160◦C时纤维素无定型区域的链结构开始断裂;当温度升高到180◦C时纤维素聚合度(degree of polymerization,DP)急剧下降,同时木质素去除率达到最高(31.6%).FTIR分析结果表明:与预处理前相比,预处理后纤维素中的C—O—C吸收峰减弱,说明纤维素的糖苷键被破坏,纤维素链发生了断裂.XRD分析结果表明:在预处理过程中玉米芯中纤维素的结晶度增大,说明在预处理过程中纤维素的无定型部分被脱除,同时部分纤维素Ⅰ转化为纤维素Ⅱ.
水热预处理;干冰;聚合度;木质素脱除率;纤维素结构
在木质纤维素生产生物乙醇的工艺中,由于多糖通过酯键和醚键与木质素之间的交联作用造成了木质纤维素的高稳定性和顽抗性,使得水解酶的可及性变差从而降低了水解效率.预处理技术可以破坏木质纤维素的致密结构,去除木质素,从而提高水解酶的可及度.目前,研究和应用较多的预处理技术包括:研磨、蒸汽爆破、氨纤维爆破、二氧化碳爆破、臭氧分解、酸水解、有机溶剂预处理、脉冲电场预处理和水热预处理等[1-6].在这些预处理方法中,水热预处理由于其反应时间短、转化率高和反应温度相对低等优点,已成为一种有前途的预处理技术[7].本工作采用玉米芯为实验原料,在前期研究[8]的基础上,考察了添加干冰为辅助介质的水热预处理技术对玉米芯中纤维素结构及聚合度的影响,为水热预处理技术的应用提供理论指导.选取干冰为辅助介质的原因是随着CO2爆破和超临界CO2在生物质预处理中的成功应用,CO2在生物质预处理中具有良好的应用前景.干冰廉价易得,利用干冰与水构成酸性环境,与传统预处理(使用酸)相比,能够真正从源头上防止酸对环境的污染以及对设备的腐蚀; CO2为纤维素乙醇生产过程中的产物,不需要从外界引入,减少了后续反应中的提纯除杂步骤,降低了操作费用.选取玉米芯为原料是因为玉米芯作为我国主要的农业废弃物之一,年均产量可达约4.0×107t,且目前我国尚缺乏对其有效的利用途径.玉米芯中木质纤维素含量较高(其中纤维素∼40%、半纤维素∼30%和木质素∼25%),适用于生物乙醇的制取.
1 实验部分
1.1 主要试剂与仪器
所用试剂包括苯、乙醇、冰醋酸、氢氧化钠、亚氯酸钠、硫酸铜、浓氨水、乙二胺、盐酸、碘化钾、硫代硫酸钠、氢氧化钾、乙醇、溴化钾、硫酸、碳酸钙和硫氰酸铵,均为分析纯(国药化学试剂有限公司).所用仪器包括电子天平(PL 203,梅特勒-托利多仪器上海有限公司);电热恒温鼓风干燥箱(DGG-9070B,上海森信实验仪器有限公司);程控箱式电炉(马弗炉, SXL-1208,上海精宏实验设备有限公司);傅里叶转换红外线光谱分析仪(Fourier transform infrared spectroscopy,FTIR,Avatar 370,美国Thermo Nicolet公司);X射线衍射仪(X-ray diffraction,XRD,Dmax-2200,日本理学电机株式会社);玉米芯购自于山东高唐;水热预处理设备为盐浴炉,加热温度范围为150∼300◦C;反应管材质为304不锈钢,长110 mm,内径为11 mm.
1.2 原料的准备及实验步骤
1.2.1 原料的准备
绝干玉米芯用粉碎机粉碎,然后过18目和16目筛,得到粒径约为1.0∼1.2 mm的玉米芯颗粒,并用体积比为2∶1的苯/醇混合物在索氏提取器中进行抽提脱蜡.
1.2.2 水热预处理工艺过程
水热预处理的具体操作过程如下:将1.5 g的绝干脱蜡玉米芯颗粒加入到不锈钢反应管中,再加入4.5 mL的去离子水和一定量的干冰,将反应管密封后放入温度已经稳定的盐浴炉中,并开始计时.预处理结束后,将反应管完全冷却并通过过滤收集预处理后的玉米芯,留用.
1.2.3 α-纤维素与木质素的分离及测定
α-纤维素的分离流程如图1所示.α-纤维素的特性黏度η以铜乙二胺溶液作为溶剂在乌氏粘度计(25◦C)中进行测定,根据马丁公式计算其聚合度(degree of polymerization,DP)[9]:


图1 α-纤维素的分离Fig.1 Separation of α-cellulose
剩余的部分预处理固体产物被用于分离木质素.木质素的分离和含量的测定是采用美国国家可再生能源实验室提供的方法[10],具体分离流程如图2所示,其中ASL为酸可溶木质素(acid soluble lignin),UV为紫外线(ultraviolet).

图2 木质素的分离Fig.2 Seperation of lignin
酸不溶木质素又称克拉松木质素(Klason lignin,KL),其百分含量的计算公式为

式中,wa为酸不溶木质素的百分含量,m1为105◦C恒重下木质素的质量(g),m2为575◦C灼烧下的剩余灰分的质量(g),m为样品的质量(g).
木质素总百分含量wt=wa+wb,其中酸溶木质素的百分含量wb是由UV分析结果计算得到.预处理前木质素总百分含量为33.88%,
1.3 分析方法
1.3.1 FTIR分析
α-纤维素样品通过370型FTIR(上海赛默飞世尔科技(中国)有限公司)扫描,扫描时间为32 s,波长范围为400∼4 000 cm−1.
1.3.2 XRD分析
为了进一步证实纤维素在预处理过程中发生的结构变化,在室温下对未经预处理的玉米芯和预处理后的玉米芯中的纤维素进行了广角XRD扫描.X光管为铜靶,用镍片消除Cu Kα辐射,管电压40 kV,管电流40 mA,扫描速度0.02◦/s,样品扫描范围3◦∼70◦.玉米芯的纤维素结晶度(crystallinity of cellulose,CI)通过式(3)来确定[12]:

式中,It是对应于纤维素Ⅰ分子中(002)晶面的强度,通常在22.5◦左右,对于纤维素Ⅱ,是在20◦∼21.9◦之间的双峰;Ia是纤维素Ⅰ在2θ=18◦观察到的峰强度,对于纤维素Ⅱ,则是在2θ=12.1◦的峰强度[12-13].
2 结果与讨论
2.1 预处理对纤维素聚合度和木质素百分含量的影响
2.1.1 温度的影响
在不同预处理温度下纤维素DP、木质素脱除率与温度的关系如图3(a)所示,ASL百分含量、KL百分含量与温度的关系如图3(b)所示,时间固定在90min,干冰0.4 g.实验测定未经水热预处理的玉米芯中纤维素DP是991.

图3 预处理温度对于木质素脱除率、纤维素DP、ASL和KL百分含量的影响Fig.3 Effects of pretreatment temperature on removal of lignin,DP of cellulose,contents of ASL and KL
从图3(a)可以看出,在160◦C下水热预处理玉米芯,纤维素的DP相比原料玉米芯中纤维素的DP下降了14.3%,这表明在该条件下纤维素结构中无定型区域链片段中的糖苷键开始断裂[14].由于木质素极复杂的结构难以被脱除,故在160◦C下木质素的脱除率仅为1.8%,这主要是由小分子量的木质素降解产物和木质素中的亲水性衍生物(ASL)在水溶液中的水解造成的[15].随着温度升高至180◦C,纤维素的DP下降了54.9%,而木质素脱除率达到最高值(31.6%).从图3(b)中可以看出,在180◦C时ASL的百分含量已达到最高值,而KL的百分含量已降至最低,表明木质素中大部分的低分子降解产物和亲水性衍生物在180◦C左右已经完全水解.因此,180◦C时水更容易进入到玉米芯的内部结构中,糖苷键也最大程度地发生断裂,随着温度继续升高,纤维素DP的下降相比前一阶段趋缓.而温度高于190◦C后,虽然DP进一步降低,但是木质素的脱除率下降,故预处理温度为180◦C是最适宜的.
2.1.2 时间的影响
水热预处理时间对纤维素DP和木质素脱除率的影响如图4(a)所示,水热预处理时间对ASL含量和KL含量的影响如图4(b)所示.温度固定在180◦C,干冰0.4 g.
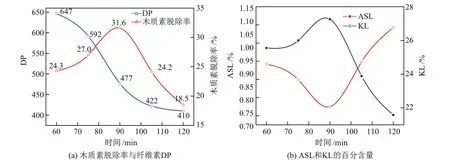
图4 预处理时间对于木质素脱除率、纤维素DP、ASL和KL百分含量的影响Fig.4 Effects of pretreatment time on removal of lignin,DP of cellulose,contents of ASL and KL
从图4(a)中可以看出,当水热预处理时间从60增加到90 min时,纤维素的DP急剧下降,且木质素脱除率在预处理时间为90 min时达到最大值.随着预处理时间的延长并超过90 min时,木质素脱除率反而下降,纤维素DP的下降趋势放缓,且在100 min之后更为平缓. DP预处理时间超过100 min时纤维素DP降低到平台期,可能有两个原因:一方面,最初纤维素DP的降低可能是由无定形纤维素的溶解造成的,而在后一阶段纤维素DP缓慢地降低可能是由于结构更紧凑的纤维素的降解[16];另一方面,由于木质素降解产物进一步生成,在水解液中形成沉淀覆盖到生物质的表面,使得ASL百分含量降低,KL百分含量增大(见图4(b)),木质素的脱除率降低,阻碍了纤维素的降解[17].综上可知,合适的水热预处理时间为90 min.
2.1.3 干冰添加量的影响
图5(a)为干冰添加量对纤维素DP和木质素脱除率的影响,图5(b)为干冰添加量对ASL和KL百分含量的影响.时间固定在90 min,温度180◦C.
从图5可以看出,起初随着干冰添加量的增加,木质素的脱除率和ASL百分含量先增加然后下降,且在干冰添加量为0.4 g时木质素脱除率达最大值(约31.6%).同时,纤维素的DP随着干冰添加量达到0.4 g急剧下降,然后当木质素脱除率达到最大值后纤维素DP降低趋势变缓.这是因为在干冰加入量较少时,随着干冰加入量的增加,钢管中CO2的分压增加,水中CO2的溶解度增加,促使水的酸性增加,促进了木质素的脱除和纤维素的解聚.当干冰添加量大于0.4 g后,进一步增大干冰的添加量,木质素脱除率降低,纤维素DP缓慢下降,这是由于木质素的降解是解聚反应和缩合反应的竞争反应,酸性的继续增大使得木质素小分子降解产物如糠醛、酚类和酮类物质的量增加,当溶液中这些可溶性木质素降解产物类似达到“饱和”时,继续生成的降解产物将难以溶解(图5(b)中ASL百分含量降低),这些小分子降解产物又会发生二次缩合,导致木质素各单体之间的交联作用增大,使其热稳定性增强,难以发生降解,不利于木质素的降解脱除[18].因此,考虑到木质素的脱除率以及为了保护低聚纤维素不被进一步分解,合适的干冰添加量为0.4 g.
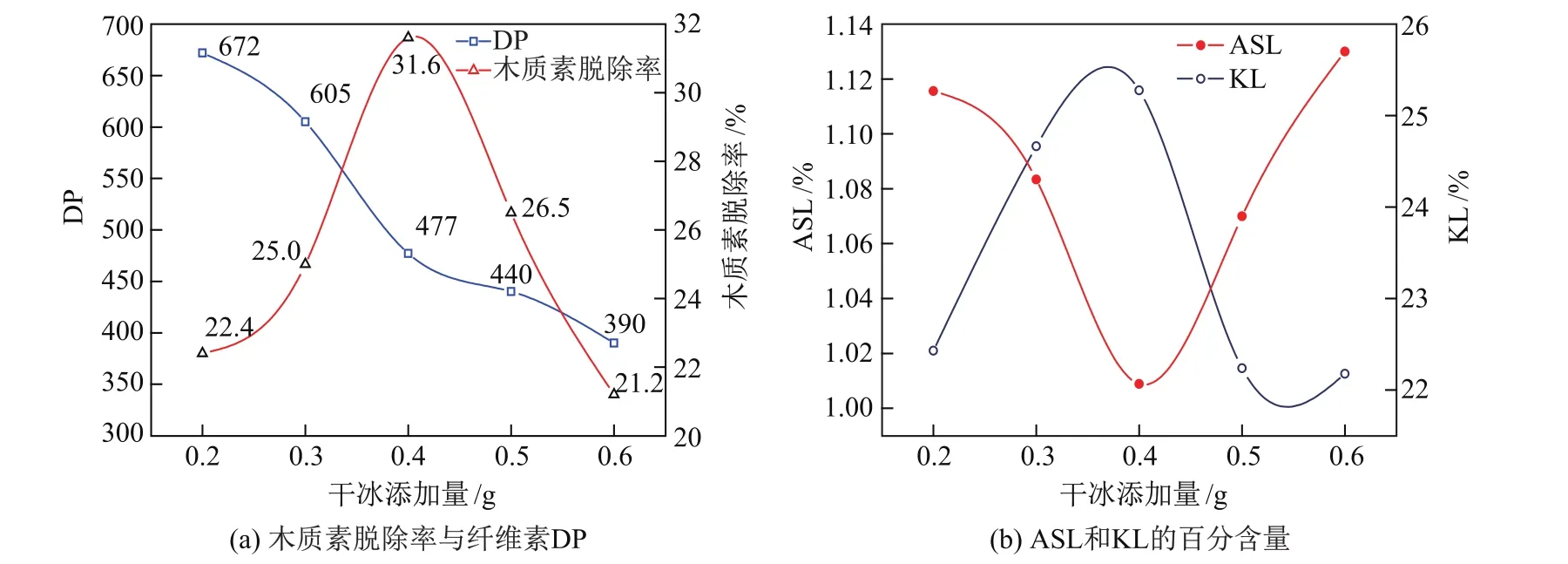
图5 干冰添加量对于木质素脱除率、纤维素DP、ASL和KL百分含量的影响Fig.5 Effects of addition of solid CO2on removal of lignin,DP of cellulose,contents of ASL and KL
2.2 α-纤维素的FTIR
红外光谱能提供特定分子结构的吸收峰,可用于木质纤维素生物质结构的分析.图6为预处理前后玉米芯中α-纤维素的FTIR光谱.图6(a)∼(e)分别代表未经预处理和预处理条件为160◦C,60 min;200◦C,60 min;160◦C,120 min和200◦C,120 min(干冰添加量均为0.4 g)时的α-纤维素FTIR光谱图.
通过比较预处理前后玉米芯中的纤维素的FTIR光谱图可以明显看出,在未预处理样品中出现的1 470和845 cm−1处尖锐的吸收峰在预处理后的样品中消失.—OCH3的伸缩振动出现在1 470 cm−1,芳香族C—H的外部平面振动出现在845 cm−1.这两个吸收峰的存在表明,在未经预处理玉米芯所提取的纤维素中有一定量的木质素,预处理后样品中这两个吸收峰的消失表明木质素在预处理过程中被脱除,从而使得分离所得的纤维素中基本不含木质素.在纤维素中,C—O—C的反对称伸缩振动出现在1 170 cm−1,C—O的伸缩振动出现在1 020∼1 070 cm−1.由图6可以看出,预处理后的纤维素样品中,1 170 cm−1处纤维素的特征吸收峰显著减弱,这表明在水热预处理过程中纤维素的糖苷键部分被破坏,纤维素链发生了断裂,使得纤维素DP下降.在895 cm−1的弱峰是C1基团频率,这是纤维素和半纤维素的特征吸收峰[19].预处理后,895 cm−1处的吸收峰变得更加明显尖锐,这说明水热预处理过程使得木质素与纤维素、半纤维素发生了充分的分离,分离所得的纤维素纯度更高.
2.3 α-纤维素的XRD分析
表1为纤维素的结晶度和半宽高值,α-纤维素的XRD图谱如图7所示.纤维素Ⅰ是天然存在的纤维素形式,具有两种不同的晶型:单链三斜结构Iα和双链修饰单斜结构Iβ,两种晶体都由氢键以平行链排布成平面结构.纤维素Ⅱ是由纤维素Ⅰ经再生或丝光化得到的结晶变体,其氢键以反平行结构排布,热力学性质更为稳定.

图6 纤维素FTIR光谱图Fig.6 FTIR spectra of cellulose

表1 纤维素结晶度和半宽高值Table 1 Degree of crystallinity and half-height width of cellulose
如图7所示,在20◦的峰主要是由纤维素Ⅱ中的(101)晶面产生的.在22.0◦∼22.7◦的另一个峰是由(002)晶面产生的[20].同时可以明显观察到,未经预处理的纤维素样品的(002)晶面的2θ值为22.2◦,对于其他样品主要结晶峰则在20◦∼22◦之间,这表明纤维素Ⅰ的晶格结构在预处理后发生了膨胀,且一部分纤维素Ⅰ转化成纤维素Ⅱ[20-21].34◦左右的弱峰对应于沿着纤维结构方向、纤维二糖单元的1/4长度处的面,此峰对于纤维素链的转变比较敏感[21].由表1可以看出,在预处理前纤维素具有更宽的(I002)结晶峰,且结晶度为45.74%.预处理后,结晶峰从22.2◦向稍低的2θ角转移,出现(101)面的峰,并且显著增强,34◦处的峰减弱,这也说明纤维素Ⅰ向纤维素Ⅱ发生了转变[20].预处理后结晶度显著增加,这可能是因为在水热预处理过程中纤维素的无定型部分发生了水解,使得总结晶度增加.

图7 预处理前后玉米芯中提取的纤维素的XRD图谱Fig.7 XRD patterns of cellulose extracted from raw corncob and pretreated corncob
纤维素无定形部分的降解和纤维素Ⅰ向纤维素Ⅱ的转化随着预处理时间的延长((e)较于(d))、温度的提高((c)较于(b))和干冰添加量的增加((g)较于(f))变得明显.而纤维素Ⅰ向纤维素Ⅱ转变的过程中发生了链的断裂和重排,使得纤维素的DP降低.
3 结论
(1)随预处理时间的延长、温度的提高、干冰添加量的增加,木质素的脱除率不断增大,纤维素DP急剧下降.但当预处理条件改变到特定值后,木质素脱除率达到最大,之后预处理木质素的脱除率降低,这可能是因为伪木素和木质素降解产物产生的沉积物会阻碍木质素的脱除和纤维素的解聚,使得木质素脱除率降低及纤维素解聚速度变缓.水热预处理合适的条件为在干冰添加量0.4 g、温度180◦C下处理90 min,此时木质素脱除率达到最大值(31.6%).
(2)从FTIR光谱图中可以看出,在预处理样品中C—O—C吸收峰减弱,这表明在水热预处理过程中纤维素的糖苷键部分被破坏,纤维素链发生了断裂,使得纤维素DP下降,同时木质素被脱除.通过XRD进一步分析表明,在预处理过程中纤维素的无定型部分被脱除,同时发生了纤维素Ⅰ向纤维素Ⅱ的转变,在此过程中发生的链的断裂和重排使得纤维素DP降低.
[1]Sun Y,Cheng J.Hydrolysis of lignocellulosic materials for ethanol production:a review[J]. Bioresource Technology,2002,83:1-11.
[2]陈育如.植物纤维素原料预处理技术的研究进展[J].化工进展,1999,18(4):24-27.
[3]罗鹏,刘忠,王高升.蒸汽爆破预处理条件对麦草生物转化为乙醇影响的研究[J].酿酒科技,2005, 10:43-47.
[4]张超.氨水循环爆破法对玉米秸秆预处理效果的研究[D].天津:天津大学,2010.
[5]陈尚钘,勇强,徐勇,等.稀酸预处理对玉米秸秆纤维组分及结构的影响[J].中国粮油学报,2011, 26(6):13-18.
[6]高凤芹,孙启忠,邢启明.木质纤维素乙醇的研究进展[J].农业科技与信息,2009(4):54-56.
[7]Alvira P,Tom´as-Pej´o E,Ballesteros M,et al.Pretreatment technologies for an efficient bioethanol production process based on enzymatic hydrolysis:a review[J].Bioresource Technology,2010,101(13):4851-4861.
[8]Guo X Y,Zhang L,Shu S T,et al.Effects of hydrothermal pretreatment on the content and structure of lignin extracted from corncob[C]//Applied Mechanics and Materials.2014: 672/673/674:154-158.
[9]Ma X J,Cao S L,Lin L,et al.Hydrothermal pretreatment of bamboo and cellulose degradation[J].Bioresource Technology,2013,148:408-413.
[10]Sluiter A,Hames B,Ruiz R,et al.Determination of structural carbohydrates and lignin in biomass,NREL/TP-510-42618[R].Fort Collins:National Renewable Energy Laboratory,2008.
[11]张莎莎,费兆奎,薛冬桦.Box-Behnken法优化玉米秸秆预处理工艺对酶解糖化的影响[J].中国酿造,2014,33(10):22-27.
[12]Segal L,Creely J J,Martin A E,et al.An empirical method for estimating the degree of crystallinity of native cellulose using the X-ray diffractometer[J].Textile Research Journal, 1959,29:786-94.
[13]Ago M,Endo T,Hirotsu T.Crystalline transformation of native cellulose from celluloseⅠto celluloseⅡpolymorph by a ball-milling method with a specific amount of water[J].Cellulose, 2004,11:163-167.
[14]Yu Y,Wu H W.Significant differences in the hydrolysis behavior of amorphous and crystalline portions within microcrystalline cellulose in hot compressed water[J].Industrial&Engineering Chemistry Research,2010,49:3902-3909.
[15]Yasuda S,Fukushima K,Kakehi A.Formation and chemical structures of acid-soluble lignin in sulfuric acid treatment time and acid-soluble lignin content of hardwood[J].Journal of Wood Science,2001,47:69-72.
[16]Stephens C,Whitmore P,Morris H,et al.Hydrolysis of the amorphous cellulose in cottonbased paper[J].Biomacromolecules,2008,9:1093-1099.
[17]Leschinsky M,Zuckerstter G,Weber H K,et al.Effect of auto hydrolysis of Eucalyptus globulus wood on lignin structure.Part 2:influence of auto hydrolysis intensity[J].Holzforschung,2008,63:653-658.
[18]任苗苗.玉米秸秆超临界CO2-乙醇-水预处理过程木质素降解脱除[D].天津:天津大学,2012.
[19]Ka˘cur´akov´a M,Capek P,Sasinkov´a V,et al.FT-IR study of plant cell wall model compounds:pectic polysaccharides and hemicelluloses[J].Carbohydrate Polymers,2000,43:195-203.
[20]Kumar S,Gupta R,Lee Y Y,et al.Cellulose pretreatment in subcritical water:effect of temperature on molecular structure and enzymatic reactivity[J].Bioresource Technology,2010, 101:1337-1347.
[21]Cheng G,Varanasi P,Li C L,et al.Transition of cellulose crystalline structure and surface morphology of biomass as a function of ionic liquid pretreatment and its relation to enzymatic hydrolysis[J].Biomacromolecules,2011,12:933-941.
本文彩色版可登陆本刊网站查询:http://www.journal.shu.edu.cn
Influence of hydrothermal pretreatment of corncob on structure of cellulose
ZHANG Li,WANG Zheng,SHU Sitao,GUO Xiaoya
(School of Environmental and Chemical Engineering,Shanghai University,Shanghai 200444,China)
To solve the problem of high costs in pretreatment,secondary pollution and complicated subsequent purification,solid CO2was added as an auxiliary medium under hydrothermal pretreatment conditions.The effects of operating conditions including temperature,time and the amount of solid CO2on the cleavage behavior of cellulose and lignin removal were investigated.Fourier transform infrared spectroscopy(FTIR)and X-ray diffraction(XRD)were used to analyze the structural variation of cellulose,which had great significance of theoretic instruction to optimize the pretreatment process.The results show that cellulose chain cleavage basically occurs when the temperature exceeds 160◦C.As temperature rises to 180◦C,degree of polymerization(DP)decreases dramatically,and the removal of lignin reaches the highest(31.6%).From the analysis of FTIR, peaks associated with C—O—C bonds are weakened in pretreated samples,indicating that glycosidic bonds and chains of cellulose are broken down during the pretreatment process.Further analysis by XRD shows an increase in crystallinity of cellulose in pretreated corncob,indicating removal of the amorphous part of cellulose,and transition of celluloseⅠto celluloseⅡduring pretreatment.
hydrothermal pretreatment;solid CO2;degree of polymerization;removal of lignin;structure of cellulose
TQ 353
A
1007-2861(2017)03-0464-09
10.12066/j.issn.1007-2861.1684
2015-09-17
国家自然科学基金面上资助项目(21571127)
郭晓亚(1976—),女,副教授,博士,研究方向为生物质能源的利用.E-mail:gxy@shu.edu.cn
