人类胚胎干细胞来源的心肌细胞模型的建立及系统鉴定方案
2017-07-19陈欣欣刘珠媛顾寰宇周蕾
陈欣欣,刘珠媛,顾寰宇,周蕾
(南京医科大学第一附属医院心脏内科,南京 210029)
•精准与转化医学•
人类胚胎干细胞来源的心肌细胞模型的建立及系统鉴定方案
陈欣欣,刘珠媛,顾寰宇,周蕾
(南京医科大学第一附属医院心脏内科,南京 210029)
心肌细胞是研究心血管疾病的重要工具之一,但是人类心肌细胞较难获得和培养.为人类胚胎干细胞诱导分化成心肌细胞提供一个有用的实验方法和鉴定方案.人胚胎干细胞以其多向分化的特性为体外研究提供了细胞资源.在人胚胎干细胞诱导分化为心肌细胞的过程中,通过荧光定量聚合酶链式反应(polymerase chain reaction,PCR)检测发现,在分化过程中干细胞标记物Cripto,Dnmt3b,Wnt3,KIF4,Oct4,SOX2和Nanog表达下降,心肌特异性结构蛋白cTnT和α-actinin以及心脏前体细胞分化标记物Nkx2.5表达上升.分化完成后用免疫荧光检测心肌特异性结构蛋白TnnT2和α-actinin,通过分析TnnT2阳性细胞的比例, α-actinin阳性细胞的比例,以及TnnT2和α-actinin双阳性细胞的比例发现,在所提出的胚胎干细胞诱导分化体系中,三者比例分别为90.80%,91.00%,90.91%,表明在此诱导分化条件下人胚胎干细胞可成功分化成为心肌细胞.成功建立了人胚胎干细胞来源的心肌细胞模型以及基于标记物荧光定量PCR及免疫荧光系统检测的鉴定方案,为未来心血管疾病的基础研究及心脏毒性药物检测奠定了一定的基础.
人胚胎干细胞;细胞分化;心肌细胞
心血管疾病已成为21世纪人类健康的首要杀手,针对心血管疾病的基础研究是研发此类疾病治疗方法的基本手段.但遗憾的是,人类心肌细胞的获取和培养都极其困难,而基于人类心肌细胞的研究相较大鼠心肌细胞更有助于模拟人类心血管疾病.人胚胎干细胞(human embryonic stem cells,hESCs)具有分化全能性,可诱导分化为心肌细胞[1-3].分化后的心肌细胞在形态结构[4]、基因表达[5]、电生理特性[6]、离子通道[7]等特征上均和人体内心肌细胞相同.随着胚胎干细胞技术的发展,人胚胎干细胞可以被诱导生成人类心肌细胞,但是缺乏简单可靠的方案[8-9].
近年来,人胚胎干细胞在药物研发及药物安全性评价研究中的作用越来越受到人们的重视[9-10],美国国家研究委员会提出的“21世纪毒性测试新策略”将基于人胚胎干细胞的新的药物心脏毒性评价模型纳入其中[11],欧洲替代法验证中心(European Centre for the Validation of Alternative Methods,ECVAM)也正式批准胚胎干细胞为体外药物和化合物毒性筛选的替代方法,并制定了相应的评价标准[12].但是,进行药物心脏毒性研究时采用人胚胎干细胞诱导的人类心肌细胞效果更佳.此外,开发人胚胎干细胞来源的心肌细胞可避免动物模型的种属差异,缩短研发周期,降低模式动物的消耗,减少研发费用,是大规模筛选心脏疾病相关药物的理想手段[13].但遗憾的是,目前人胚胎干细胞向心肌细胞分化的比率并不高[14],且对于分化完成后心肌细胞的鉴定方案单一,局限于镜下观察或对少量标记物的检测,缺少系统完善的鉴定体系[15-17].本实验对在体外定向诱导人胚胎干细胞向心肌细胞的分化方法进行了优化,并对干细胞相关标记物和心肌细胞标记物进行鉴定,建立了一种人类胚胎干细胞分化为心肌细胞的优化方法,同时为该来源的心肌细胞模型建立提供了系统的评价方法,为更好地服务体外心脏毒性实验、心肌细胞实验等研究提供一定的理论基础.
1 材料与方法
1.1 材料
人胚胎干细胞购自Wicell公司.
人胚胎干细胞的培养及分化:DMEM/F12,RPMI1640/B27,胎牛血清,8 000 U/mL青霉素和8 mg/mL链霉素混合液,0.25%Trypsin-EDTA(1X)购于Gibco公司,CHIR99021(GSK3抑制剂)和IWP2(Wnt抑制剂)购于Selleck公司,碱性成纤维细胞生长因子/bFGF购于Peprotech公司.
聚合酶链式反应(polymerase chain reaction,PCR)及荧光定量PCR相关试剂:trizol购于Takara公司,反转录试剂盒购于BioRad公司,PCR引物购于华大基因公司,SYBR Green荧光定量PCR试剂盒购于BioRad公司,96/384孔荧光定量PCR板及配套贴膜购于Abcam公司.
免疫荧光检测相关试剂:载玻片购于南通天盛公司,免疫荧光用特异性单克隆一抗TnnT2,α-actinin购于Abcam公司,荧光二抗购于Jackson公司,Hoechst购于凯基公司.
1.2 方法
1.2.1 人胚胎干细胞的培养
人胚胎干细胞饲养于小鼠滋养层细胞上,且用添加碱性成纤维细胞生长因子(basic fibroblast growth factor,bFGF,4 ng/mL)的无血清培养基(DMEM/F12+20%KSR)进行培养.待人胚胎干细胞克隆长至足够大小后(大约5 d),吸去培养基,用DMEM/F12洗一遍,然后加入1 mL Dispase于37◦C消化3 min,再次加入DMEM/F12,洗一遍后吸去Dispase和DMEM/F12.后用移液管将人胚胎干细胞克隆机械分割成直径约200µm的细胞团块, 100×g离心1 min.用含有bFGF的培养基重悬至小鼠滋养层细胞(预先用DMEM/F12洗去小鼠滋养层细胞培养基中的血清)上.次日,全换液,接下来每天换液时留下前一天的0.5 mL培养液(以保留少量滋养层细胞分泌的细胞因子).等到第五天左右传代.
1.2.2 人胚胎干细胞向心肌细胞的定向诱导分化
人胚胎干细胞向心肌细胞定向诱导分化前一天传代时,将细胞克隆机械分割成100~150µm的细胞团块.第五天,提前3 h用rock抑制剂Y27632(5µmol/L)处理,后吸去培养基,先用2 mL 0.05%Trypsin清洗,中和残余培养基,再加入2 mL 0.05%Trypsin,于37◦C消化3 min,吸去Trypsin后置于37◦C再消化3~5 min,直至大部分细胞克隆消化成单细胞.然后用培养基重悬,50×g离心30 s去除未消化成单细胞的细胞团块.取上清液1 000×g离心2 min,去上清液用培养基重悬洗涤2次后计数.用含5µmol/L rock抑制剂Y27632和4 ng/mL bFGF的3 mL培养基,将40~60万细胞接种于铺有低密度滋养层细胞的6孔板(预先用DMEM/F12洗去小鼠滋养层细胞培养基中的血清)中.第五天处理后每天换液,换液时不添加Y27632.第八天换液时用3 mL含12µmol/L CHIR99021(GSK3抑制剂)的RPMI1640/B27(不含胰岛素)培养基,以便诱导人胚胎干细胞形成中胚层细胞.第九天,用不含CHIR99021的RPMI1640/B27(不含胰岛素)培养基.第十天换成3 mL含5µmol/L IWP2(Wnt抑制剂)的RPMI1640/B27(不含胰岛素)培养基,以便诱导形成心肌中胚层.第十二天后,用不含IWP2的RPMI1640/B27(不含胰岛素)培养基.
1.2.3 免疫荧光
将分化完成的人胚胎干细胞以20万/mL铺于24孔板.将培养基吸弃,用4%多聚甲醛固定15 min,0.5%Triton X-100破膜25 min,5%牛血清白蛋白(bovine serum albumin,BSA)室温封闭1 h.用5%BSA稀释一抗:α-actinin(1∶200),TnnT2(1∶100),4◦C孵育过夜.次日,吸弃抗体孵育液,磷酸盐缓冲液(phosphate buffered saline,PBS)清洗,用5%BSA配制相应荧光二抗(1∶200),室温避光孵育2 h.PBS清洗,用Hoechst染细胞核.最后,每孔加入100µL PBS,于荧光显微镜下拍照.
1.2.4 荧光定量PCR检测
采用荧光定量PCR检测Cripto,Dnmt3b,Wnt3,KIF4,Oct4,SOX2,Nanog,cTnT, α-actinin和Nkx2.5的表达,引物序列如表1所示.
从培养箱中取出6孔板,在每孔中加入700µL Trizol,裂解3 min,室温放置5 min,收集每孔的裂解到1.5 mL离心管中,在每个离心管中加入140 mL氯仿,涡旋30 s,室温放置3 min,4◦C,12 000×g离心15 min,Trizol∶氯仿=5∶1(体积比),吸取上层无色水相到新的1.5 mL离心管中,加入等体积异丙醇混匀,室温放置10 min,在管底可见微量RNA沉淀,弃上清,加入75%乙醇700µL(75%乙醇用DEPC水配),4◦C,7 500×g离心10 min,弃上清液,通风橱内干燥5~10 min,将沉淀溶于20µL DEPC水中,测RNA浓度.逆转录反应体系如下:5×iScript Reaction mix 4µL,iScript Reverse Transcriptase 1µL,总RNA 2.0µg, Nuclease free H2O的体积为7.5µL减去RNA体积,逆转录成cDNA.利用合成的cDNA和对应的PCR引物检测目的基因的表达水平.

表1 引物序列Table 1 Primer sequences
1.2.5 统计方法
运用SPSS21.0软件进行统计学分析.选用单因素方差分析进行组间比较,并以Bonferroni作两两比较.P<0.05表示有统计学差异.
2 结果
2.1 干细胞相关基因表达变化
分别在分化的0,1,5,8 d用荧光定量PCR检测干细胞相关基因Cripto,Dnmt3b,Wnt3, KIF4,Oct4,SOX2,Nanog,结果显示,在分化过程中上述基因表达依次下调,说明在本工作的分化体系下,干细胞逐渐失去干性,开始分化(见图1).图1中,相对于0 d,∗为P<0.05,∗∗为P<0.01,∗∗∗为P<0. 001;相对于1 d,#为P<0.05,##为P<0.01,##为P<0. 001;相对于5 d,$为P<0.05,$$为P<0.01,$$$为P<0.001,n=4.
2.2 心肌细胞相关基因的表达
分别在分化的0,1,5,8 d用荧光定量PCR检测心肌特异性结构蛋白cTnT和α-actinin,以及心脏前体细胞分化标记物Nkx2.5.结果显示,在分化过程中,cTnT,α-actinin和Nkx2.5表达逐渐上升,说明人类胚胎干细胞逐渐向心肌细胞分化(见图2).
在分化完成的胚胎干细胞中,运用免疫荧光检测心肌特异性结构蛋白TnnT2和α-actinin(见图3),通过分析TnnT2阳性细胞的比例,α-actinin阳性细胞的比例,以及TnnT2和α-actinin双阳性细胞的比例发现,在本工作提出的胚胎干细胞诱导分化体系中,三者比例分别为90.80%,91.00%,90.91%(见图4).
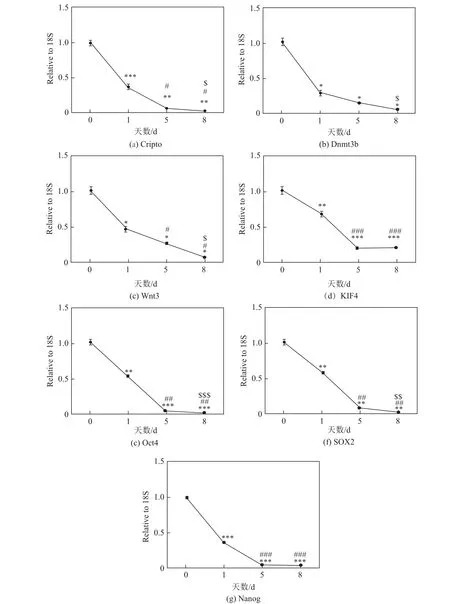
图1 荧光定量PCR检测人胚胎干细胞干性相关基因Fig.1 Fluorescent quantitative PCRs determines genes related to pluripotency state of hESCs
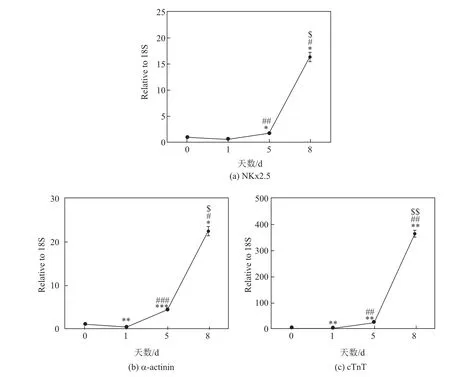
图2 荧光定量PCR检测心肌细胞分化标志物Fig.2 Fluorescent quantitative PCRs determines markers of cardiomyocytes differentiation
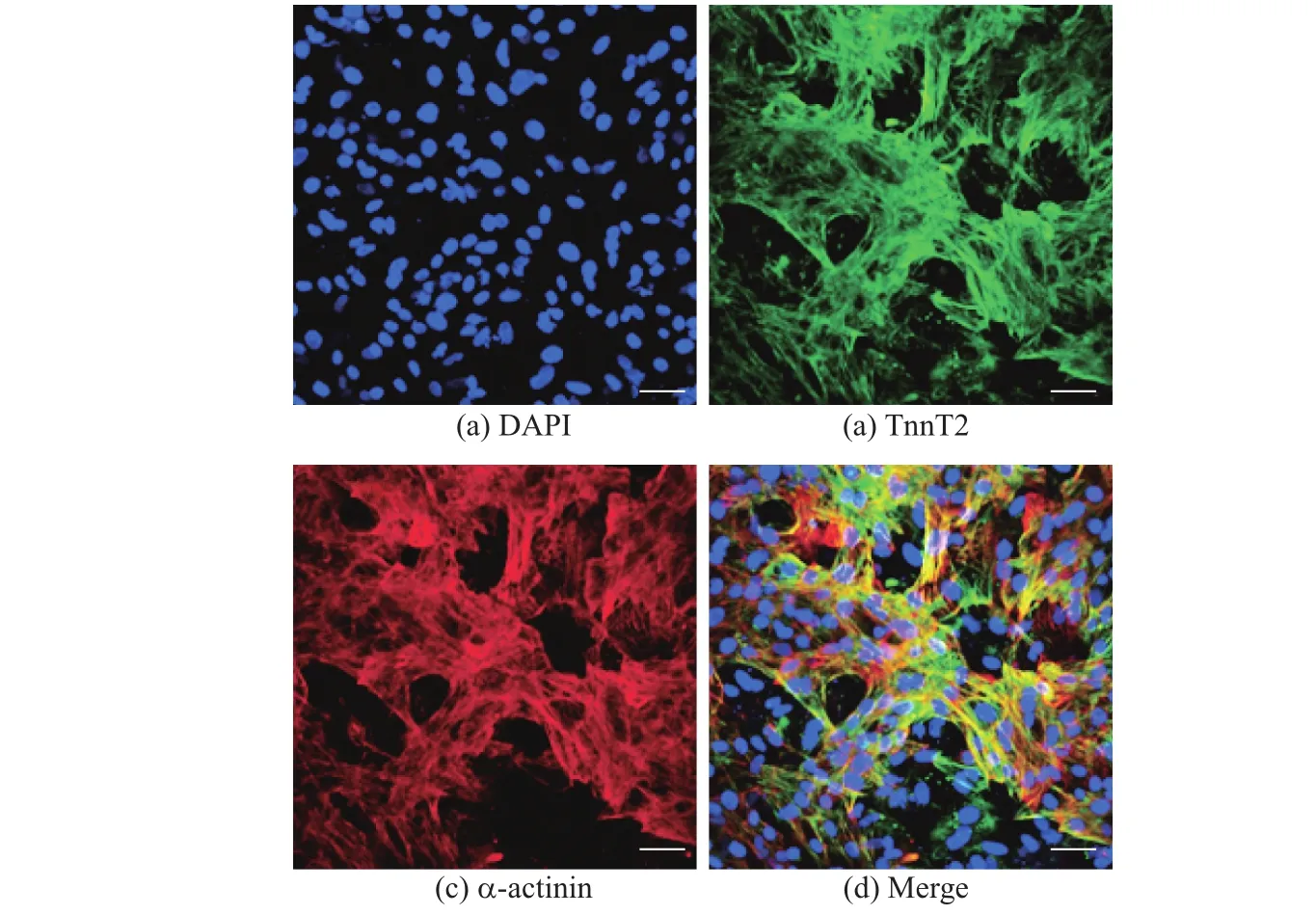
图3 免疫荧光检测心肌特异性结构蛋白TnnT2和α-actininFig.3 Immunofluorescence stainings for TnnT2 and α-actinin
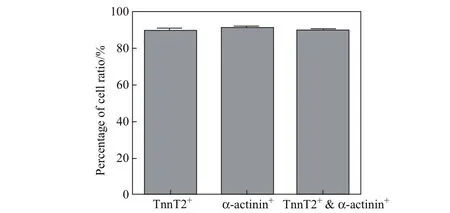
图4 免疫荧光检测人胚胎干细胞分化效率Fig.4 Immunofluorescence stainings for the differentiation efficiency
3 讨论
人胚胎干细胞具有多向分化的能力,在不同的诱导条件下可以分化为神经细胞、成骨细胞、脂肪细胞和心肌细胞等多种细胞,在体外可长时间培养、传代.本工作在既往研究的基础上总结经验,成功建立了一种将人类胚胎干细胞分化为心肌细胞的优化方法,并建立了全面系统的鉴定体系.
通过荧光定量PCR检测人胚胎干细胞在诱导分化后干性基因和心肌分化标志物基因的表达情况.结果表明,Cripto,Dnmt3b,Wnt3,KIF4,Oct4,SOX2,Nanog是未分化人胚胎干细胞中特异表达基因.这些基因经诱导后在人胚胎干细胞的表达逐渐下降,提示人胚胎干细胞不再维持自身的未分化状态,而细胞逐渐分化并失去干性.Nkx2.5在心肌发育过程中发挥关键性作用,是心脏前体细胞特异性表达的重要转录因子,其激活常常意味着心肌细胞分化程序的启动.荧光定量PCR结果显示,人胚胎干细胞经过诱导后,Nkx2.5表达并逐渐升高,说明心肌细胞的分化程序已被启动.cTnT和α-actinin是心肌特异性结构蛋白,同样在诱导后表达逐渐升高,这提示在本工作的诱导分化模型中,人胚胎干细胞已被定向分化为人心肌细胞.通过对干细胞标记物表达和心肌细胞标记物表达两方面的动态检测,对人源性胚胎干细胞分化成心肌细胞进行了验证.
为了进一步证实本工作提出的细胞分化体系可以获得成熟的人心肌细胞,用免疫荧光方法检测了分化完成的细胞.通过分析TnnT2阳性细胞的比例,α-actinin阳性细胞的比例,以及TnnT2和α-actinin双阳性细胞的比例发现,在优化后的胚胎干细胞诱导分化体系中,三者比例分别为90.80%,91.00%,90.91%.通过荧光定量PCR和免疫荧光两种检测方式对人源性胚胎干细胞分化成心肌细胞进行了验证.基于此,本工作建立了对人胚胎干细胞诱导分化的过程中心肌细胞标记物和干细胞标记物两方面验证;并在分化完成后对心肌细胞标记物和干细胞标记物通过荧光定量PCR和免疫荧光两种检测方式验证系统鉴定方案.
人胚胎干细胞可以在不同的诱导条件下分化成各种类型的终末细胞,这种能力为进行靶细胞、靶器官特异性毒性评价提供了条件.完善高纯度、稳定的人胚胎干细胞定向诱导心肌细胞体系是构建药物心脏毒性评价模型等心脏疾病相关基础研究的一个重要思路,也是药物大规模筛选的理想平台,能够实现药物研发及安全性评价的个性化,提高药物治疗、药物研发的针对性,避免动物实验带来的种属差异,减少药物研发费用,缩短研发周期.
本工作初步建立了一个高效、简便的定向诱导人胚胎干细胞分化为心肌细胞的优化模型,同时建立了一种综合全面的鉴定方案,为细胞模型建立提供了系统的评价方法,为体外心脏毒性评价方法的发展提供了方向,为今后将大量纯化人胚胎干细胞来源的心肌细胞用于心脏疾病的科学研究打下了扎实基础.
[1]Sartiani L,Bettiol E,Stillitano F,et al.Developmental changes in cardiomyocytes differentiated from human embryonic stem cells:a molecular and electrophysiological approach[J]. Stem Cells,2007,25(5):1136-1144.
[2]Mummery C,Van Der Heyden M A,De Boer T P,et al.Cardiomyocytes from human and mouse embryonic stem cells[J].Methods in Molecular Medicine,2007,140:249-272.
[3]Mummery C.Cardiomyocytes from human embryonic stem cells:more than heart repair alone[J].BioEssays:News and Reviews in Molecular,Cellular and Developmental Biology, 2007,29(6):572-579.
[4]Wendel J S,Ye L,Tao R,et al.Functional effects of a tissue-engineered cardiac patch from human induced pluripotent stem cell-derived cardiomyocytes in a rat infarct model[J].Stem Cells Translational Medicine,2015,4(11):1324-1332.
[5]Pekkanen-Mattila M,Chapman H,Kerkela E,et al.Human embryonic stem cell-derived cardiomyocytes:demonstration of a portion of cardiac cells with fairly mature electrical phenotype[J].Experimental Biology and Medicine,2010,235(4):522-530.
[6]Zhang J,Wilson G F,Soerens A G,et al.Functional cardiomyocytes derived from human induced pluripotent stem cells[J].Circulation Research,2009,104(4):e30-e41.
[7]Chan H Y,Cheung M C,Gao Y,et al.Expression and reconstitution of the bioluminescent Ca(2+)reporter aequorin in human embryonic stem cells,and exploration of the presence of functional IP3 and ryanodine receptors during the early stages of their differentiation into cardiomyocytes[J].Science China Life Sciences,2016,59(8):811-824.
[8]Binah O,Dolnikov K,Sadan O,et al.Functional and developmental properties of human embryonic stem cells-derived cardiomyocytes[J].Journal of Electrocardiology,2007,40:S192-S196.
[9]Steel D,Hyllner J,Sartipy P.Cardiomyocytes derived from human embryonic stem cellscharacteristics and utility for drug discovery[J].Current Opinion in Drug Discovery&Development,2009,12(1):133-140.
[10]Rathjen P D,Lake J,Whyatt L M,et al.Properties and uses of embryonic stem cells: prospects for application to human biology and gene therapy[J].Reproduction,Fertility,and Development,1998,10(1):31-47.
[11]Adler S,Lindqvist J,Uddenberg K,et al.Testing potential developmental toxicants with a cytotoxicity assay based on human embryonic stem cells[J].Alternatives to Laboratory Animals, 2008,36(2):129-140.
[12]Rovida C,Vivier M,Garthoff B,et al.ESNATS conference—the use of human embryonic stem cells for novel toxicity testing approaches[J].Alternatives to Laboratory Animals,2014, 42(2):97-113.
[13]Genschow E,Spielmann H,Scholz G,et al.The ECVAM international validation study on in vitro embryotoxicity tests:results of the definitive phase and evaluation of predictionmodels.European Centre for the Validation of Alternative Methods[J].Alternatives to Laboratory Animals,2002,30(2):151-176.
[14]Muller M,Fleischmann B K,Selbert S,et al.Selection of ventricular-like cardiomyocytes from ES cells in vitro[J].Faseb Journal,2000,14(15):2540-2548.
[15]Vidarsson H,Hyllner J,Sartipy P.Differentiation of human embryonic stem cells to cardiomyocytes for in vitro and in vivo applications[J].Stem Cell Reviews,2010,6(1):108-120.
[16]Xu C,Police S,Hassanipour M,et al.Efficient generation and cryopreservation of cardiomyocytes derived from human embryonic stem cells[J].Regenerative Medicine,2011, 6(1):53-66.
[17]Arbel G,Caspi O,Huber I,et al.Methods for human embryonic stem cells derived cardiomyocytes cultivation,genetic manipulation,and transplantation[J].Methods in Molecular Biology,2010,660:85-95.
本文彩色版可登陆本刊网站查询:http://www.journal.shu.edu.cn
Human embryonic stem cell-derived cardiomyocytes model establishment and systemic identification scheme
CHEN Xinxin,LIU Zhuyuan,GU Huanyu,ZHOU Lei
(Department of Cardiology,First Affiliated Hospital of Nanjing Medical University, Nanjing 210029,China)
Cardiomyocytes is useful in the study of many cardiovascular diseases,while human cardiomyocytes are difficult to obtain and culture.With multi-directional differentiation properties,human embryonic stem cells can provide cell resources in vitro.This study aims to establish a useful protocol to induce the differentiation of human embryonic stem cells into cardiomyocytes,and observe identification of human cardiomyocytes. Expression of stem cell markers including Cripto,Dnmt3b,Wnt3,KIF4,Oct4,SOX2 and Nanog decrease during differentiation while cardiac progenitor cell marker Nkx2.5 andcardiomyocytes specific markers TnnT2 and α-actinin increase.Ratios of TnnT2 positive cells,α-actinin positive cells,TnnT2 and α-actinin double positive cells are 90.80%,91.00%, and 90.91%.These results indicate that human embryonic stem cells can be efficiently induced into cardiomyocytes in the proposed protocol.In conclusion,differentiation of human embryonic stem cells into cardiomyocytes has been successfully induced and an identification scheme has been established,and markers have been detected through quantitative PCR and immunofluorescence stainings.The protocol will facilitate better understanding of pathogenesis of cardiovascular diseases and enable better cardiotoxicity drug screening. Key words:human embryonic stem cell;cell differentiation;cardiomyocytes
Q 25
A
1007-2861(2017)03-0378-09
10.12066/j.issn.1007-2861.1939
2017-04-03
国家自然科学基金资助项目(81370280,81570332)
周蕾(1970—),女,教授,主任医师,博士生导师,博士,研究方向为心力衰竭. E-mail:zhouleinjmu@163.com
