新生大鼠心脏再生模型的改良及评价模式
2017-07-19朱浩丁胜光黄海涛许嘉鸿仲崇俊
朱浩,丁胜光,黄海涛,许嘉鸿,仲崇俊
(1.南通大学第二附属医院心胸外科,江苏南通 226001; 2.同济大学医学院附属同济医院心内科,上海 200065)
新生大鼠心脏再生模型的改良及评价模式
朱浩1,丁胜光1,黄海涛1,许嘉鸿2,仲崇俊1
(1.南通大学第二附属医院心胸外科,江苏南通 226001; 2.同济大学医学院附属同济医院心内科,上海 200065)
探索改良新生大鼠心脏再生模型并进行初步评价,以优化哺乳动物在体心脏再生模型.取出生12 h左右的大鼠,采用低温麻醉行心尖切除改良术,术后统计1,3,7和21 d存活率,并取材测量切除的心尖横截面积来评估改良术的效果.术后1 d对照组存活率为61%,改良组为77%,并且改良组术后3,7,21 d的存活率都高于对照组.改良组心尖切除的横截面积变异较小,说明新生大鼠心脏再生模型改良术均一稳定,手术成功率高,可用于哺乳动物心脏再生相关基因和信号通路的研究.
心脏再生;细胞增殖;心尖切除
随着人们生活水平的改善,心血管疾病的发病率逐年升高.冠心病患者在发病后心肌受损、坏死,心功能急剧下降,常导致死亡.近二十年来,随着诊疗技术的发展,心血管疾病的病死率已经显著下降[1].然而,由于心脏损伤后心肌细胞不能有效再生,导致心血管疾病进入慢性阶段后的病死率仍居高不下,且目前尚无有效的治疗手段[2].心肌细胞的再生和修复研究还处于初级阶段,越来越多的实验证据表明,虽然成年哺乳动物的心脏在心肌受损后无法完全再生,但是新生的心肌细胞能进行自身分裂和再生,参与心脏自稳态的维护和病变组织的修复[3].因此,激活心脏内源性再生潜能具有重大的研究意义[4-5].
已有研究表明,成年斑马鱼心脏即便切除心室体积的20%,依旧能非瘢痕性完全再生[6].这一修复过程主要是心肌细胞的增殖[7-8].哺乳动物与鱼心脏的基本结构有很大差异,哺乳动物心脏为4个腔室双循环,心脏负荷压力也比双腔单循环的鱼类更大.哺乳动物的心肌细胞在出生后即退出细胞周期变为双核细胞[9-10],而斑马鱼的心肌细胞为单核,终身保持增生活性.有研究表明,成年斑马鱼的心脏更接近于尚未分隔的胚胎期哺乳动物的心脏,胚胎期哺乳动物的心脏在损伤后也能激活增生性反应,这提示哺乳动物早期心脏有再生的能力[3,11-13].为了明确新生鼠心脏在组织学水平对损伤的反应,有学者切除新生1 d小鼠心尖部心肌(约占心室的10%),通过一系列组织学分析方法检测到小鼠心肌损伤后的再生过程,并发现在21 d内被切除的心肌细胞得以完全修复,且心肌细胞的收缩功能恢复正常.心尖切除8周后,通过心脏B超发现小鼠左室射血分数(ejection fractions,EF)正常,与假手术组无差异.新生小鼠心肌细胞具有增殖潜能[14],这已被磷酸化H3组蛋白(phosphohistone H3,pH3)和极光激酶B与心肌肌钙蛋白的共定位证实,说明心肌细胞具有一定的有丝分裂与胞质分裂的能力.当心肌细胞增殖时,肌节会发生标志性的形态学改变,在有丝分裂过程中,肌节结构会发生边集效应向细胞周边分散[14].这种效应在心尖切除术后7 d达到顶峰,并且不仅仅局限在心尖部,在整个心脏都会发生,这表明具有分化和增殖潜能的心肌细胞广泛分布于新生小鼠的心脏.
尽管以上研究已证实了新生小鼠心尖切除可作为一种心脏再生模型,并提供了各类反应心肌细胞再生的研究参数,但还没有建立统一标准,心尖切除未能实现定量均一化.本实验尝试通过对新生大鼠行心尖切除术探索改良心脏再生模型,并试图建立一种初步的评价方式.
1 材料与方法
1.1 实验动物与器械
(1)实验动物:SPF级雄性SD大鼠,3∼4月龄,体质量250∼300 g;SPF级雌性SD大鼠, 3∼4月龄,体质量200∼250 g,由常州卡文斯实验动物有限公司提供;新生大鼠,<12 h.新生大鼠因性别无法区分未设定性别比例.所有操作均依照美国国立卫生院(National Institutes of Health)的相关规定.
(2)实验器械:体视显微镜、光源、微型台式真空泵、加热垫.显微外科手术器械:蚊剪、直镊、弯镊、显微尖镊、显微弯镊.7-0手术缝合线,8-0手术缝合线,真空泵外接移液枪200µL黄色枪头,冰盒,10 mm培养皿,纱布,碘伏棉棒等.
1.2 实验方法
1.2.1 新生大鼠准备
将SPF级雄性与雌性SD大鼠合笼饲养,按1∶1合笼.雌鼠怀孕14 d(E14)后可看到腹部隆起,此时可将雌鼠分出置于单笼中饲养,早晚各一次查看大鼠出生情况并记录出生时间.本实验取出生<12 h的新生大鼠进行造模.
1.2.2 新生大鼠心尖切除改良术
手术过程如图1所示,具体如下.
(1)将新生大鼠用纱布包裹置于冰上3∼5 min进行低温麻醉(见图1(a)),要频繁检测其爪反射,过长时间置于低温中会增加术后死亡率.新生大鼠在低温状态下呼吸心跳可完全停止,因此可在无需通气的情况下完成心尖切除手术,手术过程最好不超过10 min.
(2)将新生大鼠用消毒纱布擦净置于手术区,保持仰卧位,用碘伏棉棒消毒手术区域3遍(见图1(b)).
(3)于新生大鼠两腋水平连线下方约1 cm处做平行于肋间隙的水平切口(见图1(c)).切口的选择至关重要,精准地找到最佳切口有利于顺畅地进入胸腔使心尖完美暴露,并能使肺部损伤最小化.手术过程中切勿用显微尖镊粗暴夹持皮肤,否则会造成复杂性伤口撕裂伤.扩大的切口虽然能有助于进胸,扩大视野,但会使伤口愈合减缓造成母鼠食子,不利于后续实验进行.
(4)在第四或第五肋间用显微弯镊逐层钝性分离肋间肌肉,缓慢进入胸腔(见图1(d)),形成长度约2 cm的开口.当打开胸膜后空气涌入左侧胸腔,左肺被压缩贴近至背侧,此时可见到停搏的心脏.在配有光源的体视显微镜下用显微弯镊钝侧小心打开心包膜,切勿损伤心脏及周围肺组织.此时左手捏起新生大鼠背侧皮肤,右手拇指按压新生大鼠腹部,心脏会突出于胸壁(见图1(e)).

图1 手术过程Fig.1 Surgical procedure
(5)找到左室心尖部,用微型台式真空泵通过细软管外接200µL的黄色枪头(见图1(f)),枪头开口直径调至约3 mm,定量真空泵吸引力,用枪头柔和地将心尖吸牢,直至没有空气抽吸声.操作过程中吸引力不可过大,以免损伤心肌组织.此时,用7-0手术缝合丝线紧贴枪头下缘并环绕切割(见图1(g)),可平整地切除心尖组织.
(6)用8-0手术缝合线逐层关胸(见图1(h)).缝合时进针方向尽量平行贴近胸壁,避免戳破肺组织.手术结不可太紧以免勒断肋骨,导致死亡率增加.
(7)用8-0手术缝合线缝合表皮.缝合后用湿纱布将新生大鼠身上残留的血迹擦干,并用酒精棉棒消毒伤口(见图1(i)),以减少感染几率,避免造成母鼠食子.
(8)将做完手术的新生大鼠轻轻握在手中,并置于暖风机下使其迅速复温,待新生大鼠有自主呼吸后置于加热垫上,温度不可过高,并用母鼠笼中的敷料覆盖,待所有新生大鼠术后恢复后可一起放入母鼠笼中.
1.2.3 心脏的取材及固定
(1)准备心脏停搏液(KCl溶于磷酸盐缓冲液(phosphate buffered saline,PBS),最终浓度为50 mmol/L),体积分数为3.7%的多聚甲醛备用.术前10 min在新生大鼠腹膜下注射50µL的肝素.
(2)通过颈脱位法使新生大鼠安乐死,摆为仰卧体位,用胶布固定四肢及尾巴,用显微剪在整个腹部做横切口,然后由两侧垂直往上延伸直至膈肌显露.
(3)用弯镊提起胸骨暴露膈肌,然后将膈肌小心地从前胸壁上钝性分离下来,可暴露胸腔.
(4)弯镊从心脏下方走行,夹住主动脉等大血管将心脏小心上提,用蚊剪在弯镊下方离断血管,取出心脏置于冷冻的心脏停搏液中.取出心脏时若有黏连,在体视镜下用显微尖镊小心分离组织.当不确定黏连物是否为心脏组织时,保留于心脏上,在固定时其可自行脱落.
(5)在心脏停博液中用弯镊平行于心脏长径轻轻挤压,排出心腔内残余的血.
(6)将取下的心脏置于多聚甲醛中固定,4◦C过夜.第二天吸出多聚甲醛换为PBS后室温振荡5 min,重复此过程3次.
1.3 统计学分析
用SPSS 20.0软件进行统计学分析.计量资料呈正态分布,用±s表示,两组间比较采用独立样本t检验.P<0.05为差异有统计学意义.
2 结果
2.1 手术结果统计
本实验采用低温麻醉,新生大鼠呼吸停止,心脏停博,无麻醉意外发生.总计78只大鼠, sham组6只大鼠全部存活.术后1 d,对照组36只大鼠存活22只,存活率为61%;手术改良组36只大鼠存活28只,存活率为77%,死亡22只的原因可能为母鼠吞食、肺部损伤等.术后1∼21 d存活结果如图2所示.
2.2 对照组与改良组效果比较
取16只体重相近的新生大鼠随机分配成两组,将心尖切除后新生大鼠的心脏取出,用体积分数为3.7%的多聚甲醛固定,将各组8只心脏心尖朝上置于同一视野中拍照(见图3(a)),随后用软件ImageJ将心尖切除后的横截面积圈出(见图3(b)),并求变异系数(coefficient of variance,CV)(见表1).CV可比较均数有差异的两组数据,排除平均水平的影响.
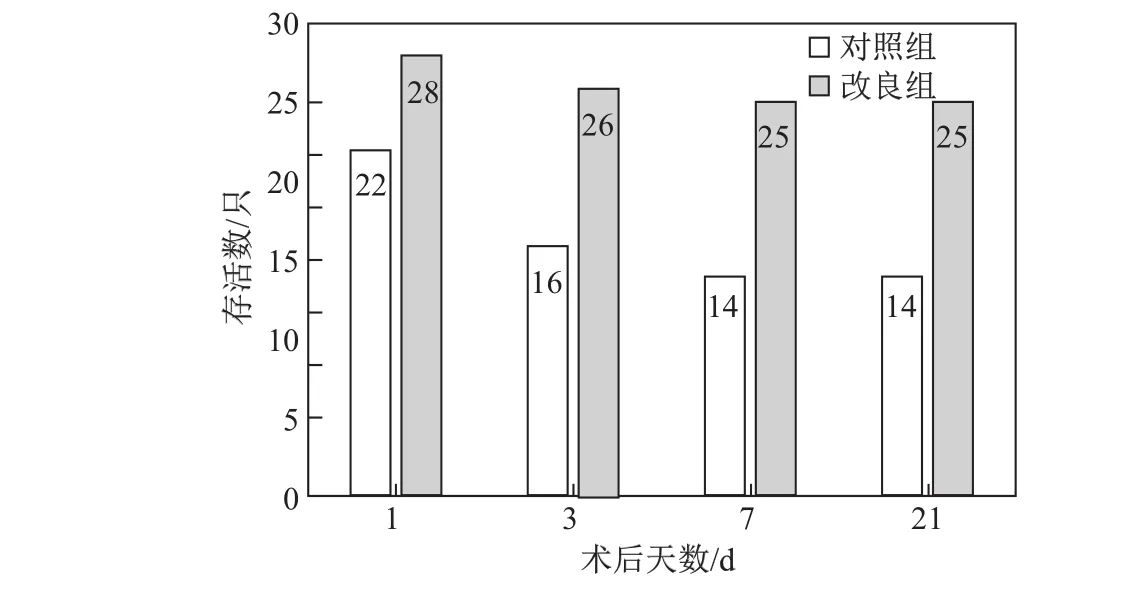
图2 术后1∼21 d存活结果统计Fig.2 Postoperative survival rate at 1—21 d
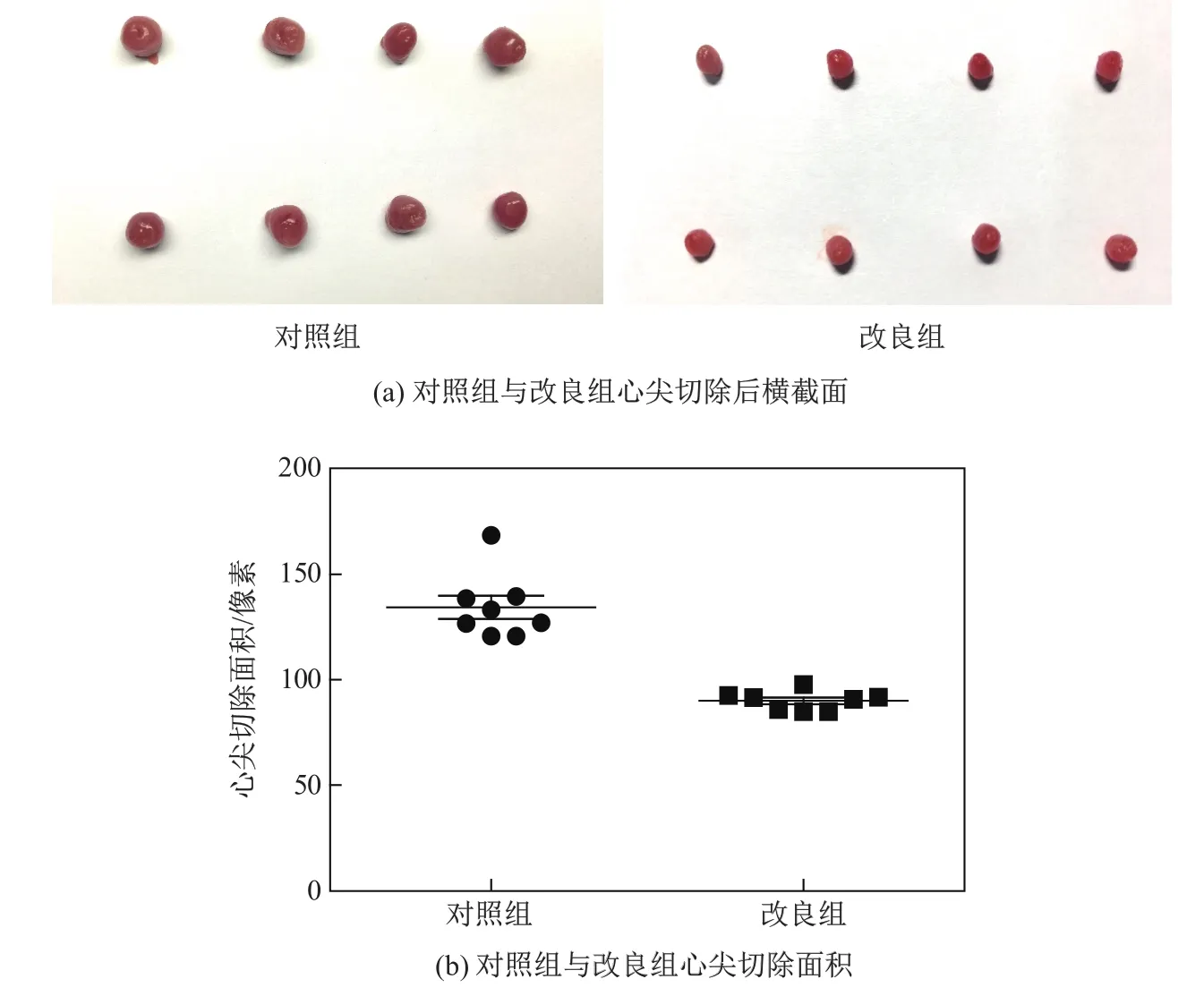
图3 心尖切除结果Fig.3 Results of apex section
3 讨论
心脏再生是全球医学研究的重要课题.最初有学者尝试诱导骨髓干细胞分化研究心脏再生[15-16],也有学者采取新的研究方法来识别心肌祖细胞[17],激活心脏外膜的祖细胞再生[18].另外,有报道称受损的心肌成纤维细胞可以重新分化为心肌细胞[19],或者心肌细胞本身可以增殖[20].但目前已知研究成果还不足以解释再生如何修复坏死区域及恢复心脏功能[21].当已有研究发现斑马鱼心尖被切除后可以再生,人们推测新生鼠心尖切除后也有可能再生[8,22].因此新生鼠心脏再生模型的创建为哺乳动物心脏再生的研究打开了一扇崭新的大门[23].如何保持再生模型的均一稳定性目前颇有争议,尚无统一标准[24].相对于新生小鼠而言,新生大鼠数量充足、存活率高、便于操作,因此本工作探索了新生大鼠心尖切除改良术,并详细阐明了每一步操作方法,以期为其他研究者更好地研究心脏再生原理提供参考.

表1 对照组和改良组变异系数Table 1 CVs of the control and the improved group
新生大鼠心脏再生模型创建面临的首要问题是新生鼠心脏体积小,不易操作.因此手术者对于自身基本技能的训练至关重要.判断技能是否合格的一项重要指标便是手术存活率.在本工作的手术过程中,将新生大鼠用纱布包裹置于冰上3∼5 min,避免与冰直接接触造成组织冻伤,并频繁检测其爪反射,防止过长时间置于低温中增加术后死亡率,且全程最好不超过10 min.切口位置、大小的选择亦至关重要,不当的操作会导致伤口愈合缓慢,使死亡率升高.
已有研究发现,心尖切除大小对新生大鼠心脏的再生影响很大[25].新生大鼠心脏再生模型面临的另一个重要挑战便是如何使手术模型均一稳定化.本工作使用定量微型台式真空泵负压吸力,取用合适口径的枪头(d=3 mm),确保每次吸取的心尖部肌肉占心室体积的10%左右,再用7-0手术缝合线环绕枪头尖端切割,可形成光滑均一的切口,避免因无参照物切割带来的一系列干扰误差.术后统计了存活率,术后1 d对照组存活率为61%,改良组为77%,并且改良组术后,3,7,21 d的存活率都高于对照组.随后,用软件ImageJ求出切除心尖的横截面积,得到两组数据的方差,可发现改良组组内差异较小.本工作改良的模型可用于哺乳动物心脏再生机理及相关药物的开发研究,可结合成年鼠心肌梗死模型、急性缺血再灌注模型阐述细胞增殖分化相关信号通路及细胞周期相关基因对心脏再生的作用,并可在此基础上对药物的治疗效果进行评价.
综上所述,新生大鼠心尖切除能激活心肌细胞增殖,促进心脏结构和功能完整性的恢复.在大鼠出生7 d后,心肌细胞的再生能力明显下降,这与心肌细胞变为双核细胞退出细胞周期的时间相吻合.发育成熟的心脏丧失再生潜能可能与固有细胞周期被阻滞或有丝分裂刺激源丢失有关.目前已有研究表明,心肌细胞的增殖可能在新生大鼠心脏再生过程中扮演重要角色,同时干细胞或祖细胞的作用也不容忽视.本工作尝试了一种全新的新生大鼠心脏再生模型,并提出了一种评估手术均一性的方式,以期为未来更多的心脏再生研究提供一定的帮助与借鉴.
参考文献:
[1]Moran A E,Forouzanfar M H,Roth G,et al.Temporal trends in ischemic heart disease mortality in 21 world regions,1980—2010:the Global Burden of Disease 2010 Study[J].Circulation,2014,129(14):1483-1492.
[2]Nabel E G,Braunwald E.A tale of coronary artery disease and myocardial infarction[J]. New England Journal of Medicine,2012,366(1):54-63.
[3]Bergmann O,Bhardwaj R D,Bernard S,et al.Evidence for cardiomyocyte renewal in humans[J].Science,2009,324(5923):98-102.
[4]Forbes S J,Rosenthal N.Preparing the ground for tissue regeneration:from mechanism to therapy[J].Nature Medicine,2014,20(8):857-869.
[5]Garbern J C,Lee R T.Cardiac stem cell therapy and the promise of heart regeneration[J]. Cell Stem Cell,2013,12(6):689-698.
[6]Poss K D,Wilson L G,Keating M T.Heart regeneration in zebrafish[J].Science,2002, 298(5601):2188-2190.
[7]Jopling C,Sleep E,Raya M,et al.Zebrafish heart regeneration occurs by cardiomyocyte dedifferentiation and proliferation[J].Nature,2010,464(7288):606-609.
[8]Kikuchi K,Holdway J E,Werdich A A,et al.Primary contribution to zebrafish heart regeneration by gata4(+)cardiomyocytes[J].Nature,2010,464(7288):601-605.
[9]Li F,Wang X,Capasso J M,et al.Rapid transition of cardiac myocytes from hyperplasia to hypertrophy during postnatal development[J].Journal of Molecular and Cellular Cardiology, 1996,28(8):1737-1746.
[10]Walsh S,Pont´en A,Fleischmann B K,et al.Cardiomyocyte cell cycle control and growth estimation in vivo—an analysis based on cardiomyocyte nuclei[J].Cardiovascular Research, 2010,86(3):365-373.
[11]Hsieh P C H,Segers V F M,Davis M E,et al.Evidence from a genetic fate-mapping study that stem cells refresh adult mammalian cardiomyocytes after injury[J].Nature Medicine,2007, 13(8):970-974.
[12]Pasumarthi K B,Nakajima H,Nakajima H O,et al.Targeted expression of cyclin D2 results in cardiomyocyte DNA synthesis and infarct regression in transgenic mice[J].Circulation Research,2005,96(1):110-118.
[13]Quaini F,Urbanek K,Beltrami A P,et al.Chimerism of the transplanted heart[J].New England Journal of Medicine,2002,346(1):5-15.
[14]Ahuja P,Sdek P,MacLellan W R.Cardiac myocyte cell cycle control in development,disease, and regeneration[J].Physiological Reviews,2007,87(2):521-544.
[15]Martin-Rendon E,Brunskill S J,Hyde C J,et al.Autologous bone marrow stem cells to treat acute myocardial infarction:a systematic review[J].European Heart Journal,2008, 29(15):1807-1818.
[16]Marb´an E,Malliaras K.Mixed results for bone marrow-derived cell therapy for ischemic heart disease[J].JAMA,2012,308(22):2405-2406.
[17]Yi B A,Wernet O,Chien K R.Pregenerative medicine:developmental paradigms in the biology of cardiovascular regeneration[J].The Journal of Clinical Investigation,2010,120(1): 20-28.
[18]Smart N,Bollini S,Dub´e K N,et al.Myocardial regeneration:expanding the repertoire of thymosin β4 in the ischemic heart[J].Annals of the New York Academy of Sciences,2012, 1269(1):92-101.
[19]Qian L,Huang Y,Spencer C I,et al.In vivo reprogramming of murine cardiac fibroblasts into induced cardiomyocytes[J].Nature,2012,485(7400):593-598.
[20]Senyo S E,Steinhauser M L,Pizzimenti C L,et al.Mammalian heart renewal by pre-existing cardiomyocytes[J].Nature,2013,493(7432):433-436.
[21]Makkar R R,Smith R R,Cheng K E,et al.Intracoronary cardiosphere-derived cells for heart regeneration after myocardial infarction(CADUCEUS):a prospective,randomised phase 1 trial[J].The Lancet,2012,379(9819):895-904.
[22]Porrello E R,Mahmoud A I,Simpson E,et al.Transient regenerative potential of the neonatal mouse heart[J].Science,2011,331(6020):1078-1080.
[23]Haubner B J,Adamowicz-Brice M,Khadayate S,et al.Complete cardiac regeneration in a mouse model of myocardial infarction[J].Aging(Albany NY),2012,4(12):966-977.
[24]Konfino T,Landa N,Ben-Mordechai T,et al.The type of injury dictates the mode of repair in neonatal and adult heart[J].Journal of the American Heart Association,2015,4(1):e001320.
[25]Sen S,Sadek H A.Neonatal heart regeneration:mounting support and need for technical standards[J].Journal of the American Heart Association,2015,4(1):e001727.
本文彩色版可登陆本刊网站查询:http://www.journal.shu.edu.cn
Improvement and preliminary evaluation of neonatal rat cardiac regeneration model
ZHU Hao1,DING Shengguang1,HUANG Haitao1, XU Jiahong2,ZHONG Chongjun1
(1.Department of Thoracic and Cardiovascular Surgery,The Second Affiliated Hospital of Nantong University,Nantong 226001,Jiangsu,China; 2.Department of Cardiology,Tongji Hospital Affiliated to Medical College of Tongji University, Shanghai 200065,China)
An improved neonatal rat cardiac regeneration model was established and a preliminary evaluation was conducted.Neonatal rats of 12 h and exercised apical resection surgery with low-temperature anesthesia were used.Postoperative survival rates were taken on 1,3,7 and 21 d,and the cross-sectional area were measured to evaluate the advantage of the improved technique.In the control group,postoperative survival rate at 1 d was 61%, while the improved group was 77%.In addition,survival rates of the improved group on 3,7 and 21 d were higher than that in the control group.Variation of resected apex crosssectional area was smaller in the improved group.In conclusion,the improved neonatal rat cardiac regeneration model is more stable and more uniform with a higher operation success rate.This model may be used to investigate genes and the signaling pathways mediating mammalian heart regeneration.
heart regeneration;cell proliferation;apical resection
R 541
A
1007-2861(2017)03-0387-08
10.12066/j.issn.1007-2861.1938
2017-04-03
国家自然科学基金资助项目(81670362,81470515);上海市科委医学引导(重点)基金资助项目(134119a3000)
仲崇俊(1962—),男,主任医师,博士,研究方向为心脏再生.E-mail:chongjunzhong@hotmail.com
