NELL1和 FMO3基因mRNA在绵羊肝脏与脂肪组织中的表达
2017-07-18田崇奇周世卫王小芳田春丽代丽霞王小龙杨雨鑫张恩平陈玉林寇启芳
田崇奇,周世卫,王小芳,田春丽,代丽霞,曾 洁,王小龙,杨雨鑫,张恩平,陈玉林,寇启芳
(西北农林科技大学 动物科技学院,陕西杨凌 712100)
NELL1和 FMO3基因mRNA在绵羊肝脏与脂肪组织中的表达
田崇奇,周世卫,王小芳,田春丽,代丽霞,曾 洁,王小龙,杨雨鑫,张恩平,陈玉林,寇启芳
(西北农林科技大学 动物科技学院,陕西杨凌 712100)
旨在探究不同营养水平及不同生长阶段脂尾型绵羊 NELL1和 FMO3基因mRNA的组织特异性表达模式。选择健康、体质量相近的9月龄滩羊、同羊、哈萨克羊和西藏羊(羯羊)各3只,活体采集尾部脂肪样品。选择健康4月龄滩羊112只随机分为4组,公母各半,每组 4 个重复,每个重复7只羊。根据体质量增加目标分为3个阶段:22~28 kg,28~35 kg,35~40 kg,每个阶段各组分别饲喂不同营养水平的日粮。每个生长阶段结束时采集肝脏、肾周脂肪、尾脂、皮下脂肪的组织样品,提取样品总RNA,采用实时荧光定量PCR的方法分析 NELL1和 FMO3mRNA的表达差异。结果表明, FMO3 mRNA在哈萨克羊尾脂中的表达量最高,在同羊、滩羊、西藏羊尾脂中依次下降,且差异显著; NELL1 mRNA在西藏羊尾脂中的表达量最高,在滩羊、同羊、哈萨克羊中的表达量依次下降;营养水平和月龄对尾脂和肝脏中 NELL1和 FMO3mRNA的表达水平有显著影响,而对皮下脂肪和肾周脂肪中 NELL1和 FMO3mRNA的表达影响不显著。表明 FMO3 mRNA的表达水平与脂肪沉积呈正相关,而 NELL1 mRNA的表达水平与脂肪沉积呈负相关; NELL1与 FMO3对绵羊尾脂和肝脏中的脂肪沉积起调控作用,为进一步揭示脂尾型绵羊体内脂肪沉积的调控机制提供理论基础。
绵羊; NELL1; FMO3;基因表达;营养水平 ;生长阶段
家畜的生长和发育是肉类生产的基础,而胴体脂肪的分布和含量是决定肉品质的重要因素。脂尾型绵羊约占世界绵羊品种的25%[1],脂尾型绵羊将大量脂肪储存于尾部,在一定程度上影响体内其他部位脂肪的沉积,进而影响其肉品质。因此,揭示功能基因、日粮及生长阶段对不同脂尾型绵羊脂肪沉积的影响,对改良脂尾型绵羊肉品质具有重要意义。在转录组测序研究中发现,不同脂尾型绵羊尾脂中表达显著上调和下调的基因分别是 NELL1与 FMO3 基因[2],而这 2 个基因与脂肪代谢相关,说明 NELL1与 FMO3基因可调控绵羊尾部脂肪沉积。 NELL1基因最早从人类胎儿脑cDNA文库中分离出来,其重要的功能是在骨组织发育过程中促进成骨分化和骨再生[3]。近年来研究表明[4-7], NELL1能够促进成骨组织生长,而成骨与成脂是两个相反的过程,所以 NELL1可能抑制脂肪的生成。万林子等[8]研究发现, NELL1对脂肪干细胞成骨有一定的促进作用。SONIC Hedgehog信号通路与 NELL1基因对人类脂肪间充质干细胞成骨和成脂分化的加性效应研究发现, NELL1基因和SONIC Hedgehog信号通路能够促进人体干细胞向成骨分化而抑制其向成脂分化,并且 NELL1能够加强SONIC Hedgehog通路的作用[9]。 FMO3(黄素单氧化酶3)是一种重要的肝微粒体酶,是FMOs家族中的重要成员。该基因的主要功能是参与体内大量药物、外源性物质及其他一些化学物质的氧化代谢[10-11]。对 FMO3基因的突变、 FMO3基因与家禽肉品质相关性研究[12]发现, FMO3基因可以改善禽蛋、肉类品质[10-11,13],并在药物代谢和毒性中发挥作用[14]。 FMO3基因在不同脂尾绵羊品种中表达差异最显著[2],但 FMO3基因在脂肪沉积方面的研究较少,因此有必要进一步研究其在脂尾型绵羊脂肪沉积过程中的作用。
本试验旨在研究 NELL1与 FMO3基因在不同品种绵羊的尾脂与滩羊不同营养水平和不同阶段肝脏、尾脂、皮下脂肪及肾周脂肪的表达差异,为进一步研究 NELL1和 FMO3基因的功能与脂肪沉积机制提供理论依据。
1 材料与方法
1.1 不同品种绵羊尾脂样品采集
不同品种绵羊尾脂样品分别来源于宁夏农垦滩羊繁育中心(滩羊、哈萨克羊和西藏羊)、陕西省白水县同羊原种场(同羊),供试羊群均为舍饲饲养,采样时间均在10月。采样时,随机选择健康、体质量相近的9月龄滩羊、同羊、哈萨克羊和西藏羊(羯羊)各3只,用手术法活体采取绵羊个体尾部脂肪组织约3 cm3,样品在DEPC水中剪碎,立即转入RNAlater中,带回实验室于-80 ℃保存,备用。
1.2 试验动物与日粮
1.2.1 试验滩羊 选择健康、体质量相近的4月龄滩羊112只,公母各半,随机分配到4个处理组,每个处理组4个重复(公母各半),每个重复7只羊。试验羊初始体质量差异不显著。
1.2.2 试验日粮 根据体质量增加目标分为3个阶段:22~28 kg、28~35 kg、35~40 kg。每阶段日粮营养水平参考肉羊饲养标准(NY/T816-2004),按体质量22 kg、日增质量200 g育肥羔羊营养需要为标准(DE:12.30 MJ/kg,CP:15.37%),设置0.84×标准、0.96×标准、1.08×标准和1.20×标准 4 个营养水平,分别记为T1组、T2组、T3组和T4组,保持能量∶蛋白质为0.8,其他营养水平保持一致,第1阶段T1、T2、T3、T4组能量水平分别为7.92、9.05、10.19和11.32 MJ/kg,蛋白水平分别为9.90%、11.32%、12.73%、14.15%。第2阶段T1、T2、T3、T4组能量水平分别为7.20、 8.15、8.96和10.65 MJ/kg,蛋白水平分别为9.00%、10.18%、11.20%和13.61%。第3阶段T1、T2、T3、T4组能量水平分别为7.08、7.51、9.53和10.21 MJ/kg,蛋白水平分别为8.85%、9.39%、11.91%和12.75%。
1.2.3 试验滩羊样品采集 在每个体质量增加阶段的最后 1 d,每组从每个重复选取1只与该重复平均体质量最接近的试验羊,共16只进行屠宰。宰前16 h断料、2 h断水。颈动脉放血至死,采集肝脏、肾周脂肪、尾脂、皮下脂肪组织,用PBS缓冲液冲洗干净,滤纸吸干,迅速用锡箔纸包好并标记清楚,置液氮速冻,-80 ℃冷冻保存,备用。
1.3 试验试剂
超纯RNA提取试剂盒Ultrapure RNA Kit、2×TaqPCR Master Mix购自康为世纪公司,反转录试剂盒PrimeScriptTMRT Master Mix、荧光染料SYBR○RPremix ExTaqTMⅡ、pMD19-T Vector(simple)购自大连宝生物公司。
1.4 试验方法
1.4.1 总RNA提取、鉴定及cDNA合成 采用超纯RNA提取试剂盒Ultrapure RNA Kit,按照试剂盒所提供的方法提取所有样品组织总RNA。用核酸质量浓度测定仪测定RNA质量浓度及纯度,用10 g/L的琼脂糖凝胶电泳检测总RNA质量,-80 ℃保存,备用。
1.4.2 cDNA的合成 取500 ng经检测质量良好的各组织总RNA,按照试剂盒所提供的方法进行反转录反应,产物于-20 ℃保存,备用。
1.4.3 引物设计与合成 根据GenBank提供的绵羊(Ovisaries) FMO3基因(登陆号:NM_174057)、 NELL1基因(登陆号:NM_031069)序列,使用Primer Premier 5软件分别设计特异性引物,引物信息见表1。
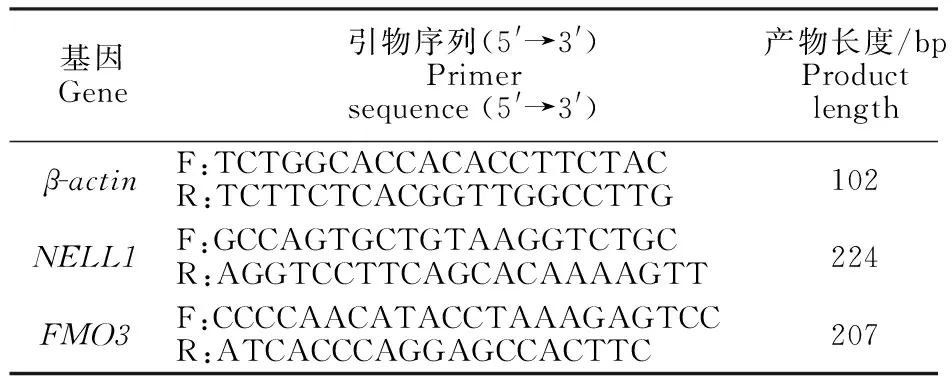
表1 引物序列Table 1 Primer sequences
1.4.4 荧光定量PCR反应 以绵羊β-actin基因为内参基因,采用荧光染料SYBR○RPremix ExTaqTMⅡ测定各组织样品中 NELL1基因和 FMO3基因mRNA的相对表达量,每个样品3个重复。PCR反应体系为25 μL:2×SYBR○RPremix ExTaqⅡ(内含TaKaRa ExTaqHS、dNTP Mixture、Mg2+、TliRNaseH、SYBR○RGreen Ⅰ)12.5 μL,上下游引物(10 μmol/L)各1 μL,cDNA模板2 μL,双蒸水8.5 μL。实时荧光定量PCR反应采用3 步法,反应条件:95 ℃预变性1 min;95 ℃变性15 s,60 ℃退火30 s、72 ℃延伸45 s,循环数45;每个循环结束后采集荧光。全部反应结束后进行熔解曲线分析,根据溶解曲线判断PCR反应的特异性。反应条件:55~95 ℃,每30 s升温0.5 ℃,循环数81。
1.4.5 数据统计分析 所有样品采用内参基因β-actin进行标准化校正处理,采用2-△△Ct法计算 NELL1和 FMO3的相对表达量。数据以“平均值±标准误”表示,n=3,试验数据用Excel 2013初步整理和计算后,用SPSS 22.0统计软件进行单因子方差分析(one-way ANOVA),以Duncan’s进行多重比较。
2 结果与分析
2.1 不同尾型绵羊尾脂中 NELL1mRNA和 FMO3mRNA的表达差异
由图1可知, NELL1基因在西藏羊尾脂中的表达量最高(P<0.05);在滩羊和同羊中的表达量依次下降(P<0.05);而在哈萨克羊中的表达量最低(P<0.05)。图2显示 FMO3 mRNA在哈萨克羊尾脂中的表达量最高(P<0.05);在同羊、滩羊和西藏羊尾脂中的表达量较低。
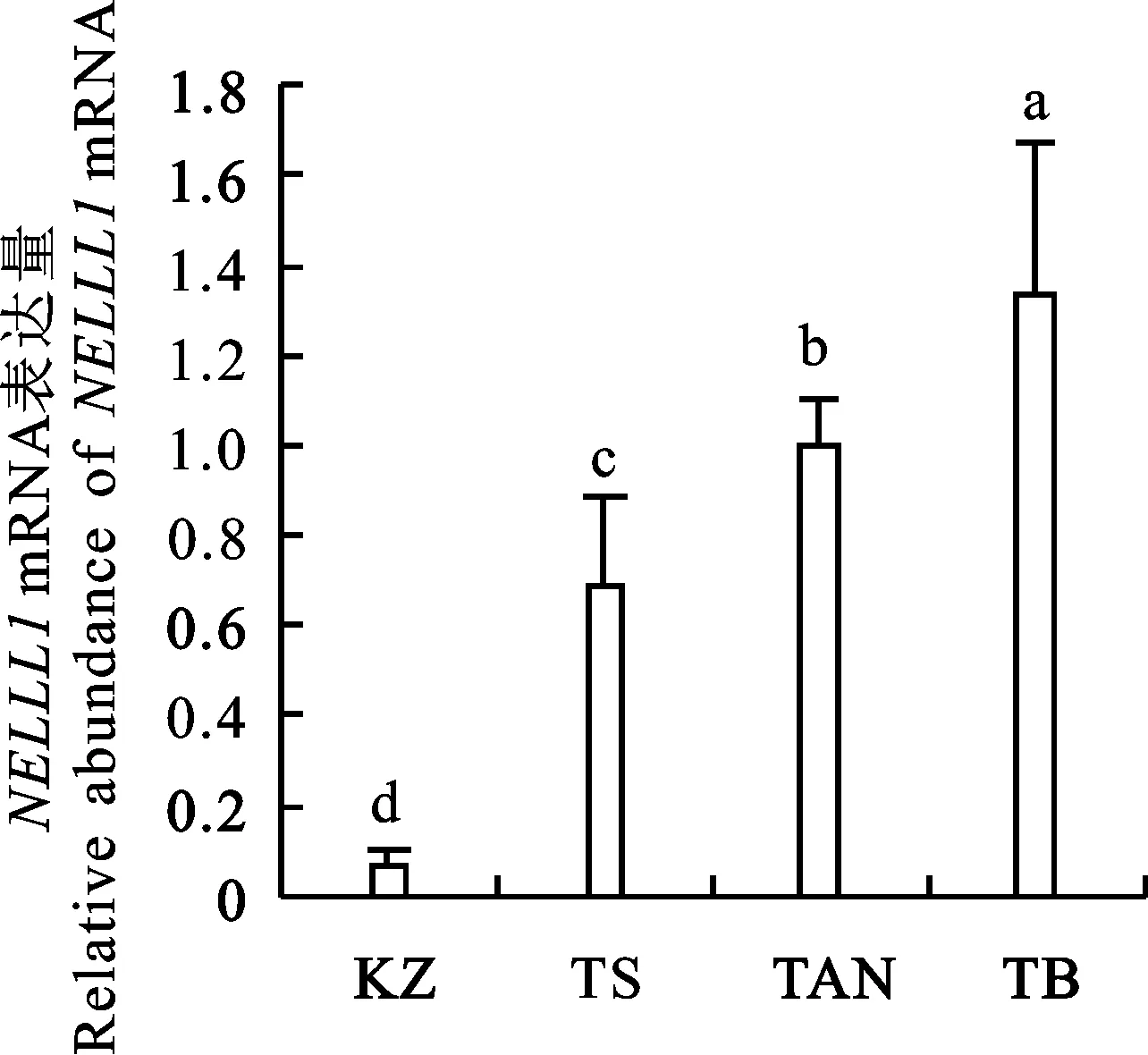
KZ.哈萨克羊(肥臀型) Kazakh sheep(Hip fat-tail);TS.同羊(短脂尾) Tong sheep(short fat-tail);TAN.滩羊(短脂尾) Tan sheep(short fat-tail);TB.西藏羊(短瘦尾) Tibetan sheep(short thin-tail).图上标注不同字母表示差异显著(P<0.05) Without the same letters indicate significant difference between different tissues atP<0.05. 下同 The same as below
图1 NELL1mRNA在4个品种绵羊尾部脂肪组织中的表达量
Fig.1 NELL1 mRNA expression in tail fat of four sheep breeds

图2 FMO3mRNA在4个品种绵羊尾部脂肪组织中的表达量Fig.2 FMO3mRNA expression in tail fat of four sheep breeds
2.2 NELL1和 FMO3的转录表达规律
2.2.1 NELL1 mRNA的表达规律 由图3可知, NELL1mRNA在滩羊尾部脂肪、皮下脂肪、肾周脂肪和肝脏的表达发育模式不同。
在第1阶段(22~28 kg), NELL1 mRNA在尾脂中的表达量以T4组为最高(P<0.05),T1、T2、T3组间差异不显著;在皮下脂肪、肾周脂肪和肝脏中,T1、T2、T3、T4组间差异不显著(P>0.05)。在空间上, NELL1基因的表达量均为肝>皮下脂肪>尾脂(肾周脂)。
在第2阶段(28~35 kg), NELL1 mRNA在尾脂中的表达量以T4组为最高(P<0.05),T1、T2、T3组间差异不显著;在肝脏中的表达量以T4组为最高(P<0.05),依次为T3、T1、T2组;而在肾周脂肪和皮下脂肪中营养水平对其表达量影响不显著(P>0.05)。在空间上, NELL1mRNA的表达量均为肝>肾周脂肪>尾脂(皮下脂肪)。
在第3阶段(35~40 kg), NELL1 mRNA在尾脂中的表达量以T4组为最高(P<0.05),依次为T2、T3、T1组;在皮下脂肪中的表达量以T4组为最高(P<0.05),依次为T2、T3、T1组;在肝脏中的表达量以T1组为最高(P<0.05),依次为T2、T3、T4组;在肾周脂肪中各组的表达量无显著差异(P>0.05)。在空间上, NELL1 mRNA的表达量在肝脏中最高。
以T2组(因为T2组最接近标准)为例来讨论同等营养水平下, NELL1mRNA阶段性表达的差异。在尾脂中, NELL1 mRNA的表达量在第2阶段最低(P<0.05),3个阶段呈先降低再升高趋势,随着生长阶段的不同也会有变化;在皮下脂肪中, NELL1mRNA在第1阶段的表达量最高(P<0.05),第2阶段和第3阶段依次降低; NELL1 mRNA在肝脏和肾周脂肪组织中的表达量均在第3阶段最高(P<0.05),第2阶段和第1阶段依次降低。在肝脏中随着营养水平的升高, NELL1mRNA表达量升高的幅度会降低,而在肾周脂肪中平稳增加,说明在肝脏中 NELL1mRNA的表达量是由月龄和营养水平共同决定的。
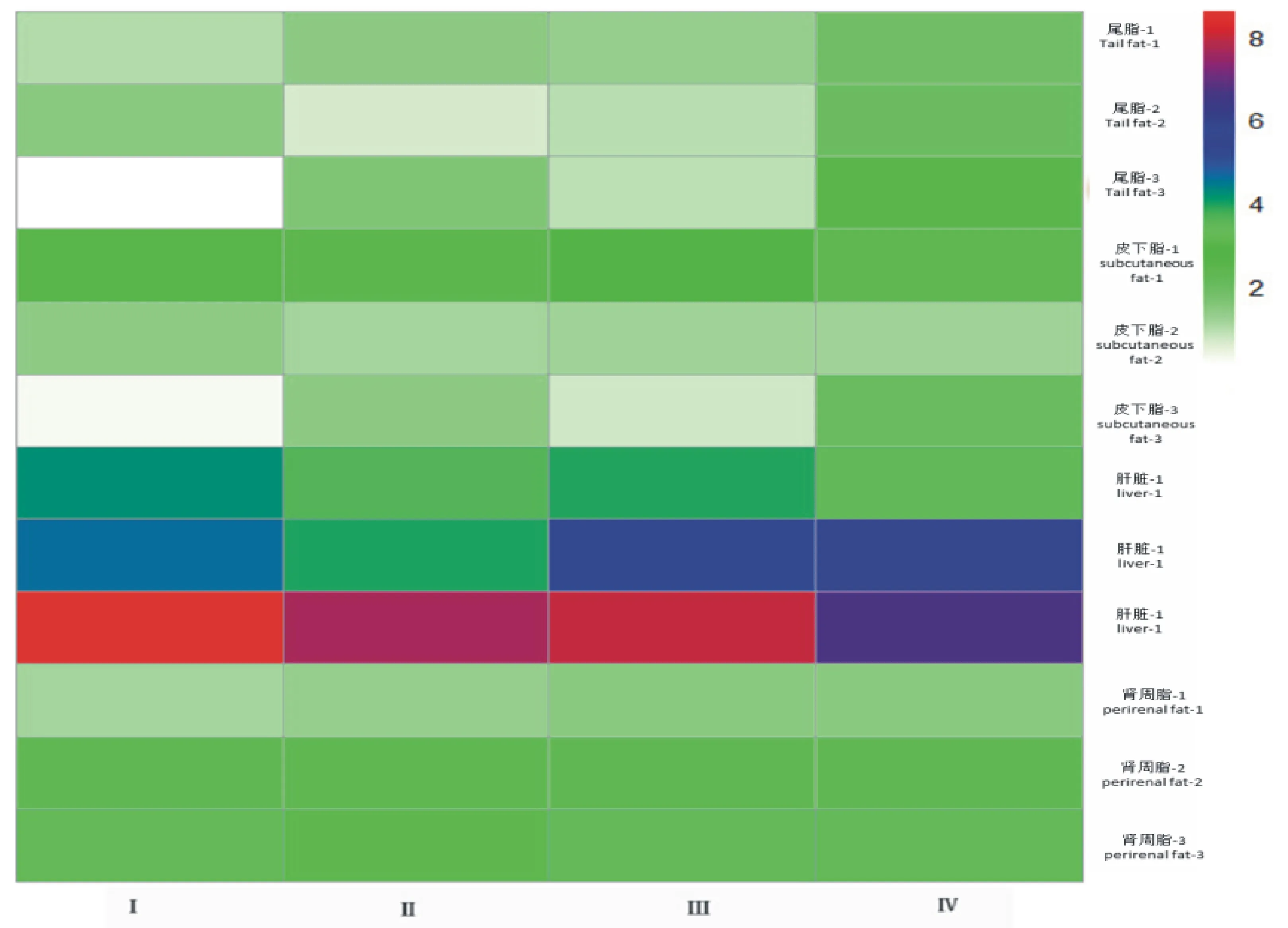
颜色由蓝到红深浅表示表达量由低到高 The color from blue to red means expression quantity from low to high;尾脂-1表示第一阶段尾脂的表达量,依次类推 Fat Tail-1 said the first phase expression quantity of fat tail,and so forth;Ⅰ~Ⅳ.由低到高4个营养水平 Four nutrient levels from low to high.下图同 The same as next figure
图3 NELL1 mRNA在滩羊组织中的表达量
Fig.3 NELL1mRNA expression in tissues of Tan sheep
2.2.2 FMO3mRNA的表达规律 由图 4可知, FMO3mRNA在滩羊尾部脂肪、皮下脂肪、肾周脂肪和肝脏的表达发育模式不同。在相同生长阶段,尾部脂肪组织 FMO3 mRNA的最高表达量均在T2组,皮下脂肪在T3组,肾周脂肪最高表达量在T1组,肝脏的最高表达量在T4组,最高表达组与相同阶段时的最低表达组相比差异显著(P<0.05)。在空间上, FMO3 mRNA在肝脏组织的表达量最高,在尾脂、皮下脂和肾周脂中的表达量并无太大差异。
在同等营养水平下,尾部脂肪组织中 FMO3 mRNA在第2阶段的表达量最低,与最高表达阶段(第3阶段)差异显著(P<0.05);皮下脂和肝脏中 FMO3mRNA在第3阶段的表达量最低(P<0.05);在肾周脂肪组织中,第1阶段的表达量最高(P<0.05)。总而言之,在同等营养水平下 FMO3mRNA的表达量在尾部脂肪是第3阶段>第1阶段>第2阶段,而在皮下脂肪、肝脏和肾周脂肪中都是第1阶段>第2阶段>第3阶段。
3 讨 论
本试验结果表明, NELL1基因在西藏羊尾脂中的表达量最高;在同羊、滩羊、哈萨克羊尾脂中的表达量依次下降;表明其在短瘦尾、短脂尾、肥臀型的表达量依次降低;哈萨克羊属肥臀型羊,尾部脂肪沉积最多, NELL1的表达量最低,而短脂尾、短瘦尾型羊尾部脂肪沉积依次减少, NELL1的表达量依次增加,结果提示 NELL1基因的表达量与脂肪的沉积呈负相关。James 等[15]通过携带 NELL1基因的腺病毒表达载体转染脂肪细胞抑制脂肪的生成,并且初步验证通过影响PPARγ、LPL、AP2相关基因来影响脂肪合成,本研究与其研究结果一致。Shen等[16]研究发现, NELL1提高BMP2诱导成骨,抑制BMP2诱导成脂作用,并且 NELL1这一作用需要通过Wnt信号途径来实现,也与本试验研究结果相一致。
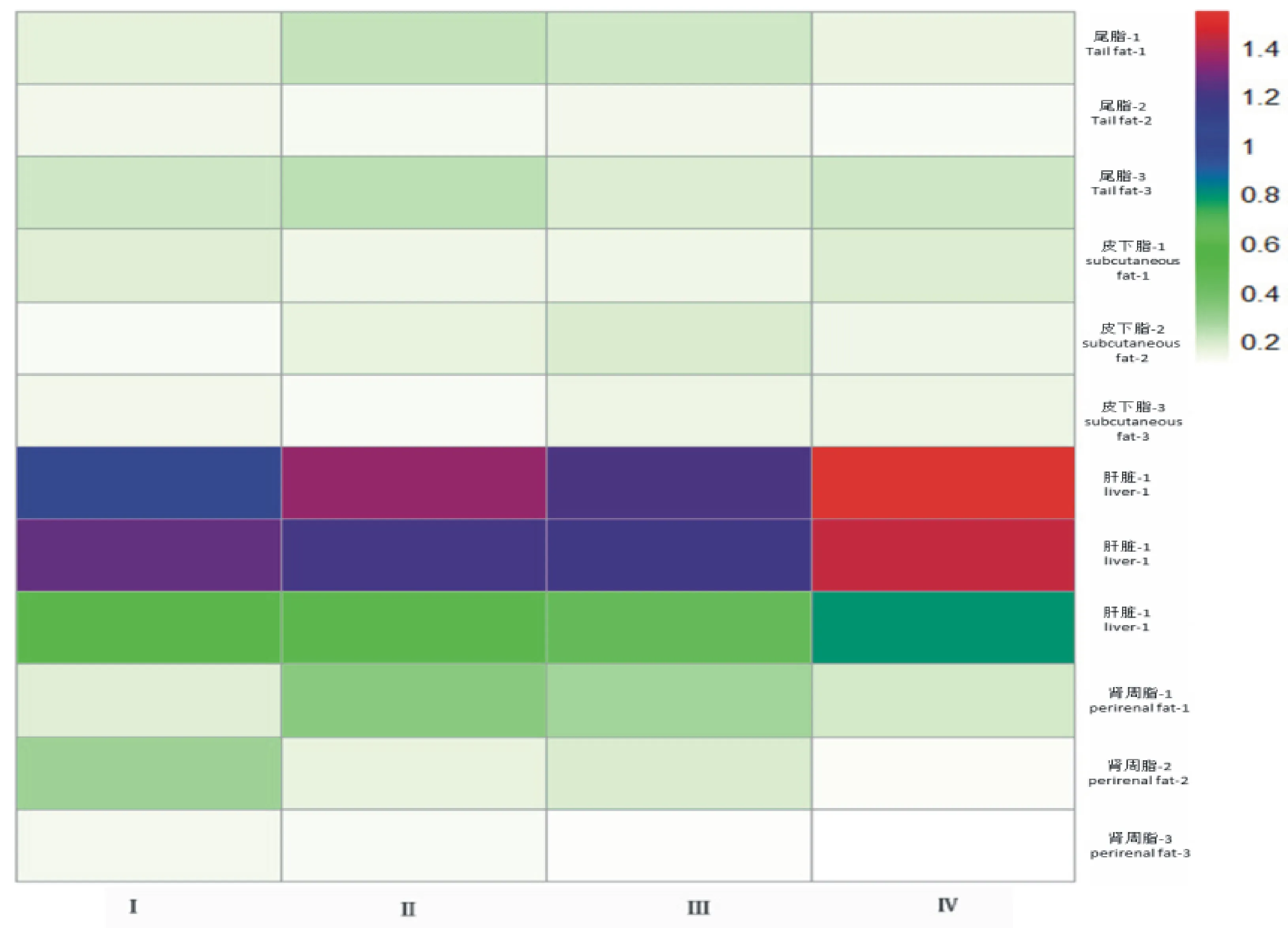
图4 FMO3 mRNA在滩羊组织中的表达量Fig.4 FMO3 mRNA expression in different tissues of Tan-sheep
尾部脂肪中 NELL1mRNA的表达量在 3 个生长阶段中都是T4组最高。说明 NELL1基因的表达会随着营养水平的提高而增加。一方面,本试验第1阶段与第2阶段滩羊分别处于4~5、6~7月龄,4月龄后由于受到断奶应激的影响,滩羊采食量较少,体质量增长也相对较慢,至6月龄时,滩羊处于育成前期,准备进入性成熟阶段(7~8月龄)[17],脂肪沉积缓慢。另一方面,众所周知,高营养水平有助于脂肪的沉积,苗海明[18]在不同营养水平对蒙古绵羊肌内脂肪沉积相关基因mRNA表达量的影响中发现,营养限制组粗脂肪、肌内脂肪沉积会下降,因此 NELL1基因的mRNA表达量在此阶段随营养水平升高而升高,可能是机体为抵抗脂肪沉积而产生的自平衡机制;而在第1阶段与第2阶段时,肾周脂肪与皮下脂肪中 NELL1基因的表达量在各营养水平差异并不显著,这可能由滩羊本身品种特性决定,脂尾型绵羊(滩羊)脂肪沉积以尾部为主,而尾部脂肪的沉积在一定程度上影响全身脂肪的分布。这与Kashan等[19]的研究结果相一致,脂尾型的Chaal和Zandi品种小鼠与杂交小尾品种Zel相比,由于脂肪大量沉积于尾部,皮下脂肪相对较少。对滩羊生长发育规律的研究发现[17,20],9月龄时,滩羊进入育成后期(本试验的第3个阶段),体质量快速增加,脂肪沉积速度加快,而在此阶段,在尾脂和皮下脂肪中都是T4组表达最高,而实际结果是不同营养水平下,滩羊尾部从表型上看并无太大差异,其原因可能是机体为抵抗脂肪沉积而产生的平衡机制。在肝脏中,T1组的表达量最高(P<0.05),而T1组是营养水平最低组,结合3个阶段 NELL1在空间表达情况来看,都是肝脏中最高;众所周知,肝脏是脂肪合成的主要器官,低营养水平时,肝组织中以高表达 NELL1来抑制脂肪的合成,相反在高营养水平时,则表达较低。
在相同营养水平下,不同阶段滩羊各组中的 NELL1基因mRNA也出现差异性表达。尾脂中 NELL1的表达量在低能量组时,第1阶段表达量最高;而随着能量水平的逐渐增加,表达量最高的阶段依次出现在第2阶段和第1阶段。第3阶段是脂肪沉积阶段,表达量应该会低,但由于能量不足,机体可能会表达较高的 NELL1来抑制脂肪形成,来满足机体自身生长的能量需求。而肝脏及肾周脂表达最高出现在第3阶段,第3阶段滩羊正处在脂肪沉积的高峰,需要较高水平的NELL来调节沉积方式。
本研究结果表明,西藏羊尾脂中 FMO3基因的表达水平只有哈萨克羊的1/5左右。 FMO3基因与 NELL1基因相反,其表达水平在尾型大的品种中的表达量高。阿勒泰羊在体成熟后,其尾部脂肪的生成主要表现在脂肪细胞体积的增大[21]。由此猜想, FMO3在脂尾型绵羊中的表达量高,此基因可能是影响脂肪沉积的功能基因,推测其对绵羊尾部脂肪的沉积具有一定的促进作用。 FMO3基因在各组织中的表达模式不同,营养水平对其影响存在一定的规律性,例如,相同阶段下,尾脂、皮下脂肪、肾周脂肪、肝脏中其表达量最高依次出现在T2、T3、T1、T4组。
4 结 论
绵羊 NELL1和 FMO3基因的表达与绵羊脂肪沉积具有相关性。不同尾型绵羊尾的大小与脂肪沉积多少直接相关,而尾部脂肪的沉积与 NELL1和 FMO3基因的表达有相关性,并且 NELL1基因的表达与脂肪沉积呈负相关, FMO3基因的表达与脂肪的沉积呈正相关。而且 NELL1和 FMO3基因的表达也受营养水平和所处生长阶段影响,具有不同的发育性表达规律。
Reference:
[1] DAVIDSON A.The Oxford Companion to Food[M].Oxford:Oxford University Press,2014.
[2] WANG X L,ZHOU G X,XU X CH,etal.Transcriptome profile analysis of adipose tissues from fat and short-tailed sheep[J].Gene,2014,549(2):252-257.
[3] 刘亚京,陈彩云,刘洪臣.骨生长因子 NELL1的研究进展[J].口腔颌面修复学杂志,2012,13(1):52-56.
LIU Y J,CHEN C Y,LIU H CH.Advances in NELL1[J].ChineseJournalofProsthodonticsJanuary,2012,13(1):52-56 (in Chinese).
[4] PEI L,TONTONOZ P.Fat’s loss is bone’s gain [J].JournalofClinicalInvestigation,2004,113(6):805-806.
[5] OTERO M,LAGO R,LAGO F,etal.Leptin,from fat to inflammation:old questions and new insights[J].FEBSLetters,2005,579(2):295-301.
[6] GIMBLE J M,ZVONIC S,FLOYD Z E,etal.Playing with bone and fat[J].JournalofCellularBiochemistry,2006,98(2):251-266.
[7] LIU Y,CHEN C Y,HE H X,etal.Lentiviral-mediated gene transfer into human adipose-derived stem cells:role of NELL1 versus BMP2 in osteogenesis and abiogenesis in vitro[J].ActaBiochimicaetBiophysicaSinica,2012,44(10):856-865.
[8] 万林子,金 晗,吴熙凤,等.脂质体介导 NELL1基因对脂肪干细胞影响的体外研究[J].现代口腔医学杂志,2015,29(3):161-165.
WAN L Z,JIN H,WU X F,etal.The effect of NELL1 gene mediated by liposome on the poliferatiaon and differentiation of adipose-derived stem[J].JournalofModernStomatology,2015,29(3):161-165 (in Chinese with English abstract).
[9] JAMES A W,PANG S,ASKARINAM A,etal.Additive effects of sonic hedgehog and Nell-1 signaling in osteogenicversus adipogenicdifferentiation of human adipose-derived stromal cells[J].StemCellsandDevelopment,2012,21(12):2170-2178.
[10] 周志刚.三甲胺及黄素单氧化酶的研究进展[J].家禽科学,2014(5):49-54.
ZHOU ZH G.Advances in TMA and FMO[J].PoultryScience,2014(5):49-54(in Chinese).
[11] 王 晶. FMO3基因型和胆碱对鸡蛋三甲胺含量影响的研究[D].哈尔滨:东北农业大学,2011.
WANG J.Effects of FMO3 genotype and dietary choline supplementation on trimethylamine concentration in egg yolks.[D].Harbin:Northeast Agricultural University,2011 (in Chinese with English abstract).
[12] SHIMIZU M,YANO H,NAGASHIMA S,etal.Effect of genetic variants of the human flavin-containing monooxygenase 3 on N- and S-oxygenation activities[J].DrugMetabolismandDisposition,2007,35(3):328-330.
[13] MASSEY V.Activation of molecular oxygen by flavins and flavoproteins [J].TheJournalofBiologicalChemistry,1994,269(36):22459-22462.
[14] 巩 政,王 旗.黄素单加氧酶3的基因多态性及其在药物代谢和毒性中的作用[J].中国中药杂志,2015,40(14):2701-2705.
GONG ZH,WANG Q.Genetic polymorphism of FMO3 and its role in drug metabolism and toxicity [J].ChinaJournalofChineseMateriaMedical,2015,40(14):2701-2705 (in Chinese with English abstract).
[15] JAMES A W,PAN A,CHIANG M,etal.A new function of Nell-1 protein in repressing adipogenic differentiation [J].BiochemicalandBiophysicalResearchCommunications,2011,411(1):126-131.
[16] SHEN J,JAMES A W,ZHANG X,etal.Novel wntregulator NEL-like molecule-1antagonizes adipogenesisand augments osteogenesisinduced by bone morphogenetic protein 2[J].AmericanJournalofPathology,2016,186(2):419-434.
[17] 赵金宇.宁夏滩羊早期生长发育规律和生产性能研究[D].陕西杨凌:西北农林科技大学,2013.
ZHAO J Y.Study on the growth-development and productivity of tan sheep in Ningxia[D].Yangling Shaanxi:Northwest A&F University,2013(in Chinese with English abstract).
[18] 苗海明.不同营养水平对蒙古绵羊肌内脂肪沉积相关基因mRNA表达量的影响[D].呼和浩特:内蒙古农业大学,2013.
MIAO H M.Effect of different nutrient levels on the IMF related gene mRNA expression in Mongolia sheep [D].Huhhot:Inner Mongolia Agricultural University,2013(in Chinese with English abstract).
[19] KASHAN N E J,AZAR G H M,AFZALZADEH A,etal.Growth performance and carcass quality of fattening lambs from fat-tailed and tailed sheep breeds[J].SmallRuminantResearch,2005,60(3):267-271.
[20] 侯鹏霞,吉 帅,周玉香,等.舍饲滩羊产肉力变化规律的研究[J].黑龙江畜牧兽医,2013(1):68-70.
HOU P X,JI SH,ZHOU Y X,etal.Study on feeding meat sheep the change law[J].HeilongjiangAnimalScienceandVeterinaryMedicine,2013(1):68-70(in Chinese with English abstract).
[21] 韦 璇.LPL、C/EBPα基因在不同尾型绵羊尾部脂肪组织中的表达分析[D].陕西杨凌:西北农林科技大学,2014.
WEI X.The analysis ofLPL,C/EBPαgenes’ expression in tail adipose tissues of sheep with different types of tail[D].Yangling Shaanxi:Northwest A&F University,2014(in Chinese with English abstract).
(责任编辑:顾玉兰 Responsible editor:GU Yulan)
mRNA Expression of NELL1 and FMO3 in Liver and Adipose Tissue of Sheep
TIAN Chongqi,ZHOU Shiwei,WANG Xiaofang,TIAN Chunli,DAI Lixia,ZENG Jie,WANG Xiaolong,YANG Yuxin,ZHANG Enping ,CHEN Yulin and KOU Qifang
(College of Animal Science and Technology,Northwest A&F University,Yangling Shaanxi 712100,China)
This experiment was to explore the tissue specific expession of NELL1 and FMO3 in fat-tailed sheep under different nutrition levels and in different growth periods. Firstly,nine-month-aged Tan sheep,Tong sheep,Kazakh and Tibetan sheep which had the similar body mass were selected for adipose tissue collection,three individuals were used for each breed. In total,112 healthy Tan sheep were randomly divided into four groups (according to a completely random experiment design) with four replicates per group (two males and two females),each replicate comprises seven animals. This experiment was divided into three periods according to mass gain target:22-28 kg,28-35 kg,35-40 kg. At the end of each stage,the liver fat,perineal fat,tail fat and subcutaneous fat were collected. The total RNA was extracted from adipose tissues,and the expression level of FMO3 and NELL1 were analyzed by quantitative PCR. The results showed as that: the highest expression level of FMO3 was in the Kazakh breed (fat-tailed),followed by Tong,Tan,and Tibetan sheep (short-tail). In addition, NELL1 is highly expressed in the tails of Tibetan sheep,declined in turn with Tan sheep,Tong sheep,and Kazakh breed. The expression of FMO3 and NELL1 in liver and tail fat were significantly affected by nutrition levels and ages,while there was no detectable influence in perineal and subcutaneous fat. In conclusion,fat deposition had a positive correlation to FMO3 expression and negatively correlated to NELL1 expression in sheep. The effects of FMO3 and NELL1 on fat deposition may be regulated through their expression difference in liver and tail fat. Our results provide molecular basis to illustrate the mechanism of fat deposition in fat-tailed sheep breeds.
Sheep; NELL1; FMO3; Gene expression; Nutrition levels; Growth periods
2016-03-24 Returned 2016-06-24
The National Hair Sheep Industry Technology System(No.CARS-40-13);the Public Service Sectors (agriculture) Research Projects(No.201303059);the Science and Technology Research and Development Program of Shaanxi(No.2014K01-17-03);the Agricultural Science and Technology Research Projects of Shaanxi (No.2014K01-17-04).
TIAN Chongqi,male,master student.Research area:animal nutrition and feed science.E-mail:tianchongqi@126.com
ZHANG Enping,male,professor,master supervisor.Research area: animal nutrition and feed science.E-mail:zhangenping@nwafu.edu.cn
日期:2017-06-05
2016-03-24
2016-06-24
国家绒毛用羊产业技术体系(CARS-40-13);公益性行业(农业)科研专项(201303059);陕西省科学技术研究发展计划(2014K01-17-03);陕西省农业科技攻关(2014K01-17-04)。
田崇奇,男,硕士研究生,研究方向为动物营养与饲料科学。E-mail: tianchongqi@126.com
张恩平,男,教授,硕士生导师,研究方向为动物营养与饲料科学。E-mail:zhangenping@nwafu.edu.cn 陈玉林,男,教授,博士生导师,研究方向为动物营养与饲料科学。E-mail:chenyulin@nwafu.edu.cn
S826.8
A
1004-1389(2017)06-0805-07
CHEN Yulin,male,professor,doctoral supervisor.Research area: animal nutrition and feed science.E-mail:chenyulin@nwafu.edu.cn
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170605.1714.002.html
