海岛棉GbHCT基因的表达分析
2017-07-18加得拉吐留汗倪志勇邱迎风曲延英陈全家
加得拉·吐留汗,倪志勇,邱迎风,曲延英,陈全家
(新疆农业大学 农学院,农业生物技术重点实验室,乌鲁木齐 830052)
海岛棉GbHCT基因的表达分析
加得拉·吐留汗,倪志勇,邱迎风,曲延英,陈全家
(新疆农业大学 农学院,农业生物技术重点实验室,乌鲁木齐 830052)
通过海岛棉基因组数据库和GSDS 2.0在线生物信息学软件,分析GbHCT基因的结构,利用实时荧光定量PCR技术,检测GbHCT基因在海岛棉不同组织和棉纤维不同发育时间的表达量。结果表明,该基因DNA序列长度为1 953 bp,开放阅读框长度为1 311 bp,编码436个氨基酸,在海岛棉基因组中对应scaffold3453序列,含有1个内含子和2个外显子。GbHCT基因在不同组织和纤维发育不同时期中均有表达,在各个组织中,苞叶和花中表达量最高,在棉纤维不同发育时期开花后5 d和25 d表达量最强。该基因可能参与棉纤维发育伸长期和次生壁增厚期。为深入研究该基因的功能,构建植物表达载体pEGAD-GbHCT并转入根癌农杆菌,为下一步研究奠定试验基础。
海岛棉;GbHCT;棉花纤维基因表达;植物表达载体
木质素(lignin)是自然界中仅次于纤维素的大分子物质,是植物细胞壁的重要组成成分[1]。主要由对-羟基苯基木质素(p-hydroxyphenyl lignin,H木质素)、愈创木基木质素(guaiacyl lignin,G木质素)和紫丁香基木质素(syringyl lignin,S木质素) 3种单体分别聚合形成[2]。莽草酸/奎宁酸羟基肉桂酰转移酶(shikimate/quinatehydroxycinnamoyltransferase,HCT)是木质素生物合成途径中控制木质素G/S-单体生物合成的关键限速酶,该酶通过调节木质素H-单体与G/S-单体的生物转化从而达到调控植物体木质素单体组成[3-4]。Hoffmann等[5]从烟草茎的抽提物中克隆HCT基因,葛文雅等[6]和王雪霞等[7]在拟南芥、烟草、大麦、毛果杨、黄瓜、高粱、玉米等植物中得到HCT基因。前人用RNA干扰(RNAi)技术和烟草脆裂病毒(tobaccorattlevirus,TRV)侵染的方法抑制拟南芥和烟草中HCT基因表达,发现转基因植株表现出植株矮小的特征[8]。
陆地棉(GossypiumhirsutumL.)和海岛棉(GossypiumbarbadenceL.)是商业价值最高的栽培品种。棉纤维由棉花种子的表皮毛发育而成,是一种优良的天然纤维。一般经历45~50 d,根据其形成和发育过程可分为纤维起始分化、纤维伸长及初生壁合成、次生壁合成和脱水成熟4个时期[9-10]。有研究证明,纤维品质优越的海岛棉中木质素总体含量低于其他棉种,这可能是海岛棉棉纤维比其他品种更细的原因[11]。通过基因工程手段降低木质素含量,从而实现纤维品质的改良是一个可行的方法。改变植物木质素生物合成调控的途径有两种方法,一种是降低木质素含量,另一种方法是改变木质素的组成结构[12]。棉花不同基因型和不同发育时期有上千个可调控基因,仅有少数基因被分离鉴定。目前,研究者们对于HCT基因的研究更多的是在模式植物中,棉花中研究主要集中在基因的克隆和生物信息学分析等方面。因此,在棉花中分离并鉴定与纤维发育相关基因,分析这些基因在纤维发育中具有的功能,阐明棉纤维发育的分子机理,对于棉花纤维品质的改良和产量的提高具有非常重要的理论和经济意义。
本研究利用实时荧光定量PCR技术从海岛棉‘新海21’中克隆棉花GbHCT基因,并对其进行生物信息学分析。通过实时荧光定量PCR技术对海岛棉不同组织和纤维发育不同时期的表达量进行分析并成功构建pEGAD-GbHCT植物表达载体,为研究GbHCT基因的功能提供基础。
1 材料与方法
1.1 材 料
1.1.1 植物材料 在棉花生长盛花期 (7月至8月中旬)于新疆阿克苏地区收集‘新海21’海岛棉的苞叶、花及棉纤维不同发育时期即开花后8个不同时间0、5、10、15、20、25、30、35 d的纤维。室内种植‘新海21’,待长出2~3片叶后取根、茎和叶。
1.1.2 菌种、载体与试剂 10×buffer含(Mg2+)、dNTP、TaqDNA聚合酶、DNA marker DL 2000、DNA marker DL 15000、琼脂糖凝胶回收试剂盒、质粒小提试剂盒、RNA plant plus reagent试剂盒、多糖多酚植物总RNA提取试剂盒均购自北京天根生化科技有限公司;TransStart○RTip Green qPCRSuperMix、大肠杆菌(E.coli)DH5α感受态购自北京全式金生物科技有限公司;pMD19-T载体和限制性内切酶T4连接酶购自TaKaRa公司;EcoRⅠ、HindⅢ、ThermoRevertAid First strand cDNA Synthesis Kit购自Thermo Fisher Scientific公司;农杆菌EH105菌株、pEGAD载体均由新疆农业大学农业生物技术重点实验室保存;其他试剂均为国产分析纯;引物合成由北京华大生物科技公司完成;测序工作由上海美季生物科技公司完成。
1.2 方 法
1.2.1 RNA的提取及cDNA 第一链的合成 利用TianGen公司RNA plant plus reagent试剂盒,提取‘新海21’海岛棉根、茎、叶、苞叶、花的总RNA,参照TianGen多糖多酚植物总RNA提取试剂盒说明书,提取不同发育时期棉纤维总RNA。参照ThermoRevertAid First strand cDNA Synthesis Kit试剂盒操作步骤合成cDNA第一条链,-20 ℃保存,备用。
1.2.2 目标基因的克隆 根据棉纤维发育转录组库中筛选得到的目标Unigene序列Unigene30610,利用primer premer 5.0软件设计特异引物:GbHCT-F:5′-ATGGAGATTACTATAAAGGAGTCTGC-3′ 和GbHCT-R:5′-TTAAAACTCATAAATAAGTTTTTCAAAAA-3′送华大科技合成,合成后引物进行RT-PCR扩增。反应条件为:10×Buffer含(Mg2+) 5 μL,2.5 mmol/L dNTP 4 μL,10 μmol/L 上游引物和下游引物各2 μL,cDNA 1.5μL,Taq酶(5 U/μL )0.5μL,ddH2O 35 μL,总体积为50 μL。反应程序为:预变性94 ℃ 4 min;变性 94 ℃ 30 s,退火50 ℃ 30 s,延伸72 ℃ 1 min ,35个循环;再延伸72 ℃ 10 min,结束反应。取 4 μL PCR 产物进行电泳检测。采用普通DNA产物纯化试剂盒纯化PCR产物与pMD19-T连接,转化大肠杆菌DH5ɑ感受态细胞,涂布于含有氨苄青霉素(50 mg/mL)的LB固体培养基上,37 ℃培养12~14 h 后挑取单菌落,PCR和双酶切鉴定阳性克隆送上海美季公司测序。
1.2.3 序列分析 用已获得的GbHCT基因的cDNA序列作为探针在GossypiumbarbadenceAnnotation Project(Http://cotton.cropdb.org)检索获得对应海岛棉基因组DNA序列,采用GSDS 2.0(http: //gsds.cbi.pku.edu.cn /index.php)分析基因的结构[13]。
1.2.4 实时荧光定量PCR分析 根据GbHCT序列设计实时荧光定量PCR引物。序列为GbHCT-F:5′-AAGTCGACTATTCTGGAGGAA- TATCTTC-3′和GbHCT-R:5′-ATGGTACAA- TGGCAGGCGTCA-3′。以棉花 GhUBQ7为内参基因。序列GhUBQ7-F为:5′-GACCTACACCAAGCCCAAGAAG-3′ ,GhUBQ7-R:5′-TGA- GCCCACACTTACCACAATAGT-3′。采用Trans Start Tip Green qPCR SuperMix试剂盒。反应体系为20 μL,模板cDNA 1.5 μL,10 μmol/L 上下游引物各0.4 μL,2×TransStartTip Green qPCR Super Mix 10 μL,Passive Reference Dye(50×) 0.4 μL,加 ddH2O至20 μL。利用7500 Fast Real-Time PCR仪扩增反应程序采用两步法:预变性95 ℃ 20 s,95 ℃ 3 s,退火60 ℃ 30 s收集荧光。目的基因与内参基因分别设3个技术重复。试验结果按照2-△△Ct法进行数据分析。
1.2.5 构建植物表达载体pEGAD-GbHCTpEGAD载体和GbHCT序列设计2条添加酶切位点EcoRⅠ和HindⅢ的引物序列为nTHCT-F:5′-TAAGAATTCATGGAGATTACTATAAAGGAGTCTGC-3′和nTHCT-R:5′-TATAAGCTTTTAAAACTCATAAATAAGTTTTT- CAAAAA-3′以pMD19-T-GbHCT重组质粒为模板,进行PCR扩增。将扩增得到的目标片段经凝胶纯化回收试剂盒纯化回收后,用EcoR I和Hind III双酶切回收产物与pEGAD载体,在T4DNA连接酶的作用下连接转化。酶切体系为:EcoR I和Hind III各1 μL,Buffer 5 μL,回收的目的片段pEGAD质粒 13 μL。连接体系:10×T4ligase Buffer 1 μL,pEGAD Vector 2 μL,目的DNA回收片段6 μL,T4DNA ligase 1 μL,总体积 10 μL。放入 22 ℃连接仪连接20 min,转化大肠杆菌 DH5α,培养过夜后挑取单菌落,进行菌液PCR和质粒双酶切鉴定后送至上海美季测序。
1.2.6GbHCT基因植物表达载体转化农杆菌 挑取根癌农杆菌EHA105单菌落于5 mL YEB 液体培养基(含Rifampicin 50 mg/L)中,28 ℃ 250 r/min振荡培养,吸取2 mL菌液加入50 mL YEB培养基至OD600为0.6左右,制备农杆菌感受态细胞,采用冻融法把pEGAD-GbHCT质粒DNA转化到农杆菌感受态细胞,接种于含有50 mg/L Kan 和50 mg/L Rif 的YEB 固体平板上,28 ℃培养约2 d,挑单菌落,接种于YEB 液体培养基中,28 ℃振荡培养过夜。经PCR鉴定得到1 311 bp 条带的特异条带。
2 结果与分析
2.1 RNA的提取与检测
分别提取海岛棉‘新海21’的根、茎、叶、苞叶、花及8个纤维发育时期(开花后时间)0、5、10、15、20、25、30、35 d的总RNA,利用Colibri Spectrometer紫外分光光度计检测RNA样品的质量浓度和完整性。结果显示:提取的RNA样品OD260/OD280的比值在1.8~2.0,OD260/OD230比值均大于1.8(图1、图2)。经10 g/L的琼脂糖凝胶电泳后28S rRNA、18S rRNA和5S rRNA条带明亮,清晰可用于后续试验。

图1 海岛棉不同组织RNA电泳图Fig.1 Electrophoresis of PCR product of RNA extracted from different tissues of Gossypium barbadence L.

图2 海岛棉纤维不同发育时期RNA电泳图Fig.2 Electrophoresis of PCR product of RNA extracted from different development stages of Gossypium barbadence L.
2.2GbHCT基因的克隆和氨基酸序列分析
根据海岛棉转录组数据中的HCT序列设计引物,将扩增产物克隆到pMD19-T载体上(图3)测序,结果表明:GbHCT基因开放阅读框长度为1 311 bp,编码436个氨基酸,GenBank登录号为KT378286。预测的GbHCT蛋白质分子质量为48.58 ku,等电点为6.03。GbHCT基因对应海岛棉基因组中的Gbscaffold3453.1序列,含有1个长度为91 bp的内含子和2个长度分别为410 bp和899 bp的外显子。
2.3GbHCT基因的q-PCR分析
为揭示GbHCT基因在海岛棉中的表达特性,以海岛棉‘新海21’的根、茎、叶、苞叶、花、及花后0、5、10、20、25、30、35 d纤维的总RNA作为模板,以UBQ7为内参基因,进行不同组织和不同发育时期的表达分析,试验结束后按照2-△△Ct法进行数据分析。将叶和花后20 d设为对照组,表达量为1。结果表明:GbHCT基因在不同组织和不同发育时期均有表达,在不同组织中,苞叶和花中优势表达,根、茎和叶中表达量较低(图4)。
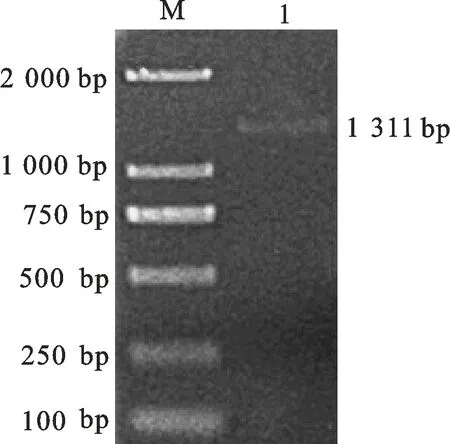
M.DNA Marker;1.PCR产物 PCR products
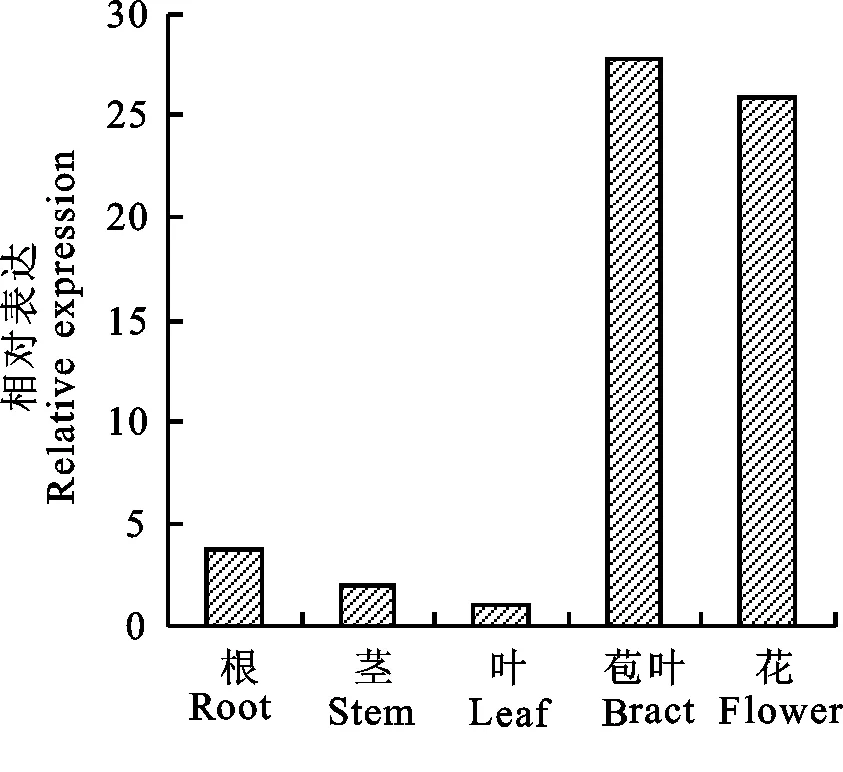
图4 GbHCT基因在海岛棉不同组织中的表达Fig.4 Expression of GbHCT in different tissues of Gossypium barbadence L.
在不同发育时期5 d和25 d出现GbHCT基因表达量最高峰,分别达到对照组的69倍和36倍,其次是10 d和15 d。其他时期表达量微弱(图5)。
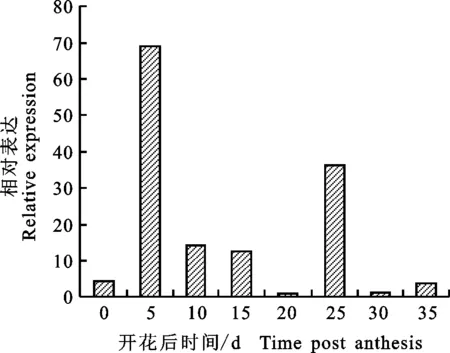
图5 GbHCT 基因在海岛棉纤维不同发育时间的表达Fig.5 Expression of GbHCT different fiber development periods of Gossypium barbadence L.
2.4GbHCT基因植物表达载体的构建及农杆菌转化
利用带酶切位点引物进行PCR扩增,获得目的片段(图6-A),利用EcoR I和Hind III酶切重组质粒,与相同酶切的植物表达载体连接转化。菌液PCR、双酶切鉴定获得1 311 bp左右的片段,经上海美季测序证实目的基因已成功整合(图6-B)。用测序正确的重组质粒pEGAD-GbHCT转化农杆菌EHA105菌株,进行菌液PCR鉴定,得到1 311 bp的目的条带,证明pEGAD-GbHCT重组质粒已经被成功转入农杆菌(图7)。

M.DNA Marker;1.植物表达载体PCR产物 PCR products of plant expression vector;2.重组质粒的酶切鉴定 Restriction enzyme digestion of recombinant plasm
图6 植物表达载体pEGAD-GbHCT的构建
Fig.6 Construction of plant expression vector pEGAD-GbHCT
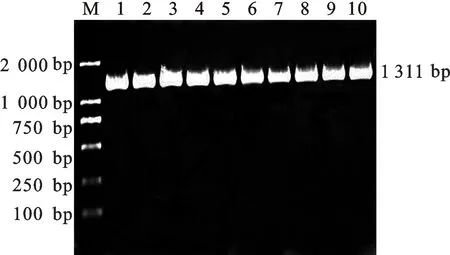
M.DNA marker;1~10.GbHCT基因GbHCTgene
图7 转化农杆菌菌液 PCR 检测
Fig.7 Identification of transformed agrobacterial liquid with PCR
3 讨 论
棉纤维发育的各个时期参与多个基因和转录因子,这些基因和转录因子在不同组织和不同发育时期的表达中有显著差异。明确这些基因在各个时期的表达特征,对改良纤维品质提供候选基因具有重要意义。有研究已证实,在成熟棉纤维细胞细胞壁形成过程中存在木质素的生物合成途径,而且在不同棉花亚种(海岛棉和陆地棉)及不同棉花类型(白色棉和彩色棉)木质素含量存在显著差异[14]。曹双瑜等[15]研究发育中棉纤维木质素的含量,得出单位棉铃木质素的含量随棉纤维发育的递增木质素含量越低,棉纤维断裂比强度越高。Fan等[16]研究表明,木质素沉积可能与减少细胞壁的增厚和影响细胞成熟过程中细胞壁停止生长有关。
本研究以海岛棉‘新海21’的根、茎、叶、苞叶、花等组织和8个不同棉纤维发育时间即花后0、5、10、15、20、25、30、35 d为材料,通过实时荧光定量PCR检测GbHCT基因在海岛棉中的表达量。在材料选择上,本研究收集棉纤维发育的4个时期的纤维,为充分研究该基因在棉纤维发育各个时期的表达提供基础。利用实时荧光PCR检测这些组织和不同发育时期发现GbHCT基因在不同组织中苞叶和花中表达量最高,棉纤维发育时期5 d和25 d中具有很强的表达。棉花纤维次生壁的发育和苯丙烷代谢途径基因的表达量在时间上具有一致性,因此,GbHCT基因在25 d 具有较强的表达与预期的结果一致。肖向文等[11]研究的GhHCT在棉纤维发育16 d出现最高峰与本文高表达出现的25 d都是细胞壁加厚期与本研究结果相似。而在5 d出现的高表达量,初步推测GbHCT基因可能参与棉纤维起始。比较GbHCT基因在不同组织和不同棉纤维发育时期的表达可以发现,GbHCT基因虽然在各个组织中均有表达,但GbHCT基因表达高峰期出现在棉纤维不同发育时期。表明GbHCT基因是一个与棉纤维发育相关的基因并参与棉纤维发育的伸长期和次生壁增后期。棉纤维的长度是由纤维伸长期决定,强度和细度由次生壁增后期决定,因此,可以初步断定GbHCT基因可能在棉纤维的长度、细度和强度等指标形成中有作用。
Reference:
[1] 刘 伟,李 高,杨 杞,等.柠条锦鸡儿HCT基因克隆及序列分析[J].内蒙古农业大学学报,2014,35(1):77-82.
LIU W,LI G,YANG Q,etal.Cloning and sequence analysis of a hydroxycinnamoyl-coenzyme a shikimate/quinate hydroxycinnamoyl transferase encodinggene fromCaraganakorshinkiikom[J].JournalofInnerMongoliaAgriculturalUniversity,2014,35(1):77-82 (in Chinese with English abstract).
[2] 聂明才,霍淑平,孔 武.木质素模型化合物的研究进展[J].林产化学与工业,2010,30(5):115-121.
NIE M C,HUO SH P,KONG W.Research progress of lignin model compounds[J].ChemistryandIndustryofForestProducts,2010,30(5):115-121 (in Chinese with English abstract).
[3] 李宗梅.小立碗藓羟基肉桂酰基转移酶基因功能及调控研究初探[D].武汉:华中农业大学,2013.
LI Z M.Identification and characterization of a novel hydoxycinnamoyl transferase from thePhyscomitrellapatensand the regulation ofP.patensHCT[D].Wuhan:Huazhong Agricultural University,2013 (in Chinese with English abstract).
[4] 王雪霞,薛永常,赵文超.木质素生物合成中C3H/HCT的研究进展[J].生命的化学,2008,28(5):650-653.
WANG X X,XUE Y CH,ZHAO W CH.Progrees C3H/HCT in lgnin biosynthesis[J].ChemistryofLife,2008,28(5):650-653 (in Chinese with English abstract).
[5] HOFFMANN L,MAVRY S,MARTZ F,etal.Purification,cloning and properties of an acyltransferase controliting shikimate and quinate ester intermediatas in phenyl propanod metabolism[J].JournalofBiologicalChemistry,2003,278(1):95-103.
[6] 葛文雅,惠 伟,闫洪波,等.鸭梨 PbHCT3基因的克隆及表达分析[J].西北植物学报,2012,32(5):0871-0875.
GE W Y,HUI W,YAN H B,etal.Cloning and expression analysis of PbHCT3 gene inPyrusbretschneideriRehd .cv.‘Yali’ [J].ActaBotanicaBoreale-OccidentaliaSinica,2012,32(5):871-875(in Chinese with English abstract).
[7] 王雪霞,曹 方,薛永常.杨树木质素合成酶hct基因的克隆及核苷酸序列分析[J].辽宁林业科技,2009,6(1):4-7.
WANG X X,CAO F,XUE Y CH.Cloning sequence analysis of lignin biosynthesishctgene in poplar[J].JournalofLiaoningForestryScience&Technology,2009,6(1):4-7 (in Chinese with English abstract).
[8] HOFFMANN L,BESSEAU S,GEOFFROY P,etal.Silencing of hydroxycinnamoyl-coenzyme A shikimate/quinate hydroxycinnamoyltransferase affects phenylpropanoid biosynthesis[J].PlantCell,2004,16(6):1446-1465.
[9] 闫洪颖.棉花纤维发育过程超微结构观察和次生壁木质素含量的分析[D].乌鲁木齐:新疆农业大学,2009.
YAN H Y.ltra-structural observation on fiber cell and lignin content analysis of secondary wall during cotton fiber development [D].Urumqi:Xinjiang Agriculture University,2009(in Chinese with English abstract).
[10] 陈 蔷,崔百明,黎娟华,等.棉花纤维品质分子改良研究进展[J].中国生物工程杂志,2009,29(5):111-115.
CHEN Q,CUI B M,LI J H.Progress on molecular improvement of cotton fiber qualities [J].ChinaBiotechnology,2009,29(5):111-115(in Chinese with English abstract).
[11] 肖向文,朱奇朗,刘海峰,等.棉花莽草酸/奎宁酸羟基肉桂酰转移酶基因(GhHCT)的克隆、生物信息学分析及表达特性[J].农业生物技术学报,2014,22(05):572-579.
XIAO X W,ZHU Q L,LIU H F.etal.Cloning,bioinformatics analysis and expression characteristic of shikimate/quinate hydroxycinnamoyl transferase gene(GhHCT) in cotton (GossypiumhirsutumL.)[J].JournalofAgriculturalBiotechnology,2014,22(5):572-579(in Chinese with English abstract).
[12] 刘 媛,黄真池,曾富华,等.木质素单体生物合成途径研究进展[J].湛江师范学院学报,2007,28(6):87-99.
LIU Y,HUANG ZH CH,ZENG F H,etal.Advances in study of the biosynthesis pathway of lignin monomer[J].JournalofZhanjiangNormalCollege,2007,28(6):87-99((in Chinese with English abstract).
[13] 汪晓东,陈 洋,于月华,等.大豆 GmNF-YA3基因结构及原核表达分析[J].作物杂志,2015(4):47-50.
WANG X D,CHEN Y,YU Y H,etal.Structural and prokaryotic expression analysis of GmNF-YA3 gene [J].Crops,2015(4):47-50(in Chinese with English abstract).
[14] 胡文冉,范 玲,师维军,等.一种确立棉花纤维中木质素含量和纤维品质相关关系的方法:中国,201010143263[P].2010-08-11.
HU W R,FAN L,SHI W J,etal.A method to establish the relationship between lignin content and fiber quality: China,201010143263[P].2010-08-11 (in Chinese).
[15] 曹双瑜,胡文冉,范 玲.发育中棉纤维硫酸木质素含量动态变化[J].新疆农业科学,2012,49(7):1184-1189.
CAO SH Y,HU W R,FAN L.The dynamic changes of klason lignin contents during cotton fiber development[J].XinjiangAgriculturalSciences,2012,49(7):1184-1189(in Chinese with English abstract).
[16] FAN L,SHI W J,HU W R,etal.Molecular and biochemi-cal evidence for phenylpropanoid synthesis and pres-ence of wall-linked phenolics in cotton fibers[J].JournalofIntegrativePlantBiology,2009,51(7):626-637.
(责任编辑:史亚歌 Responsible editor:SHI Yage)
Expression Analysis ofGbHCTGene inGossypiumbarbadenceL.
Jiadela·Tuliuhan,NI Zhiyong,QIU Yingfeng,QU Yanying and CHEN Quanjia
(College of Agronomy,Xinjiang Agricultural University,Key Laboratory of Agricultural Biological Technology,Urumqi 830052,China)
In this study,the structure of geneGbHCTwas analyzed by using an online bioinformatics software genomic database ofGossypiumbarbadenceand GSDS 2.0.The expression ofGbHCTgene in different tissues and different fiber development stages of cotton was analyzed by real-time quantitative PCR.A length of 1 953 bp from genomic DNA ofGbHCTwas cloned by PCR.GbHCTcontain open reading frames of 1 311 bp encoding proteins of 436 amino acid residues.The genomic DNA ofGbHCTcontained two exons and one intron which were located in the scaffold 3 453 ofGossypiumbarbandenseL.Real-time quantitative PCR analysis revealed thatGbHCTwas expressed at higher level in bracts and flowers,and it was predominantly expressed in 5 d and 25 d during cotton fiber development,so we suggested that this gene may be involved in regulating fibre elongation and secondary wall thickening.Plant expression vector pEGAD-GbHCTwas constructed and transferred into theAgrobacteriumtumefaciensEHA105 for further experiment.
GosypiumbarbadenseL.;GbHCT; Cotton fiber gene expression ;Plant expression vector
2016-03-31 Returned 2016-05-23
High-tech Research and Development Program of Xinjiang Uygur Autonomous Region (No.20141103).
Jiadela·Tuliuhan,female,master student.Research area:quality of cotton fiber.E-mail:jaderatoleuhan@163.com
CHEN Quanjia,male,professor.Research area:cotton genetic breeding.E-mail:chqjia@126.com
日期:2017-06-05
2016-03-31
2016-05-23
自治区高技术研究发展计划(20141103)。 第一作者:加得拉·吐留汗,女,硕士研究生,研究方向为棉花纤维品质改良。E-mail:jaderatoleuhan@163.com 通信作者:陈全家,男,教授,主要从事棉花分子育种研究。E-mail:chqjia@126.com
Q786
A
1004-1389(2017)06-0849-06
网络出版地址:http://kns.cnki.net/kcms/detail/61.1220.S.20170605.1715.014.html
