UV/PS工艺降解水中环丙沙星的产物及机理分析*
2017-07-18郭洪光刘杨柯亭伶赵程伟唐炜鸿
郭洪光,刘杨,柯亭伶,赵程伟 ,唐炜鸿
(1.四川大学 建筑与环境学院,四川 成都 610065;2.同济大学 水污染与控制国家重点实验室,上海 200092)
UV/PS工艺降解水中环丙沙星的产物及机理分析*
郭洪光1,2†,刘杨1,柯亭伶1,赵程伟1,唐炜鸿1
(1.四川大学 建筑与环境学院,四川 成都 610065;2.同济大学 水污染与控制国家重点实验室,上海 200092)
水环境中残留的氟喹诺酮抗生素(FQs)所造成的长期生态及生理毒性已引起了人们的广泛关注.本文采用基于紫外光活化过硫酸盐的新型高级氧化工艺氧化降解水中典型氟喹诺酮抗生素环丙沙星(CIP),对其降解产物进行定性与定量表征,并通过量子化学分析与质谱检测结果提出UV/过硫酸盐工艺降解环丙沙星的详细降解路径.结果表明,该工艺降解CIP最佳pH为9.0,30 min反应后,溶液体系中检测出包括醇类、酚类、酰胺类及酮类等在内13种中间产物,且部分中间产物浓度呈现先升高后降低的趋势.氧化反应主要集中在喹诺酮核心的C-F键、羧酸基团及哌嗪基团上.UV/PS工艺降解环丙沙星的降解包含四个主要路径,通过一系列的脱氟、光裂解、取代、加成及脱氨基反应,最终导致目标物开环裂解.
氟喹诺酮药物;过硫酸盐;紫外活化;机理;产物
近年来,由于抗生素等药物的广泛使用及其不完全代谢特点,使得水环境中广泛残留的药物活性物质受到人们的关注[1-4].氟喹诺酮抗生素(FQs)由于对革兰氏阳性及阴性细菌都具有活性作用,被广泛用于治疗人类和动物类疾病,从而导致其在地表水和污水中大量检出,对水体中的微生物及水生态环境产生了长期的毒理效应,并最终会危害人体健康[1,4-5].其中又以第二代氟喹诺酮类抗菌素环丙沙星(ciprofloxacin)使用最为广泛[6-7].鉴于FQs在水环境中的难降解性,传统的水处理方法对其去除效果有限,亟需寻找高效、方便的水处理工艺应对该类水环境污染[8].
基于活化过硫酸盐产生·SO4-(E0=2.60 V)的新型高级氧化工艺(SR-AOPs)相比传统的羟基自由基氧化工艺(HR-AOPs)具有反应条件温和,激活方式多样(可被热、光波、过渡金属、酚类及醌类物质激活),氧化选择性较强的特点,近年来受到了研究者的高度关注[9-11].SR-AOPs可以在一定条件下氧化降解多种水中的微污染物质,然而,现阶段该新型工艺的矿化程度及对特定目标物的降解产物分析仍显不足[12-15].基于此,本文首次采用UV活化过硫酸盐工艺降解水中环丙沙星,对其在最优pH条件下反应产物进行定性与定量分析,并基于量子化学理论与质谱分析提出反应详细降解路径,从而为水环境中FQs污染治理提供相应理论依据.
1 材料与方法
1.1 材料
盐酸环丙沙星(CIP,>98%) ,购自日本TCI 株式会社,分析用乙腈及甲酸购自Sigma-Aldrich (Shanghai,China),其他试剂购自上海国药集团化学试剂有限公司,试验中的试剂及反应液均采用Milli-Q(RO)超纯水系统配置.
1.2 试验及分析方法
试验采用开放式紫外激活装置(Φ=10.0 cm,H=30.0 cm),反应器采用双层水浴夹层控温(20±0.5 ℃),紫外灯(11 W)内置于反应器中,反应溶液体积为2.0 L,采用磁力搅拌器确保反应混合均匀.溶液pH值采用0.1 mol/L的HCl和NaOH调节.反应开始前预热紫外灯管45 min,并通入20 min的N2以去除溶解氧的干扰,反应开始后加入定量的过硫酸盐溶液,在固定的反应时间进行取样,并立即加入100 μL甲醇淬灭,12 h内将样品进行高效液相色谱(HPLC)及液相色谱-串联质谱(LC-MS/MS)分析,CIP浓度及降解产物定性与定量分析采用先前文章所述的仪器检测方法[12,16].
2 结果与讨论
2.1 溶液初始pH的影响
为研究紫外激活过硫酸盐工艺的最佳pH值,试验考察了均一紫外光照射下,初始pH为3.0,5.0,7.0,9.0及11.0时,投加0.05 mM的Na2S2O8工艺降解初始浓度为0.013 mM的抗生素的去除效果,试验结果如图1所示.
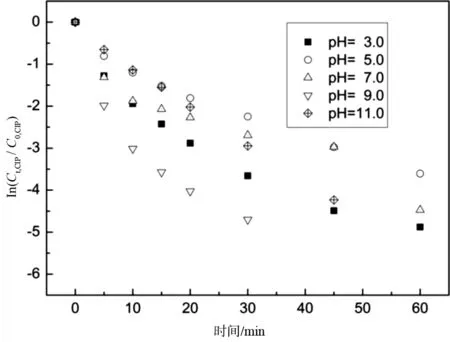
图1 pH值对紫外激活过硫酸盐降解环丙沙星的影响Fig.1 Effect of pH value on degradation of CIP by UV activated persulfate
如图1所示,紫外激活过硫酸盐工艺能够快速有效地降解水中环丙沙星,反应60 min后基本已经降解完全.实验证明UV/PS工艺降解CIP最佳pH为9.0.在pH 9.0的条件下,CIP去除率RCIP=95.08%,而相同条件下的pH=3.0,5.0,7.0,及11.0情况下,去除率分别为85.65%,69.91%,84.71%及68.00%,这与热激活过硫酸盐降解CIP有所不同,表明紫外光的引入对反应体系产生了重要影响[12].造成此现象的原因主要是由于两性化合物CIP在不同pH下的带电性差异,以及溶液中的自由基种类与浓度分布不同的结果[2].在较低pH条件下(pH<9),CIP的哌嗪基团发生脱质子化效应,带有正电荷,从而较容易与带负电的·SO4-发生反应.而随着pH升高质子化效应逐渐减弱,在较高pH条件下(pH>9),带负电的CIP-占据主要部分,从而对反应起到了抑制作用(Eq.1)[17].此外强碱性条件下,·SO4-会转化为·OH,作为非选择性氧活性物质,·OH浓度的增加亦降低了目标物的降解效率[17].
(1)
2.2 UV/PS工艺降解CIP产物种类及浓度检测
2.2.1 产物种类鉴定
在pH 9.0条件下,实验采用紫外活化0.05 mM PS降解0.013 mM CIP,反应30 min后将降解CIP生成的非挥发性产物采用HPLC-MS-MS进行检测,实验结果共发现了 13种有机中间产物,其母离子分子量及特征离子碎片如表 1所示.中间产物的分子结构式基于量子化学,分子量碎片质谱图综合确定.
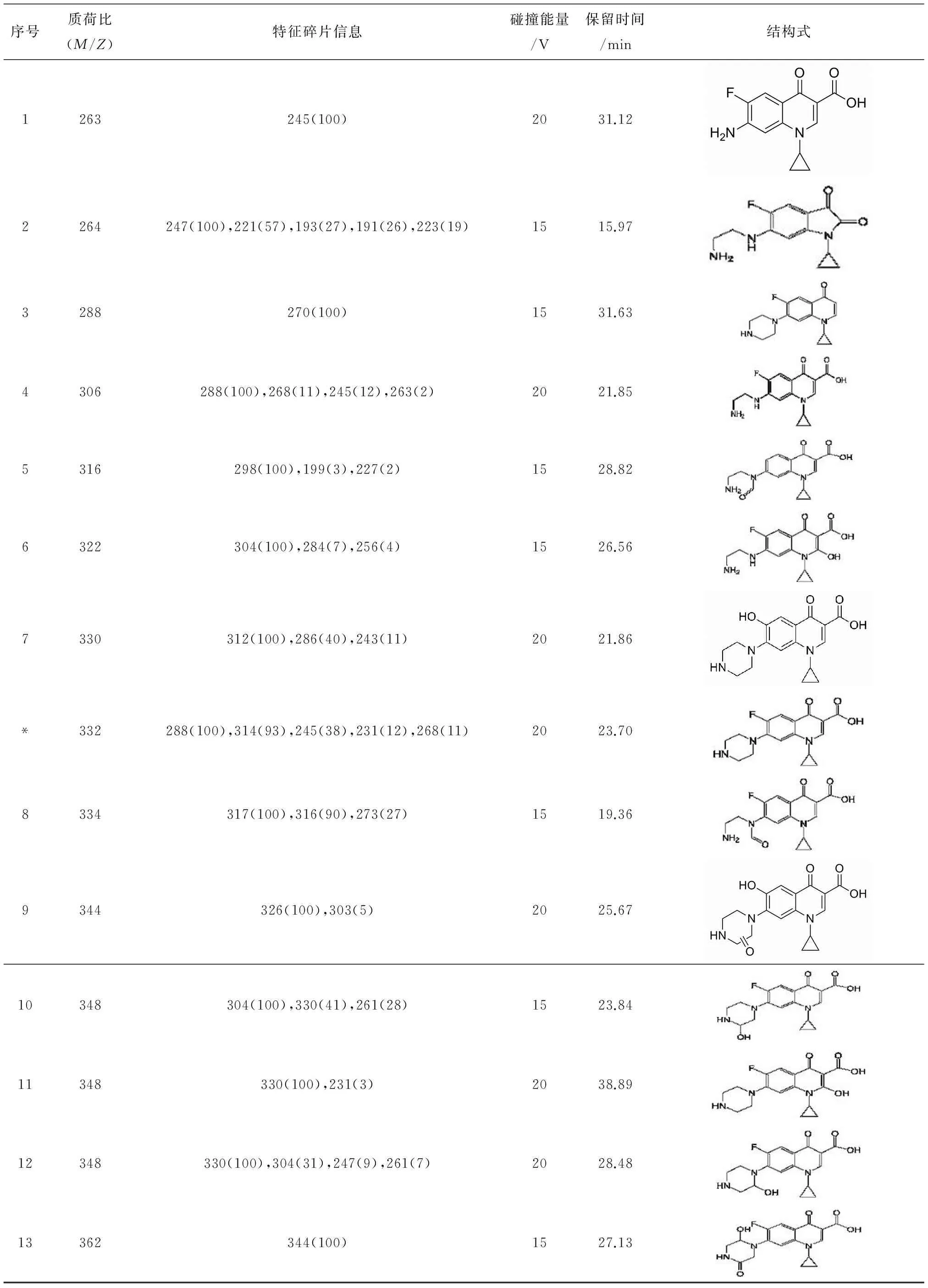
表1 紫外激活过硫酸盐降解CIP产物分析Tab.1 Ciprofloxacin degradation products by UV activated persulfate
*-CIP
如表 1信息所示,紫外激活过硫酸盐降解环丙沙星的产物相比热激活过硫酸盐降解环丙沙星氧化工艺得到的产物要多[12].这主要是两方面因素在起作用:一方面单独紫外工艺可以直接裂解环丙沙星[18],另一方面在紫外光的照射下,环丙沙星局部官能团发生电子能级跃迁,变成激发态,比稳态情况下更容易受到·SO4-的攻击,从而生成更多的氧化产物[19].
紫外激活过硫酸盐降解环丙沙星反应产物主要包括在哌嗪六元环上生成的醇类(产物10#,12#及13#)、酮类(产物9#)及酰胺类(产物5#,8#),发生在氟喹诺酮基团上的酚类(产物7#)、醇类(产物 11#),以及哌嗪基团及氟喹诺酮基团的开环裂解产物(产物1#~4#及6#).
为考察各种中间产物生成的先后顺序,研究对特征中间产物的浓度进行了监测,产物浓度随反应时间的变化如图 2所示.
从产物浓度峰面积变化图可知,产物浓度随着反应时间的增加,呈现大体上升的趋势,而产物4#,7#及11#的浓度出现先升高后降低的趋势,表明三者为重要的中间产物,在前期阶段随着反应时间延长,浓度升高较快,在达到一个峰值后,中间产物在反应中后期会与底物发生竞争作用,其生成速率会逐渐小于降解速率,导致其浓度下降,并生成更为稳定的产物.
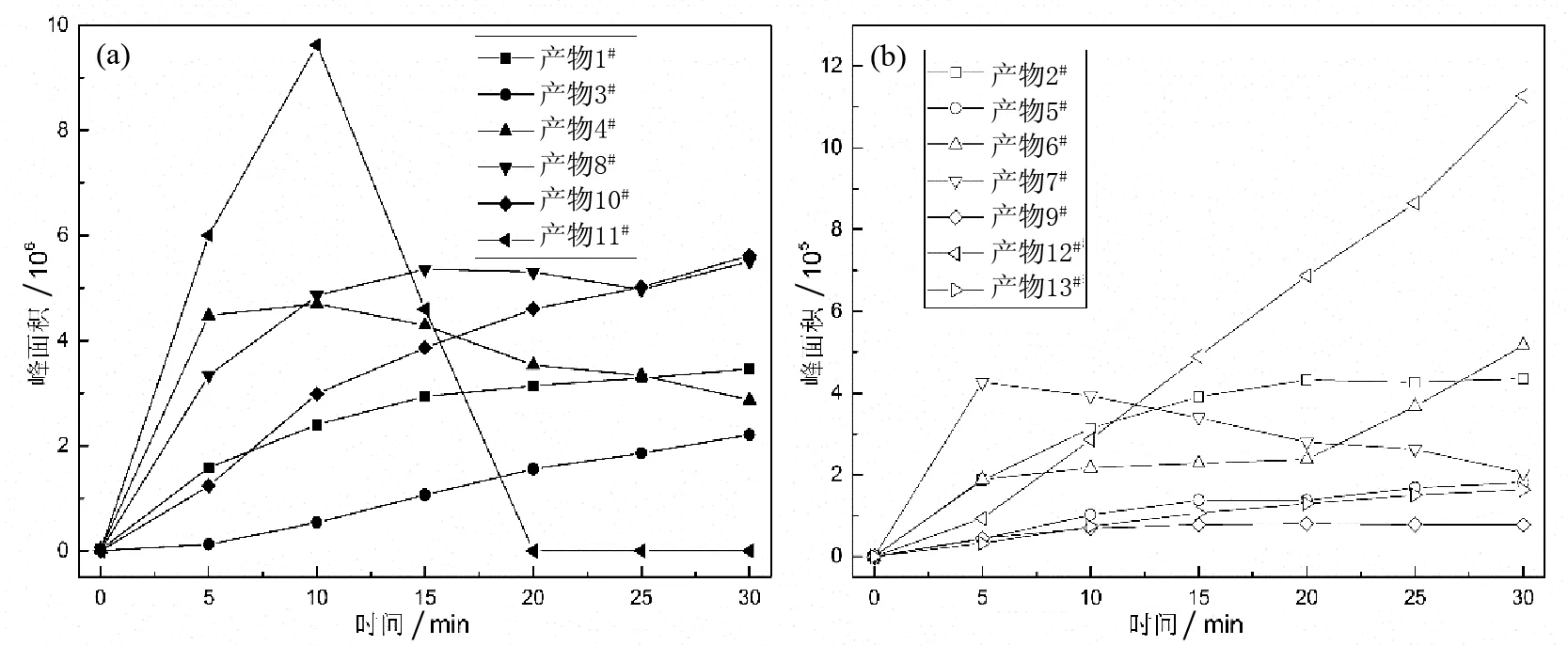
(a)峰面积>106 (b)峰面积>105图2 紫外激活过硫酸盐降解环丙沙星的产物LC-MS/MS峰面积变化Fig.2 Integrated LC-MS/MS peak areas of products from degradation of CIP by UV/Na2S2O8 process
2.2.2 量子化学分析
为研究紫外激活过硫酸盐降解环丙沙星的降解路径,研究采用Gaussian 03V及ChemBioffice 2010程序计算了环丙沙星的分子轨道.环丙沙星的最高占据轨道(HOMO)以及最低未占据轨道(LUMO)的分子轨道示意图如图 3所示.根据前线电子理论,在化合物分子中,HOMO上的电子能量最高,所受束缚最小,所以最活泼,容易变动;而LUMO在所有的未占轨道中能量最低,最容易接受电子,因此这两个轨道决定分子电子得失和转移能力,决定着分子间反应的空间取向等重要化学性质[20]. HOMO轨道及LUMO轨道能量值分别为-7.729 eV及-1.897 eV,其分子重原子上的带电量如表 2所示.
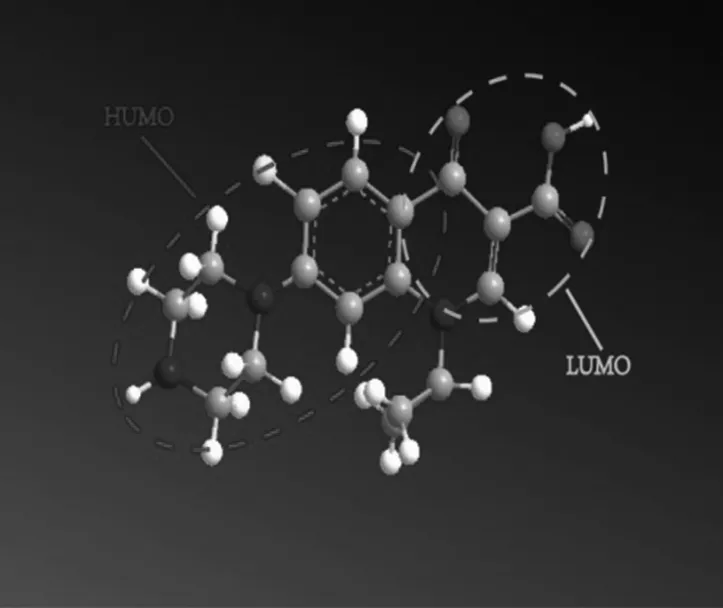
图3 CIP的HOMO及LOMO分子轨道示意图Fig.3 HOMO and LOMO molecular orbits of ciprofloxacin表2 环丙沙星分子重原子上的电荷数Tab.2 Atomic charges of heavy atoms on ciprofloxacin

序号原子电荷序号原子电荷1C0.12571613C0.0234702C-0.04285214C0.0957493C0.11317715N-0.2986504C-0.06339016N-0.1987795C0.02721517C0.1133886C0.20054518C0.1339967N-0.26679319C0.1451628C0.20752320C0.1128649C-0.10610021F-0.14310710O-0.25244122C0.32201011C0.15437223O-0.32286112C0.12571624O-0.096819
由图 3及表 2可知,环丙沙星的HOMO轨道在哌嗪基团上及C-F键上,其上具有较高能量的电子,在热激活Na2S2O8生成·SO4-过程中,有研究者认为其氧化机理主要是电子转移反应[21],即·SO4-得到电子转化为SO42-,而LOMO轨道主要位于氟喹诺酮基团上的羧基上,此处并未发现大量的水解反应产物,因此反应主要发生在哌嗪基团上及C-F键,这与前述实验结果相符.
2.2.3 降解机理分析
根据紫外激活过硫酸盐降解环丙沙星的中间产物的定性及定量分析结果,并结合量子化学中的分子轨道理论,研究提出了CIP的降解路径图(如图4所示),在紫外光的协同作用下环丙沙星的降解主要有四大途径:(1)路径I:紫外光子攻击氟喹诺酮上的C-F键,使其活化,并发生羟基取代反应,并在氧化剂的作用下进一步发生开环及脱羟基反应;(2)路径II:紫外光子攻击羧酸基团,使环丙沙星发生脱羧反应;(3)路径III:·SO4-攻击环丙沙星哌嗪基团发生不同位的羟基取代反应,并在后续过程中进一步氧化其中间产物;(4)路径IV:在紫外光的协助下,·SO4-攻击环丙沙星的氟喹诺酮基团,使其C—N六元环发生羟基取代及后续氧化反应.其中以路径III及路径IV为主要降解途径.如图 4所示,在路径I作用下,环丙沙星首先发生脱氟反应,生成产物 7#[22],在哌嗪环上引入一个非定位羰基后(产物 9#),产物 7#上的羟基在紫外光裂解下被·H所取代,并进一步发生哌嗪环裂解生成酰胺类物质(产物 5#).
在路径II作用下,环丙沙星氟喹诺酮基团上的羧酸基团被紫外光裂解,与母体脱离,在紫外活化后·H的作用下形成产物3#,试验中未检测到产物 3#的后续反应产物,表明其性质较为稳定.
在路径III作用下,·SO4-攻击环丙沙星哌嗪基团,在H2O的共同作用下,使其发生邻位及间位上的羟基取代,生成产物10#及产物12#,一方面产物10#在经历对位C=O键加成后(产物 16#),经过开环裂解反应,最终生成有机产物 1#[23].另一方面产物 12#在继续氧化生成酰胺类物质(产物 8#)后,经脱去C=O,生成产物 4#,而产物 4#又可以直接脱氨基生成产物 1#.
在路径IV作用下,氟喹诺酮基团C—N六元环在发生羟基取代生成产物 11#后,进一步发生开环反应及脱羰基反应,分别生成中间产物 A及产物6#,在继续失去一个C原子后,产物 6#经过不稳定中间产物 B的过渡,最终生成了产物 2#[24].
3 结 论
紫外激活过硫酸盐工艺能够快速有效地降解水中典型的氟喹诺酮类抗生素环丙沙星,且在pH 9.0 条件下降解速率最快.采用前线电子轨道理论及液相色谱-串联质谱方法检测结果表明,UV/PS工艺降解CIP可产生包括醇类、酚类、酰胺类及酮类在内的13种降解产物,降解产物主要集中在哌嗪基团及氟喹诺酮基团上.UV/PS工艺降解环丙沙星的降解包含多个路径:其中包括紫外光子攻击氟喹诺酮上的C-F和羧酸基团键,使其活化,并发生脱羟基及脱羧基等反应;·SO4-攻击环丙沙星哌嗪基团发生不同位的羟基取代反应;·SO4-攻击环丙沙星的氟喹诺酮基团发生羟基取代及后续氧化反应,并最终导致开环裂解反应.
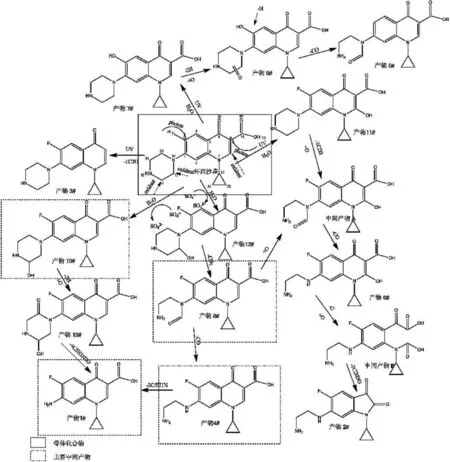
图4 UV/Na2S2O8 工艺降解CIP机理图Fig.4 Proposed Pathways of ciprofloxacin degradation by UV/Na2S2O8 process
[1] WAMMER K H,KORTE A R,LUNDEEN R A,etal.Direct photochemistry of three fluoroquinolone antibacterials:Norfloxacin,ofloxacin,and enrofloxacin[J].Water Research,2013,47(1):439-448.
[2] GE L K,CHEN J W,WEI X X,etal.Aquatic photochemistry of fluoroquinolone antibiotics:kinetics,pathways,and multivariate effects of main water constituents[J].Environmental Science & Technology,2010,44(7):2400-2405.
[3] 范长征,王聪,鲁伦慧,等.湘江四环素及抗性基因含量特征及其季节变化[J].湖南大学学报:自然科学版,2015,42(6):107-112.
FAN Changzheng,WANG Cong,LU Lunhui,etal.Occurrence and seasonal changes of tetracycline antibiotic resistance genes in the Xiang River[J].Journal of Hunan University:Natural Sciences,2015,42(6):107-112.(in Chinese)
[4] EPOLD I,TRAPIDO M,ULOVA N.Degradation of levofloxacin in aqueous solutions by Fenton,ferrous ion-activated persulfate and combined Fenton/persulfate systems[J].Chemical Engineering Journal,2015,279:452-462.
[5] STURINI M,SPELTINI A,MARASCHI F,etal.Photolytic and photocatalytic degradation of fluoroquinolones in untreated river water under natural sunlight[J].Applied Catalysis B-Environmental,2012,119:32-39.
[6] WANG P,HE Y L,HUANG C H.Oxidation of fluoroquinolone antibiotics and structurally related amines by chlorine dioxide:Reaction kinetics,product and pathway evaluation[J].Water Research,2010,44(20):5989-5998.
[7] WATKINSON A J,MURBY E J,COSTANZO S D.Removal of antibiotics in conventional and advanced wastewater treatment:Implications for environmental discharge and wastewater recycling[J].Water Research,2007,41(18):4164-4176.
[8] MARTINEZ L J,SIK R H,CHIGNELL C F. Fluoroquinolone antimicrobials:Singlet oxygen,superoxide and phototoxicity[J].Photochemistry and Photobiology,1998,67(4):399-403.
[9] WALDEMER R H,TRATNYEK P G,JOHNSON R L,etal.Oxidation of chlorinated ethenes by heat-activated persulfate:Kinetics and products[J].Environmental Science & Technology,2007,41(3):1010-1015.
[10]CHU W H,HU J L,BOND T,etal.Water temperature significantly impacts the formation of iodinated haloacetamides during persulfate oxidation[J].Water Research,2016,98:47-55.
[11]施周,衣启航,卜令君.镍铁氧体催化过硫酸氢钾对奥卡西平的降解研究[J].湖南大学学报:自然科学版,2016,43(6):124-129.
SHI Zhou,YI Qihang,BU Lingjun.Catalyzingperoxymonosulfate by NiFe2O4for oxcarbazepine degradation[J].Journal of Hunan University:Natural Sciences,2016,43(6):124-129.(In Chinese)
[12]GUO H G,GAO N Y,YANG Y,etal.Kinetics and transformation pathways on oxidation of fluoroquinolones with thermally activated persulfate[J].Chemical Engineering Journal,2016,292:82-91.
[13]TAN C Q,GAO N Y,DENG Y,etal.Degradation of antipyrine by heat activated persulfate[J].Separation and Purification Technology,2013,109(19):122-128.
[14]TAN C Q,GAO N Y,DENG Y,etal.Radical induced degradation of acetaminophen with Fe3O4magnetic nanoparticles as heterogeneous activator of peroxymonosulfate[J].Journal of Hazardous Materials,2014,276(9):452-460.
[15]FANG G D,DIONYSIOU D D,ALABED S R,etal.Superoxide radical driving the activation of persulfate by magnetite nanoparticles:Implications for the degradation of PCBs[J].Applied Catalysis B-Environmental,2013,129(6):325-332.
[16]GUO H G ,GAO N Y,CHU W H,etal.Photochemical degradation of ciprofloxacin in UV and UV/H2O2 process:kinetics,parameters,and products[J].Environmental Science and Pollution Research,2013,20(5):3202-3213.
[17]VANDOORSLAER X,DEMEESTERE K,HEYNDERICKX P M,etal.UV-A and UV-C induced photolytic and photocatalytic degradation of aqueous ciprofloxacin and moxifloxacin:Reaction kinetics and role of adsorption[J].Applied Catalysis B-Environmental,2011,101(3/4):540-547.
[18]郭洪光,高乃云,张永吉,等.水中环丙沙星的UV 及UV /H2O2光化学降解[J].沈阳工业大学学报,2011,34(4):468-475.
GUO Hongguang,GAO Naiyun,ZHANG Yongji,etal.UV and UV/H2O2photochemical degradation of ciprofloxacin in aqueous solution[J].Journal of Shenyang University of Technology,2011,33(4):468-475.(In Chinese)
[19]AVISAR D,LESTER Y,MAMANE H.pH induced polychromatic UV treatment for the removal of a mixture of SMX,OTC and CIP from water[J].Journal of Hazardous Materials,2010,175(1/3):1068-1074.
[20]CEKLI S,WINKEL R W,SCHANZE K S.Effect of oligomer length on photophysical properties of platinum acetylide donor-acceptor-donor oligomers[J].Journal of Physical Chemistry A,2016,120(28):5512-5521.
[21]FURMAN O S,TEEL A L,WATTS R J.Mechanism of base activation of persulfate[J].Environmental Science & Technology,2010,44(16):6423-6428.
[22]PEREIRA V J,WEINBERG H S,LINDEN K G,etal.UV degradation kinetics and modeling of pharmaceutical compounds in laboratory grade and surface water via direct and indirect photolysis at 254 nm[J].Environmental Science & Technology,2007,41(5):1682-1688.
[23]DEWULF J,WITTE B DE,DEMEESTERE K,etal.Ozonation and advanced oxidation by the peroxone process of ciprofloxacin in water[J].Journal of Hazardous Materials,2009,161(2/3):701-708.
[24]PAUL T,DODD M C,STRATHMANN T J.Photolytic and photocatalytic decomposition of aqueous ciprofloxacin:Transformation products and residual antibacterial activity[J].Water Research,2010,44(10):3121-3132.
Products and Mechanism Analysis of Ciprofloxacin Degradation inWater by UV-activated Persulfate
GUO Hongguang1,2†,LIU Yang1,KE Tingling1,ZHAO Chengwei1,TANG Weihong1
(1. College of Architecture and Environment,Sichuan University.,Chengdu 610065,China;2.State Key Laboratory of Pollution Control and Resources Reuse,Tongji University,Shanghai 200092,China)
Long-term ecological and physiological toxicity caused by the residuals of fluoroquinolones (FQs) in the aquatic environment has raised much attention. Ciprofloxacin as a typical FQs was degraded by UV-activated persulfate,which was a new advanced oxidation technology. The degradation products were characterized using qualitative and quantitative methods,and the detailed degradation mechanism and pathways of ciprofloxacin by UV/persulfate were proposed by using the analysis results of quantum chemistry and mass spectra. The results revealed that the optima condition for CIP degradation was pH 9.0. After a 30 min reaction,13 intermediates were identified in the solutions,including alcohols,phenols,ketones and amides. The concentrations of several intermediates exhibited an up-and-down trend. Oxidations mainly occurred at the C-F bond and carboxylic acid on quinolone group,as well as piperazine group. The degradation of CIP by UV/PS mainly included four pathways,and a series of defluorination,photolysis,substitution,addition and deamination were observed,leading to the final open-ring reaction of target compound.
fluoroquinolones; persulfate; ultraviolet activation; mechanism; products
1674-2974(2017)06-0150-07
10.16339/j.cnki.hdxbzkb.2017.06.024
2016-10-25
国家自然科学基金资助项目(51508354),National Natural Science Foundation of China (51508354);国家博士后科学基金资助项目(2016M590888),National Science Foundation for Post-doctoral Scientists of China(2016M590888);成都市科技局资助项目(2015-HM01-00502-SF)
郭洪光(1986-),男,黑龙江嫩江人,四川大学副教授,博士†通讯联系人,E-mail: hgguo@scu.edu.cn
X131.2
A
