抗氧化剂对精子质量影响的研究进展
2017-07-18方南洙李钟淑徐礼杰李福俊
周 晶,方南洙,李钟淑,徐礼杰,李福俊
(延边大学农学院畜牧学系,吉林延吉 133000)
抗氧化剂对精子质量影响的研究进展
周 晶,方南洙*,李钟淑,徐礼杰,李福俊*
(延边大学农学院畜牧学系,吉林延吉 133000)
为提高优良公畜的利用率并获得大量高质量的胚胎,畜牧业引入体外授精技术。体外授精技术成功的关键因素之一是精液保存,精液长期保存的方法主要是冷冻保存。然而,冷冻容易使精子受到氧化应激损伤。其中一个原因是体外的精子缺乏机体内氧化-抗氧化体系的保护;另外冷冻会刺激精液产生过量的活性氧(ROS)组分,二者均能削弱精子的抗氧化能力,导致精子的结构和功能受到损伤。ROS是造成氧化应激的关键因素之一,它会影响精子质量,进一步降低胚胎成活率,最终导致动物繁殖能力下降。针对这一问题,科学工作者已研究了大量的改进措施,如添加抗氧化剂、改善精液储存的环境条件,或二者协同处理。目前,抗氧化药物已在体外受精领域取得很大的新突破,但精子受到氧化损伤的问题还未完全解决,本文就目前精子抗氧化方面的研究作一综述。
精子;体外受精;氧化应激;抗氧化剂
体外受精(In Vitro Fertilization,IVF)是借助人工操作让精子和卵子在体外环境中完成受精过程的一项技术。IVF技术可以给动物繁殖提供数量更多、成本更低的胚胎,不仅能开发优良母畜的繁殖潜力,同时加速了良种公畜的育种进程。然而IVF技术中用于体外受精精子的保存条件难以控制。若保存条件不佳,精子的质量就会下降,从而导致受精率降低以及胚胎发育不良。例如,环境中活性氧(ROS)含量持续升高会产生氧化应激(Oxidative Stress,OS),精子在这种条件下保存就可能导致其质量下降。雄性生殖器官的新陈代谢是处于不断产生的ROS条件下,在交配过程中精子也必经过高氧环境,因此,为了保护雄性生殖能力,必须重视氧化应激保护机制[1]。睾丸组织自身含有抗氧化酶体系,并且它们是清除ROS的主力军,因此,精子在生物体内几乎不受到OS。但是在体外环境中,由于温度和光照等因素,使精子容易遭受OS。因此,要在家畜生产上提高IVF效率,首先要解决精子在体外环境中的氧化损伤,本文将从以下几个方面进行综述。
1 精子与氧化应激作用
1.1 ROS及其对精子的有益作用 ROS是指生物体内含氧且具有较强氧化还原活性的自由基和非自由基氧的衍生物。ROS是生物正常有氧代谢过程中产生的一系列副产物,主要包括超氧阴离子(O2-)、过氧化氢(H2O2)、羟自由基(OH-)、一氧化氮(NO-)等。因为核外有未配对的电子存在,所以具有很强的化学反应活性。在精子结构和功能成熟的生理过程中,ROS的生成是有益的[2]。如图1所示,ROS(主要是H2O2)是通过催化磷酸酯酶的氧化灭活来控制高活性半胱氨酸巯基(Cys-SH)的催化中心,进一步保证细胞的连续增殖,由于体内研究数据的逐渐积累,表明相同的机制也可能适用于生殖系统中[3]。由此可知,ROS信号转导可能有助于维持精子体内的稳态,还能促进精子发生细胞的生长。此外,精子在体外保存过程中,呼吸代谢产生的少量而持续的ROS可以诱发精子超激活运动并获能[4],参与相关的酪氨酸磷酸化活动,并且ROS水平的变化还能调节细胞凋亡和精子获能2个过程之间的平衡[5]。

图1 ROS信号功能共识机制的总结
1.2 OS对精子的危害 精子离开体内的抗氧化系统后,精子体内代谢机制异常,ROS水平会不断上升,其氧化速度超过氧化物的清除速度,导致氧化-还原体系失衡,最终造成精子遭受OS[6]。OS是由ROS生产不平衡造成的,即细胞内氧化和抗氧化系统之间的稳态被破坏。ROS不仅能减少抗氧化酶的活性,还能损伤线粒体DNA(mtDNA)。mtDNA是线粒体膜的电子传递链上必不可少的一种多肽,密切参与线粒体的氧化磷酸化和ATP的生成,因此mtDNA缺陷将导致线粒体膜电位下降,从而使氧化还原平衡更趋向于OS,最终,对精子造成不可逆的伤害。OS会损伤精子发生的细胞、精子发生的过程以及精子功能。OS对精子发生细胞最直接的危害是破坏其内部结构,现在已有20多种不同类型的结构损伤已被确认[7](图2)。精子发生对温度十分敏感,因此热休克蛋白(HSP70)与哺乳动物精子生成密切相关,有研究表明,OS会影响精子发生过程中HSP70的表达[8]。ROS浓度超标会干扰精子的代谢,导致多不饱和脂肪酸质膜发生脂质过氧化,进而降低精子能动性;还会影响精子的受精能力,具体表现为顶体反应能力下降[9]。
2 精子的抗氧化原理
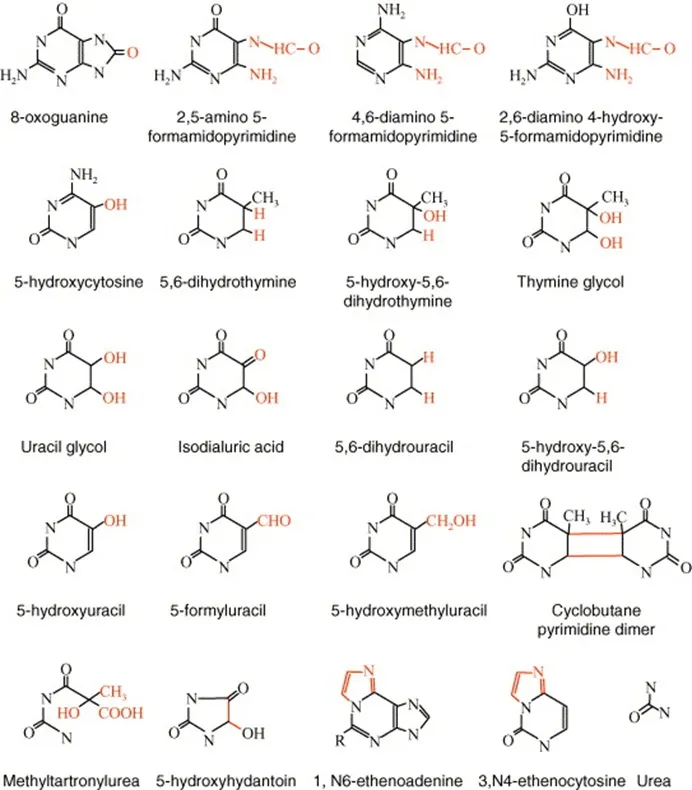
图2 内源性ROS造成含氮碱基的氧化和环基碎裂
在体内,精子本身具有氧化还原能力,例如,能量供应和氧化还原电位对维持液态保存精液中的精子功能是必不可少的。有研究表明,哺乳动物的精子通过糖酵解、糖酵解结合线粒体三羧酸循环或三羧酸循环结合磷酸戊糖途径获得的能量均可使精子产生极大的氧化还原能力[10]。但Qiu等[11]研究发现,在维持山羊精子运动性时,磷酸戊糖途径比糖酵解更重要,因为磷酸戊糖途径可以减少精子OS并为糖酵解提供更多的中间产物。此外,还有报道证明,通过柠檬酸循环获得能量能维持牛精子的运动性,但对小鼠精子无影响[12]。精子自身还能修复ROS的损伤,主要包括脂肪酶、蛋白酶及其他酶类对损伤分子进行修复。但有研究表明,只有当ROS对精子DNA造成的损伤程度轻时,其自身修复功能才会自动开启[13]。

图3 哺乳动物体内的抗氧化机制
在动物体内生殖组织中也存在氧化-还原平衡体系,受到ROS刺激时抗氧化机制就会被启动,降低精子受到氧化损伤的程度。哺乳动物体内进化出几种减少氧化应激和降低ROS损伤的抗氧化机制(图3):一个是由酶和低分子量化合物(如维生素)组成的抗氧化系统,这个系统在有害ROS有机会接触其他重要分子并终止后续连锁反应之前将其清除;另一个是氧化还原系统,这个系统不仅能清除有害氧化物,还能不断地恢复已氧化的分子[1]。精子发生过程中新陈代谢高度活跃,这表明生殖系统本身就能产生高水平的ROS。因此在生殖道上皮细胞和睾丸支持细胞上经常出现高含量水平的氧化还原分子,如AKR(Aldo-Keto Reductases)是醛-酮还原酶,能减轻羰基化合物产生的氧化应激[14]。
3 抗氧化剂对精子的影响
抗氧化剂主要是消除或减弱ROS对精子的刺激,通过阻止自由基链的生成和蔓延来减少OS造成的损伤。选用抗氧化剂时要考虑不能完全清除ROS,为防止细胞受到氧化压力,就要维持细胞内正常生理水平的ROS[15]。
3.1 提高精液质量 液态保存法常用于精子生理结构特殊的动物精液的储存。例如,猪精液常采用液态保存法,原因是猪精子质膜上不饱和脂肪酸含量高,对温度变化极为敏感,若温度降低直接会影响精子的质量,因此冷冻保存不能满足对猪受精质量的要求。然而,在液态保存条件下,精子易受到OS。针对这一问题,刘亚伟[16]做了相关实验,用α-硫辛酸、维生素-P和L-肉碱3种抗氧化剂对液态保存的精液进行处理,结果发现3种抗氧化剂均能不同程度地提高精液的活率、活力、顶体完整性、质膜完整率和线粒体活性等指标,还降低脂质过氧化水平。许春荣等[17]发现,0.01 mmol/L褪黑素可以提高猪精液液态保存后的品质,1 mmol/L多巴胺有利于猪精子的液态保存。Eslami等[18]研究了公羊精液的液态保存,发现棕榈油酸可以作为一种抗氧化剂来保护精子免受损伤,用它处理72 h可以显著提高精子的活力和运动能力,并且通过PCR测定进一步证明榈油酸可以提高精子的抗氧化水平及超氧化物歧化酶(SOD)活性。
通常各类保存的精液冷冻-解冻后质量都会下降,包括活率和活力的降低以及精子DNA完整性的破坏。因此,经冷冻-解冻后的精液也需要抗氧化剂的保护来提高精液质量。Pang等[19]研究结果显示,1 mmol褪黑素可以提高牛冷冻-解冻精液的质量。肉碱是一种强大的抗氧化剂,在冷冻-解冻后的精液中补充7.5 mmol的肉碱能通过促进线粒体ATP的生成而减少ROS的产生,进而改善水牛精子质量,但对体外受精能力没有任何作用[20]。用5 mmol的精胺处理冷冻-解冻后的精液时,能有效地清除精子内的ROS,防止细胞凋亡,维持精子功能[21]。
3.2 延长精子的寿命 精液稀释液可以维持精子在体外保存过程中的受精能力并延长其存活时间,根据用途和性质可分为现用稀释液、常温稀释液、低温稀释液和冷冻保存稀释液4种。在稀释液中添加抗氧化剂可提高稀释液对精子的抗氧化保护能力。Cheema等[22]研究表明,在精液冷冻稀释液中添加150 μmol的化学物质锰可以给精子提供抗氧化的保护,延长精子寿命,提高体外受精和人工授精的成功率。稀释液中添加0.8%卵磷脂可显著提高精子的运动力和生育能力,并降低精子的形态异常率,结果表明卵磷脂是精液冷冻保存后稀释液的增强剂,可作为保护长期储存冷冻精液寿命的一个工具[23]。盐酸-半胱氨酸和抗坏血酸2个抗氧化添加剂混合添加到精液稀释液中可以提高-196℃低温保存的水牛精子的质量参数,减少天冬氨酸转氨酶、乳酸脱氢酶和碱性磷酸酶等在精液中的泄露,进而延长水牛精子的寿命[24]。维生素C和维生素E作为抗氧化剂添加到精液稀释液中,可以显著提高冷冻后精子的寿命和质量,Azawi等[25]用Awassi公羊的精液进行实验验证了这一结论。
3.3 提高精子受精率 受精率的高低取决于精液的质量,而精子质量的评估指标之一是精子DNA碎片指数(DNA Fragmentation Index,DFI)。DFI是代表精子DNA损伤程度的参数,它受ROS和抗氧化剂之间平衡的影响[26]。在精子总碱性磷酸酶(TALP)介质中加入10 μg/mL氯化锌、500 μg/mL D-天冬氨酸盐(D-Asp)和40 μg/mL辅酶Q10,可以有效防止精子能动性的损失,降低DFI,此外,在精液中添加这些抗氧化剂可以提高精子受精率,并使受精后胚胎的囊胚发育率显著高于对照组[27]。抗氧化剂的确可以提高精子的受精率,但是只有添加适当的剂量才能发挥其作用。白藜芦醇(Res)和儿茶素-3-没食子酸酶(EGCG)是2种具有高水平抗氧化活性的抗氧化剂。Gadani等[28]实验表明,在解冻的猪精液中添加25 μmol/L或50 μmol/L EGCG,精子受精率显著高于对照组和其他浓度处理组;同时,添加2 mmol/L的Res也可以观察到相同的效果。也有研究表明,抗氧化剂褪黑素虽然能影响精液质量和生育能力,但是对精液受精率无影响[29]。
3.4 提高胚胎发育效率 动物体外受精最终的目的是获得质量好的胚胎,ROS造成的OS不仅会扰乱精子的受精潜力,还会减弱这些细胞创造出一个正常健康胚胎的能力[30]。因此要保证体外受精的精子免受氧化损伤,目前研究中常采用添加抗氧化剂来达到此目标。例如超氧化物歧化酶模拟剂(MnTE)具有抗氧化作用,这种抗氧化剂可通过细胞的渗透行为来保护精子免受ROS诱导的基因组DNA损伤。Mohsen等[31]实验结果表明,在冷冻-解冻的山羊精液中添加0.1 μmol MnTE可以显著提高膜的完整性,而在冷冻的精液中补充0.01 μmol MnTE,发现解冻后精子的顶体完整性显著高于对照组和其他浓度处理组,同时还能提高囊胚形成率和孵化率。
4 结 语
近年来,动物繁殖率日益下降,虽已有大量关于提高精子性能的研究及改进措施,但精子的氧化现象仍很严峻,需要继续进行精子抗氧化方面的研究。目前,在畜牧业中,最简单有效的解决办法就是使用抗氧化剂。确定氧化应激的诱因及其作用机制,才能合理选择抗氧化剂种类并更好地利用其来改善精子的抗氧化损伤,提高体外受精的成功率。
[1] Fujii J, Iuchi Y, Matsuki S, et al. Cooperative function of antioxidant and redox systems against oxidative stress in male reproductive tissue[J]. Asian J Androl, 2003, 5:231-242.
[2] Stanescu M, Bîrtoiu A I. Comparative studies of canine semen freezing protocols[J]. Bull UASVM Vet Med, 2010, 67:290-215.
[3] Fujiii J, Tsunoda S. Redox regulation of fertilization and the spermatogenic process[J]. Asian J Androl, 2011, 13(3):420-423.
[4] Guthrie H D, Welch G R. Eects of reactive oxygen species on sperm function[J]. Theriogenology, 2012, 78:1700-1708.
[5] Del Olmo E, Garcia-Alvarez O, Maroto-Morales A, et al. Oestrous sheep serum balances ROS levels to supply in vitro capacitation of ram spermatozoa[J]. Reprod Domest Anim, 2016, 51(5):743-750.
[6] Du Plessis S S, Agarwal A, Halabi J, et al. Contemporary evidence on the physicological role of reactive oxygen species in human sperm function[J]. J Assist Reprod Genet, 2015, 32(4):509-520.
[7] Slupphaug G, Kavli B, Krokan H E. The interacting pathways for prevention and repair of oxidative DNA damage[J]. Mutat Res, 2003, 531(1-2):231-251.
[8] Kaur P, Bansal M P. Effect of oxidative stress on the spermatogenic process and hsp70 expressions in mice testes[J]. Indian J Biochem Biophys, 2003, 40(4):246-251.
[9] Moazamian R, Polhemus A, Connaughton H, et al. Oxidative stress and human spermatozoa:diagnostic and functional significance of aldehydes generated as a result of lipid peroxidation[J]. Mol Human Reprod, 2015, 21(6):502-515.
[10] Rodriguez-Gil J E. Mammalian sperm energy resources management and survival during conservation in refrigeration [J]. Reprod Domest Anim, 2006, 41(suppl 2):11-20.
[11] Qiu J H, Li Y W, Xie H L, et al. Effects of glucose metabolism pathways on sperm motility and oxidative status during long-term liquid storage of goat semen[J]. Theriogenology, 2016, 86:839-849.
[12] Mukai C, Okuno M. Glycolysis plays a major role for adenosine triphosphate supplementation in mouse spermagellar movement[J]. Biol Reprod, 2004, 71:540-547.
[13] 夏春梅, 吴中红, 张林波, 等. 氧化应激和抗氧化剂对精子生理过程影响的研究进展[J]. 畜牧与兽医, 2011, 43(9):95-100.
[14] Wallner E I, Wada J, Tramonti G, et al. Relevance of aldoketo reductase family members to the pathobiology of diabetic nephropathy and renal development[J]. Ren Fail, 2001, 23:311-320.
[15] Ko E Y, Sabanegh E S Jr, Agarwal A. Male infertility testing:reactive oxygen species and antioxidant capacity[J]. Fertil Steril, 2014, 102:1518-1527.
[16] 刘亚伟. α-硫辛酸、维生素-P和L-肉碱对猪精液常温和低温保存效果的研究[D]. 杨凌: 西北农林科技大学, 2014.
[17] 许春荣, 朱银莉, 胡传水, 等. 褪黑素及多巴胺对猪精液液态保存效果的影响[J]. 繁殖生理, 2014, 50(9):29-31.
[18] Eslami M, Ghasemiyan H, Zadeh Hashem E. Semen supplementation with palmitoleic acid promotes kinematics, microscopic and antioxidative parameters of ram spermatozoa during liquid storage[J]. Reprod Domest Anim, 2017, 52:49-59.
[19] Pang Y W, Sun Y Q, Jiang X L, et al. Protective eects of melatonin on bovine sperm characteristics and subsequent in vitro embryo development[J]. Mol Reprod Dev, 2016, 83 (11) :993-1002.
[20] Longobardi V, Salzano A, Campanile G, et al. Carnitine supplementation decreases Capacitation-like changes of frozen-thawed buffalo sper-matozoa[J]. Theriogenology, 2016, 9:1-8.
[21] Setyawan E M, Kim M J, Oh H J, et al. Sperminereduces Reactive oxygen species level and decreases cryocapacitation in canine sperm cryopreservation[J]. Biochem Bioph Res Co, 2016, 47(9):927-932.
[22] Cheema R S, Bansal A K, Bilaspuri G S. Manganese provides antioxidant protection for sperm cryopreservation that may offer new consideration for clinical fertility[J]. Oxid Med Cell Longev, 2009, 2(3):152-159.
[23] Kmenta I, Strohmayer C, Muller-Schlosser F, et al. Eects of a lecithin and catalase containing semen extender and a second dilution with different enhancing buffers on the quality of cold-stored canine spermatozoa[J]. Theriogenology, 2011,75(6):1095-10103.
[24] Patel H A, Siddiquee G M, Chaudhari D V, et al. Effect of different antioxidant additives in semen diluent on cryopreservability (-196℃) of bualo semen[J].Vet World, 2016, 9(3):299-303.
[25] Azawi O I, Hussein E K. Effect of vitamins C or E supplementation to Tris diluent on the semen quality of Awassi rams preserved at 5℃[J]. Vet Res Forum, 2013, 4 (3):157-160.
[26] Bungum M, Bungum L, Giwercman A. Sperm chormatin structure assay (SCSA): a tool in diagnosis and treatment of infertility[J]. Asian J Androl, 2011, 13:69-75.
[27] Gualtieri R, Barbato V, Fiorentino I, et al. Treatment with zinc,D-aspartate,and coenzyme Q10 protects bull sperm against damage and improves their ability to support embryo development[J]. Theriogenology, 2014, 82(4):592-598.
[28] Gadani B, Bucci D, Spinaci M, et al. Resveratrol ang Epigallocatechin-3-gallate addition to thawed boar sperm improves in vitro fertilization[J]. Theriogenology, 2017, 90:88-93.
[29] Malm G, Haugen T B, Rylander L, et al. Seasonaluctuation in the secretion of the antioxdant melatonin is not associated with alterations in sperm DNA damage[J]. Asian J Androl, 2017, 19(1):52-56.
[30] Aitken R J, De luliis G N, Finnie J M, et al. Analysis of the relationships between oxidative stress, DNA damage and sperm vitality in a patient population: development of diagnostic criteria[J]. Hum Reprod, 2010, 25:2415-2416.
[31] Forouzanfar M, Abid A, Hosseini S M, et al. Supplementation of sperm cryopreservation media with cell permeable superoxide dismutase mimetic Agent (MnTE) improves goat blastocyst formation[J]. Cryobiology, 2013, 67(3):394-397.
Research Progress on Antioxidant Ef f ect of on Sperm Quality
ZHOU Jing, FANG Nan-zhu*, LI Zhong-shu, XU Li-jie, LI Fu-jun*
Animal husbandry technology introduced in vitroertilization to increase the utilization rate ogenetically and phenotypically improve sire and to obtain high number ogood quality embryos. One othe keyactors osuccessul in vitroertilization is semen preservation. cryopreservation is one othe best methodor long-term preservation osemen. However preservation easily produce oxidative stress which is harmulor sperm . One othe main reasonor this is that in vitro sperm lack the oxidant-antioxidant system protection othe body; Second reason is that the preservation process stimulates the overproduction oreactive oxygen. Both condition weaken sperm antioxidant ability and lead to structural andunctional damage othe sperm. One othe keyactors ooxidative stress is reactive oxygen species(ROS), which aect the quality osperm, reduce the survival rate oembryos and decline the animal reproduction ability. To solve this problem, scientically a large number oimprovement measures have been studied such as adding antioxidants, improving conditionsor semen storage environment, or both etc. At present, in theeld oin vitroertilization antioxidant drug has made a lot onew breakthroughs, but oxidative damage with sperm has not beenully solved. In this paper, we summarized the antioxidative eect on semen preservation.
Sperm; in vitroertilization; Oxidative stress; Antioxidant
S814.1
:A
:10.19556/j.0258-7033.2017-07-013
2017-02-22;
2017-04-23
国家自然科学基金项目(31360546)
周晶(1993-),女,吉林大安人,硕士研究生,主要从事动物遗传育种与繁殖研究,E-mail:1021825630@qq. com
* 通讯作者:李福俊,男,吉林龙井人,讲师, E-mail:fujun li66@hotmail.com ;方南洙,男,教授, E-mail:nzfang@ ybu.edu.cn
