抗Aβ42单链抗体对阿尔茨海默病小鼠脑中淀粉样沉积的改善作用
2017-07-18方勇涛陈晓云
刘 秦 方勇涛 陈 源 陈晓云
(广州医科大学附属第一医院神经内科,广东 广州 510000)
抗Aβ42单链抗体对阿尔茨海默病小鼠脑中淀粉样沉积的改善作用
刘 秦 方勇涛1陈 源2陈晓云3
(广州医科大学附属第一医院神经内科,广东 广州 510000)
目的 探讨以β淀粉样蛋白(Aβ)42为靶抗原筛选人源天然单链抗体(scFv)噬菌体抗体库中的特异性抗体对阿尔茨海默病(AD)模型鼠中淀粉样沉积的影响。方法 以Aβ42抗原包被免疫管,对人源天然scFv噬菌体抗体库进行筛选,经过3轮吸附-洗脱-扩增淘选富集,制备单克隆噬菌体抗体颗粒,用酶联免疫吸附(ELISA)法检测scFv的结合活性,得到一株阳性克隆scFv23。采用Western印迹和免疫组化的方法检测了scFv23与Aβ42单体、寡聚体、纤维和鼠脑中Aβ沉积的结合能力。并通过甲氮甲唑蓝(MTT)法检测scFv23对Aβ42寡聚体引起细胞毒性的影响,同时采用硫黄素-T荧光法(ThT-F)测定scFv23对Aβ42聚集形成纤维的影响。最后,通过体内实验检测了scFv23对AD鼠模型脑中Aβ42沉积的影响。结果 通过对人源天然scFv噬菌体抗体库进行筛选得到一株与Aβ42具有高亲和力的克隆scFv23。实验发现scFv23可以特异性识别Aβ42寡聚体,纤维聚集体和鼠脑中Aβ42沉积,但是不能与Aβ42单体特异性结合。根据体外实验结果,scFv23可以有效抑制Aβ42寡聚体所诱导的细胞死亡,并且scFv23可以抑制Aβ42纤维聚集体的形成。体内实验结果发现,scFv23可以有效清除AD鼠模型中Aβ42沉积。结论 通过噬菌体文库筛选得到的scFv23能够特异性识别脑组织中的淀粉样沉积,并且有效抑制转基因鼠中淀粉样沉积的形成。体外实验表明scFv23可以有效抑制Aβ42寡聚体所诱导的细胞毒性。特异性识别Aβ42的scFv可能会成为治疗AD的一种有效策略。
阿尔茨海默病;β淀粉样蛋白;单链抗体;免疫治疗
阿尔茨海默病(AD)是一个与年龄有很大关系的神经退行性疾病〔1〕。β淀粉样蛋白(Aβ)积累形成的老年斑(SP)和tau蛋白的过度磷酸化形成的神经纤维缠结(NFT)是病理上的主要特征〔2〕。淀粉样沉积的主要组成是Aβ肽段。Aβ与其前体蛋白(APP)在AD的病理过程中发挥着重要作用,在转基因鼠中过度表达突变的APP可以导致类似AD的病理学特征:β淀粉样沉积。研究发现通过向这些AD模型鼠中注射合成的Aβ1~42肽段可以阻止和减轻脑内的Aβ沉积,并且缓解记忆和学习能力的丢失〔3〕。临床试验表明,当用Aβ肽段免疫患者的时候会引起患者脑内的炎症反应,这使临床试验不得不中止,而这种炎症反应可能是由T细胞或者Fc所介导的免疫反应〔4〕。与此同时,人们发现用Aβ抗体去免疫AD模型鼠同样会引起脑中Aβ沉积的清除〔5〕。但是,尽管抗体的浓度低于血清浓度,还是会引起炎症反应。随后人们选择用只包含F(ab′)2的抗体片段去免疫AD鼠模型,人们发现免疫后的小鼠脑中的Aβ沉积被有效清除〔6〕。这说明不包含有Fc片段的抗体对于清除Aβ沉积也有效果。这使得不包含Fc片段的抗体成为了一个可能治疗AD的策略。
在本研究中,通过用Aβ与人源的单链抗体库进行杂交,筛选出能与Aβ寡聚体和大脑中淀粉样斑块特异性反应的单链抗体。这个单链抗体可以抑制Aβ纤维聚集体的形成并且抑制Aβ介导的神经毒性;并且检测了人源单链抗体在AD鼠模型中的作用。由于单链抗体中缺少Fc片段,所以人源单单抗体在用于治疗AD患者的过程中可能不会伴有脑内的炎症反应。本研究就此问题进行观察分析。
1 材料和方法
1.1 主要的试剂及材料 植物乙烯(ETH-2) human antibody phage library购自MRC HGMP Resource Centre,Cambridge UK。大肠杆菌(TG1)购自STRATGENE公司;辅助噬菌体(M13K07)购自Invitrogen公司;Aβ(1~42)肽、六氟异丙醇(HFIP)购自Sigma公司;辣根过氧化物酶(HRP)-anti-M13抗体,6E10,anti-His抗体,抗兔IgG,生物素抗兔二抗,HRP标记链亲和素购买自Santa Cruz;HRP标记的增强型化学发光试剂(碧云天);3,3′,5,5′-四甲基联苯胺(TMB),噻唑蓝(MTT),二氨基联苯胺(DAB)试剂盒购买自Sigma公司;免疫管(Immuno-tube)购自丹麦NUNC公司;人胚肾细胞株(HEK293)细胞购于German Collection of Microorganisams and Cell Cultures;青霉素和链霉素购买自Sigma公司;胎牛血清(BSA)和DMEM培养基购买于GIBCO,Tg2576转基因鼠购买自北京博泰宏达生物技术有限公司。
1.2 细胞培养 人胚肾细胞293(HEK293)培养于添加10% BSA,1%青霉素和链霉素双抗,2 mmol/L谷氨酰胺的DMEM培养液中,放入5% CO2,37℃培养箱中培养。待细胞长到80%左右进行细胞传代培养,加入适量的磷酸盐缓冲液(PBS)清洗除去未贴壁的细胞,加入1 ml 0.25%的胰蛋白酶室温消化,细胞变圆后用弯头滴管加入新鲜的培养液吹打瓶壁进行细胞重悬,并对细胞进行计数,根据所做实验需要的细胞数对细胞进行稀释,将稀释后的细胞传到培养瓶,96孔板,24孔板或者6孔板进行培养。
1.3 Aβ单体和寡聚体的制备及鉴定 将Aβ1~42无菌条件下溶解于1 mg/ml的HIFP,水浴超声10 min,真空干燥,-20℃冻存。使用时将Aβ42用二甲基亚砜(DMSO)溶解至1 mg/ml,再将Aβ42稀释到终浓度为10 μmol/L的PBS中,终浓度为20 μmol/L,此条件下为Aβ42单体。在37℃孵育12 h,形成Aβ42寡聚体。然后通过透射电子显微镜观察确认其聚集状态。Aβ42单体和寡聚体的制备和聚集体结构的透射电镜形态参考文献〔7〕。由于Aβ42形成聚集体的不可逆性,Aβ42寡聚体的使用均为现用现制备,若短期使用置于-80℃储存。
1.4 抗Aβ单链抗体的淘选 包被4 ml的20 μg/ml的Aβ42寡聚体与5 ml的免疫试管中(包被液为PBS)4℃过夜。弃掉包被液,PBS洗涤3次。2%的脱脂牛奶室温封闭2 h,PBS洗3次。加入1012ETH-2噬菌体展示单链抗体文库,37℃孵育2 h。PBS(0.1% Tween20)洗涤10次。用1 ml 0.2 mol/L的甘氨酸-盐酸缓冲液(pH2.2)洗脱掉特异性结合的噬菌体,然后加入0.5 ml 1 mol/L的Tris·HCl(pH9.1)中和洗脱液。随后用洗脱下来的噬菌体感染大肠杆菌TG1(E.coli TG1)(OD600=0.4),37℃放置30 min,取出部分被感染的TG1进行10-4、10-3、10-2、10-1逐级稀释,涂布于TYE平板(100 μg/ml青霉素和1%葡萄糖)37℃过夜培养,测定洗脱下来的噬菌体滴度(cfu)。将余下感染的E.coli TG1涂布于TYE平板(同上),37℃过夜培养。第二天刮下平板上的菌落加到100 ml 2×TY(100 μg/ml青霉素和1%葡萄糖)中,用于扩增噬菌体。扩增后的噬菌体用辅助噬菌体M13K07挽救后用于第二轮淘选。如此进行3次淘选,然后进行ELISA鉴定。
1.5 单链抗体噬菌体的ELISA鉴定 淘选完成后,从噬菌体感染的E.coli TG1平板上随机挑选96个单菌落加到96孔板,每孔加入150 μl 2×TY(同上)培养基,37℃孵育12 h。每孔转移2 μl至新96孔板(含150 μl 2×TY培养基)继续培养,剩余放置4℃保存。于96孔板加入异丙基硫代半乳糖苷(IPTG),37℃培养2 h,加25 μl 2×TY(109cfu辅助噬菌体M13K07),培养30 min,1 800 r/min离心10 min,弃去上清。每孔加入180 μl 2×TY悬细菌沉淀,加入IPTG,37℃过夜培养。1 800 r/min离心10 min,取100 μl上清用于单链抗体ELISA。
Aβ42寡聚体(10 μg/ml)以100 μl/孔包被96孔板,4℃,16~18 h。弃抗原液,每孔加100 μl 1%的BSA,37℃封闭1 h。PBS(0.1%吐温-20)洗板3次,每孔加入100 μl上述收集的上清液,37℃孵育2 h。阳性对照孔中加入商品化的Aβ抗体B4,阴性对照孔中加BSA。PBS洗板6次。加入100 μl(1∶2 000)HRP-anti-M13抗体,37℃孵育1 h。PBS洗板六次。加入TMB 50 μl/孔,室温避光15 min,每孔加30 μl 2 mol/L H2SO4终止反应,酶标仪(ELX800,Bio-Tek)测OD值(波长为450 nm)。
1.6 单链抗体的表达纯化 挑取ELISA亲和性最高的噬菌体克隆,加到3 ml 2×TY培养基中,37℃培养至OD600约0.8,加入辅助噬菌体,37℃孵育30 min。3 300 r/min离心10 min,菌体重悬于1.5 ml 2×TY培养基,37℃培养,10 800 r/min 4℃离心30 min,收集上清。加入1/5体积PEG/NaCl(20% PEG6000,2.5 mol/L NaCl),混合后放置1 h以上,10 800 g,4℃离心10 min,去上清。沉淀重悬于300 μl PBS中,离心收集上清。将上述制备的阳性克隆噬菌体上清15 μl(约106pfu)感染200 μl处于对数生长期的HB2151。37℃水浴静置30 min。梯度稀释铺板,37℃过夜培养挑去生长良好的单克隆,将其接种于3 ml 2×TY培养基,37℃过夜培养。以1∶100的比例接种,37℃培养OD600约0.8后加入IPTG诱导表达,37℃过夜培养。1 800 r/min离心30 min收集上清。将收集到的上清通过组氨酸镍柱进行纯化。纯化后的单链抗体保存在-80℃。
1.7 免疫组化检测scFv23对鼠脑中Aβ42沉积的识别 12个月的Tg2576鼠的脑组织取出后于4%的多聚甲醛中浸泡24 h固定,然后经过脱水、透明、浸蜡、包埋,并制成5 μm厚度的切片。将切片固定载玻片上后进行干燥处理。将石蜡切片放入二甲苯(Ⅰ)(Ⅱ)中进行脱蜡,然后逐级放置于100%的纯酒精(Ⅰ)(Ⅱ)、95%、80%、70%的酒精和水中各5 min进行水化。水化后的片子放于3%的H2O2中室温孵育10 min,PBS洗涤3次。将片子放入柠檬酸缓冲液(0.01 mol/L,pH6.0)中,加热至沸腾改中火(92℃以上),室温下复温,PBS洗涤3次。吸干多余液体,滴加山羊血清封闭液,37℃孵育30 min。阳性实验组用6E10抗体处理切片,阴性对照组用PBS处理切片。实验组分别用scFv+Aβ42混合物和scFV孵育载玻片,4℃ 16 h。滴加anti-His抗体(1∶2 000)4℃过夜,取出后在37℃烤箱中复温30 min,用PBS洗3次。滴加生物素抗兔二抗,37℃孵育1 min,PBS洗涤3次。滴加HRP标记链亲和素,37℃孵育15 min,PBS洗涤3次。用DAB试剂盒进行显色,显色终止后清洗片子。滴加苏木素室温染液3 min,清水洗掉苏木素染液,盐酸酒精分化1 s,氨水返蓝5 min。将片子分别放入70%、80%的酒精各1 min,90%的酒精2 min,95%的酒精3 min,100%的酒精(Ⅰ)(Ⅱ)各3 min。二甲苯(Ⅰ)(Ⅱ)中各放置15 min,取出晾干后用中性树胶封片。每个标本以只滴加PBS的为阴性对照,在显微镜(CK30-F200,日本Olympus公司)下观察各切片着色。
1.8 Western印迹检测单链抗体对Aβ42单体,寡聚体,纤维的识别 4℃分离12个月Tg2576鼠的鼠脑,称重后按2.5 ml/g鼠脑中加入相当体积的冰生理盐水,匀浆器研磨组织后冰浴下超声波粉碎制成匀浆。4℃,10 000 r/min离心10 min,取上清。二喹啉甲酸(BCA)法测定蛋白质浓度。各组取30 μg总蛋白上样,经非变性聚丙烯酰胺凝胶电泳(Native-PAGE)分离后,转至聚偏氟乙烯(PVDF)膜上,80 V转膜 90 min。5%脱脂牛奶-PBS(0.1%Tween-20)封闭1 h,PBS洗膜。将膜置于杂交袋中,孵育制备的单链抗体,对照组加入6E10抗体(1∶1 000),室温杂交1 h后,PBS洗膜。将膜置于杂交袋中,实验组加入anti-His抗体(1∶1 000),室温杂交1 h后,PBS洗膜。加入HRP标记的IgG(羊抗鼠,1∶10 000),室温杂交1 h。洗膜后,采用辣根过氧化物酶标记的增强型化学发光法显色,显影于X光片上。
1.9 荧光染色(ThT-F)法检测单链抗体对Aβ42聚集的抑制作用 将Aβ42贮液(5 mmol/L)用PBS(pH7.4)稀释到15 μmol/L,分别于等摩尔的单链抗体和等体积的PBS混合,37℃孵育3 d。孵育后用ThT-F测定Aβ42的聚集程度。将样品加入到990 μl PBS(50 mmol/L,pH6.0)中。用RF-5301PC荧光分光光度计(杭州英斯特科技有限公司)检测其荧光强度,Ex=450 nm,Em=482 nm。
1.10 MTT法检测单链抗体抑制Aβ42对细胞的毒性作用 取对数生长期细胞,以每孔 2×103个细胞(100 μl)接种在96孔板,培养24 h。根据实验要求分别加入Aβ42寡聚体(1.4 μmol/L),Aβ42寡聚体(1.4 μmol/L)+单链抗体,孵育24、48、72 h。Aβ42寡聚体终浓度为700 nmol/L。细胞在处理完毕之后,每孔加入5 g/L MTT 20 μl,继续培养 4 h,吸出培养液,加入DMSO 150 μl,待甲臜完全溶解后,用酶标仪(Bio-Tek,ELX800)在波长 490 nm处读取吸光度(A490 nm)值。
1.11 向Tg2576鼠的海马区和皮质区定向注射scFv 将小鼠用戊巴比妥进行麻醉后,固定于定位仪上。在头盖骨前卤偏后0.2 cm对海马皮质区进行注射。每只小鼠注射4次(2 μl/次,1 μg/μl scFv23),其中2次注射深度0.17 cm(海马体),2次注射深度0.07 cm(大脑皮层)。对照组注射等体积的PBS。将处理好的小鼠鼠脑取出,然后进行固定,脱水,透明,浸蜡,包埋,脱蜡,水化,内源性过氧化物灭活,抗原修复,封闭处理载玻片。然后分别用6E10抗体,兔抗鼠IgG抗体,HRP标记链亲和素,DAB试剂盒,苏木素分别处理载玻片后,在显微镜下观察切片(具体方法参见免疫组化部分)。
1.12 统计学方法 应用SPSS16.0软件进行t、χ2检验及单因素方差分析。
2 结 果
2.1 文库筛选 为了筛选到与Aβ42有高亲和力的抗体分子,共进行了3轮亲和筛选,新一轮的洗脱液滴度和回收率都比上一轮高,而且第3轮回收率与第2轮回收率相近,说明经过第3轮筛选已经富集到了与靶蛋白有亲和活性的阳性噬菌体克隆。同时我们从经过3轮筛选富集的阳性克隆噬菌体克隆中随机挑选96个噬菌体克隆,用ELISA做进一步的特异性结合活性测定,ELISA结果显示96个噬菌体克隆中有1株(scFv23)能特异结合Aβ42蛋白,BSA、scFv23的OD值分别为0.10±0.02,0.67±0.03,t=27.382,P=0.000。

表1 文库筛选结果
2.2 免疫组化鉴定scFv23对鼠脑中Aβ42沉积的识别 与阳性对照组相比,scFv23免疫染色的结果与阳性对照结果定位相同,而且免疫染色的程度也相似。如果将scFv23与Aβ42混合,孵育一段时间后再将混合物免疫染色小鼠大脑皮层组织切片,发现scFv23不能识别小鼠大脑中的Aβ42沉积。这说明scFv23特异性识别Aβ42沉积。见图1。
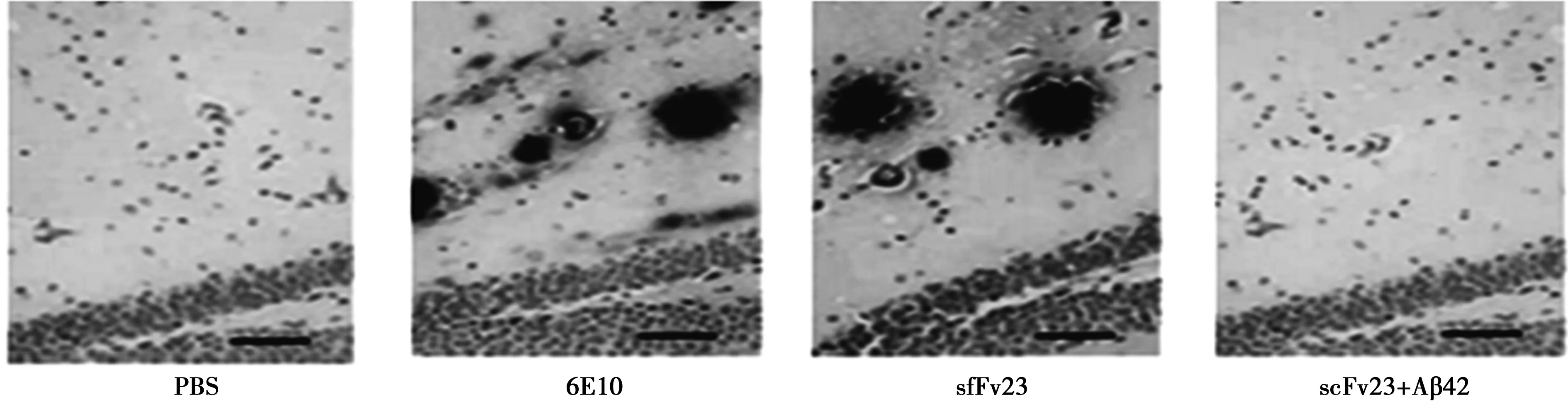
图1 免疫组化鉴定scFv23对Aβ42沉积的识别(×100)
2.3 Western印迹检测单链抗体对Aβ42单体,寡聚体,纤维识别的分析 首先我们以购买的Aβ42制备了Aβ42单体和寡聚体,经过非变性凝胶电泳分离Aβ42单体和寡聚体后,将目的条带转移到PVDF膜上,然后分别以scFv23和6E10为抗体作用PVDF膜。6E10可以特异性结合Aβ42单体和寡聚体,而scFv23与Aβ42寡聚体具有很强的结合能力,但是几乎不能与Aβ42单体结合。随后对12个月大的Tg2576小鼠鼠脑蛋白提取物进行Native-PAGE以分离鼠脑中Aβ42单体和纤维聚集体。待目的条带转移到PVDF膜上之后,以scFv23和6E10为抗体作用PVDF膜。6E10可以特异性结合Aβ42单体和纤维,而scFv23与Aβ42纤维特异性结合。这表明scFv23能特异性的识别Aβ42寡聚体和Aβ42纤维。见图2。
2.4 单链抗体对Aβ42纤维抑制作用 将Aβ42单体分别与等摩尔的scFv23和等体积的PBS混合,37℃孵育,分别在1、2、3 d用ThT-F法测定Aβ42的聚集程度。在存在单链抗体的情况下,Aβ42单体孵育1、2、3 d后的聚合程度(255±15、302±14、401±19)显著性低于单独Aβ42的聚合度(453±28、568±20、645±18)(均P<0.01)。

图2 Western印迹检测单链抗体对Aβ42单体,寡聚体,纤维的识别
2.5 单链抗体抑制Aβ42对细胞的毒性作用 以HEK293为细胞模型,MTT检测单链抗体抑制Aβ42对细胞的毒性作用。与对照组相比,实验组中细胞的存活率显著性提高。单独用Aβ42纤维作用HEK293细胞24、48、72 h后,细胞的存活率分别为(68.3±0.53)%(P<0.05),(45.5±0.08)%(P<0.05),(38.5±0.78)%(P<0.05)。而经单链抗体作用的实验组细胞的存活率分别为(80.5±7.3)%(P<0.05),(79.2±1.4)%(P<0.05),(75.89±2.6)%(P<0.05),明显高于对照组的细胞存活率。
2.6 免疫组化鉴定scFv23对小鼠脑中Aβ42沉积的清除作用 为了进一步鉴定scFv23对小鼠脑中Aβ42沉积的清除作用,将制备好的scFv23对小鼠鼠脑进行注射,随后我们用6E10抗体对小鼠脑切片进行了免疫染色。与对照组相比(注射PBS),实验组小鼠脑切片中Aβ42沉积明显少于对照组,这说明scFv23对于清除小鼠脑中Aβ42沉积发挥重要作用。见图3。

图3 免疫组化鉴定scFv23对小鼠脑中Aβ42沉积的清除作用(×100)
3 讨 论
AD转基因小鼠的培育,成为早期研究AD治疗方式的重要工具。人们在用Aβ免疫小鼠的过程中发现可以有效清除鼠脑中的Aβ沉积。随后,人们将这种方法用于临床试验。但是,在临床治疗的过程中,有一小部分病人的脑中出现了免疫反应,并且研究人员推测这种免疫反应可能是由于T-细胞或者Fc-所介导的免疫反应〔7〕。另一种可能的方案是主动免疫,就是在患有AD的病人中主动注射人源抗体。为了进一步研究这个治疗方案的可能性,有些实验室已经从人源单链抗体库中分离出可以与Aβ42特异性反应的scFv,并且证实了这种单链抗体可以有效地抑制体外Aβ42的聚集和引起的神经毒性〔8〕。为了进一步研究scFv在治疗AD病中的作用,本研究以AD模型鼠为实验对象,研究scFV在体内的作用,并成功地分离出能与Aβ42沉积和Aβ42寡聚体特异性反应的scFv,并且能有效地抑制体外Aβ42纤维的聚集。同时发现,scFv对鼠脑中的Aβ42沉积具有很好的清除作用。
在应用合成的Aβ1~42肽段(AN1792)免疫治疗的临床研究过程中Hock等〔9〕报道发现,Aβ42免疫过程中产生的抗体并不能与Aβ42单体和寡聚体发生交叉反应,但是可以与脑中的Aβ42沉积发生特异性反应。后来,Lee等〔10〕发现用AN1792疫苗治疗AD病人的抗血清可有有效识别Aβ42单体和Aβ42沉积,但是仍然不能与Aβ42寡聚体特异性结合。而本实验结果发现,scFv23并不能有效地识别Aβ42单体,但是可以有效识别Aβ42寡聚体和Aβ42纤维。相比于能有效结合Aβ42单体的单链抗体来说,能有效结合Aβ42寡聚体和Aβ42纤维的单链抗体在治疗AD病的研究的过程中意义更大,这是因为Aβ42单体具有很重要的生理意义。研究表明Aβ42寡聚体比Aβ42纤维有着更强的神经毒性〔11〕。本研究发现,3个月大的APP23转基因小鼠(表达APP751基因同时伴随着K670N,M671L双突变)在脑中在产生淀粉样沉积之前进行水迷宫的实验过程中已经表现出记忆的缺失〔12〕。同样,APP/IND转基因小鼠(V717F突变)在脑内不存在淀粉样沉积的时候已经表现出突出形态的异常〔13〕。所以,人们推测在AD的免疫治疗的过程中,针对Aβ42寡聚体的治疗方案比针对Aβ42单体和纤维具有更好的疗效〔14〕。
对于AD鼠模型中产生Aβ沉积的机制并不清楚。之前有研究表明体外培养神经胶质细胞可以有效吞噬培养基中的Aβ聚集体〔15〕。并且有早期的报道推测这种神经胶质细胞吞噬Aβ42聚集体可能是由Fc接受子所介导的〔16〕。随后,Solomon等〔17〕报道在体外,Aβ抗体可以与Aβ沉积发生反应,并导致Aβ聚集体的解聚。Bacskai等报道单独应用来自鼠抗Aβ抗体中的F(ab′)2片段对于清除转基因鼠脑中Aβ沉积的效果与用完整抗体清除转基因鼠脑中的Aβ沉积效果相似〔18〕。本实验结果同样支持了非Fc介导的体内Aβ沉积清除机制。
1 Çerman E,Eraslan M,Çekiç O.Age-related macular degeneration and Alzheimer disease〔J〕.Turk J Med Sci,2015;45(5):1004-9.
2 黄福德.β淀粉样肽在阿尔兹海默病中作用的逐步认识〔J〕.生命科学,2014;26(1):9-14.
3 Viola KL,Klein WL.Amyloid β oligomers in Alzheimer′s disease pathogenesis,treatment,and diagnosis〔J〕.Acta Neuropathol,2015;129(2):183-206.
4 Wyss-Coray T,Rogers J.Inflammation in Alzheimer disease-a brief review of the basic science and clinical literature〔J〕.Cold Spring Harb Perspect Med,2012;2(1):a006346.
5 Tarasoff-Conway JM,Carare RO,Osorio RS,etal.Clearance systems in the brain-implications for Alzheimer diseaser〔J〕.Nat Rev Neurol,2016;12(4):248.
6 Rotman M,Welling MM,van den Boogaard ML,etal.Fusion of hIgG1-Fc to 111In-anti-amyloid single domain antibody fragment VHH-pa2H prolongs blood residential time in APP/PS1 mice but does not increase brain uptake〔J〕.Nucl Med Biol,2015;42(8):695-702.
7 Fyfe I.Alzheimer disease:blocking microglial proliferation halts Alzheimer disease in mice〔J〕.Nat Rev Neurol,2016;12(2):64.
8 Hatami A,Albay R,Monjazeb S,etal.Monoclonal antibodies against Aβ42 fibrils distinguish multiple aggregation state polymorphisms in vitro and in Alzheimer disease brain〔J〕.J Biol Chem,2014;289(46):32131-43.
9 Hock C,Konietzko U,Papassotiropoulos A,etal.Generation of antibodies specific for beta-amyloid by vaccination of patients with Alzheimer disease〔J〕.Nat Med,2002;8(11):1270-5.
10 Lee M,Bard F,Johnson-Wood K,etal.Abeta42 immunization in Alzheimer′s disease generates Abeta N-terminal antibodies〔J〕.Ann Neurol,2005;58(3):430-5.
11 刘盈盈,杨 玲,杨建光,等.β-淀粉样多肽低分子量寡聚体对大鼠学习记忆功能的影响〔J〕.现代生物医学进展,2012;12(1):49-51,68.
12 Ryan D,Koss D,Porcu E,etal.Spatial learning impairments in PLB1Triple knock-in Alzheimer mice are task-specific and age-dependent〔J〕.Cell Mol Life Sci,2013;70(14):2603-19.
13 Lalonde R,Fukuchi K,Strazielle C.Neurologic and motor dysfunctions in APP transgenic mice〔J〕.Rev Neurosci,2012;23(4):363-79.
14 Hefti F,Goure WF,Jerecic J,etal.The case for soluble Aβ oligomers as a drug target in Alzheimer′s disease〔J〕.Trends Pharmacol Sci,2013;34(5):261-6.
15 Lai AY,McLaurin J.Clearance of amyloid-β peptides by microglia and macrophages:the issue of what,when and where〔J〕.Future Neurol,2012;7(2):165-76.
16 Bard F,Fox M,Friedrich S,etal.Sustained levels of antibodies against Aβ in amyloid-rich regions of the CNS following intravenous dosing in human APP transgenic mice〔J〕.Exp Neurol,2012;238(1):38-43.
17 Solomon B,Koppel R,Frankel D,etal.Disaggregation of Alzheimer beta-amyloid by site-directed mAb〔J〕.Proc Natl Acad Sci,1997;94(8):4109-12.
18 Bacskai BJ,Kajdasz ST,McLellan ME,etal.Non-Fc-mediated mechanisms are involved in clearance of amyloid-beta in vivo by immunotherapy〔J〕.J Neurosci,2002;22(18):7873-8.
〔2017-03-22修回〕
(编辑 袁左鸣)
刘 秦(1974-),女,硕士,副主任医师,主要从事脑血管病、痴呆的研究。
R745.1
A
1005-9202(2017)13-3173-05;
10.3969/j.issn.1005-9202.2017.13.022
1 广东番禺中心医院神经内科 2 广州医科大学附属第一医院检验科
3 广州医科大学临床技能中心
