m iR-10b-5p作用于胰腺癌潜在靶基因及分子机制的探讨
2017-07-18蒋梦彤唐瑞雪罗殿中
蒋梦彤唐瑞雪罗殿中
作者单位:530021南宁1广西医科大学第一附属医院病理科;2广西医科大学研究生院
m iR-10b-5p作用于胰腺癌潜在靶基因及分子机制的探讨
蒋梦彤1,2唐瑞雪1罗殿中1
作者单位:530021南宁1广西医科大学第一附属医院病理科;2广西医科大学研究生院
目的探讨miR-10b-5p在胰腺癌发生发展中潜在的靶基因和分子机制。方法通过高通量基因表达(gene expression omnibus,GEO)数据库和在线预测数据库对潜在靶基因进行初步探讨,再利用生物信息学计算,对miR-10b-5p与靶基因间的相互作用关系进行分析。结果本研究共得到586个miR-10b-5p潜在靶基因。基因富集分析(gene ontology,GO)表明,靶基因主要在蛋白转运途径中富集。京都基因与基因组百科全书通路分析(kyoto encyclopedia of genes and genomes,KEGG)显示miR-10b-5p靶基因主要存在于两个重要途径:癌症相关通路和胰腺癌相关通路。蛋白-蛋白网络互作分析(protein-protein interaction,PPI)重点展示了胰腺癌相关通路上7个突变基因(EGFR、RAC3、SMAD4、PIK3CA、CDK6、Bcl2L1和STAT3)之间的相互作用关系。结论miR-10b-5p可能通过靶向潜在的基因和途径在胰腺癌的发生发展中发挥作用。
胰腺肿瘤;miR-10b-5p;生物信息学;靶基因;分子机制
胰腺癌是常见的消化系统恶性肿瘤之一。其中胰腺导管腺癌(pancreatic ductal adenocarcinoma,PDAC)占全部胰腺癌的90%以上,恶性程度极高,5年存活率极低。影响胰腺癌不良预后的因素有以下三种:一是目前对胰腺癌仍缺乏有效的筛选测试;二是胰腺癌早期几乎没有任何症状;三是胰腺癌对现有的大部分化疗方案都具有较高的抗药性。因此胰腺癌患者需要更加个性化的治疗方法。
微小RNA(microRNA,miRNA)是内源的非编码小RNA分子,长度约为22个核苷酸。它们可以通过结合mRNA的3′-UTR区域中的互补序列诱导靶向mRNA降解或抑制mRNA翻译调控蛋白质表达[1]。miRNA可以作为致癌基因或肿瘤抑制基因起作用,成为治疗的新靶点[2]。研究发现miR-10b-5p在乳腺癌[3]、结直肠癌[4]、胃癌[5]、肝细胞癌[6]、小细胞肺癌[7]、胰腺癌[8]和神经胰腺癌[9]等多种肿瘤中表达上调。然而,尚无研究报道miR-10b-5p调控胰腺癌的具体分子机制。本研究通过高通量基因表达(gene expression omnibus,GEO)数据库和在线预测数据库,确定了miR-10b-5p的潜在靶基因。并通过生物信息学分析,进行基因富集分析(geneontology,GO)、京都基因与基因组百科全书通路分析(kyoto encyclopedia of genes and genomes,KEGG)和蛋白-蛋白网络互作分析(protein-protein interaction,PPI),探索miR-10b-5p及其靶基因在胰腺癌发生发展中的分子作用机制。
1 材料与方法
1.1 在线靶基因的预测和实验验证的靶基因收集
采用包括DIANA-microTv 4.0、DIANA-microTCDS、miRanda-rel 2010、miRanda-rel 2010、miRDB 4.0、miRmap、miRNAMap、PicTar2、PITA,RNA22v2,RNAhybrid 2.1和Targetscan 6.2在内的12个在线miRNA靶基因预测数据库预测miR-10b-5p靶基因。整合结果后,计算预测数据库中每个靶基因的频率。采用表达差异倍数(fold-change,FC)以及t检验统计学方法对差异基因进行筛选,挑选条件:FC>2且P<0.05,各数据库所预测的靶基因进行取交集处理。此外,还收集了来自miRTarbase和Tarbase实验验证的目标基因,挑选条件与上述12个在线网站的筛选条件相同,所得靶基因与上述靶基因进行取交集处理。
1.2 潜在的重要靶基因收集
首先在GEO数据库内以“miR-10b ormiRNA-10b or microRNA-10b”和“pancreatic cancer or PDAC”为关键词进行检索,去掉非人类研究和重复的样本信息,最终提取纳入基因序列的原始数据,通过Excel表格软件匹配相应基因ID的基因名称,选取Log2(FC)>0的差异基因为靶基因,并移除重复。最后对此部分所得靶基因与第一部分所得的靶基因取交集处理,两部分重复出现的差异基因最终即为miR-10b-5p的靶基因。
1.3 GO分析和KEGG分析
利用在线工具网站DAVID(https://david.ncifcrf. gov/)完成基因富集分析和基因通路富集分析。将上述最终的靶基因上传到DAVID中,即可收集到重要的富集基因和基因通路,P<0.05被认为差异具有统计学意义。
1.4 PPI网络构建和模块分析
将最终的靶基因上传到STRING数据库(http:// www.string-db.org/)构建PPI网络。互动评分>0.4作为中等互动置信度的阈值。
2 结果
2.1 潜在靶基因的探索
通过12个在线预测数据库、miRTarbase和Tarbase实验验证的基因数据库,共收集到2 969个预测靶基因。另外,通过关键词检索,在GEO数据库中仅发现一个合格的数据系列:GSE40189。该系列是对胰腺癌PDAN-1细胞系进行处理,其中三组样本为miR-10b-5p沉默组,另有三组为miR-10b-5p过表达组。匹配好基因ID和基因名称后,对同一基因的三组表达值取平均值,对沉默组与过表达组表达值之比进行以2为底的对数处理,经过筛选,共得到4 352个差异基因。进一步比较来自GEO芯片的差异基因和预测的靶基因,发现重复的基因有586个。这586个基因最终被认为是胰腺癌中一组关键的miR-10b-5p靶基因,并以此行进一步生物信息学分析。
2.2 GO和KEGG分析
通过DAVID功能注释模块注释后,重点分析上述586个靶基因。GO和KEGG分析显示这些基因存在多种潜在的机制通路。其中富集最显著的生物过程为蛋白质转运,最重要的两个途径为癌症相关通路和胰腺癌相关通路。
2.3 PPI网络互作分析
PPI网络能根据网络中每个基因的富集程度帮助确定最重要的靶基因之间的相互作用关系,即关键基因间的互作关系。基于上述对潜在靶基因的探索和富集通路机制的预测,本研究对存在于癌症相关通路上的靶基因(RASSF1、CASP8、ITGA2、CRK、CBL、PLCG1、CDK6、PTEN、PIKSCA、XIAP、RUNX1、MMP9、EGFR、BCR、IGFIR,Bcl2L1、CTNNA1、CTNNB1、RAC3,STAT3、CTBP1、SMAD4、ARHGEF11、HIF1A、PIAS2,DVL3、F2D1、RXRA)和存在于胰腺癌相关通路上的靶基因(EGFR、RAC3、SMAD4、PIK3CA、CDK6、Bcl2L1、STAT3)构建了PPI网络(图1、图2)。
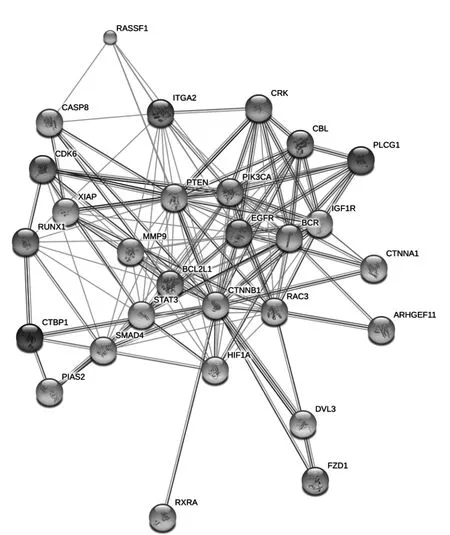
图1 癌症相关通路的PPI网络互作分析结果(hsa05200)
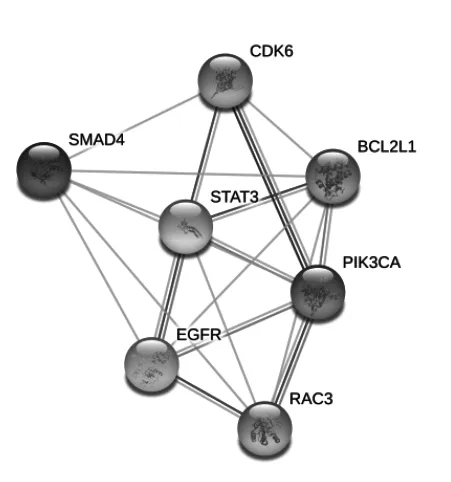
图2 胰腺癌相关通路的PPI网络互作分析结果(hsa05212)
3 讨论
据2017肿瘤年报报道,胰腺癌的发病率在女性中居第9位,而死亡率在男性和女性中均位于第4位[10],这与缺乏有效的早期诊断和治疗有关,大多患者确诊时已处于晚期阶段,而目前的治疗方法仍以手术治疗为主,但手术切除只能对处于早期尚未发生远处转移的患者有效。随着分子肿瘤学的发展,人们逐渐将目光聚焦到胰腺癌的分子靶向治疗。特异地影响胰腺癌发生发展的分子机制,是帮助胰腺癌早期诊断和治疗的关键。目前的研究表明miR-10b-5p在胰腺癌中的表达存在显著差异,提示miR-10b-5p可能在胰腺癌的发生发展中起重要作用。
现代医学已进入大数据时代,这为人类各种恶性肿瘤的研究提供了更加广阔的平台。GEO数据库是支持符合MIAME标准数据提交的公共的功能基因组数据库。GO富集分析和KEGG通路分析都有助于确定目标基因和其富集的分子通路。PPI蛋白网络互作是基于所提供基因,经过已有研究在线分析后,进一步挖掘富集的多个基因之间的相互作用关系,进一步揭示这些关键基因如何彼此影响而在肿瘤相关机制通路中发挥作用。
本研究通过生物信息学分析发现了miR-10b-5p作用于胰腺癌发生发展进程中潜在的靶基因有586个,比较有趣的是这些基因所富集的最显著的生物学过程为蛋白质转运,密切相关的通路机制癌症相关通路和胰腺癌相关通路。尤其是胰腺癌相关通路上,存在EGFR、RAC3、SMAD4、PIK3CA、CDK6、Bcl2L1和STAT3 7个明显差异的基因。
表皮生长因子(epidermal growth factor,EGFR)是具有酪氨酸激酶结构域的ERBB家族的跨膜受体成员。EGFR通过激活RAS/MAP激酶、信号转导和转录激活因子(signal transducerand activatorof transcription,STAT)、磷脂酶C/蛋白激酶C和磷脂酰肌醇3′-激酶(phosphatidy inositol 3-kinase,PI3K)/AKT途径参与细胞周期调节、黏附分化和细胞存活[11]。以往的研究发现EGFR在超过90%的胰腺癌样本中过表达。基于这一发现,靶向EGFR的酪氨酸激酶抑制剂被认为是有效的治疗药物。其中,厄洛替尼已被FDA批准与吉西他滨联合作为晚期胰腺癌的一线治疗药物[12]。另外STAT3参与多种抗肿瘤免疫应答的过程,是STAT家族中较为关键的分子之一[13]。已有研究表明超过90%的胰腺癌中存在K-RAS基因突变,而降低STAT3的表达,可明显抑制K-RASG12D的突变活性,并诱导胰腺癌细胞凋亡[14]。SMAD4是SMAD家族信号的成员之一,并且是转化因子β(transforming growth factorβ,TGF-β)信号通路的中枢介质。有研究指出,在60%~90%的胰腺癌中发现SMAD4失活或丧失[15]。SMAD4基因的等位基因丢失导致其突变和降解,从而激活TGF-β依赖性途径,导致细胞周期停滞和凋亡减少,并促进上皮间质转化[16]。因此,TGF-SMAD4信号在胰腺癌细胞中被认为起肿瘤抑制因子的作用[17]。而CD6/CD4抑制剂可以增加SMAD的转录活性,诱导上皮向间质转化并增强胰腺癌细胞的侵袭力[18]。PIK3CA又称PI3K,RAS的激活可以使PIK3CA磷酸化,并依次激活AKT、丝氨酸/苏氨酸激酶。PIK3CA/ AKT信号通路的激活,在胰腺癌细胞增殖、代谢和存活中发挥作用。而这一过程的发生依赖下游靶基因发挥作用,如雷帕霉素(mTOR)靶标[19]。目前mTOR抑制剂对胰腺癌疗效的临床试验评估仍在进行中[20-21]。而有趣的是,有研究指出,将Bcl-2/Bcl-XL(Bcl2/Bcl2L1)抑制剂与PIK3CA抑制剂联合应用于胰腺癌细胞模型,相比单用时具有更强的细胞杀伤力[22]。肝细胞核因子-1(hepatocyte nuclear factor-1,HNF-1)在胰腺B细胞基因调控中起调控作用,且HNF-1可与RAS相关C3肉毒杆菌底物3(RAC3)特异性结合,激活一系列转录机制,因此RAC3被认为是影响胰腺癌发生发展潜在的调节分子,但RAC3参与胰腺癌调节的具体机制有待进一步验证[23]。
综上所述,EGFR、RAC3、SMAD4、PIK3CA、CDK6、Bcl2L1和STAT3等7个基因就目前研究提示是调节胰腺癌发生发展的关键分子,同时具有彼此相互影响作用。本研究通过生物信息学的方式将它们之间潜在的关系挖掘出来,并提示其作用机制都是通过调节miR-10b-5p产生,为进一步研究胰腺癌发生发展机制以及胰腺癌的治疗提供了新的思路和初步依据。然而本研究仍存在局限性,例如所有分析都是通过生物信息学计算完成,缺乏体内外实验。因此,该结果仍然需进一步验证。
[1]Lawlor H,Meunier A,McDermott N,et al.Identification of suitable endogenous controls for gene and miRNA expression studies in irradiated prostate cancer cells[J].Tumour Biol,2015,36(8):6019-6028.
[2]Winsel S,Maki-Jouppila J,Tambe M,et al.Excess ofmiRNA-378a-5p perturbs mitotic fidelity and correlates with breast cancer tumourigenesis in vivo[J].Br JCancer,2014,111(11):2142-2151.
[3]Bertoli G,Cava C,Castiglioni I.MicroRNAs:new biomarkers for diagnosis,prognosis,therapy prediction and therapeutic tools for breast cancer[J].Theranostics,2015,5(10):1122-1143.
[4]Jiang H,Liu J,Chen Y,et al.Up-regulation of mir-10b predicate advanced clinicopathological featuresand livermetastasis in colorectal cancer[J].Cancer Med,2016,5(10):2932-2941.
[5]Huang Z,Zhu D,Wu L,et al.Six serum-based miRNAs as potential diagnostic biomarkers for gastric cancer[J].Cancer Epidemiol Biomarkers Prev,2017,26(2):188-196.
[6]Liao CG,Kong LM,Zhou P,et al.miR-10b is overexpressed in hepatocellular carcinoma and promotes cell proliferation,migration and invasion viaRhoC,uPARand MMPs[J].JTranslMed,2014,12:234.
[7]Zhang J,Xu L,Yang Z,et al.MicroRNA-10b indicates a poor prognosis of non-small cell lung cancer and targets E-cadherin[J].Clin Transl Oncol,2015,17(3):209-214.
[8]Ouyang H,Gore J,Deitz S,et al.microRNA-10b enhances pancreatic cancer cell transmission by suppressing TIP30 expression and promoting EGF and TGF-βactions[J].Oncogene,2014,33(38):4664-4674.
[9]Zhang X,Cheng J,Fu L,et al.Overexpression of tissue microRNA10b may help predict glioma prognosis[J].J Clin Neurosci,2016,29:59-63.
[10]SiegelRL,Miller KD,JemalA.CancerStatistics,2017,[J].CA Camcer JClin,2017,67(1):7-30.
[11]Fitzgerald TL,Lertpiriyapong K,Cocco L,et al.Roles of EGFR and KRAS and their downstream signaling pathways in pancreatic cancer and pancreatic cancer stem cells[J].Adv Biol Regul,2015,59:65-81.
[12]Tobita K,Kijima H,Dowaki S,et al.Epidermal growth factor receptor expression in human pancreatic cancer:significance for livermetastasis[J].Int JMol Med,2003,11(3):305-309.
[13]Wang S,AnW,Yao Y,etal.Interleukin 37 expression inhibits STAT3 to suppress the proliferation and invasion of human cervical cancer cells[J].JCancer,2015,6(10):962-969.
[14]Rabi T,Catapano CV.Aphanin,a triterpenoid from Amoora rohituka inhibits K-Rasmutant activity and STAT3 in pancreatic carcinoma cells[J].Tumour Biol,2016,37(9):12455-12464.
[15]Moustakas A,Heldin CH.Non-smad TGF-beta signals[J].J Cell Sci,2005,118(Pt 16):3573-3584.
[16]Lin X,Feng XH.Abrogation of transforming growth factor-signaling in pancreatic cancer[J].World JSurg,2005,29(3):312-316.
[17]Ahmed S,Bradshaw AD,Gera S,et al.The TGF-β/Smad4 signaling pathway in pancreatic carcinogenesisand its clinical significance[J]. JClin Med,2017,6(1):E5.
[18]Liu F,Korc M.Cdk4/6 inhibition induces epithelial mesenchymal transition and enhances invasiveness in pancreatic cancer cells[J]. Mol Cancer Ther,2012,11(10):2138-2148.
[19]Hezel AF,Kimmelman AC,Stanger BZ,et al.Genetics and biology of pancreatic ductal adenocarcinoma[J].Genes Dev,2006,20(10):1218-1249.
[20]Wolpin BM,Hezel AF,Abrams T,et al.OralmTOR inhibitor everolimus in patients with gemcitabinerefractory metastatic pancreatic cancer[J].JClin Oncol,2009,27(2):193-198.
[21]Kordes S,Klümpen HJ,Weterman MJ,etal.Phase IIstudy of capecitabine and the oral mTOR inhibitor everolimus in patients with advanced pancreatic cancer[J].Cancer Chemother Pharmacol,2015,75(6):1135-1141.
[22]Tan N,Wong M,NanniniMA,et al.Bcl-2/Bcl-xL inhibition increases the efficacy of MEK inhibition alone and in combination with PI3 kinase inhibition in lung and pancreatic tumor models[J].Mol Cancer Ther,2013,12(6):853-864.
[23]Soutoglou E,Papafotiou G,Katrakili N,et al.Transcriptional activation by hepatocyte nuclear factor-1 requires synergism between multiple coactivator proteins[J].J Biol Chem,2000,275(17):12515-12520.
[2017-03-24收稿][2017-04-16修回][编辑江德吉]
Identification of potential target genes and m olecu lar m echanism s of m iR-10b-5p in pancreatic cancer
Jiang Mengtong1,2,Tang Ruixue1,Luo Dianzhong1(1Department of Pathology,FirstAffiliated HospitalofGuangxiMedicalUniversity;2Graduate School of GuangxiMedica University,Nanning 530021,P.R.China)
Luo Dianzhong.E-mail:13878802796@163.com
Objective We aimed to explore target genes and molecularmechanisms potentially affected bymiR-10b-5p in the developmentof pancreatic cancer.Methods We predicted potential targetgenesaffected bymiR-10b-5p using theGene Expression Omnibus database and other online prediction databases.Results A total of 586 candidate target genes were identified,and Gene Ontology enrichment analysis showed thatmany target genes are involved in protein transport.Pathway analysis using the Kyoto Encyclopedia of Genes and Genomes suggested that miR-10b-5p is involved in tumor-associated pathways as well as specifically in pancreatic cancer-related pathways.Network analysis using the Protein-Protein Interaction tool suggested interactions among seven mutant genes(EGFR,RAC3,SMAD4,PIK3CA,CDK6,Bcl2L1,STAT3)in pancreatic cancer-related pathways.Conclusions The microRNA miR-10b-5p may target genes and pathways involved in pancreatic cancer,potentially making it important in diagnosis and treatment of the disease.
Pancreatic neoplasms;miR-10b-5p;Bioinformatics;Target genes;Molecularmechanism
R735.9
A
1674-5671(2017)03-05
10.3969/j.issn.1674-5671.2017.03.03
国家自然科学基金资助项目(81660424)
罗殿中。E-mail:13878802796@163.com
