新疆红枣缩果病和枣果黑斑病病原鉴定
2017-07-11何丽郭开发艾尼古丽依明赵思峰
何丽,郭开发,艾尼古丽·依明,赵思峰*
(新疆绿洲农业病虫害治理与植保资源利用自治区高校重点实验室/石河子大学农学院,新疆 石河子 832003)
新疆红枣缩果病和枣果黑斑病病原鉴定
何丽,郭开发,艾尼古丽·依明,赵思峰*
(新疆绿洲农业病虫害治理与植保资源利用自治区高校重点实验室/石河子大学农学院,新疆 石河子 832003)
为了明确新疆枣缩果病和枣果黑斑病病原菌的种类,从新疆红枣主要种植区哈密地区、阿克苏地区和巴音郭楞蒙古自治州分别采集红枣缩果病样品95份和枣果黑斑病样品77份。采用常规组织分离法对采集样品分离,并挑选典型代表菌株进行致病性测定和鉴定。结果表明:从缩果病样品中分离获得90株分离物,从枣果黑斑病样品中分离获得49株分离物,在139株分离物中,链格孢菌131株,占94.25%,镰刀菌6株,占4.32%,青霉菌2株,占1.44%。选取20株代表分离物进行致病性测定,18株链格孢菌分离物均可导致红枣果实发病,而镰刀菌无致病力。对18株代表性分离物的鉴定结果,明确了新疆枣缩果病和枣果黑斑病病原菌是链格孢菌。
缩果病;枣果黑斑病;病原菌;鉴定;链格孢菌
新疆气候干燥,昼夜温差大,日照丰富,非常适合红枣种植,所产红枣味甘香甜,即可鲜食也可制干,具有丰富的营养和药用价值[1]。近年来随着红枣直播建园技术和矮化密植栽培模式的推广,新疆红枣种植面积迅速增加,截止到2012年底新疆红枣种植面积已达47.37万hm2,红枣种植已成为新疆近年来发展最快、效益最突出和惠民成效最为显著的一项林果产业[2-3]。
随着新疆红枣种植面积的迅速增加,枣缩果病、枣果黑斑病、裂果病、枣树叶斑病、腐烂病等各种病害发生日益严重,其中缩果病一般病果率为20%-30%,严重者达到50%以上[4];枣果黑斑病自 2009年首次在阿克苏、和田地区发现以来,2010年在阿克苏爆发成灾,其中新疆兵团第一师的商品果产量损失超过30%[2],2015和2016年,南疆红枣再次因该病的爆发造成了严重损失。
目前,枣缩果病和枣果黑斑病已成为制约新疆红枣产业发展的主要因素,但对造成这2种病害的病因,还存在一定争议,其中张萍等[5]和赵乐等[6]报道缩果病的病原菌是链格孢菌(A.alternata(Fr.)Keissler),武自强等[7]研究认为细极链格孢菌A.tenuissima和A.alternata均是新疆枣缩果病的病原菌,赵燕等[3]认为短小芽孢杆菌(Bacillus pumilus) 是新疆枣缩果病的主要致病菌,而陈小飞等[8]根据缩果病田间分布规律,推测南疆枣缩果病可能是由环境因子引起的生理性病害。在枣果黑斑病病原研究方面,刘晓琳等[9]、向征 等[10]和包慧芳等[11]鉴定认为链格孢菌A.alternata是主要致病菌,而赵燕等[3]则认为枣果黑斑病是由细极链格孢菌A.tenuissima感染所致。
由于对这2种病害病原菌鉴定结果不一致,从而影响了对其病害的防治。因此,本研究对新疆哈密地区、巴音郭楞蒙古自治州和阿克苏地区3个红枣主产区的缩果病和枣果黑斑病病样进行采集和病原物的分离,通过致病性测定、形态学观察和分子生物学技术对分离获得的病原菌进行鉴定,以期明确这2种病害的病原菌种类,为制定其病害的防治措施提供理论依据。
1 材料与方法
1.1 材料
病样:分别于2014和2015年6月-10月从新疆哈密地区第十三师火箭农场、巴音郭楞蒙古自治州第二师红枣种植团场以及阿克苏地区第一师6团等地采集红枣缩果病病样95份,枣果黑斑病病样77份。
供试培养基:PDA培养基、PCA培养基和WA培养基[12]。
供试枣果:采自阿拉尔市周边骏枣膨大期果实,用于致病性测定。
1.2 方法
1.2.1 病原物分离与纯化
切取缩果病和枣果黑斑病样品的病健交界处果肉,采用常规组织分离法[12]分离病原菌,在PDA平板上进行分离,待分离物长出后,在WA平板上进行单孢纯化,将纯化后获得的菌株保存在PDA斜面上,置于4℃冰箱中,储存备用。
1.2.2 致病性测定
采用离体菌块贴接法[13]对获得的分离物进行致病性测定。分别从缩果病和枣果黑斑病的分离物中挑选20株代表菌株进行致病力测定,其中链格孢菌代表菌株为 33T11L、hm-32、hm-24、21-HB、34T11L、hm-36、hm-41、hm-52、hm-60、hm-35、hm-62、30-HB等18株,镰刀菌为48T3L-hb和53T17L-S 2个代表菌株。将单孢分离所得到的纯菌株在PDA培养基,25℃条件下培养5d后,用灭菌的直径5 mm打孔器在菌落边缘打取菌饼,将采集的健康无伤的红枣果实用清水洗净晾干后,用75%酒精表面消毒,再用无菌水将果实冲洗干净,最后用灭菌滤纸吸干果实上残留的水分,用无菌牙签刺孔,在超净工作台中将菌饼菌面朝下接种至红枣果实刺伤处,以PDA培养基块为对照,然后放入铺有湿润滤纸的方形发芽盒内(12 cm×12 cm×1.5 cm)中,每个代表菌株接种3个果实,28℃条件下,12 h光照、12 h黑暗交替培养,每日观察病斑生长情况,5 d后量取病斑直径,并对发病果实进行再分离。
1.2.3 病原菌鉴定
1.2.3.1 形态学观察
将病原菌的单孢菌株接于PDA、PCA平板中央,于28℃恒温光暗交替培养5 d,记录下各菌株在PDA、PCA平板上的菌落特征,参照张天宇[14]的方法在显微镜下观察分生孢子、分生孢子梗及喙的形态,并观察其成链情况。
1.2.3.2 分子生物学鉴定
分别挑选缩果病和枣果黑斑病的代表菌株33T11L、hm-32、hm-24、21-HB、34T11L、hm-36 等,在PDA平板上培养3 d后用打孔器打直径为 5 mm菌块接种在PDA平板上,12 h白昼交替,28℃恒温培养7 d后,刮取菌丝,放入1.5 mL离心管中,采用CTAB法[15]提取菌丝的基因组DNA。用通用引物ITS1 和 ITS4[16]扩增代表菌株的 ITS 和 5.8S rDNA;用引物 EF1-728F和 EF1-986R[17]扩增代表菌株的EF-1a 基因;用引物 Beta-F 和 Beta-R[17]扩增代表菌株的β-tubulin基因;用引物ACT-512-F和ACT-783R[16]扩增代表菌株的Actin基因。PCR反应体系:PCR TaqMix 12.5 μL、10 μmol/L 上游引物1 μL、10 μmol/L 下游引物 1 μL、基因组 DNA 0.5 μL、ddH2O 10 μL 至终体积为 25 μL。ITS 基因PCR扩增反应程序为94℃预变性4 min,94℃变性 30 s,55 ℃退火 1 min,72 ℃延伸 1 min,共30个循环,最后72℃延伸10 min;EF-1a基因PCR扩增反应程序为:94℃预变性4 min,然后94℃变性30 s,55 ℃退火 30 s,72 ℃延伸 1 min,共 30个循环,最后72℃延伸 10 min;β-tubulin基因PCR扩增反应程序为:94℃预变性4 min,然后94℃变性 30 s,59 ℃退火 30 s,72 ℃延伸 1 min,共30个循环,最后72℃延伸10 min;Actin基因PCR扩增反应程序为94℃预变性4 min,然后94℃变性 30 s,58 ℃退火 30 s,72 ℃延伸 1 min,共 30个循环,最后72℃延伸10 min。
反应完成后,1%琼脂糖凝胶电泳检测PCR反应产物。将不同引物的PCR反应产物进行进一步纯化后,委托北京六合华大基因科技股份有限公司进行测序。测序后的序列经校正后,在核酸序列数据库GenBank中进行同源序列搜索(BLAST搜索),比较测试菌株同现有数据库中相应序列的相似程度,用DNAMAN6.0软件进行比对并构建系统树,应用自展法(bootstrap)检验系统树,自展数据集为1000次。利用Mega5软件中邻接法(neighbour-joining methods,NJ)构建聚类分析树状图,分析供试菌株与同属其他菌株的亲缘关系,确定其分类地位。
2 结果与分析
2.1 病样采集及病原物的分离
缩果病主要在幼果期至果实膨大期发生,发病初期果实表面形成不规则浅黄色变色斑,后病果逐渐失水发软萎缩,发病部位提前着色,病果易脱落(图1B)。枣果黑斑病在枣果着色期开始发生,在果实成熟期达到发病高峰期,在田间典型症状是初期在枣果表面腰部或胴部出现深褐色至黑色圆形斑点,后病斑不断扩大,果肉变黑变硬,病变果肉易分离(图1A)。从采集的172份样品中共计分离获得了139株分离物,其中从缩果病样品中分离获得90株分离物,从枣果黑斑病样品中获得49株分离物。在139株分离物中,依据菌落形态初步确定链格孢菌131株,占总分离物的94.25%,青霉菌2株,占1.44%,镰刀菌 6株,占 4.32%(表 1)。
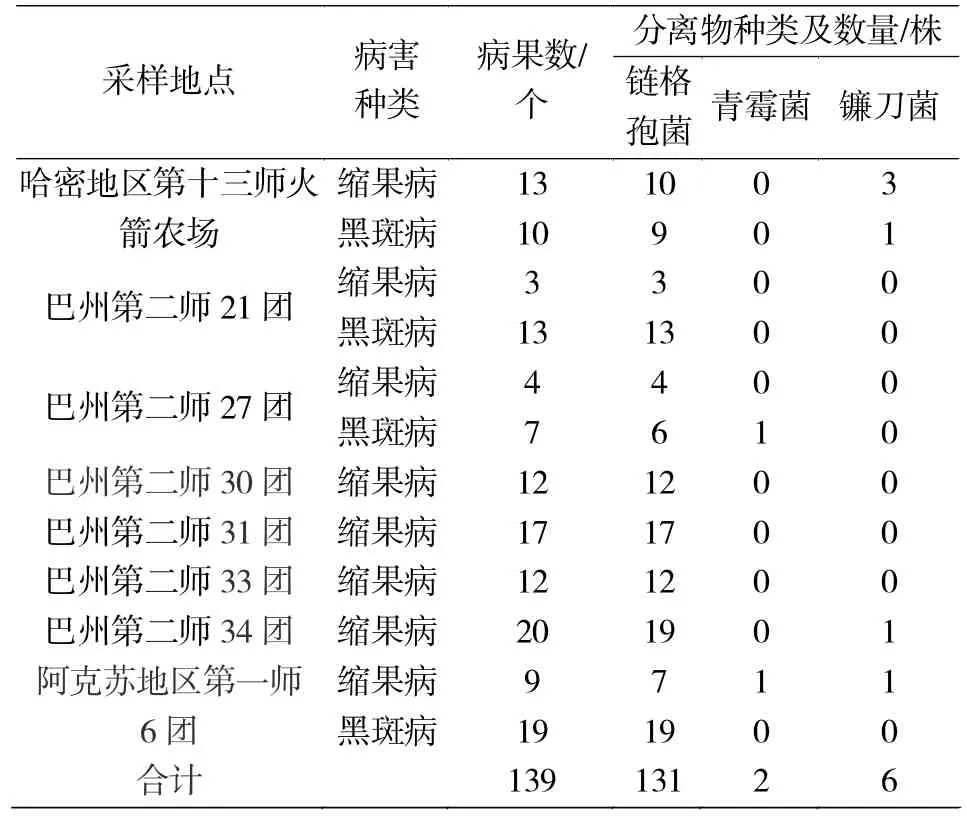
表1 红枣果实病害病样采集及分离Tab.1 The results of collection and separation pathogens from fruit disease ofZizyphus jujubae

图1 枣果黑斑病和缩果病的症状Fig.1 Symptoms of jujube black spot and fruit shrink disease
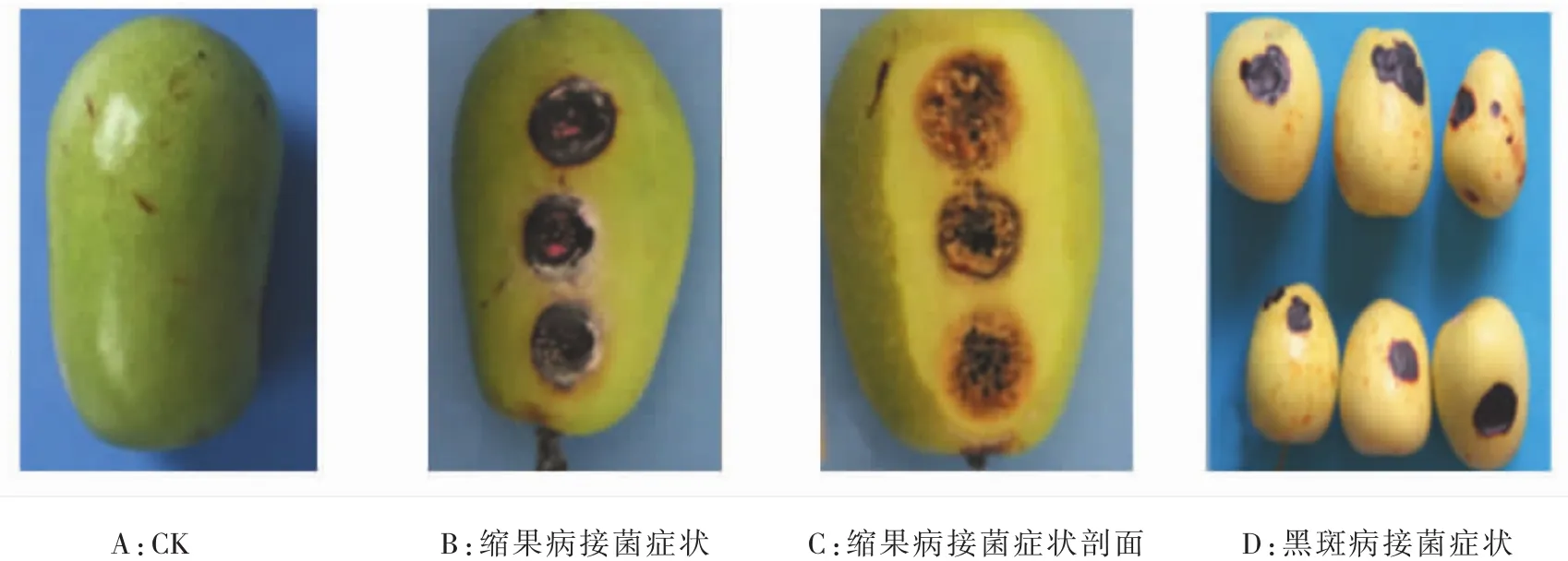
图2 枣果黑斑病和缩果病病原菌接种症状Fig.2 Symptom of inoculation with jujube black spot and fruit shrink disease pathogen
2.2 致病性测定
由图2可见,枣果接种5 d后,接种部位开始出现水渍状黑色圆形或椭圆形病斑,后逐渐扩大,变硬,枣果内部果肉分离,后期发病部位凹陷,整个果实变软,腐烂。从枣缩果分离得到的致病菌引起与黑斑病菌相似症状,且离体接种枣果不发生缢缩现象。链格孢菌 33T11L、hm-32、hm-24、21-HB、34T11L、hm-36、hm-41、hm-52、hm-60、hm-35、hm-62、30-HB等18个代表菌株菌引起红枣果实发病,但镰刀菌代表菌株48T3L-hb和53T17L-S接种枣果后未发病,因此可以判断新疆红枣缩果病和枣果黑斑病的致病菌主要是链格孢菌。
2.3 病原菌鉴定
2.3.1 形态学鉴定
将自缩果病枣果分离获得的 hm-32、hm-24、21-HB、hm-36等8株菌和自枣果黑斑病病果上分离的菌株 33T11L、34T11L、hm-62、30-HB 等 10 株菌,接种在PDA培养基上,28℃恒温、12 h昼夜交替培养7 d后,菌落初期为白色,后逐渐变为灰色至暗青褐色(图3A-C)。在PCA平板上,滤纸上培养7 d后,显微镜观察发现其分生孢子梗单生或簇生,直或弯曲,罕分支,淡褐色至褐色,随着连续产孢作合轴式分支,33.0-75.0 μm ×4.0-5.5 μm。分生孢子单生或链生,倒棍棒形,卵形,倒梨形或近椭圆形,淡褐色至褐色,表面光滑,具3-8个横膈膜,1-4个纵膈膜,分隔出略隘缩,孢身22.5-40.0 μm×8.0-13.5 μm(图3E-F)。依据菌落特征、分生孢子梗、分生孢子特征和参照文献 [14],初步鉴定为Alternaria alternate。
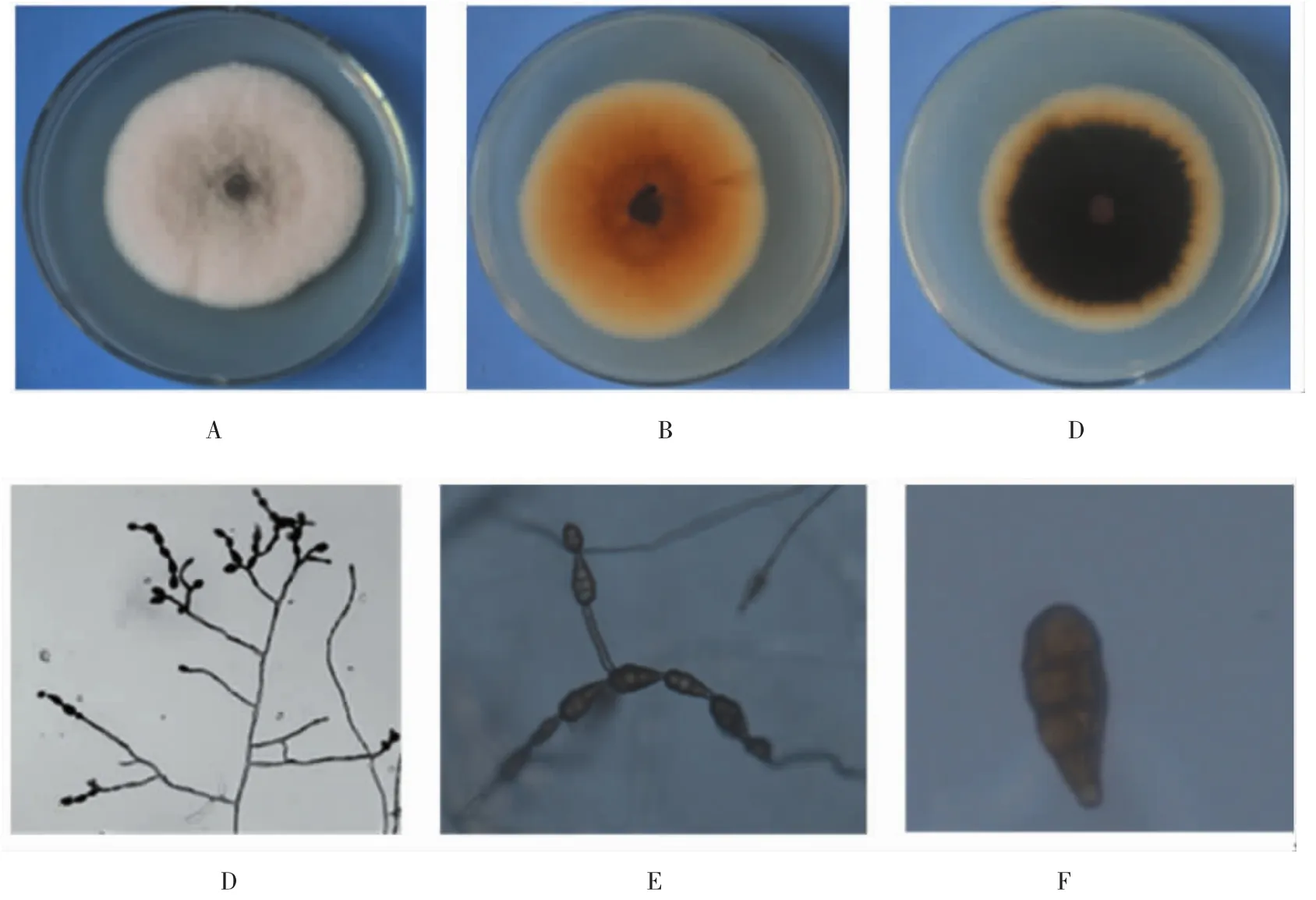
图3 病原菌菌落形态及分生孢子形态Fig.3 Morphology of pathogen colony and conidia
2.3.2分子生物学鉴定
采用 ITS、β-tubulin、ACT和 EF-1α 对病原菌分别扩增,得到大小约为500、250、750和250 bp的片段。将测得的序列登陆NCBI进行Blast比对,通过MEGA5.0用邻接法(Neighbor-joining method)构建系统发育树。ITS、EF-1α、Actin基因序列构建系统发育树(图 4、6、7)显示所有供试菌株与A.alternata、A.tenuissima聚在同一个单源分支上,同源性分别达到92%、100%、99%,并不能准确区分引起枣缩果和枣黑斑病的病原菌种类。β-tubulin基因序列构建系统发育树(图 5),缩果病代表菌株 hm-24、hm-32、hm-60,黑斑病代表菌株33T11L等均与A.alternata聚类在同一分支上,相似率为96%,聚类分析结果可区分A.alternata和A.tenuissima,表明新疆枣果黑斑病和缩果病病菌均为A.alternata。

图4 各代表菌株基于ITS序列构建的系统发育树Fig.4 Phylogenetic trees based on ITS sequences of representative strains
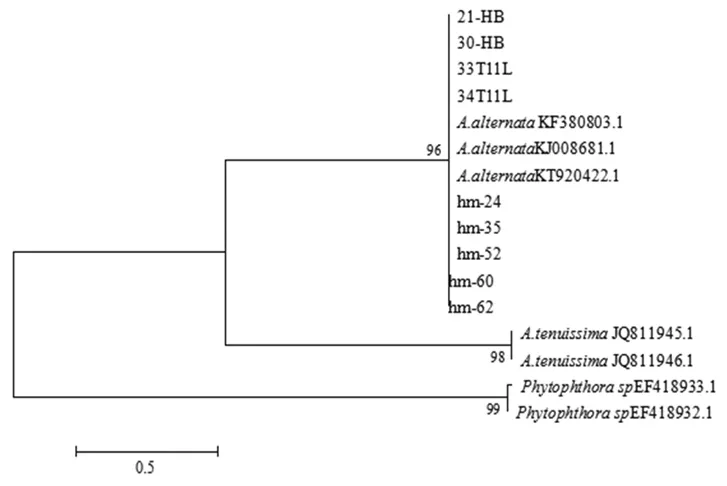
图5 各代表菌株基于β-tubulin序列构建的系统发育树Fig.5 Phylogenetic trees based on β-tubulin sequences of representative strains
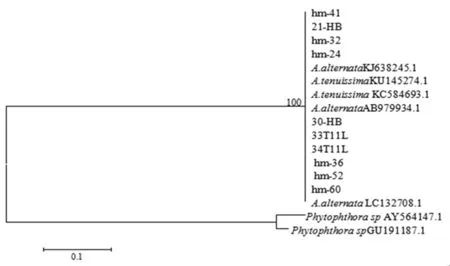
图6 各代表菌株基于EF-1α构建的系统发育树Fig.6 Phylogenetic trees based on EF-1α sequences of representative strains

图7 各代表菌株基于Actin序列构建的系统发育树Fig.7 Phylogenetic trees based on Actin sequences of representative strains
3 讨论
目前新疆特色林果种植面积已达167.67×104hm2,年产值4.50×105余万元,新疆已成为全国重要的“西域大果园”[18],其中红枣种植面积占特色林果种植的1/3以上,红枣产业对新疆各族人民的增收发挥了重要作用。然而枣缩果病和枣果黑斑病这2种病害对新疆红枣的产量和品质均已造成了严重影响。枣缩果病发生后,造成幼果缢缩变色,严重时大量幼果脱落;枣果黑斑病在红枣采收期普遍发生,在红枣枣果上形成黑色斑块,严重时整个果实霉烂。因新疆红枣大面积种植时间短,很多基层技术人员及枣农对2种病害的发病原因认识不清,在病害防治时存在盲目用药和用药时机不当等问题,很多枣农在红枣果实上发现黑斑后才开始喷洒杀细菌、杀真菌或用微肥等各种药剂,但防效均不佳。本研究通过对2种红枣果实病害病样进行采集,并对病原物进行了分离和鉴定,明确了这2种病害的主要病原菌均为交链格孢菌A.alternata,此结果与张萍等[5]、赵乐等[6]、向征等[10]和董宁等[19]的研究结果相一致,说明该病原菌在红枣幼果期侵染红枣,造成早期缩果病,中后期引起枣果黑斑病的发生,因此对新疆红枣上的这2种病害进行防治时,应采用杀真菌的药剂,而施药时期应在红枣开花前或开花坐果期。
目前已报道的链格孢属真菌种类有500余种,因其菌落颜色、分生孢子梗和孢子易随着寄主、培养基的养分条件发生变化,给形态学鉴定造成一定的困难[14],这也是枣缩果病和枣果黑斑病病菌鉴定出现一定争议的原因[3,6-7,19]。因此 ITS、EF-1α、Actin和β-tubulin基因序列等分子辅助鉴定方法被广泛用于链格孢属真菌的鉴定[16-17]。本研究结果表明,采用 ITS、EF-1α、Actin基因序列分析无法有效区分A.alternata和A.tenuissima两个种,而β-微管蛋白基因在不同的类群间即是高度保守的,又具有一定的变异性,已被用作一些低等真核生物进化分析的分子指标[20-22],通过序列分析可有效区分A.alternata和A.tenuissima两个种,且明确了造成新疆枣缩果和枣果黑斑病的病原菌种类是链格孢菌A.alternata,该菌还可引起烟草赤星病[23]、番茄早疫病[24]、梨黑斑病[25]等多种病害。
4 结论
从新疆红枣主产区累计缩果病病样95份,采集枣果黑斑病病样77份。从缩果病样品中分离到90株分离物,从枣果黑斑病样品中获得49株分离物,在139株分离物中,链格孢菌131株,占94.25%,镰刀菌6株,占4.32%,青霉菌2株,占1.44%,挑选代表菌株进行致病性测定,链格孢菌可以导致红枣果实发病,而镰刀菌不致病。对挑选的代表性链格孢菌进行形态学以及分子辅助鉴定,结果表明新疆红枣缩果病和枣果黑斑病的病原菌为链格孢菌A.alternata,对这2种病害的防治应采用杀真菌剂,用药时期应在开花前或开花坐果期,而不应当在田间发病以后才开始采取防治措施。
[1]付威,何荣,坎杂,等.红枣力学特性的试验研究[J].石河子大学学报(自然科学版),2013,31(4):518-522.
Fu W,He R,Kan Z,et al.Experimental study on mechanical properties of red jujube[J].Journal of Shihezi University(Natural Science),2013,31(4):518-522.
[2]张栋海,李克福,赵思峰.新疆南疆矮化密植枣园三种红枣病害发生规律及其影响因素研究[J].北方园艺,2015(3):105-108.
Zhang D H,Li K F,Zhao S F.Study on law and its influence factors of three main jujube diseases in south Xinjiang under dwarf and closeplanting managements[J].Northern Horticulture,2015(3):105-108.
[3]赵燕,郭庆元,王洪凯,等.新疆红枣病害种类及田间发生[J].新疆农业科学,2015,52(3):511-516,589.
Zhao Y,Guo Q Y,Wang H K,et al.Investigation of Chinese jujube diseases and their field occurrence in Xinjiang[J].Xinjiang Agricultural Sciences,2015,52(3):511-516,589.
[4]颉超,赵静静,郭庆元,等.枣缩果病在南疆的分布及在新疆的适生区预测[J].新疆农业科学,2015,52(8):1467-1451.
Xie C,Zhao J J,Guo Q Y,et al.Distribution of jujube fruit shrink in Southern Xinjiang and the potential distribution areas in the whole Xinjiang[J].Xinjiang Agricultural Sciences,2015,52(8):1467-1451.
[5]张萍,宋文,薛根生,等.新疆巴州地区红枣缩果病病原鉴定及田间防治药剂的筛选[J].北方园艺,2014(18):128-132.
Zhang P,Song W,Xue G S,et al.Identification of the pathogenic fungus causing fruit shrink disease of jujube and screening of fungicides in Xinjiang Bazhou area[J].Northern Horticulture,2014(18):128-132.
[6]赵乐,邢艺林,李正楠,等.枣缩果病初侵染链格孢菌的抗硫酸铜标记及稳定性[J].林业科学,2016,52(7):53-58.
Zhao L,Xing Y L,Li Z N,et al.Resistance-labeling and stability of jujube shrunken-fruit disease pathogenAlternaria alternateto copper sulfate [J].Scientia Silvae Sinicae,2016,52(7):53-58.
[7]武自强,马荣,崇娟,等.枣缩果病拮抗菌的鉴定及其拮抗效应[J].微生物学通报,2015,42(7):1321-1330.
Wu Z Q,Ma R,Chong J,et al.Identification of antagonistic bacteria againstAlternaria tenuissima,and its effect on antagonism[J].Microbiology China,2015,42(7):1321-1330.
[8]陈小飞,熊仁次,董红强,等.南疆骏枣黑斑病和缩果病空间分布型测定及抽样技术研究[J].新疆农业科学,2013,50(5):870-874.
Chen X F,Xiong R C,Dong H Q,et al.Studies on spatial distribution and sampling technique of jun-jujube black spot and fruit shrink disease in Southern Xinjiang[J].Xinjiang Agricultural Sciences,2013,50(5):870-874.
[9]刘晓琳,刘玉,马荣,等.新疆枣果黑斑病病原菌鉴定及生物学特性[J].西北林学院学报,2015,30(3):132-138.
Liu X L,Liu Y,Ma R,et al.Identification and biological characteristics of the pathogen causing jujube black spot in Xinjiang [J].Journal of Northwest Forestry University,2015,30(3):132-138.
[10]向征,钟聪慧,胡军,等.新疆枣果黑斑病病原鉴定[J].新疆农业科学,2013,50(5):845-850.
Xiang Z,Zhong C H,Hu J,et al.Identification of jujube black spot pathogens in Xinjiang [J].Xinjiang Agricultural Sciences,2013,50(5):845-850.
[11]包慧芳,王宁,侯敏.新疆红枣黑斑病病原菌鉴定及拮抗细菌筛选[J].新疆农业科学,2016,53(9):1667-1673.
Bao H F,Wang N,Hou M.Identification of the pathogen and screening of antagonistic bacteria of jujube black spot disease in Xinjiang[J].Xinjiang Agricultural Sciences,2016,53(9):1667-1673.
[12]杜娟,任娟,赵思峰,等.新疆马铃薯疮痂病病原的鉴定[J].石河子大学学报(自然科学版),2010,28(4):414-417.
Du J,Ren J,Zhao S F,et al.Identification of pathogen on potato scab in Xinjiang [J].Journal of Shihezi University(Natural Science),2010,28(4):414-417.
[13]王志霞,孙洁,赵思峰,等.新疆矮化密植枣园红枣叶斑病病原鉴定[J].中国森林病虫,2013,32(4):1-5.
Wang Z X,Sun J,Zhao S F,et al.Identification of the pathogenic fungus causing leaf spot ofZizyphus jujubein dwarf and close-planting orchards in Xinjiang[J].Forest Pest and Disease,2013,32(4):1-5.
[14]张天宇.中国真菌志:链格孢属[M].北京:科学出版社,2003:281.
[15]文朝慧,李铁夫,王军平,等.出口萝卜种子中芸薹生链格孢的分离与鉴定[J].植物检疫,2006,21(1):4-6.
Wen C H,Li T F,Wang J P,et al.Isolation and identification ofAlternaria brassiciaolaon radish seed[J].Plant Quarantine,2006,21(1):4-6.
[16]McKay G J,Brown A E,Bjourson A J,et al.Molecular characterisation ofAlternaria linicolaand its detection in linseed[J].European Journal of Plant Pathology,1999,105(2):157-166.
[17]Peever T L,Su G,Carpenter-Boggs L,et al.Molecular systematics of citrus-associated Alternaria species[J].Mycologia,2004,96(1):119-134.
[18]郭开发,姚兆群,吴彩兰,等.新疆4种林木腐烂病菌PCR快速检测技术研究[J].新疆农业科学,2016,53(10):1843-1849.
Guo K F,Yao Z Q,Wu C L,et al.Rapid PCR detection technology for four species ofValsa cankerpathogens of trees in Xinjiang[J].Xinjiang Agricultural Sciences,2016,53(10):1843-1849.
[19]董宁,冯宏祖,王兰,等.南疆骏枣黑斑病症状表现及病原菌鉴定[J].植物保护学报,2016,43(6):922-927.
Dong N,Feng H Z,Wang L,et al.The disease symptom and the pathogen identification of jujube black spot in southern Xinjiang [J].Journal of Plant Protection,2016,52(7):53-58.
[20]Hammond J W,Cai D,Verhey K J.Tubulin modifications and their cellular functions [J].Current Opinion in Cell Biology,2008,20(1):7l-76.
[21]Edlund T D,LiJ,Visvesvara G S,etal.Phylogenetic analysis ofβ-tubulin sequences from amitochondrial Protozoa [J].Molecular Phylogenetics and Evolution,1996,5(2):359-367.
[22]Aroca A,Raposo R,Lunello P.A biomarker for the identification of fourPhaeoacremoniumspecies using the β-tubulin gene as the target sequence [J].Applied Microbiology Biotechnology,2008,80(6):1131-1140.
[23]黄艳飞,汪汉成,陈庆元,等.六种杀菌剂对烟草赤星病菌菌丝生长和分生孢子萌发的抑制作用 [J].农药学学报,2016,18(2):263-267.
HuangY F,WangH C,Chen Q Y,etal.Inhibitory activities of six fungicides against mycelial growth and conidial germination ofAlternaria alternata[J].Chinese Journal of Pesticide Science,2016,18(2):263-267.
[24]Loganathan M,Venkataravanappa V,Saha S,et al.Morphological pathogenic and molecular characterizations of Alternaria species causing early blight of tomato in northern india[J].Proceedings of the National Academy of Sciences,India Section B:Biological Sciences,2016,86(2):325-330.
[25]Tanahashi M,Nakano T,Akamatsu H,et al.Alternaria alternataapple pathotype(A.mali)causes black spot of European pear[J].European Journal of Plant Pathology,2016,145(4):787-795.
Identification of the pathogen causing jujube fruit shrink disease and jujube black spot in Xinjiang
He Li,Guo Kaifa,Ainiguli Yiming,Zhao Sifeng*
(Key Laboratory at the Universities of Xinjiang Uygur Autonomous Region for Oasis Agricultural Pest Management and Plant Protection Resource Utilization/College of Agriculture,Shihezi University,Shihezi 832003,China)
The objective of this experiment was to determine the pathogen causing jujube shrink disease and jujube black spot in Xinjiang.The experiment used 95 jujube samples with fruit shrink disease and 77 samples with black spot.The samples were collected from important jujube production areas near Hami,Asku,and the Bayingolin Mongol Autonomous Prefecture.Representative isolates were obtained from these samples by tissue isolation.Pathogenicity tests were then conducted and the pathogens were identified.A total of 90 isolates were obtained from samples exhibiting jujube fruit shrink disease.A total of 49 isolates were obtained from samples with jujube black spot.Among the 139 isolates,there were 131 strains(94.25%)ofAlternaria alternata,6 strains (4.32%)of Fusarium,and 2 strains (1.44%)of Penicillium.Pathogenicity tests of 20 representative isolates showed that 18Alternaria isolatescaused jujube fruit disease.Two of the Fusarium isolates had no pathogenicity.In conclusion,analysis of the 18Alternaria isolatesindicated thatAlternaria alternata(Fries)Keissler is the pathogen causing jujube fruit shrink disease and jujube black spot disease in Xinjiang.
jujube fruit shrink disease;jujube black spot;pathogen;indentification;Alternaria alternata
S436.65
A
10.13880/j.cnki.65-1174/n.2017.03.008
1007-7383(2017)03-0312-07
2016-12-15
国家星火计划项目(2015GA891007)
何丽(1991-),女,硕士研究生,研究方向为植物病理学,e-mail:602157044@qq.com。
*通信作者:赵思峰(1975-),男,教授,博士生导师,从事植物病虫害生物防治研究,e-mail:zhsf_agr@shzu.edu.cn。
