马铃薯块茎不同部位淀粉含量及淀粉合成关键酶活性差异比较
2017-07-10吕文河霍丹丹李勇吕典秋白雅梅宿飞飞
吕文河,霍丹丹,李勇,吕典秋,白雅梅,宿飞飞
马铃薯块茎不同部位淀粉含量及淀粉合成关键酶活性差异比较
吕文河1,霍丹丹1,李勇2,吕典秋2,白雅梅3,宿飞飞2
(1.东北农业大学农学院,哈尔滨150030;2.黑龙江省农业科学院植物脱毒苗木研究所,哈尔滨150086;3.东北农业大学资源与环境学院,哈尔滨150030)
为探讨马铃薯块茎不同部位淀粉及相应酶活性差异,选用不同淀粉含量品种(高淀粉品种克新22号,低淀粉品种克新19号)为供试材料,分析块茎不同部位(顶部、右侧、脐部、左侧和髓部)干物质、淀粉含量(包括直、支链淀粉含量)和淀粉合成相关酶活性差异。结果表明,块茎淀粉品质(粗淀粉、直链淀粉和支链淀粉含量),由基因型可知,克新22号均高于克新19号;由块茎不同部位可知,两品种均表现块茎两侧>脐部>顶部>髓部。淀粉形成关键酶活性,由基因型可知,克新22号SSS、GBSS和SBE活性均高于克新19号,而两品种AGPase活性差异不大;由块茎不同部位可知,总体表现块茎两侧>脐部>顶部>髓部。其中,块茎不同部位SSS、GBSS和SBE活性差异显著,而AGPase活性差异不显著。研究结果为马铃薯块茎淀粉品质测定和淀粉合成酶活性合理取样提供科学依据。
马铃薯;块茎;部位;淀粉;淀粉合成相关酶
马铃薯是高产、优质的粮食作物,马铃薯块茎约含20%干物质,主要由淀粉组成,同时富含蛋白质、膳食纤维、维生素、矿物质等,淀粉含量是评价马铃薯品质的重要指标[1]。马铃薯淀粉由直链淀粉和支链淀粉组成,其中直链淀粉含量较低,支链淀粉含量较高,一般直链淀粉含量15%~ 25%,支链淀粉含量为75%~85%,在工业和食品加工中有重要作用[2-3]。
马铃薯块茎淀粉合成与积累是复杂生理生化调控过程,需要多种酶共同参与,主要包括腺苷二磷酸葡萄糖焦磷酸化酶(ADP-glucosepyrophos⁃phorylase,AGPase)、颗粒凝结性淀粉合成酶(Granule-bound starch synthase,GBSS)、可溶性淀粉合成酶(Soluble starch synthase,SSS)和淀粉分支酶(Starch branching enzyme,SBE),每种酶在不同植物中存在多种同工型[4-5]。其中AGPase是植物合成淀粉和微生物合成糖原限速酶,淀粉合成时,AGPase催化1-磷酸葡萄糖(G-1-P)与三磷酸腺苷(ATP)反应形成腺苷二磷酸葡萄糖(ADPG)并释放焦磷酸(PPi)[6]。
SSS是一种葡萄糖转移酶,以寡聚糖为前体,ADPG为底物,通过α-1,4糖苷键增加寡聚糖的葡萄糖单位,最终合成以α-1,4糖苷键连接的聚糖,而后聚糖作为SBE底物合成支链淀粉,GBSS通过与淀粉颗粒特异性结合,直接参与直链淀粉合成。具体反应过程为:CO2通过卡尔文循环形成PGA(3-磷酸甘油酸)后转化为TP(磷酸丙糖)。TP进入细胞质后生成蔗糖停留在叶绿体中转变成F-6-P(6-磷酸果糖),而后合成G-1-P(1-磷酸葡萄糖)与G-6-P(6-磷酸葡萄糖),G-1-P在AGPase作用下形成腺苷二磷酸葡萄糖(ADPG),ADPG是淀粉合成前体,SSS将其分子上葡萄糖残基转运至葡聚糖引物的非还原端延长葡聚糖链。当SSS将α-1, 4糖苷键葡聚糖链延长至一定长度时,SBE可催化切开α-1,4糖苷键重新形成α-1,6糖苷键产生分支结构[7-8]。
目前有关马铃薯淀粉、直支链淀粉及淀粉合成相关酶结构、功能及活性研究较多[9-10]。但对马铃薯块茎不同部位淀粉含量及其合成相关酶活性差异研究鲜有报道。本研究以高淀粉品种克新22号和低淀粉品种克新19号为试验材料,块茎形成中后期取样,分析马铃薯块茎不同部位淀粉含量及其合成关键酶活性差异,旨在为马铃薯块茎营养测定和生理分析合理取样提供科学依据。
1 材料方法
1.1 材料与设计
本试验以高淀粉品种克新22号和低淀粉品种克新19号为试验材料。试验于2016年在黑龙江省克山县同启现代农业农机专业合作社完成,采用随机区组设计,3次重复,6行区,行长12 m,行距90 cm,株距20 cm,小区面积64.8 m2,基肥为马铃薯专用复合肥,购自中化化肥控股有限公司(N ϑP ϑK比例14 ϑ6 ϑ20),每公顷施肥750 kg,于2016年4月30日采用60 g小整薯播种,9月27日收获,其他栽培管理同大田生产。
1.2 取样方法
块茎形成60 d左右(8月31日)取样,每个小区选取有代表性、长势一致3株植株,每株选大小均匀表皮光滑无病症马铃薯块茎取样150 g。取样方法:整薯延顶部到脐部纵切,一分为二。采用打孔取样法,直径约1 cm打孔器沿每个切面打孔取样约2 g。取样部位分别是顶部、右侧、脐部、左侧、髓部,3次重复,取样部位如图1所示。

图1 取样部位Fig.1Sampling location
每个小区3株马铃薯重量约6 g样品混合烘干,测定干物质、粗淀粉、直链淀粉含量。另外6 g装入冻存管,放入液氮中10 min,转移至-80℃冰箱保存,用于酶活性测定。
1.3 测定方法
1.3.1 干物质测定
采用烘干前后称重法,将块茎样品放入干燥铝盒中,称重后,105℃烘箱内杀青30 min,70℃烘干至恒重,计算干物质含量。干燥器中保存,用于直、支和总淀粉含量测定。
1.3.2 马铃薯粗淀粉含量测定
马铃薯块茎粗淀粉含量测定参照文献[11]谷物籽粒粗淀粉测定方法。将马铃薯块茎烘干样粉碎过60目筛并混合均匀,准确称取1 g样品(精确至0.0001 g)加入60 mL氯化钙-乙酸溶液,于(119±1)℃甘油锅内分散30 min,冷却后转移至100 mL容量瓶中,加入1 mL 30%硫酸锌溶液、1 mL 15%亚铁氰化钾溶液摇匀、定容、过滤,在20℃条件下,旋光仪测定滤液旋光值,计算块茎中淀粉含量。
1.3.3 马铃薯直链淀粉含量测定
参照文献[12-13]双波长法测定马铃薯块茎中直链淀粉含量。
标准曲线绘制:准确称取0.1000 g直链淀粉纯品,放入100 mL锥形瓶中,加入0.5 mol·L-1KOH溶液10 mL,沸水中溶解20 min后,取出加蒸馏水定容至100 mL,混匀,即为1 mg·mL-1直链淀粉标准溶液。取不同浓度梯度标准溶液加入50 mL蒸馏水,加0.1 mol·L-1盐酸溶液调至pH 3.5,加1 mL碘试剂,蒸馏水定容至刻度,混匀。静置20 min,以空白试剂为对照,测定632 nm和442 nm下吸光度,绘制双波长直链淀粉标准曲线。
样品测定:将马铃薯块茎烘干样粉碎后过60目筛,准确称取0.1000 g样品,加入0.5 mol·L-1KOH溶液10 mL,沸水中加热10 min后取出,冷却,蒸馏水定容至100 mL。吸取待测液5 mL,加入50 mL蒸馏水,用0.1 mol·L-1盐酸溶液调至pH 3.5,加入碘试剂1 mL,定容至100 mL,混匀。静置20 min,以空白试剂为对照,测定632 nm和442 nm下吸光度,计算直链淀粉含量。
1.3.4 粗酶液制备
粗酶液制备参考文献[14],略作改动。首先,称取制备好块茎样品0.5000 g放入预冷研钵,加4 mL提取缓冲液(含100 mmol·L-1Tricine-NaOH pH 7.5、8 mmol·L-1MgCl2、2 mmol·L-1EDTA、50 mmol·L-1β-Merthnol、12.5%Glycerol和1%PVP-40),冰浴研磨充分后倒入6 mL离心管,10 000 r·min-14℃离心20 min,分别收集上清液和沉淀,上清液用于AGPase、SSS和SBE活性测定,沉淀部分加入2 mL上述提取液悬浮后用于GBSS活性测定。
1.3.5 酶活性测定
AGPaes活性测定方法参照文献[15]。量取20 μL酶粗提液加入110 μL反应液(100 mmol·L-1Hepes-NaOH,pH 7.5,1.2 mmol·L-1ADPG,3 mmol·L-1PPi;5 mmol·L-1MgC12,4 mmol·L-1DTT)。30℃水浴反应20 min,沸水浴2 min终止反应。15 000 rpm·min-1离心10 min后,取上清液100 μL,加入5.2 μL比色液(5.76 mmol·L-1NADP,0.08 unit PGM,0.07 unit G6PDH)。30℃反应10 min。以20 μL煮沸粗酶液作为对照。测定OD340nm值,根据OD值增加量计算AGPaes活力。
GBSS、SSS活性测定参照文献[16]方法略有改动。EP管中加入36 μL反应液1(50 mmol·L-1Hepes-NaOH,pH 7.5,1.6 mmol·L-1ADPG,0.7 mg支链淀粉和15 mmol·L-1DTT),再加入20 μL粗酶液。30℃反应20 min,沸水浴2 min终止反应。冰浴冷却,加入20 μL反应液2(50 mmol·L-1Hepes-NaOH,pH 7.5,4 mmol·L-1PEP(烯醇丙酮酸磷酸羧激酶),200 mmol·L-1KCl,10 mmol·L-1MgCl2,1.2 IU PK丙酮酸激酶)。30℃反应20 min,沸水浴2 min终止反应。4℃,15 000 r·min-1,离心10 min。取上清60 μL,再加入43 μL反应液3(50 mmol·L-1Hepes-NaOH,pH 7.5,10 mmol·L-1葡萄糖,20 mmol·L-1MgCl2,2 mmol·L-1NADP,1.4 unit Hexokinase,0.35 unit G6P dehydrogenase)。30℃反应10 min后。以20 μL煮沸的粗酶液作为对照。测定OD340nm值。
SBE活性主要测定方法参照文献[17-18]。取50 μL粗酶液,加入1.45 mL(50 mmol·L-1Hepes-NaOH,pH 7.5,7.5 g·L-1可溶性淀粉)于反应液中。37℃水浴反应40 min,沸水浴2 min终止反应,加入150 μL 0.2%I2-KI溶液,0.4 mL蒸馏水,总体积2.05 mL,显色10 min后,测OD660nm值。以蒸馏水为参比,50 μL煮沸的粗酶液作为对照。以每降低1%碘蓝值为1个单位(U·g-1FW·min-1),计算SBE酶活力。
1.4 数据处理
采用Microsoft Excel 2010绘图,DPS7.31数据处理软件作数据方差分析。所有数据取3次重复平均值,采用新复极差法作多重比较。
2 结果与分析
2.1 块茎不同部位干物质含量差异
由图2可知,不同品种相同部位,克新22号干物质含量均高于克新19号。对于同一品种不同位置,克新22号品种,取样位置2(右侧)和4(左侧)干物质含量相近且显著高于位置1(顶部)、3(脐部)和5(髓部),其中,位置3(脐部)干物质含量高于位置1(顶部),位置1(顶部)干物质含量高于位置5(髓部),差异达显著水平;克新19号品种,取样位置2(右侧)和4(左侧),干物质含量相近且显著高于其他3个位置,其中取样位置3(脐部)干物质含量显著高于位置1(顶部)和5(髓部)。

图2 块茎不同部位干物质含量差异Fig.2Difference in dry matter content at each sampling location
2.2 块茎不同部位淀粉含量差异
2.2.1 块茎不同部位对粗淀粉含量差异
由图3可知,高淀粉品种克新22号各部位粗淀粉含量均高于低淀粉品种克新19号。克新22号品种取样位置2(右侧)和4(左侧),显著高于其他3个取样位置;取样位置1(顶部)和3(脐部)相近并显著高于位置5(髓部)。克新19号与克新22号趋势相同,取样位置2(右侧)和4(左侧)淀粉含量>位置3(脐部)>位置1(顶部)和5(髓部),差异显著。
2.2.2 块茎不同部位直链淀粉含量差异
由图4可知,克新22号各部位直链淀粉含量明显高于克新19号。对于品种克新22号,取样位置2(右侧)和4(左侧)直链淀粉含量,显著高于其他3个取样位置,取样位置3(脐部)显著高于位置1(顶部)和5(髓部);克新19号与克新22号趋势相同,取样位置2(右侧)和4(左侧)>位置3(脐部),位置3(脐部)>1(顶部)和5(髓部),差异显著。
2.2.3 块茎不同部位支链淀粉含量差异
由图5可知,克新22号各部位支链淀粉含量高于克新19号。对于品种克新22号,取样位置2(右侧)和4(左侧)支链淀粉含量显著高于其他3个取样位置;取样位置3(脐部)和1(顶部)含量相近显著高于位置5(髓部)。克新19号与克新22号趋势相同,取样位置2(右侧)和4(左侧)支链淀粉含量>位置3(脐部),取样位置3(脐部)支链淀粉含量>1(顶部)和5(髓部),且差异显著。
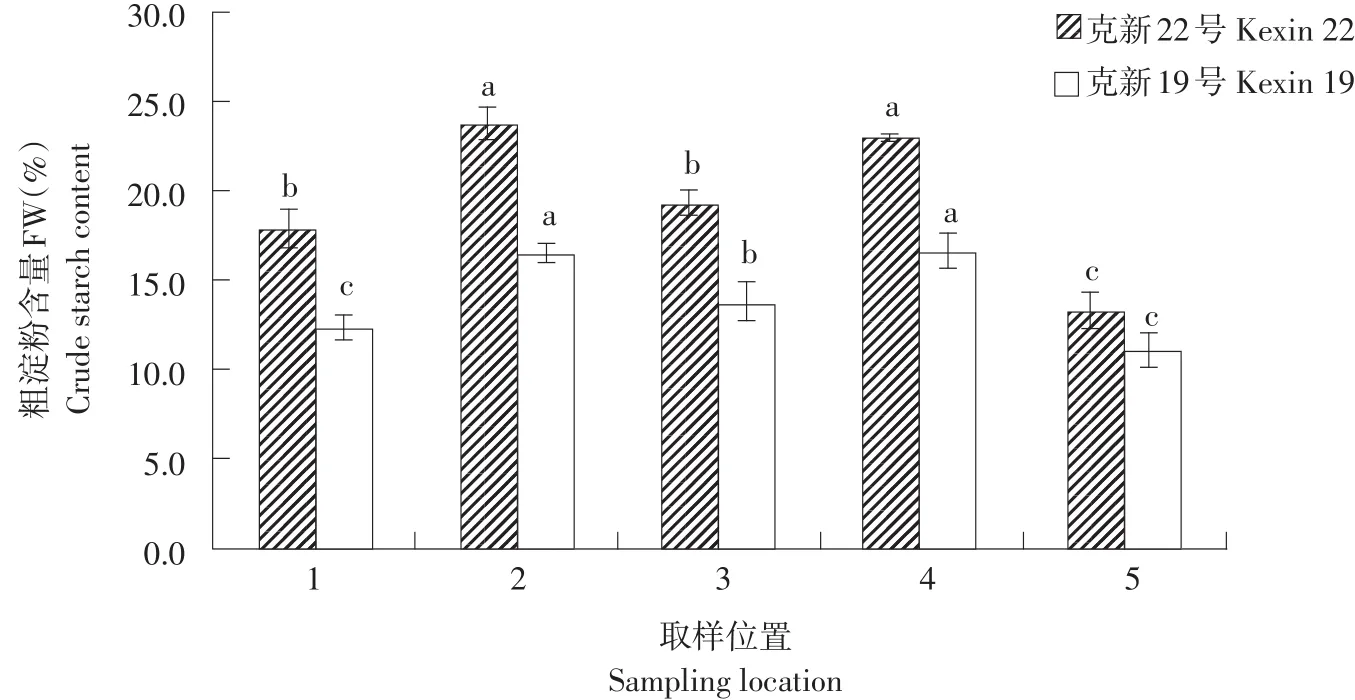
图3 块茎不同部位粗淀粉含量差异Fig.3Difference in crude starch content at each sampling location

图4 块茎不同部位直链淀粉含量差异Fig.4Difference in amylose content at each sampling location

图5 块茎不同部位支链淀粉含量差异Fig.5Difference in amylopectin content at each sampling location
2.3 块茎不同部位淀粉相关酶活性差异
2.3.1 块茎不同部位AGPase活性差异
AGPase催化1-磷酸葡萄糖(GIP)转化为ADPG,ADPG是淀粉合成直接前体物质之一,参与直链淀粉和支链淀粉合成。由图6可知,克新22号与克新19号AGPase活性无差异,两品种不同取样部位AGPase活性差异不显著。
2.3.2 块茎不同部位SSS活性差异
SSS在支链淀粉合成过程中,通过α-1,4糖苷键将ADPG中葡萄糖加到侧链非还原末端,延长侧链。
由图7可知,克新22号SSS活性高于克新19号,其中,克新22号取样位置2(右侧)和4(左侧)SSS活性相近且显著高于其他3个部位。取样位置3(脐部)和1(顶部)SSS活性显著高于位置5(髓部)。克新19号取样位置2(右侧)和4(左侧)SSS活性相近且显著高于其他3个部位。取样位置3(顶部)SSS活性显著高于1(脐部)和5(髓部)。

图6 块茎不同部位AGPase活性差异Fig.6Difference in AGPase activity at each sampling location
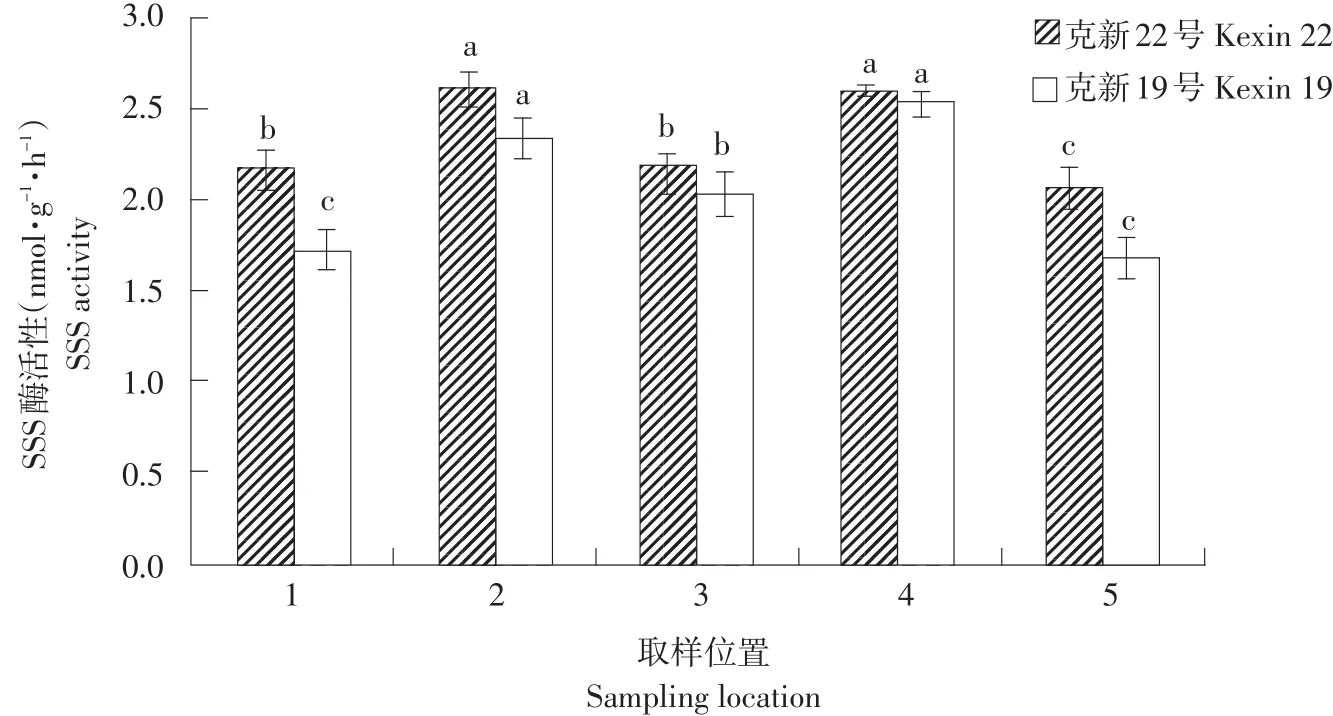
图7 块茎不同部位SSS活性差异Fig.7Difference in SSS activity at each sampling location
2.3.3 块茎不同部位GBSS活性差异
GBSS主要催化直链淀粉合成,将ADPG上葡萄糖残基转移到淀粉引物上,加长淀粉分子链。由图8可知,克新22号GBSS活性高于克新19号,其中,克新22号取样位置2(右侧)和4(左侧)GBSS活性相近且显著高于其他3个部位;取样位置3(脐部)和1(顶部)GBSS活性显著高于位置5(髓部)。克新19号取样位置2(右侧)和4(左侧)GBSS活性相近且显著高于其他3个部位。取样位置3(脐部)和1(顶部)GBSS活性显著高于5(髓部)。
2.3.4 块茎不同部位SBE活性差异
SBE主要功能是水解α-1,4糖苷键,并转移寡聚糖以α-1,6糖苷键连接糖基。由图9可知,克新22号SBE活性高于克新19号,其中,克新22号取样位置2(右侧)和4(左侧)SBE活性相近且显著高于其他3个部位,取样位置3(脐部)和1(顶部)SBE活性显著高于5(髓部)。对于低淀粉品种克新19号,取样位置2(右侧)和4(左侧)SBE活性相近且显著高于其他3个部位。取样位置1(顶部)和3(脐部)SBE活性显著高于5(髓部)。

图8 块茎不同部位GBSS活性差异Fig.8Difference in GBSS activity at each sampling location
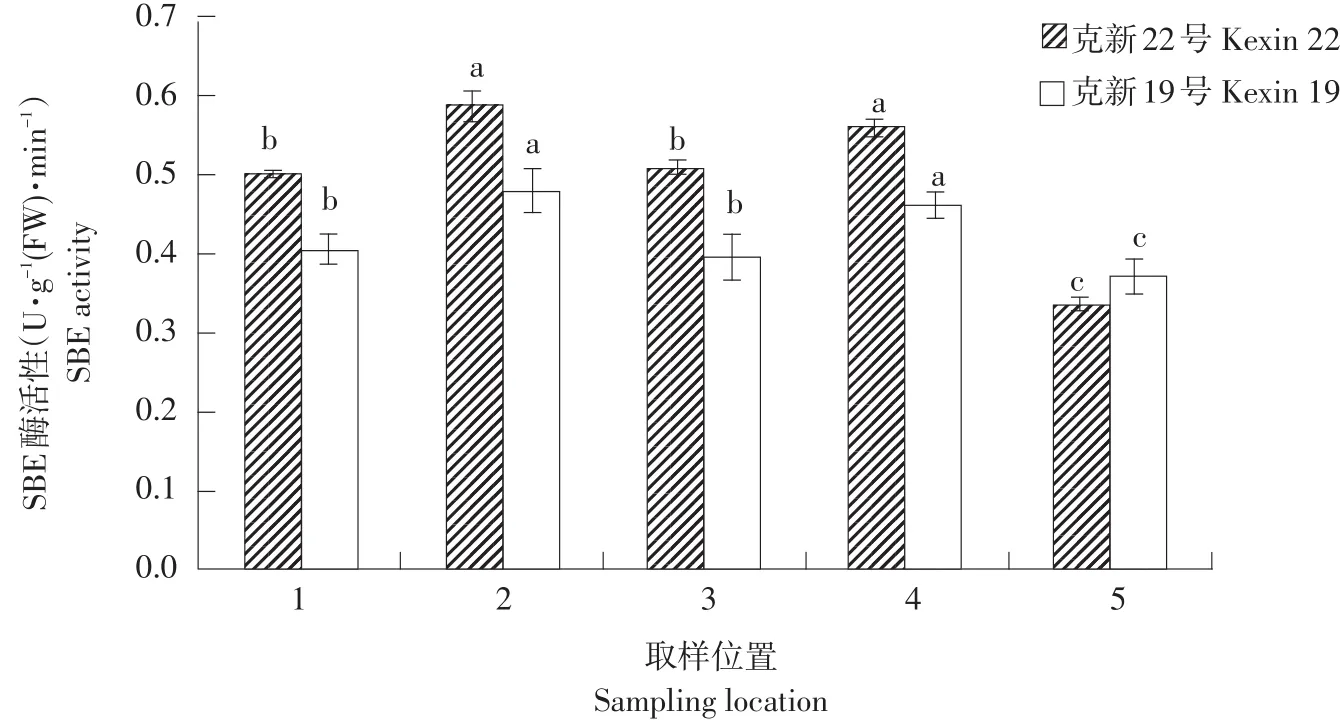
图9 块茎不同部位SBE活性差异Fig.9Difference in SBE activity at each sampling location
3 讨论
马铃薯淀粉含量是由复杂微效多基因控制的数量性状,但同等条件下,高淀粉品种淀粉含量相对较高[19]。淀粉含量受品种、气候、土壤和栽培技术等因素影响,同一块茎不同位置淀粉含量差异较大。贾延宇等研究发现,鲜甘薯中淀粉含量分布呈尾内>头内>中内、尾外>头外>中外,头尾两段(包括内、外层)淀粉含量接近,均明显高于中段,与本研究马铃薯淀粉含量脐部>头部>髓部结果相近[20]。刘梦芸等研究发现,马铃薯品种淀粉剖面上分布均以皮层区淀粉含量最高,环髓区居次,内髓最少[21]。其中环髓区淀粉在块茎中所占比重最大,淀粉相对占有率最高(达60%),皮层区淀粉相对占有率随块茎增大而降低。可见,块茎不同部位淀粉含量不同。但目前对块茎取样位置淀粉含量和酶活性差异研究较少,取样不科学造成试验误差,影响测定结果准确性。本试验共有两个马铃薯品种,分别为高淀粉品种克新22号和低淀粉品种克新19号,两品种淀粉含量差异显著。本试验选取块茎5个具有代表性位置:顶部、右侧、脐部、左侧和髓部,分别研究块茎不同部位干物质、淀粉含量以及淀粉合成关键酶活性差异,其中,两品种的干物质、粗淀粉、直支链淀粉含量均呈两侧>脐部>顶部>髓部变化趋势。
马铃薯块茎自形成时起,在匍匐茎膨大之前,开始积累淀粉,直到块茎成熟、茎叶全部枯萎[22]。近年对马铃薯块茎中淀粉合成相关酶活性研究较多,但马铃薯块茎各部位淀粉酶活性差异鲜有报道。马铃薯淀粉合成受AGPase、GBSS、SSS和SBE活性影响,在马铃薯块茎中高淀粉品种的4种酶活性均高于低淀粉品种,淀粉含量和淀粉组分量也是高淀粉品种高于低淀粉品种[10]。本试验马铃薯块茎5个取样位置3种酶(GBSS、SSS和SBE)活性均呈现克新22号大于克新19号趋势。块茎5个位置:顶部、右侧、脐部、左侧和髓部,GBSS、SSS和SBE活性均呈现两侧>脐部>顶部>髓部变化趋势。而两品种AGPase活性相差不大,同样各取样位置AGPase活性差异也不大,可能由于块茎形成后期取样,此时AGPase活性降低,两品种AGPase活性差异不显著。另外,AGPase主要催化淀粉合成葡萄糖供体ADPG形成,是淀粉合成起始酶,催化淀粉合成前体底物ADPG焦磷酸葡萄糖形成,不直接参与淀粉形成,所以淀粉合成前期,两品种AGPase活性差异较小。本研究结果表明,马铃薯块茎内部品质和生理指标存在差异,测定相关指标前,固定某一位置取样或取不同位置合样更具代表性和科学性。
[1]王彦宏,刘福刚,廉华,等.马铃薯高淀粉栽培研究进展[J].中国马铃薯,2010,24(1):50-53.
[2]姚新灵.内源淀粉特性比较研究[J].世界科技与发展,2001,23 (3):48-51.
[3]Zhu Z,Yu C,Zhou X,et al.Starch modification for slow release of herbicide encapsulated with concentrated starch paste[J].Wuhan University Journal of Natural Sciences,2007,12(3):515-521.
[4]Emes M J,Bowsher C G,Hedley C,et al.Starch synthesis and car⁃bon partitioning in developing endosperm[J].Journal of Experi⁃mental Botany,2003,54(382):569-575.
[5]Lloyd J R,Springer F,Buleon A,et al.The influence of altera⁃ tions in ADP-glucose pyrophosphorylase activities on starch structure and composition in potato tubers[J].Planta,1999,209 (2):230-238.
[6]Fettke J,Steup M.Glucose-1-phosphate transport into protoplasts and chloroplasts from leaves of Arabidopsis[J].Plant Physiology, 2011,155(4):1723-1734.
[7]Müllerröber B,Sonnewald U,Willmitzer L.Inhibition of the ADP-glucose pyrophosphorylase in transgenic potatoes leads to sugarstoring tubers and influences tuber formation and expression of tuber storage protein genes[J].Embo Journal,1992,11(4):1229-1238.
[8]陈雅玲,包劲松.水稻胚乳淀粉合成相关酶的结构、功能及其互作研究进展[J].中国水稻科学,2017,31(1):1-12.
[9]刘轶,冯涛,邴芳玲,等.双波长法测定马铃薯淀粉中直链淀粉含量[J].食品工业,2016,37(2):164-166.
[10]唐宏亮,石瑛,田洵,等.马铃薯淀粉合成关键酶与块茎淀粉积累的关系[J].中国农学通报,2015,31(27):88-93.
[11]孟广勤.谷物子粒粗淀粉测定法国家标准的研究和制订[J].黑龙江农业科学,1985(5):55-57..
[12]曾凡奎,赵鑫,周添红,等.双波长比色法测定马铃薯直链淀粉/支链淀粉含量[J].现代食品科技,2012,28(1):119-122.
[13]杨焕春,李勇,吕文河,等.马铃薯块茎直链淀粉含量检测方法的比较[J].中国马铃薯,2015,29(6):341-345.
[14]程方民,蒋德安,吴平,等.早籼稻籽粒灌浆过程中淀粉合成酶的变化及温度效应特征[J].作物学报,2001,27(2):201-206.
[15]Douglas C D,Tsung M K,Frederick C F.Enzymes of sucrose and hexose metabolism in developing kernels of two inbreds of maize[J].Plant Physiology,1988,86(4):1013-1019.
[16]Nakamura Y,Yuki K,Park S Y,et al.Carbohydrate metabolism in the developing endosperm of rice grains[J].Plant Cell Physiol, 1989,30(6):833-839.
[17]李太贵,沈波,陈能,等.Q酶在水稻籽粒垩白形成中作用的研究[J].作物学报,1997,23(3):338-344.
[18]赵法茂,齐霞,肖军,等.测定淀粉分支酶活性方法的改进[J].植物生理学通讯,2007,43(6):1167-1169.
[19]孙慧生.马铃薯育种学[M].北京:中国农业出版社,2003.
[20]贾延宇,师玉忠,田丰贺,等.甘薯不同部位淀粉的组成及黏度特性研究[J].河南农业科学,2011,40(8):84-86.
[21]刘梦芸,赵富宝,门福义,等.马铃薯高淀粉生理基础的研究——块茎组织结构与淀粉积累的关系[J].中国马铃薯,1994 (3):129-133.
[22]门福义,刘梦芸.马铃薯栽培生理[M].北京:中国农业出版社, 1995.
Comparison of starch contents and starch synthase activities in different parts of potato tuber/
LV Wenhe1,HUO Dandan1,LI Yong2,LV Dianqiu2,BAI Yamei3,XU Feifei2(1.School of Agriculture,Northeast Agricultural University,Harbin 150030, China;2.Institute of Virus-free Seeding Research,Heilongjiang Academy of Agricultural Sciences, Harbin 150086,China;3.School of Resources and Environmental Science,Northeast Agricultural University,Harbin 150030,China)
The high-starch potato variety Kexin 22 and the low-starch variety Kexin 19 were selected as the test materials in order to investigate the difference of starch and the corresponding enzyme activities in different parts of potato tubers.The dry matter content,starch content(including amylose content and amylopectin content),as well as the activity of enzymes related to starch synthesis were measured and compared in the five parts of top,right,bottom,left and center tuber.For the tuber starch quality trait(crude starch content,amylose content and amylopectin content),Kenxin 22 was higher than Kexin 19,but Kexin22 and Kexin 19 both showed the same tendency of sides>bottom>top>center.For the key enzyme activity of starch formation,the activities of soluble starch synthase(SSS),granule-bound starch synthase (GBSS)and starch branching enzyme(SBE)in Kexin 22 were higher than those in Kexin 19,however, there was no difference in ADP-glucosepyrophosphorylase(AGPase)between the two varieties.The overall trend was sides>bottom>top>center.The difference between GBSS,SSS and SBE in each sampling location was obvious,but the difference of AGPase was not.The results of this study would provide a scientific basis for adequately sampling potato tuber for determination of starch quantity and quality and starch synthase activity in potato tubers.
potato;tuber;location;starch;starch synthase
S532
A
1005-9369(2017)06-0001-08
时间2017-6-26 16:08:40[URL]http://kns.cnki.net/kcms/detail/23.1391.S.20170626.1608.008.html
吕文河,霍丹丹,李勇,等.马铃薯块茎不同部位淀粉含量及淀粉合成关键酶活性差异比较[J].东北农业大学学报,2017,48(6): 1-8.
Lv Wenhe,Huo Dandan,Li Yong,et al.Comparison of starch contents and starch synthase activities in different parts of potato tuber[J].Journal of Northeast Agricultural University,2017,48(6):1-8.(in Chinese with English abstract)
2017-03-29
黑龙江省科技攻关项目(GC12B105);黑龙江省应用技术研究与开发项目(GA15B102)
吕文河(1960-),男,教授,博士,博士生导师,研究方向为马铃薯遗传育种及栽培。E-mail:luwenhe60@163.com
