8-(1,2,4-三氮唑基)喹啉的合成与表征
2017-07-07黎钱陈乔张文进陈布霖刘立平魏琼柳利
黎钱,陈乔,张文进,陈布霖,刘立平,魏琼,柳利
(有机化工新材料湖北省协同创新中心(湖北大学),有机功能分子合成与应用教育部重点实验室(湖北大学),湖北 武汉 430062)
8-(1,2,4-三氮唑基)喹啉的合成与表征
黎钱,陈乔,张文进,陈布霖,刘立平,魏琼,柳利
(有机化工新材料湖北省协同创新中心(湖北大学),有机功能分子合成与应用教育部重点实验室(湖北大学),湖北 武汉 430062)
含氮的多齿螯合配体广泛应用于有机光电材料中. 以邻溴苯胺为原料,通过Skraup法合成8-溴喹啉,然后采用铜催化C-N交叉偶联反应合成目标化合物8-(1,2,4-三氮唑基)喹啉,为后续设计合成发光金属配合物提供重要前体.此外,采用核磁共振谱(1H、13C NMR)、傅里叶变换红外光谱(FT-IR)、液质联用飞行时间质谱(LC-MS TOF)等对目标化合物进行结构表征,确证了结构,该法在此类化合物的合成中具有成本低、产率较高的优点.
三氮唑;喹啉;合成;表征
0 引言
氮杂环一价铜配合物具有高效的磷光发射,是目前研究最广泛的OLEDs(Organic Light-Emitting Diode)材料之一[1-3]. 这是由于氮杂环配体与过渡金属离子具有较强配位能力,极易在常规条件下组装出各种目标分子[4-6]. 此外,氮杂环配体具有多个配位点,能起到使中心离子的配位数达到饱和的目的,而且具有不同配位点的氮杂环配体形成的配合物器件的发光颜色不一样,通过改变参与配位的氮原子个数可以实现调控配合物发光波长范围的目的[7-11]. 因此,近年来越来越多的科研工作者对氮杂环有机配体的研究产生了浓厚兴趣[12].
1987年,美国柯达公司的Tang等首次采用三(8-羟基喹啉)铝(Alq3)作为发光材料制备有机发光二极管(OLEO),开创了有机电致发光材料及器件研究的新局面[13]. 三氮唑是具有多个配位点的柔性配体,与金属离子配位时,可以通过调整构型来适应配位环境的变化从而得到结构新颖的配合物,含三氮唑的柔性配体也是近几年研究较多的一个领域[14-16]. 同时,喹啉和1,2,4-三氮唑均为缺电子型芳香化合物[17],将喹啉和唑类配体引入金属配合物中有可能改善金属配合物的电子传输性能、调节金属配合物的光电性能,实现金属到配体的电荷跃迁(Metal-Ligand Charge Transfer, MLCT),获得结构新颖、性能优良的金属配合物磷光材料,最终实现金属配合物磷光材料在有机电致发光平板显示中的广泛应用[18-19].因此,研究喹啉和唑类金属配合物具有重要的现实意义[20].
传统合成多齿螯合配体方法是用钯催化的N-芳基化反应,即Buchwald-Hartwig偶联反应[21-22],但钯催化剂价格昂贵、储量少,限制了它在药物合成和工业生产的应用.本文中从邻溴苯胺出发,利用Skraup法[23-24]合成8-溴喹啉,然后以CuI为催化剂,在碱性条件下通过C-N交叉偶联反应[25-26]合成了目标化合物8-(1,2,4-三氮唑基)喹啉.由于采用价格低、储量丰富的铜催化剂,降低了成本.合成路线见图1. 采用核磁共振谱(1H、13C NMR)、傅里叶变换红外光谱(FT-IR)、液质联用飞行时间质谱(LC-MS TOF)等对目标化合物进行了结构表证,为后续合成金属配合物提供了前体. 该化合物目前尚少见报道.
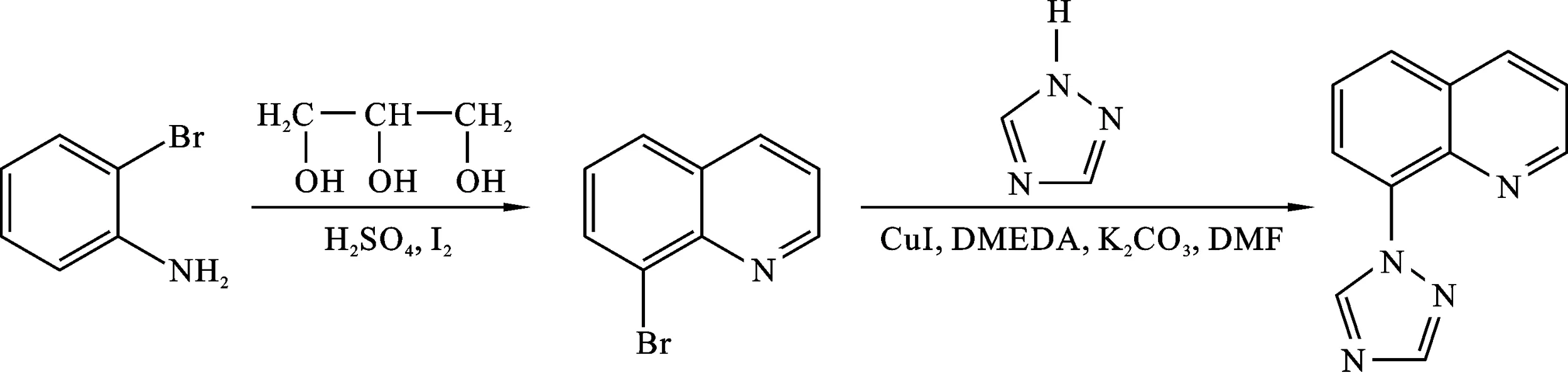
图1 8-(1,2,4-三氮唑基)喹啉的合成路线
1 实验部分
1.1 仪器与试剂 仪器:美国Varian公司AS600型高分辨率核磁共振波谱仪、美国PerkinElmer公司Frontier型傅立叶变换红外光谱仪、美国Agilent公司1260-6224型飞行时间液质联用仪、德国Elementar公司元素分析仪-Vario Macro Cube、郑州长城科工贸有限公司DF-101Z型集热式恒温加热磁力搅拌器、郑州长城科工贸有限公司SHB-Ⅲ型循环水式多用真空泵、上海亚荣生化仪器厂DE-52AA型旋转蒸发器、上海一恒科学仪器有限公司DZF-6020型真空干燥箱、德国Sartorius公司BSA24S型电子分析天平、氮气保护装置等.
试剂:邻溴苯胺和N, N′-二甲基乙二胺(DMEDA)均购自萨恩化学技术(上海)有限公司,1,2,4-三氮唑购自上海笛柏化学品技术有限公司,碘(粒状)、甘油、浓硫酸、碘化亚铜、无水碳酸钾和DMF均购自国药集团化学试剂有限公司. 所有试剂均为分析纯,实验中DMF通过氢化钙蒸馏回流干燥,其余试剂未经任何处理直接使用.

1.3 8-(1,2,4-三氮唑基)喹啉的合成 分别称取8-溴喹啉4.161 g(20 mmol)、1,2,4-三氮唑1.381 g(20 mmol)、碘化亚铜0.191 g(1 mmol)、N, N′-二甲基乙二胺0.176 g(2 mmol)和无水碳酸钾0.553 g(4 mmol)于圆底烧瓶中,加入20 mL DMF作溶剂,升温至120 ℃,搅拌12 h. 冷却至室温后,向得到的悬浮液中加入50 mL去离子水,再用二氯甲烷萃取,分液得有机相,用无水硫酸镁干燥,过滤,真空旋干溶剂,层析柱分离,洗脱剂:石油醚/乙酸乙酯=2∶1,Rf=0.3,去除洗脱剂后经真空干燥得淡棕色固体2.0 g,产率51%. MALDI-TOF-MS(m/z): Anal.Calcd. for[M+H]+:197.074 9;Found:197.081 6.IR(KBr,ν/cm-1):3 150,3 050,2 918,2 850,1 594,1 509,1 438,1 276,1 121,1 009,950,831,789,767, 670.1H NMR(600 MHz,d6-DMSO),δ=9.46(s,1H),9.04(s,J=6 Hz,1H),8.58(d,J=6 Hz,1H),8.31(s,1H),8.15(dd,J=6 Hz,2H),7.80(t,J=6 Hz,1H),7.72(q,J=6 Hz,1H).13C NMR(150 MHz,d6-DMSO),δ=151.97, 147.09, 140.31, 137.31, 134.01, 129.23, 128.92, 126.99, 124.46, 122.90.
2 结果与讨论
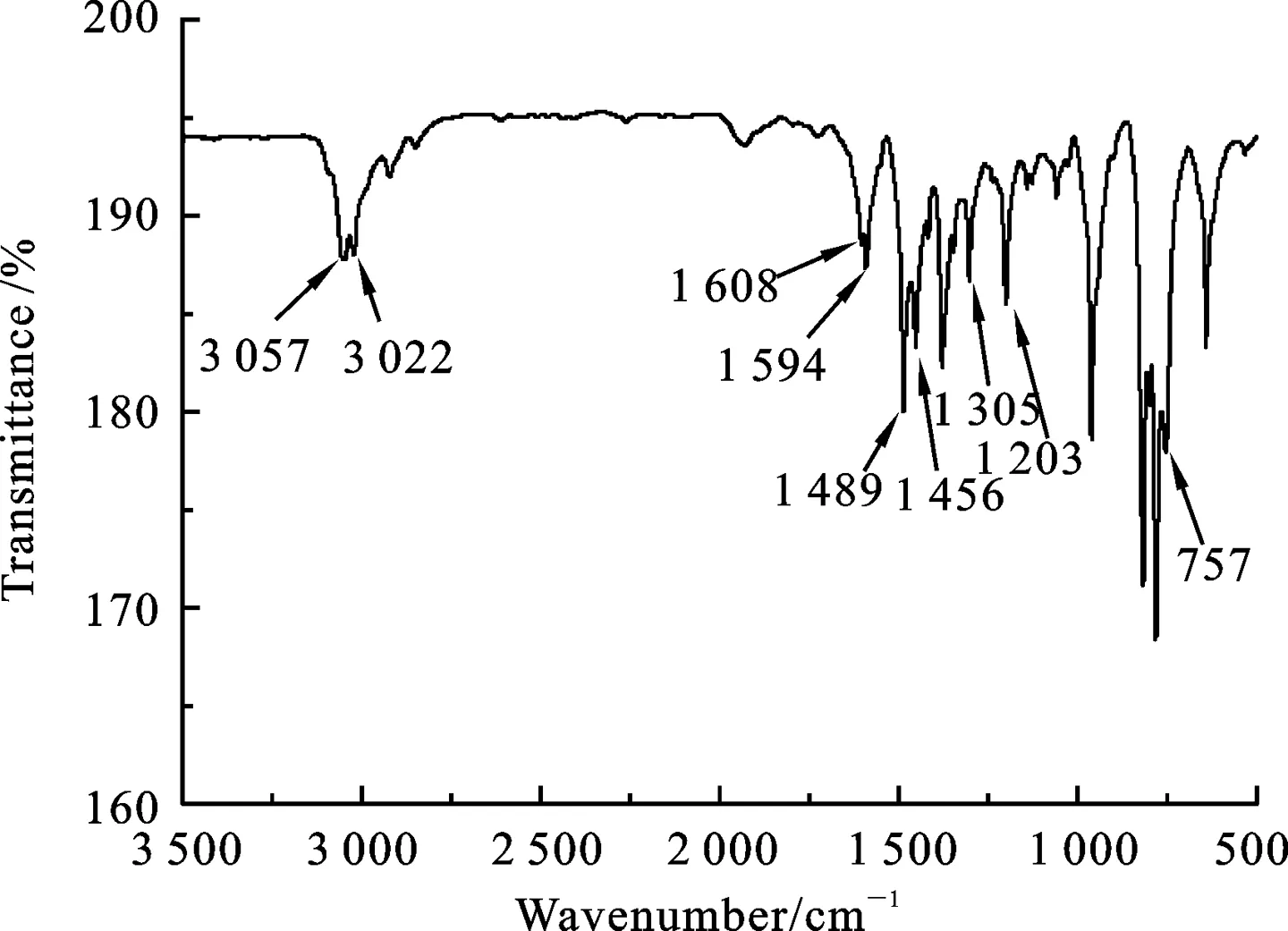
图2 8-(1, 2, 4-三氮唑基)喹啉的红外吸收谱图

2.21H NMR谱图 图3为目标化合物在氘代DMSO中的1H NMR谱图. 图中可观察到有8种质子峰. 其中三氮唑环3’位和5’位的氢的化学位移分别为8.31和9.46,且均为单峰. 喹啉环2号位和4号位的氢化学位移分别为9.04和8.58,且均为双峰,喹啉环3、5、6和7号位的氢的化学位移分别为7.72, 8.16, 7.80和8.14,与原料8-溴喹啉相比,目标化合物8-(1, 2, 4-三氮唑)喹啉的氢的化学位移均向低场移动.说明喹啉环与具有吸电子效应的三氮唑连接之后,喹啉环上氢原子的电子云密度降低,所以质子的化学位移向低场移动.每种氢对应的积分面积与结构相符.
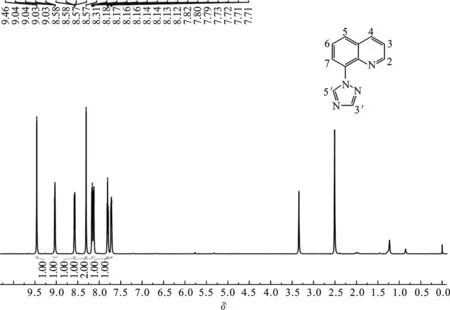
图3 8-(1, 2, 4-三氮唑基)喹啉的1H NMR谱图
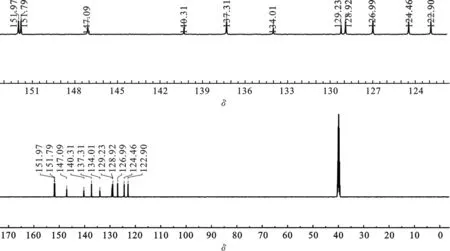
图4 8-(1, 2, 4-三氮唑基)喹啉的13C NMR谱图
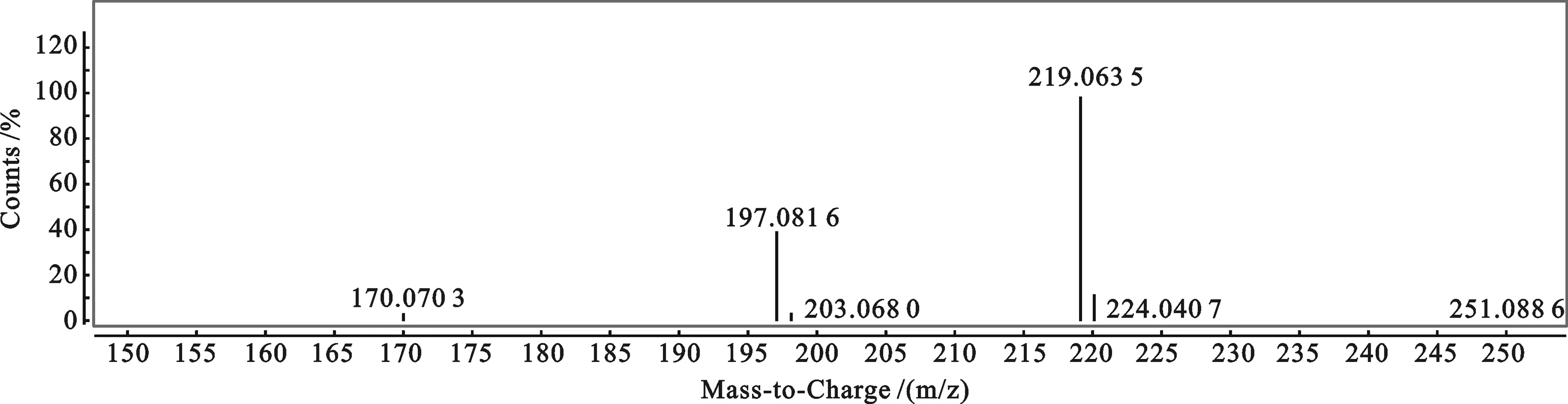
图5 8-(1, 2, 4-三氮唑)喹啉的质谱图

2.4 液质联用飞行时间(LC-MS TOF)高分辨质谱图 图5为目标产物的液质联用飞行时间(LC-MS TOF)高分辨质谱图,在m/z=197.081 6处为目标化合物的[M+H]+离子峰,与计算值197.074 9相符,进一步证实了目标化合物的结构.
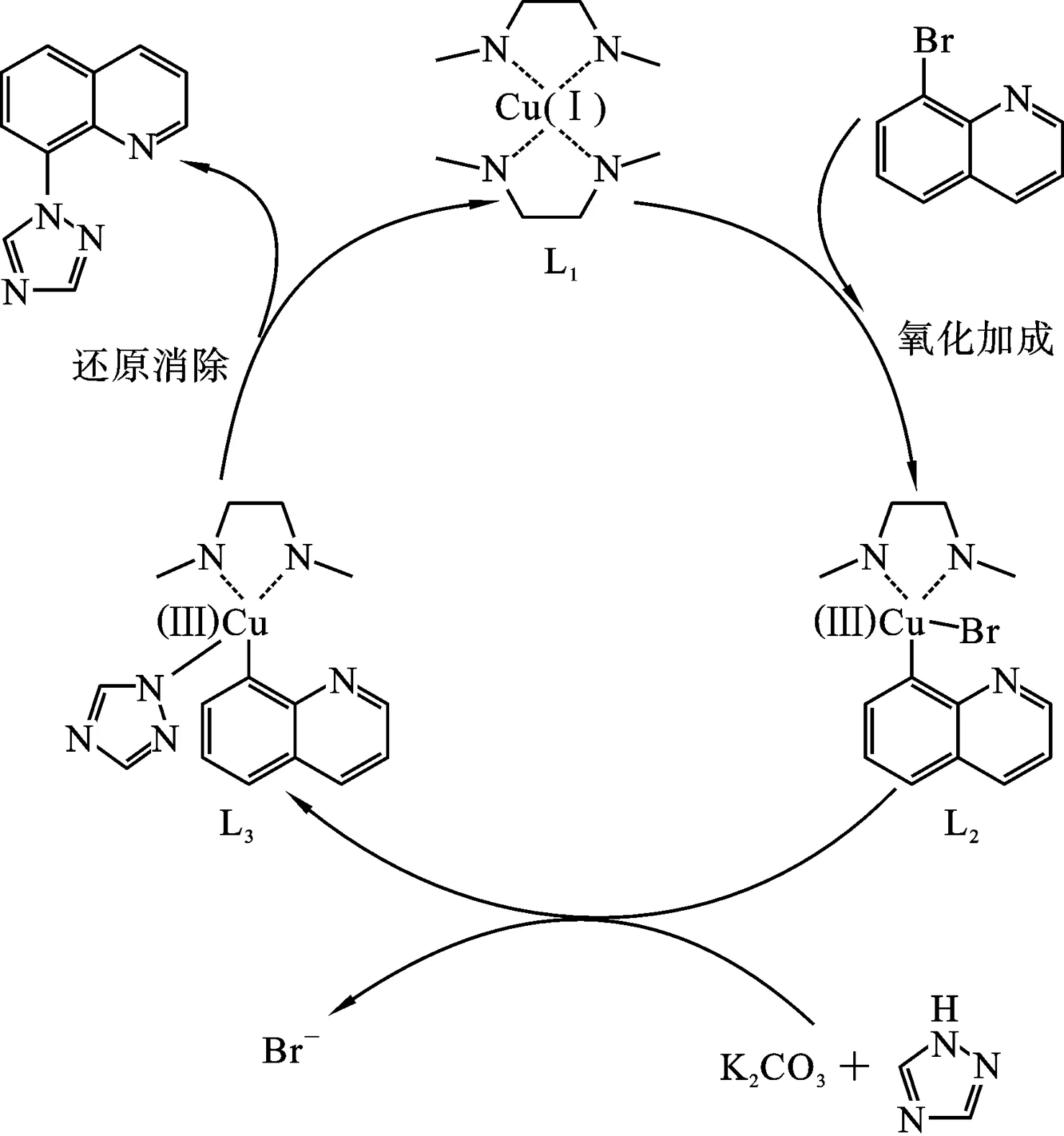
图6 C—N交叉偶联反应合成目标化合物的可能机理
通过傅里叶变换红外光谱(FT-IR)、核磁共振谱(1H、13C NMR)、液质联用飞行时间高分辨质谱(LC-MS TOF)等对8-(1, 2, 4-三氮唑基)喹啉的结构进行表征,图谱分析结果表明,能够确证该化合物的结构与结构式相符.
2.5 目标化合物的合成机理分析 以邻溴苯胺为原料,利用Skraup法合成8-溴喹啉,然后在碱性条件下以CuI为催化剂,通过C—N交叉偶联反应合成了目标化合物8-(1,2,4-三氮唑基)喹啉,推测的C-N交叉偶联反应的可能机理见图6. 机理中反应经历氧化加成、亲核离子交换和还原消除3个步骤[27].CuI首先与两分子N,N’-二甲基乙二胺(DMEDA)形成四氮Cu(I)配合物L1,然后L1与8-溴喹啉进行氧化加成生成喹啉双氮溴化Cu(Ⅲ)配合物L2.在碱碳酸钾的作用下,1, 2, 4-三氮唑作为亲核试剂与L2发生离子交换反应,脱掉Br-生成喹啉三氮唑双氮Cu(III)配合物L3,然后L3通过还原消除生成Cu(I)配合物L1和偶联产物8-(1, 2, 4-三氮唑基)喹啉,完成一个催化循环.
3 结论
本文中从邻溴苯胺出发,利用Skraup法合成8-溴喹啉,然后以CuI为催化剂,在碱性条件下通过C—N交叉偶联反应合成了目标化合物8-(1,2,4-三氮唑基)喹啉.采用核磁共振谱(1H、13C)NMR、傅里叶变换红外光谱(FT-IR)、液质联用飞行时间质谱(LC-MS TOF)等对目标化合物进行了结构表证,测试结果表明,目标化合物的结构和预期结构相符.所得目标化合物8-(1,2,4-三氮唑)喹啉是含有多个氮且具有较强配位能力的螯合配体,与一价铜等金属配位后可得到多种结构新颖的螯合金属配合物,可应用于有机光电材料、金属有机催化等领域,具有广阔的应用前景.
[1] Sylvain Gaillarda, Mohammed Kamal Elmkaddema, Cédric Fischmeiste, et al. Highly efficient and economic synthesis of new substituted amino-bispyridyl derivatives via copper and palladium catalysis[J]. Tetrahedron Lett, 2008, 49: 3471-3474.
[2] Zheng Zhanjiang, Kamal Elmkaddem Mohammed, Fischmeister Cédric, et al. Synthesis of new dipyridinylamine and dipyridinylmethane ligands and their coordination chemistry with Mg(II) and Zn(II)[J]. New J, Chem, 2008, 32: 2150-2158.
[3] Romain Charles, Gaillard Sylvain, Elmkaddem Mohammed K, et al. New dipyridylamine ruthenium complexes for transfer hydrogenation of aryl ketones in water[J]. Organometallics, 2010, 29(8): 1992-1995.
[4] Elodie Sauvageot, Ronan Marion, Fabien Sguerra, et al. Iridium(III) dipyridylamine complexes: synthesis, characterization and catalytic activities in photoredox reactions[J]. Org Chem Front, 2014, 1: 639-644.
[5] Amy Meyers, Marcus Weck. Design and synthesis of Alq3-functionalized polymers[J]. Macromolecules,2003,36(6):1766-1768.[6] Sinner Frank, Buchmeiser Michael R, Tessadri Richard, et al. Dipyridyl amide-functionalized polymers prepared by ring-opening-metathesis polymerization(ROMP) for the selective extraction of mercury and palladium[J]. J Am Chem Soc, 1998, 120: 2790-2797.
[7] Kroll Roswitha, Eschbaumer Christian, Schubert Ulrich S, et al. Access to heterogeneous atom-transfer radical polymerization(ATRP) catalysts based on dipyridylamine and terpyridine via ring-opening metathesis polymerization(ROMP)[J]. Macromol Chem Phys, 2001, 202: 645-653.
[8] Ni Jia, Wei KaiJu, Min Yuanzeng, et al. Copper(I) coordination polymers of 2,2′-dipyridylamine derivatives: syntheses, structures, and luminescence[J]. Dalton Trans, 2012, 41: 5280-5293.
[9] Xie Yongshu, Ding Yubin, Li Xin, et al. Selective, sensitive and reversible “turn-on” fluorescent cyanide probes based on 2,2′-dipyridylaminoanthracene-Cu2+ensembles[J]. Chem Commun, 2012, 48: 11513-11515.
[10] Martic Sanela, Wu Gang and Wang Suning. N2-functionalized blue luminescent guanosines by 2,2′-dipyridylamino and 2-(2′-Pyridyl)benzimidazolyl chelate groups and their interactions with Zn(II) ions[J]. Inorg Chem, 2008, 47(18): 8315-8323.
[11] Liu Qinde, Jia Wenli, Wu Gang, et al. Binuclear and starburst organoplatinum(II) complexes of 2,2′-dipyridylamino derivative ligands: structures, fluxionality, and luminescence[J]. Organometallics, 2003, 22(18): 3781-3791.
[12] Li Jian, Djurovich Peter I, Alleyne Bert D, et al.Synthetic control of excited-state properties in cyclometalated Ir(III) complexes using ancillary ligands[J]. Inorg Chem, 2005, 44(6): 1713-1727.
[13] Tang Ching W, Van Slyke Steven. Organic electroluminescent diodes[J]. Appl Phys Lett, 1987, 51: 913-915.
[14] Schottel Brandi L, Chifotides Helen T, Shatruk Mikhail, et al. Anion-π interactions as controlling elements in self-assembly reactions of Ag(I) complexes with π-acidic aromatic rings[J]. J Am Chem Soc, 2006, 128(17): 5895-5912.
[15] Zhang Jiepeng, Zheng Shaoliang, Huang Xiaochun, et al. Two unprecedented 3-connected three-dimensional networks of copper(I) triazolates: in situ formation of ligands by cycloaddition of nitriles and ammonia[J]. Angew Chem Int Ed., 2004, 116: 206-211.
[16] Dai Fangna, He Haiyan and Sun Daofeng. Polymorphism in high-crystalline-stability metal-organic nanotubes[J]. Inorg Chem, 2009, 48(11): 4613-4615.
[17] 王蕾. 平面杂环芳香族化合物芳香性的理论研究[D]. 无锡:江南大学, 2007.
[18] Lee Junghyun, Liu Qin-De, Motala Michael, et al. Photoluminescence, electroluminescence, and complex formation of novel N-7-azaindolyl- and 2, 2′-Dipyridylamino-functionalized siloles[J]. Chem Mater, 2004, 16(10): 1869-1877.
[19] Bai Dong-Ren and Wang Suning. Organoplatinum polymorphs with varying molecular conformation, intermolecular interaction, and luminescence[J]. Organometallics, 2006, 25(6): 1517-1524.
[20] Tan Runyu, Wang Zhibin, Li Yu, et al. Syntheses, structures, and luminescent properties of dipyridylamine-functionalized anthracene and its complexes[J]. Inorg Chem, 2012, 51(13): 7039-7049.
[21] Wolfe John P, Rennels Roger A and L Stephen. Buchwald. Intramolecular palladium-catalyzed aryl amination and aryl amidation[J]. Tetrahedron, 1996, 52(21): 7525-7546.
[22] Hartwig John F, Kawatsura Motoi, Hauck Sheila I, et al.Room-temperature palladium-catalyzed amination of aryl bromides and chlorides and extended scope of aromatic C-N bond formation with a commercial ligand[J]. J Org Chem, 1999, 64(15): 5575-5580.
[23] 邢孔强,刘煜,朱美香,等. 一种有机电致磷光材料中间体的合成及其光谱特性[J]. 中南林业科技大学学报,2007, 27(2):96-99.
[24] Shields Jason D, Ahneman Derek T, Graham Thomas J. A, et al. Enantioselective, nickel-catalyzed suzuki cross-coupling of quinolinium ions[J]. Chem Inform, 2014, 45(22): 142-145.
[25] To Sheung Chun and Kwong Fuk Yee. Highly efficient carbazolyl-derived phosphine ligands: application to sterically hindered biaryl couplings[J]. Chem Commun, 2011, 47: 5079-5081.
[26] Tseng Chia-Kai, Lee Chi-Rung, Tseng Mei-Chun, et al. Reactivity of[K3(phen)8][Cu(NPh2)2]3—a possible intermediate in the copper(I)-catalyzed N-arylation of N-phenylaniline[J]. Dalton Trans, 2014, 43: 7020-7027.
[27] Zhang Hui, Cai Qian, and Ma Dawei. Amino acid promoted CuI-catalyzed C-N bond formation between aryl halides and amines or N-containing heterocycles[J]. J Org Chem, 2005, 70(13): 5164-5173.
(责任编辑 胡小洋)
Synthesis and characterization of 8-(1,2,4-triazolyl) quinoline
LI Qian,CHEN Qiao, ZHANG Wenjin,CHEN Bulin,LIU Liping,WEI Qiong, LIU Li
(Hubei Collaborative Innovation Center for Advanced Organic Chemical Materials(Hubei University), Ministry of Education Key Laboratory for the Synthesis and Application of Organic Functional Molecules(Hubei University), Wuhan 430062, China)
Multidentate chelating ligands containing nitrogen were widely applied in the organic photoelectric materials. In this paper, 8-bromoquinoline was synthesized by Skraup method using 2-bromoaniline as starting material, then the title compound 8-(1,2,4-triazolyl)quinoline was synthesized by copper-catalylized C-N cross-coupling reaction and characterized by FT-IR, NMR(1H and13C), LC-MS TOF spectra.The structure of the title compound was confirmed.It provided an important precursor for subsequently designed luminescent metal complexes.
triazole; quinoline; synthesis; characterization
2016-11-08
国家自然科学基金(21671061)和湖北省自然科学基金(2013CFA087)资助
黎钱(1989-),男,硕士生;柳利,通信作者, E-mail: liulihubei@hubu.edu.cn
1000-2375(2017)04-0411-06
O626
A
10.3969/j.issn.1000-2375.2017.04.014
