融合胸腺素α1的猪干扰素α在毕赤酵母中的表达及效价测定
2017-07-07刘敏张晨瑶王飞翟彦生肖颖马立新余晓岚
刘敏,张晨瑶,王飞,翟彦生,肖颖,马立新,余晓岚
(生物资源绿色转化湖北省协同创新中心,湖北大学生命科学学院,湖北 武汉 430062)
融合胸腺素α1的猪干扰素α在毕赤酵母中的表达及效价测定
刘敏,张晨瑶,王飞,翟彦生,肖颖,马立新,余晓岚
(生物资源绿色转化湖北省协同创新中心,湖北大学生命科学学院,湖北 武汉 430062)
猪干扰素α(IFN-α)是在特定条件下由细胞产生的一种具有广谱、高效抗病毒活性的可溶性糖蛋白,胸腺素α1(Tα1)是一种具有免疫调节的活性肽.本研究中将Tα1基因与去掉信号肽序列的猪IFN-α N端融合,构建酵母表达载体PHBM-Tα1-IFNα,同时构建单独表达IFNα的重组质粒PHBM-IFNα,重组质粒电转化至毕赤酵母(Pichiapastoris)菌株,甲醛诱导表达.利用SDS-PAGE法检测融合蛋白的表达,并用细胞病变抑制法测定干扰素的效价.实验结果表明,酵母表达上清中IFNα的效价为2.916×106U/mL;Tα1-IFNα的效价为2.860×107U/mL,该结果证实胸腺素α1可提高融合表达蛋白猪干扰素的活性,因此,通过酵母表达体系获得高活性胸腺素-猪干扰素融合蛋白,可为高效、低成本获得抗病毒药物提供一种新的模式.
干扰素; 胸腺素Tα1; 毕赤酵母表达系统; 细胞病变抑制法
0 引言
干扰素是在特定条件下由细胞产生的一种高活性、多功能、低分子量的可溶性糖蛋白,具有广谱、高效抗病毒功能,且对免疫系统起速效多能的调节作用[1-2].干扰素根据免疫原性和分子结构的不同可分为3类:IFNα、IFNβ、IFNγ,IFNα因其独特的抗病毒活性、促机体免疫功能强、毒副作用小而并倍受研究者的重视,常用于病毒性疾病、肿瘤和自身免疫性疾病的治疗[3-7].临床证明,IFNα是抗乙型肝炎病毒(HBV)、慢性乙型肝炎(CHB)的干扰素药物中最具优势的一员,也是被FDA批准治疗慢性丙型肝炎的药品[8-9],研究者利用IFNα联合抗病毒药物,对慢性丙型肝炎患者等具有不同程度的疗效[10].IFNα具有调节免疫的功能,可作为免疫佐剂,增强特异性免疫应答,Schijns V等用破伤风毒素作为细菌抗原模型免疫3周龄的鸡,发现重组鸡IFNα可调节其体液免疫应答的产生[11-12].
胸腺肽Tα1是由28个氨基酸残基组成的高度保守的酸性肽,可促进免疫系统的活化.干扰素和胸腺肽具有相似和相辅相成的生物活性,它们的联合应用具有促进T细胞的生长、增殖、分化和激活NK细胞活性等功能,并有协同作用,可增强机体的免疫能力,对肿瘤和艾滋病以及其他病毒性疾病的治疗作用比它们单独使用时更强[13].已有研究者在大肠杆菌和家蚕中表达了人和鸡干扰素α2a和胸腺肽α1融合蛋白,但这些融合蛋白共同之处都是将胸腺肽α1融合在干扰素C端,有的没有加连接肽,有的连接肽为5个氨基酸(GGGGS),有的连接肽为12个氨基酸,有的连接肽为15个氨基酸(3个重复的GGGGS)[14-16],虽然这些融合蛋白能在大肠杆菌和家蚕系统中有效表达,但仍需研究者探讨新的表达方法提高其活性.
巴斯德毕赤酵母(Pichiapastoris)表达系统因其具有原核表达系统和真核表达系统的优点而广泛应用于蛋白表达[17].目前少见猪IFNα与胸腺肽融合后在酵母表达系统中表达的研究报道,鉴于酵母系统的易操作、低成本的优点,我们拟将猪IFNα与胸腺肽α1融合蛋白在毕赤酵母系统中表达.主要通过在猪IFNα的N端融合胸腺肽α1,以G-G-G-G-S为单位的2个重复作为连接肽,选择在毕赤酵母中表达该融合蛋白,并比较融合胸腺肽α1的猪IFNα与未融合胸腺肽α1的猪IFNα的效价差异,以期为获得高效抗病毒药物奠定基础.
1 材料和方法
1.1 菌株、质粒、细胞和病毒 大肠杆菌菌株XL10-Gold购自Stratagen 公司,毕赤酵母GS115菌株、含有胸腺肽的干扰素基因的菌株ABV25019购自Novagen 公司,细胞MDBK、病毒VSV购自于武汉大学菌种典藏中心,质粒pHBM905A由本实验室保存,质粒PHBM-Tα1-IFNα、PHBM-IFNα由本实验室构建.
1.2 主要试剂 培养基LB、NZY、YPD、MD、BMGY、BMMY按常规方法配制,细胞培养及牛血清均购自GIBCO公司,各种限制性核酸内切酶、PrimeSTARTM HS DNA聚合酶、SolutionI购自TaKaRa公司,DNA纯化试剂盒购自Vitagene公司,引物(表1) 均在上海桑尼生物科技有限公司合成,其他化学试剂均为分析纯.
1.3 方法
1.3.1 IFNα密码子优化及基因合成 IFNα(GenBankTM accession number AY687280)的原始序列为570 bp,其前69个碱基序列为该基因在Sus scrofa中的信号肽序列.本研究中,该信号肽序列被毕赤酵母表达载体中的信号肽序列α-MF代替.在蛋白质序列不改变的前提下,对去掉信号肽序列的IFNα序列利用DNAWORKS工具进行优化,优化后的基因序列IFNα全部由毕赤酵母偏爱密码子组成,依照此序列合成获得IFNα基因的引物,通过overlapping PCR方法获得IFNα全长基因,送上海英俊生物公司测序.1.3.2 IFNα毕赤酵母表达载体的构建及重组酵母菌株的获得 将酶切处理的pHBM905A载体和IFNα片段混合,在16 ℃条件下,用SolutionⅠ处理3 h后,转化大肠杆菌XL10-Gold, PCR鉴定为阳性的重组子随机挑选3个送上海捷瑞生物工程有限公司测序,阳性重组质粒命名为pHBM-IFNα.然后按常规方法转化至酵母菌株中,PCR鉴定转入与否.
1.3.3 重组IFNα在毕赤酵母中表达SDS-PAGE分析 挑取待表达的重组毕赤酵母单菌落于50 mL BMGY液体培养基中(按≤10%装瓶),28 ℃,250 r/min摇床培养至OD600=20.收集菌体,去上清,细胞沉淀全部转移至50 mL BMMY液体培养基中,250 r/min,每隔24 h加入甲醇诱导一次,甲醇加入量为培养基总体积的1%.收集诱导表达上清按常规方法进行SDS-PAGE检测外源基因是否表达.

表1 引物序列
1.3.4 Tα1和Tα1-IFNα片段克隆 按照GenBank TM accession number ABV25019的表达菌株含有的Tα1的序列合成引物,然后通过同源臂的PCR方式获得Tα1基因,再以PCR方式获得全长Tα1-IFNα片段,PCR鉴定片段大小正确与否.
1.3.5 Tα1-IFNα毕赤酵母表达载体的构建、转化及鉴定 参照方法1.3.2,获得Tα1-IFNα的毕赤酵母表达载体,然后按照常规的方法转化酵母菌株,PCR检测鉴定,经甲醇诱导后SDS-PAGE检测融合蛋白的表达情况.

2 结果
2.1 IFNα基因的合成和毕赤酵母表达载体的构建 按照表1中的引物序列合成引物,利用overlapping PCR方法,以IFNα的18条引物互为模板退火、延伸,30循环反应后以琼脂凝胶回收PCR产物,用该回收产物为模板,以IFNα-1、IFNα-18为引物进行第二次PCR扩增.PCR结果如图1所示,在约500 bp处有明显的条带.回收该片后序列测定证实,获得片段的基因序列与预期的IFNα的完全一致.
2.2 重组质粒pHBM-IFNα的构建及重组酵母菌株获得 用CopⅠ和NotⅠ酶切pHBM905A载体,产物均为含有粘性末端的线性片段,琼脂糖凝胶回收酶切产物.用T4 DNA聚合酶和dTTPs消化琼脂糖凝胶回收的全长IFNα基因片段,这时IFNα会产生成与pHBM905A载体经酶切后互补的粘性末端.将全长IFNα基因与载体连接后转化至大肠杆菌XL10-Gold,抽提质粒PCR和序列测定鉴定,并将鉴定正确的阳性重组质粒命名为pHBM-IFNα(见图2).
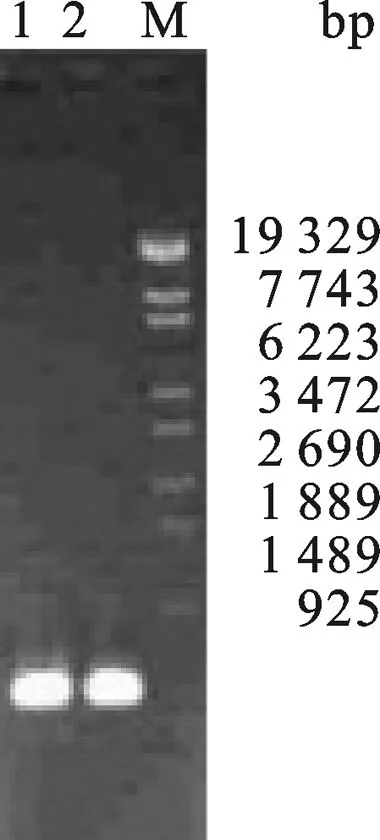
图1 IFNα PCR产物琼脂糖凝胶电泳分析M: λEco T14 DNA Marker; 1,2: IFNα PCR product.
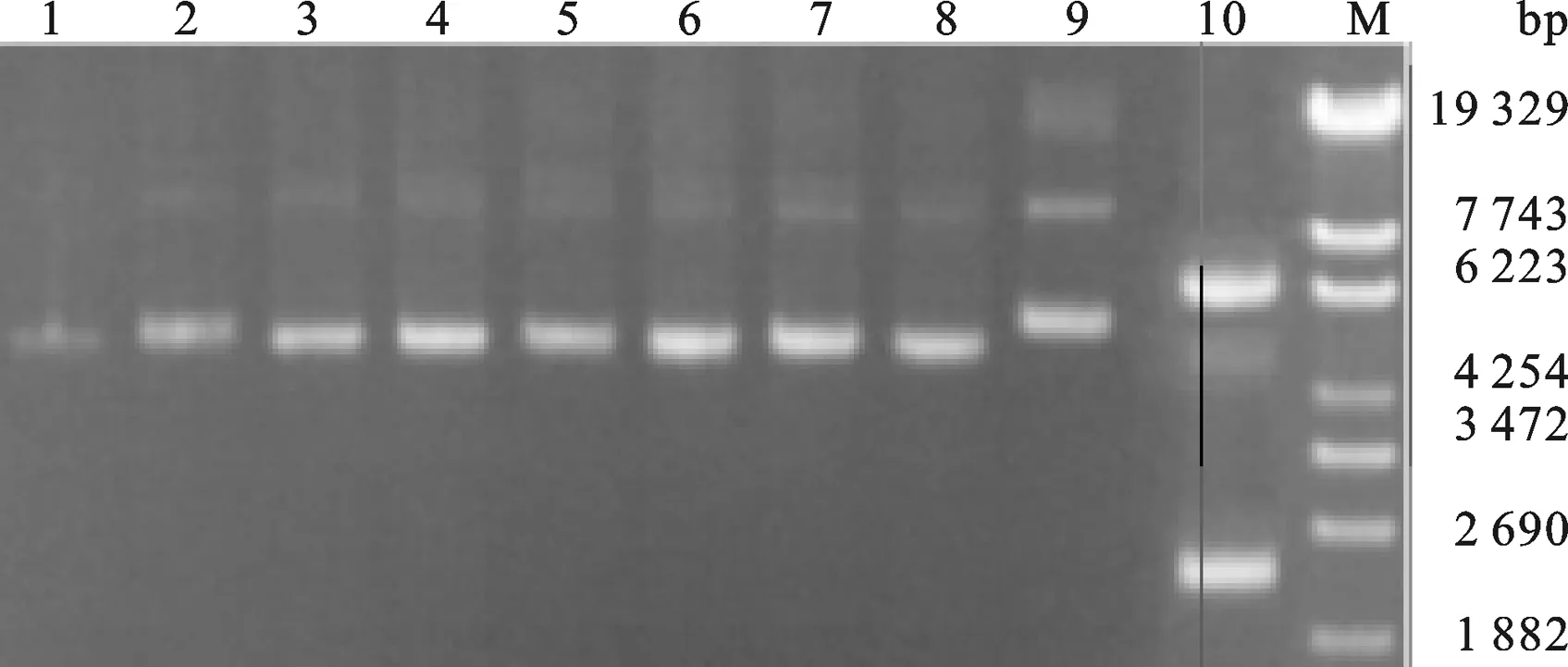
图2 IFNα毕赤酵母重组子鉴定18: pHBM-IFNα recombinants plasmids isolated from E.coli XL10-Gold strain.9: pHBM905A control vector isolated from E.coli XL10-Gold strain.

2.3 重组 IFNα在毕赤酵母中表达鉴定 将方法1.3.2中挑取待表达的重组毕赤酵母单菌落于50 mL BMGY液体培养基中(按≤10%装瓶),28 ℃,250 r/min摇床培养至OD600=20.收集菌体,去上清,细胞沉淀全部转移至50 mL BMMY液体培养基中,250 r/min,每隔24 h加入甲醇诱导一次,甲醇加入量为培养基总体积的1%.诱导一周后,收集的表达上清,加入样品处理液,进行SDS-PAGE电泳检测,考马斯亮蓝染色.检测结果如图4所示,在约21 kD处出现特异性条带,蛋白大小与IFNα预期一致,同时,在大于21 kD处也出现了一条糖基化的IFNα条带,该结果证实IFNα在毕赤酵母菌株中成功表达.
2.4 Tα1和Tα1-IFNα片段克隆 以原有融合胸腺肽的干扰素基因(GenBankTM accession number ABV25019)的表达菌株为模板,用905A-ifn-F、905A-ifn-R两条引物扩出融合胸腺肽Tα1的IFN片段.回收处理后以IFN片段为模板,用Tα1-F、Tα1-R两条引物扩出胸腺肽Tα1片段,PCR结果如图5所示,获得片段大小与预期相符.

图3 IFNα毕赤酵母转化子PCR鉴定M: λEco T14 DNA Marker.13: pHBM-IFNα transformed Pichia pastoris colonies. 4: pHBM905A transformed Pichia pastoris colonies.
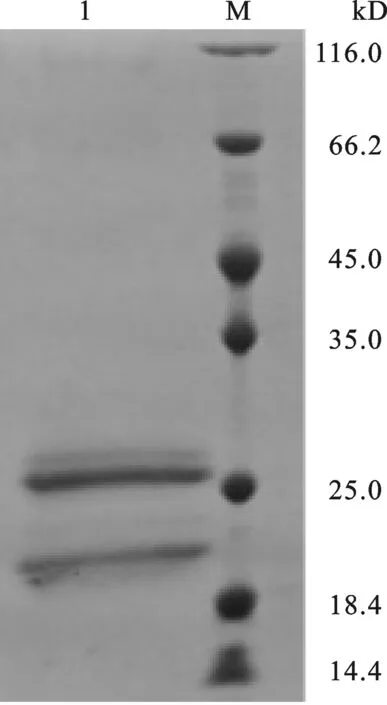
图4 IFNα在毕赤酵母中表达SDS-PAGE鉴定M: Protein Marker. 1: IFNα protein.

图5 胸腺肽Tα1的PCR鉴定12: Tα1PCR product.
以IFN片段为模板,用Tα1-IFNα、IFNα-18两条引物扩出IFNα+(与胸腺肽Tα1带17个bp的同源臂).然后再以胸腺肽Tα1和IFNα+ 为模板,用Tα1-F和IFNα-18两条引物拟扩出Tα1-IFNα,PCR结果如图6所示,片段大小与预期相符,同时将PCR产物回收后送上海生工进行序列测定,结果表明片段序列与预期完全一致.
2.5 Tα1-IFNα毕赤酵母表达载体的构建 按照2.2中用CopⅠ和NotⅠ酶切pHBM905A载体,产物为含有粘性末端的线性片段,然后琼脂糖凝胶回收酶切产物.然后,在T4 DNA聚合酶处理2.3中回收的Tα1-IFNα体系中加入dTTPs,Tα1-IFNα会产生成与pHBM905A载体经酶切后互补的粘性末端.最后,将酶切好的pHBM905A载体和Tα1-IFNα片段混合,在16 ℃条件下,用SolutionⅠ处理3 h后,转化大肠杆菌XL10-Gold,重组子经PCR鉴定(图7) 有一个样品的条带大小与预期相符.将与预期大小相符的重组子抽提质粒后送上海测序,测序结果显示序列与预期完全一致,将质粒命名为pHBM-Tα1-IFNα.
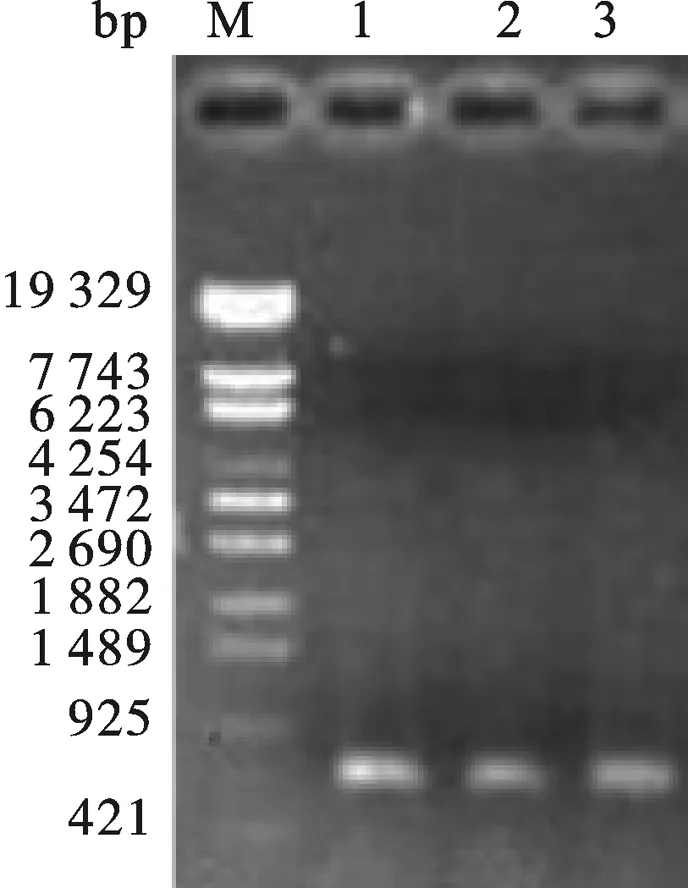
图6 Tα1-IFNα PCR鉴定13: Tα1-IFNα PCR product.
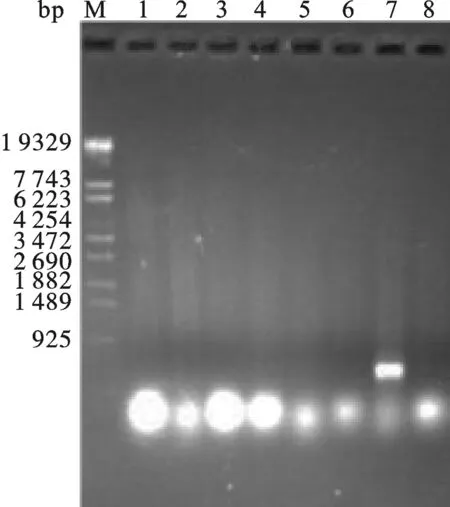
图7 毕赤酵母Tα1-IFNα重组质粒的PCR产物琼脂糖凝胶电泳鉴定16, 8: PCR product from pHBM905A E.coli XL10-Gold strain. 7: PCR product from pHBM-Tα1-IFNα E.coli XL10-Gold strain.Tα1-IFNα PCR product. M: λEco T14 DNA Marker.

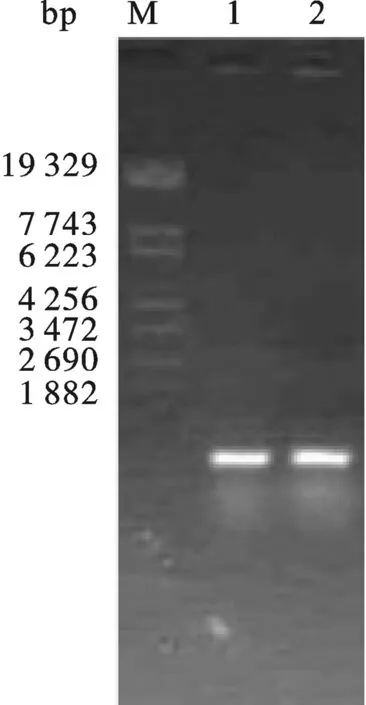
图8 pHBM-Tα1-IFNα毕赤酵母转化子PCR鉴定M: λEco T14 DNA Marker.12: pHBM-IFNα transformed Pichia pastoris colonies.
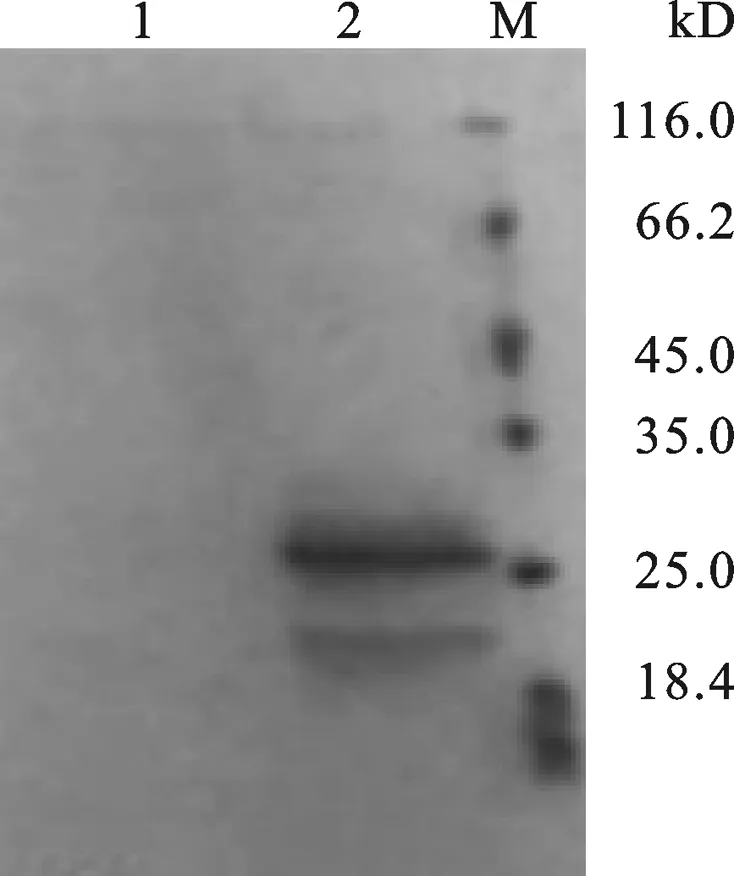
图9 Tα1-IFNα 融合蛋白的SDS-PAGE鉴定1: Control. 2: Tα1-IFNα protein. M: protein marker.

3 讨论
猪IFNα是一种具有广谱的抗病毒活性的细胞因子,具有高效、无药物残留、无副作用等优点,Tα1也是一种具有免疫活性的生态制剂,与多种药物联合使用有促进作用,其中包括与IFNα同时使用具有互促和叠加效应,能明显提高抗病毒效果[18-21].临床上使用的Tα1主要是靠人工合成,利用低成本研制出高效的胸腺肽以及胸腺肽与干扰素的融合蛋白一直是研究者探讨的方向.有研究者探讨了利用大肠杆菌表达Tα1-IFNα,旨在降低生产成本并提高两者抗病毒功效.尽管张鹏等[22]成功表达了Tα1-IFNα融合蛋白,但可能由于大肠杆菌系统表达的蛋白结构简单,没有复杂的修饰,因此也少见该产品在生产实际中的应用.也有研究者在毕赤酵母中单独表达了人Tα1-IFNα融合蛋白,其效价高、类天然结构、毒素含量低以及安全,为人类研究新的抗病毒制剂提供了一种模式[23-24],但目前仍少见在毕赤酵母中表达Tα1-IFNα的相关研究报道.
本研究分别将单独猪IFNα及猪IFNα与胸腺素α1(Tα1)的融合蛋白Tα1-IFNα在毕赤酵母中进行表达,并且比较了这两种蛋白在抗病毒效价上的差异.与传统的克隆表达方法相比,本研究具有的优势是:利用基因合成的方法合成了猪IFNα,可根据毕赤酵母密码子偏爱性进行优化后合成,该方法获得的基因既不受基因资源的限制,又可高效获得突变体;利用毕赤酵母表达系统表达猪IFNα、Tα1-IFNα,易于纯化,表达的蛋白经过酵母系统的修饰,具有类似于天然状态的活性;干扰素和胸腺肽具有相似和相辅相成的生物活性,如免疫调节,这种融合方式表达可将它们的优势进行叠加.我们将在毕赤酵母中单独或融合表达的蛋白经用细胞病变抑制法测定了其效价,结果表明这两种重组蛋白都具显著的生物学活性,都能有效抑制VSV对MDCK细胞的病变效应,其中IFNα的效价为2.916×106U/mL;Tα1-IFNα的效价为2.86×107U/mL,从该结果可以看出,与Tα1融合的猪干扰素的抗病毒效价明显高于单独表达的猪IFNα的抗病毒效价,这与以前研究的Tα1能促进与其融合药物的效价结果相符[20-21].
猪IFNα与Tα1融合表达后虽然在抗病毒方面出现了一些叠加效应,但并未达到我们预期的效果,分析原因可能是产生了复杂的糖基化,封闭了干扰素的活性位点,进而影响其效价.因此可对该研究中表达融合蛋白Tα1-IFNα的菌株诱导表达条件进行探讨,提高表达量同时降低蛋白的糖基化;同时我们也可以通过Bio-brick的方法将目的片段的表达单元串联起来,增加拷贝数量,从而在一定程度上提高表达量.该研究在毕赤酵母中所表达的融合猪干扰素Tα1-IFNα对VSV具有较强的抗病毒活性,较之单独在毕赤酵母表达的猪干扰素IFNα,表现出一定程度的叠加效应,因此,用毕赤酵母系统表达与Tα1融合猪干扰素Tα1-IFNα的方法,可望为养猪业提供一种新的抗病毒药物制备模式.
[1] Kuruganti S, Accavitti-Loper M, Walter M. Production and characterization of thirteen human type-I interferon-α subtypes[J]. Protein Expr Purif, 2014, 103:75-83.
[2] Carvalho O, Saraiva G, Ferreira C, et al. In-vitro antiviral efficacy of ribavirin and interferon-alpha against canine distemper virus[J]. Can J Vet Res, 2014, 78(4):283-289.
[3] George D, Lionel B. Overview of the biology of type I interferons[J]. Arthritis Research & Therapy, 2010, 12(1):S1.
[4] Angell T, Lechner M, Jang J, et al. MHC class I loss is a frequent mechanism of immune escape in papillary thyroid cancer that is reversed by interferon and selumetinib treatment in vitro[J]. Clin Cancer Res, 2014, 20(23):6034-6044
[5] Daliento L, Calabrese F, Tons F,et al. Successful treatment of enterovirus-induced myocarditis with interferon-a[J]. J Heart Lung Transplantation,2003,22(2)l 214-217.
[6] Shao J, Cao C, Bao J, et al. Characterization of bovine Interferon α1: expression in yeast pichia pastoris, biological activities, and physicochemical characteristics[J]. J Interferon Cytokine Res, 2014, [Epub ahead of print], doi:10.1089/jir.2013.0139.
[7] Mirvis E, Mandair D, Garcia-Hernandez J, et al. Role of interferon-alpha in patients with neuroendocrine tumors: a retrospective study[J]. Anticancer Res,2014, 34(11):6601-6607.
[8] Xu Y, Qi W, Wang X, et al. Pegylated interferon α-2a plus ribavirin for decompensated hepatitis C virus-related cirrhosis: relationship between efficacy and cumulative dose[J]. Liver Int, 2014, 34(10):1522-1531.
[9] Zhong H, Gane E, Lim S, et al. Reduction of HBV replication prolongs the early immunological response to IFNα therapy[J]. J Hepatol, 2014, 60(1):54-61.
[10] Baltayiannis G, Karayiannis P. Treatment options beyond IFNα and NUCs for chronic HBV infection: expectations for tomorrow[J]. J Viral Hepat, 2014, 21(11):753-761.
[11] Schijns V, Weining K, Nuijten P, et a1. Immunoadjuvant activities ofE.coli-and plasmid-expressed recombinant chick-eu IFN-alpha/beta, IFN-gamma and ILolbeta in 1-day-and 3-week-old chickens[J]. Vaccine, 2000, 18(20):2147-2154.
[12] Them N C, Berg T, Gisslinger B, et al. Molecular responses and chromosomal aberrations in patients with polycythemia vera treated with peg-proline-interferon alpha-2b[J]. Am J Hematol, 2014, doi: 10.1002/ajh.23928 [Epub ahead of print].
[13] Loggi E, Gramenzi A, Margotti M, et al. In vitro effect of thymosin-alpha1 and interferon-alpha on Th1 and Th2 cytokine synthesis in patients with eAg-negative chronic hepatitis B[J]. J Viral Hepat, 2008, 15(6):442-448.
[14] 郭冬生,朱成钢,张耀洲,等.人干扰素α2b和胸腺肽α1融合蛋白的融合基因在家蚕细胞中的表达和活性研究[J]. 生物化学与生物物理进展,2003,30(5):803-807.
[15] 王佳,孙铭泽,赵宇.鸡干扰素α1及胸腺肽α1融合蛋白原核表达系统的建立[J].中国兽医学报,2008,28(10):1185-1189.
[16] Yang Y, Zhao W, Zhong Y, et al. Comparison of the efficacy of thymosin alpha-1 and interferon alpha in the treatment of chronic hepatitis B: a meta-analysis[J]. Antiviral Res, 2008, 77(2):136-41.
[17] Montesino R, Garcia R, Quintero O, et al. Variation in N-linked oligosaccharide structures on heterologous proteins secreted by the methylotrophic yeast pichia pastoris[J]. Protein Expr Purif, 1998,14:197-207.
[18] Guan Q. Efficacy of interferon and thymic peptide for treatment of chronic hepatitis B[J]. J Medical Forum, 2009, 30(19):6-7.
[19] Shao C, Tian G, Huang Y, et al. Thymosin alpha-1 transformed bifidobacterium promotes T cell proliferation and maturation in mice by oral administration[J]. International Immunopharmacology, 2013, 15(3):646-653.
[20] Xiang X, Li N, Zhao Y, et al. Combination therapy with thymosin alpha1 and dexamethasone helps mice survive sepsis[J]. Inflammation,2014, 37(2):402-416.
[21] Chang Y, Li M, Yang H, et al. Roles of thymosins in cancers and other organ systems[J]. World J Surg, 2005, 29(3):254-270.
[22] 张鹏,李明谦,郝林琳,等. 猪干扰素α1与胸腺肽α1融合蛋白原核表达系统的建立[J].吉林农业大学学报,2012,34(4):449-453.
[23] Yang Y, Yuan H, Liu N, et al. Construction, expression and characterization of human interferon α2b-(G4S)n-thymosin α1 fusion proteins inPichiapastoris[J]. World J Gastroenterol, 2005, 11(17):2597-2602.
[24] Flores-Ocelotl M, Rosas-Murrieta N, Vallejo-Ruiz V, et al. Transcription of interferon stimulated genes in response to porcine rubulavirus infection in vitro[J]. Braz J Microbiol, 2011, 42(3):1167-1175.
(责任编辑 游俊)
Expression,characterization of the porcine interferon α-thymosin α1 fusion protein a inPichiapastoris
LIU Min, ZHANG Chenyao, WANG Fei, ZHAI Yansheng, XIAO Ying, MA Lixin, YU Xiaolan
(Hubei Collaborative Innovation Center for Green Transformation of Bio-resources, College of Life Science, Hubei University, Wuhan 430062,China)
Porcine interferon α(IFNα) is a broad-spectrum, highly efficient antiviral glycoprotein which is produced by cells in the specific conditions. Thymosin alpha 1(Tα1) is a kind of immune regulation peptide. Here, we constructed the fusion protein vector pHBM-Tα1-IFNα, putting Tα1 gene on the N terminal of porcine IFNα gene with the yeast expression vector pHBM respectively. The recombinant plasmids were electroporated intoPichiapastorisstrain and induced to express by formaldehyde. The fusion proteins were detected by SDS-PAGE method. We tested the potency of fusion interferon by cytopathic inhibition method. Results showed that the titer in the supernatant of yeast expression of IFNα was 2.916×106U/mL, and the Tα1-IFNα titer was 2.860×107U/mL. These results confirmed that the Tα1 could increase the activity of fusion porcine interferon. Therefore, the higher activity of porcine interferon by fusing Tα1 inPichiapastorisyeast expression system may provide a new model for developing high efficiency and low cost antiviral drugs.
interferon; thymosin alpha 1;Pichiapastorisexpression system; CPE reduction assay
2016-11-14
国家自然科学基金(31172320、31672561)资助
刘敏(1994-),女,硕士生;余晓岚,通信作者,副教授,E-mail: yxiaolan@163.com
1000-2375(2017)04-0347-07
Q939.91;Q782
A
10.3969/j.issn.1000-2375.2017.04.004
