MRI测量肿瘤大小变化评价局部进展期乳腺癌NAC疗效的研究*
2017-07-07北京大学深圳医院医学影像科广东深圳518036
北京大学深圳医院医学影像科 (广东 深圳 518036)
石 桥 周 雯 戚玉龙 周靖宇 谢婷婷 言伟强 单慧明
MRI测量肿瘤大小变化评价局部进展期乳腺癌NAC疗效的研究*
北京大学深圳医院医学影像科 (广东 深圳 518036)
石 桥 周 雯 戚玉龙 周靖宇 谢婷婷 言伟强 单慧明
目的 探讨局部进展期乳腺癌NAC前后MRI增强测量病变大小变化对于疗效评估的作用。方法 回顾性分析127例病理确诊的局部进展期乳腺癌,接受4-6个周期NAC。分别于NAC前、NAC 2周期后、4周期后行动态增强扫描。术前临床反应性评价按照RECIST分级。术后病理反应性评价按照Miller & Payne改良病理反应性分级比较术前临床反应性与术后病理反应性的符合度。结果 以Miller & Payne病理反应性分组为金标准,其中MHR组69例,NMHR组58例。NAC 2、4周期后RECIST标准判断术前化疗反应性与术后病理反应性分组差异具有显著性(P<0.05)。ROC分析显示NAC 2、4周期后最大径变化率曲线下面积(Az)分别为0.66、0.73。NAC 2、4周期后最大径变化率最佳诊断截断点分别为42.68%及58.90%。结论 NAC 2周期后癌灶大小可早期预测局部进展期乳腺癌病理反应性,以4周期后癌灶最大径评估效能较高,以NAC 4周期肿瘤最大径变化率大于58.90%作为判断治疗有效的标准可提高诊断准确性。
乳腺肿瘤;新辅助化疗;磁共振成像;肿瘤大小;病理学
近年来,新辅助化疗(NAC,neoadjuvant chemotherapy)应用于局部进展期乳腺癌(locally advanced breast cancer,LABC),以达到肿瘤降期,使原本不可切除的肿瘤获得手术机会甚至达到保乳的目的[1]。MRI作为诊断乳腺癌非常敏感的检查手段[2],目前已作为乳腺癌NAC后检出残留病灶及评价化疗效果的重要方法。本研究探讨局部进展期乳腺癌NAC前后MRI增强测量病变大小变化对于NAC疗效评估的作用。
1 材料和方法
1.1 一般资料选取2007年9月至2016年11月,术前穿刺活检诊断为乳腺癌,行新辅助化疗并以MRI监测化疗效果的病例,临床及影像资料完整。
1.2 MRI扫描技术使用GE 1.5 T MR扫描仪(GE Medical System,Signa Excite,HD),4通道双穴乳腺相控阵线圈。常规扫描方案包括横断面短TI反转恢复,T2WI TR 5000.0ms,TE 37.8ms,横断面双回波T1WI TR 180.0ms,TE 2.4及4.8ms。增强扫描行轴位乳腺容积成像(volume imaging for breast assessment,VIBRANT)。相关参数:TR/TE:6.0/2.6ms,层厚:2.4mm,层间距:1.2mm,FOV:32mm×32mm,矩阵:324×288,扫描时间:每个时相58s,共扫描6-8个时相。增强扫描使用高压注射器经静脉注射Gd-DTPA,剂量0.1mmol/kg体重,注射流率3.0ml/s。
1.3 乳腺癌病理反应性分级标准所有病理切片由1名高年资乳腺病理学家在不知道MRI结果的情况下进行评价并与术前穿刺组织学切片标本比较。根据Miller & Payne改良病理反应性分级标准,比较镜下肿瘤细胞的退缩情况,病理学反应性分级见文献[1]。
1.4 图像分析在ADW 4.2图形工作站上由1名不知道病理结果的医师用Functool 2.0软件包处理图像,选择增强早期图像,测量肿瘤最大径3次,取平均值,记录为DN,N为第N次MR检查,多灶肿瘤测量每个癌灶最大径线并计算总和作为其最大径。分别计算NAC 2周期后癌灶大小变化率(⊿D2%)、NAC 4周期后癌灶大小变化率(⊿D4%):⊿D2%=[(D1-D2)/ D1]×100% (1);⊿D4%=[(D1-D3)/D1]×100% (2)。
临床反应性分组按照实体肿瘤反应性评估标准(Response Evaluation Criteria in Solid Tumors, RECIST)[3]。
1.5 NAC 2、4周期后REICST标准判断的临床反应性及Miller & Payne改良病理反应性标准比较。
1.6 统计分析统计软件采用SPSS 18.0统计软件包。NAC 2、4周期后临床反应性与术后病理反应性评价采用χ2检验。以术后病理反应性分组作为金标准,对NAC 2、4周期后肿瘤最大径变化率进行受试者工作曲线(Receiver operating characteristic curve,ROC)分析。P<0.05认为差异有统计学意义。
2 结 果
2.1 研究对象组成最终入选病例127例,均为女性,年龄28~79岁,平均(50.1±9.4)岁。所有患者均接受4~6周期的新辅助化疗,其中85例(66.9%)接受AT方案,8例(6.3%)接受CAF方案,34例接受其他化疗方案(26.8%)。
2.2 临床及病理情况NAC前癌灶最大径中位数3.10cm,范围(0.60~12.10)cm,NAC 2周期后最大径中位数2.20cm,范围(0~9.60)cm。NAC 4周期后最大径中位数1.70cm,范围(0~7.0)cm,9例CR。NAC前粗针穿刺病理浸润性导管癌117例(92.13%),浸润性小叶癌5例(3.94%),化生性癌2例(1.57%),粘液癌、大汗腺癌及DCIS各1例(0.79%)。术后按照Miller & Payne改良病理反应性标准分组,MHR组69例,NMHR组58例。病理判断为pCR 28例。
2.3 NAC 2周期癌灶临床反应性评价与术后病理反应性差异具有显著性(χ2=9.125,P<0.05);NAC 4后周期癌灶临床反应性评价与术后病理反应性差异具有显著性(χ2=8.81,P<0.05),见表1。
2.4 对NAC 2、4周期后癌灶最大径变化率行ROC曲线分析(图1),NAC 2、4周期后曲线下面积Az分别为0.66、0.73(P<0.001),最佳截断点分别为42.68%及58.90%。以NAC 4周期后最大径变化率为诊断指标具有较高的诊断效能(Az=0.73,95% CI:0.62~0.80)且差别具有统计学意义(P<0.05),见表2。
3 讨 论
乳腺癌癌灶大小及邻近关系直接影响肿瘤的治疗方式。通过NAC,越来越多此前不适合手术的患者得以降期手术,部分甚至得以实施保乳手术。不论哪种亚型的乳腺癌,初次手术切缘阴性将减低肿瘤复发的可能性[2],因此要求准确判断NAC后癌灶大小,并且NAC化疗后癌肿体积或最大径变化也是评价NAC疗效的常用指标[4],是癌灶对化疗反应最直观的表现,这与大多数恶性肿瘤对化疗的反应一致。
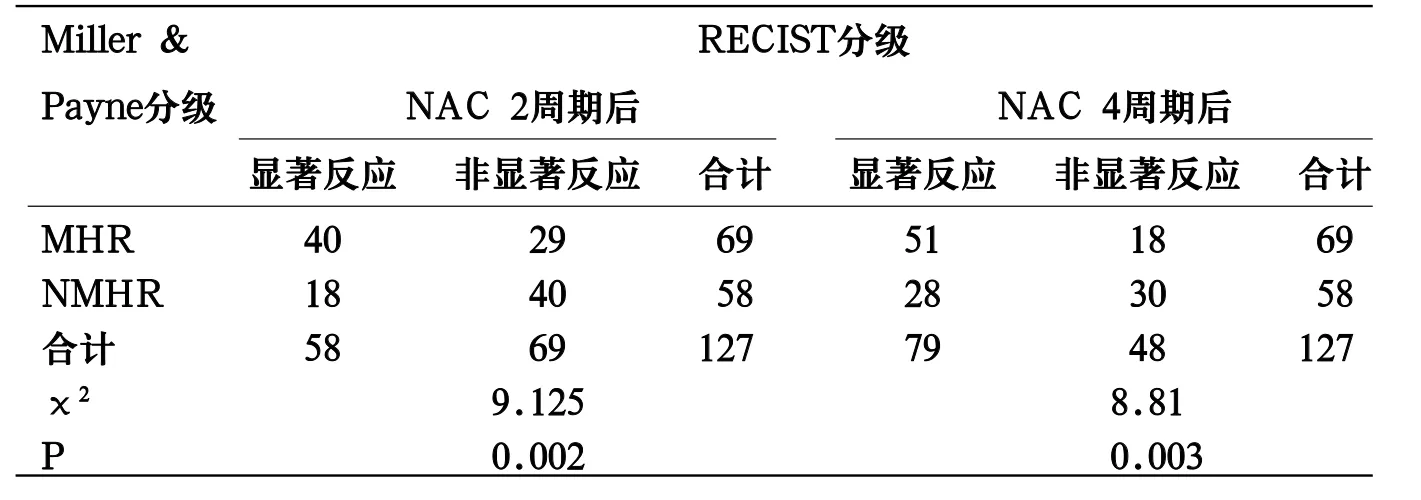
表1 化疗2、4周期后RECIST分级与病理反应性对照
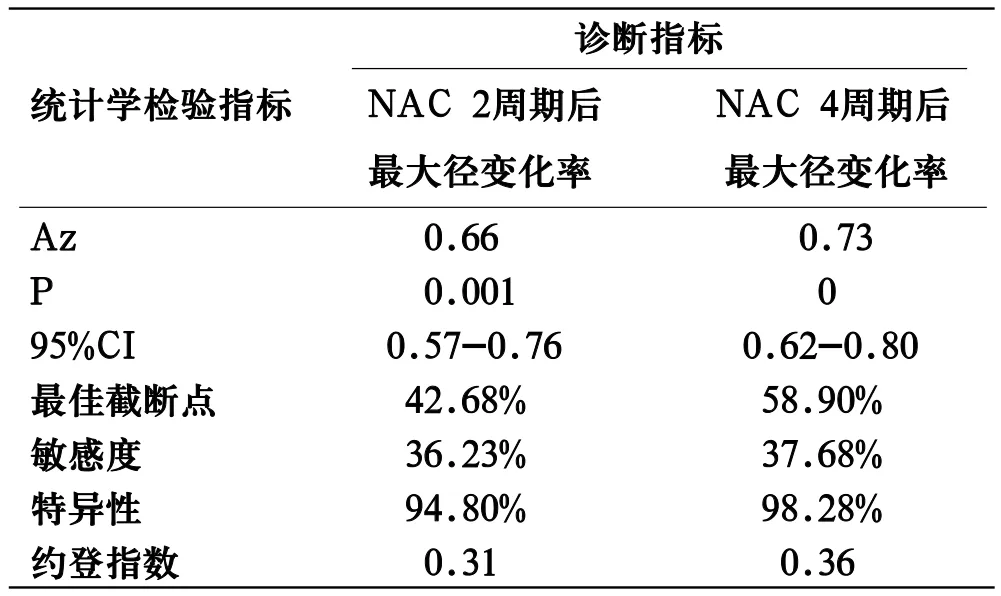
表2 ROC曲线评价NAC后癌灶最大径变化率对化疗效果的评估效能
MRI通过含钆对比剂显示残留癌灶,已被证明是评价NAC后残留癌灶最为敏感的诊断方法[5],在预测癌灶大小上也同样具有较高准确性[6]。尽管癌灶与病理测量大小的一致性随化疗时间延长而呈下降趋势,但仍具有较高的相关性[7],本组病例行ROC分析,NAC 4周期最大径变化率NAC 4周期后最大径为58.90%作为诊断指标具有较高的诊断效能(图2)。RECIST标准是评价肿瘤化疗反应性的常用标准[3],也适用于乳腺癌NAC早期化疗评估以优化化疗方案及制定手术方式[5]。RECIST分级的标准定义的是化疗晚期癌灶最大径缩小超过30%即为肿瘤对化疗具有反应性,但却未对化疗早期癌灶变化的阈值做出定义。本研究按照RECIST标准对入组病例进行分组,结果与病理反应性分组比较具有显著性差异,提示术前RECIST标准临床反应性评价以肿瘤最大径变化30%作为有效标准可能高估化疗反应性。本研究以术后病理反应性分级作为金标准对入组病例进行ROC分析。在NAC 2、4周期后癌灶最大径变化率对NAC效果的评估效能中等,曲线下面积分别为0.66及0.73,NAC 4周期后评估效能较高。NAC 2周期癌灶最大径变化率大于42.68%,NAC 4周期后癌灶最大径变化率大于58.90%作为治疗有反应的标准有较高的诊断准确性。
近年来,部分文献对RECIST分级对乳腺癌预测NAC反应的准确性提出质疑并对影响因素进行分析[4],Wasser[8]认为组织学的退变不一定与肿瘤大小有关,仅仅提示肿瘤细胞的减少及治疗反应变化,NAC后肿瘤大小可能因瘤床内各种病理改变而被高估或低估,接近67%的肿瘤都会出现化疗所致的纤维间质增生[9]。本组病例中1例NAC后肿瘤增大大于30%,术后病理反应性为G4,属于MHR组,病理提示为化生性癌,瘤灶内较多坏死及纤维成分(图3)。MRI测量癌灶大小通常基于CE-MRI,而有研究认为治疗引起的反应性改变可明显引起非特异性的强化[10],高估病例其周围正常细胞增殖、血管生成及炎性反应率均高于正常组织。使用病理反应性分级作为评价标准,是以细胞密度变化为基础,并不考虑残留肿块的大小。活检位点不佳、穿刺标本量较少等主客观因素常影响术后病理分级。因此,尽管使用肿瘤退缩率或病理反应性分级判断肿瘤对化疗反应评价结果可能不一致,但就目前应用来看,RECIST分级在术前即可获得,应用RECIST标准结合其他MRI诊断指标如TIC曲线及DWI以评价NAC疗效;Miller & Payne分级在术后取得病理标本进行切片染色后方能进行,因此回顾性分析参考Miller & Payne分级标准进行术后治疗方案制定,在二者不一致时应复习MRI图像及病理切片。
本研究不足之处,本组患者中缺少PD患者,CR患者数量较少,无法讨论不同病理分组情况下这两种肿瘤实体反应性分类与病理反应性之间的相关性。未能按照病理组织分型及化疗方案分组比较。
NAC 2周期后癌灶大小可早期预测局部进展期乳腺癌病理反应性,以4周期后癌灶最大径评估效能较高,NAC 4周期肿瘤最大径变化率大于58.90%作为判断治疗有效的标准可提高诊断准确性。
[1] Ogston KN, Miller ID, Payne S, et al. A new histological grading system to assess response of breast cancers to primary chemotherapy: prognostic significance and survival [J]. Breast, 2003,12(5):320-7.
[2] G Amano,N Ohuchi,T Ishibashi et al. Correlation of threedimensional magnetic resonance imaging with precise histopathological map concerning carcinoma extension in the breast [J]. Breast Cancer Res Treat,2000,60:43-55.
[3] Suzuki C,Jacobsson H,Hatschek T,et al. Radiologic measurements of tumor response to treatment: practical approaches and limitations [J]. Radiographics,2008,28(2):329-44.
[4] Rominger, M,Berg,D,Frauenfelder,T.et al.Which factors influence MRI-pathology concordance of tumour size measurements in breast cancer[J] Eur Radiol,2016,26(5):1457-1465.
[5] Woodhams R,Kakita S,Hata H,et al. Identification of residual breast carcinoma following neoadjuvant chemotherapy:diffusionweighted imaging-comparison with contrast-enhanced MR imaging and pathologic findings[J]. Radiology,2010,254(2):357-366.
[6] Harms SE,Flamig DP,Hesley KL,et al.MR imaging of the breast with rotating delivery of excitation off resonance: clinical experience with pathologic correlation[J].Radiology,1993, 187(2):493-501.
[7] Belli P,Costantini M,Malaspina C,et al. MRI accuracy in residual disease evaluation in breast cancer patients treated with neoadjuvant chemotherapy[J].Clin Radiol,2006, 61(11):946-953.
[8] Wasser K,Sinn HP,Fink C,et al.Accuracy of tumor size measurement in breast cancer using MRI is influenced by histological regression induced by neoadjuvant chemotherapy[J]. Eur Radiol,2003,13:1213-1223.
[9] Fisher ER,Wang J,Bryant J,et al. Pathobiology of preoperative chemotherapy. Findings from the National Surgical Adjuvant Breast and Bowel Project (NSABP) Protocol B-18[J].Cancer, 2002,95:681-695.
[10] Knopp MV,Brix G,Junkermann HJ,et al. MR mammography with pharmacokinetic mapping for monitoring of breast cancer treatment during neoadjuvant therapy[J].Magn Reson Imaging Clin N Am,1994,2(4):633-658.
An Assessment of MRI Tumor Size Measurement Predict Clinical and Pathological Response of Locally Advanced Breast Cancer Undergoing Neoadjuvant Chemotherapy*
SHI Qiao, ZHOU Wen, QI Yu-long,et al., Medical Imaging Center, Peking University Shenzhen Hospital, Shenzhen 518036, Guangdong Province, China
Objective To study the value of the maximum diameter of tumor in evaluating the therapeutic effect of neoadjuvant chemotherapy for locally advanced breast cancer (LABC). Methods 127 women with LABC underwent dynamic CEMRI examination before chemotherapy, after the 2nd cycle and the 4th cycle of chemotherapy. All patients were divided into major histological response group (MHR) and non-major histological response group (NMHR) according to the final pathologic response. The response to NAC before surgery evaluated by the variance of tumor size was compared to pathologic response after surgery. ROC curve analysis was performed to assess the effect of the maximum diameter and the variance of tumor size (⊿D %) in predicting the pathologic response to the NAC treatment. Results 127 cases of LABC patients were divided into a MHR group of 68 cases and a NMHR group of 59 cases. The response to NAC after 2ndand the 4th cycle of NAC before surgery evaluated by RECIST criterion was signif i cant difference to pathologic response(P<0.05) after surgery. Az(area under curve) of The maximum diameter variance rate of the tumor after 2ndand 4thcycle were 0.66 and 0.73 respectively. The best diagnose cut off were variance rate of 42.68% and 58.90% respectively. Conclusion The maximum diameter variance rate of the tumor after 2nd cycles of NAC may be useful in predicting the f i nal pathological response of breast cancer to NAC treatment, but which after the 4thcycle would be more eff i ciency. Take the variance rate greater than 58.90% as diagnostic criteria to def i nite the response level can improve the diagnose accuracy.
Breast Neoplasms; Neoadjuvant Chemotherapy; Magnetic Resonance; Tumor Size; Pathology
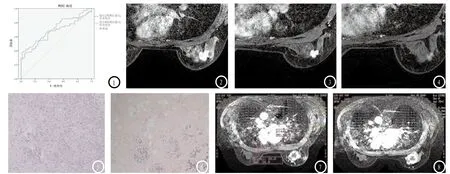
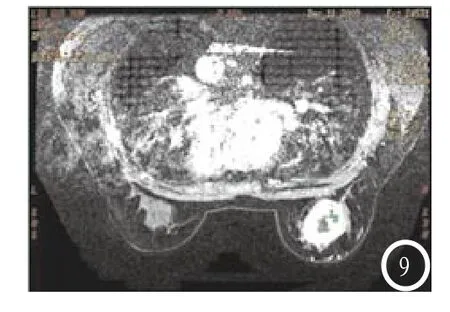
图1 NAC 2周期后、4周期后癌灶最大径变化率ROC分析。图2-6 女性,34岁,右乳浸润性导管癌,NAC后MR增强扫描高估残留病灶。图2-4 NAC前、NAC 2周期后、NAC 4周期后癌灶逐渐缩小,NAC 4周期后MR测量癌灶最大径1.1cm。图5(HE,×200)(右乳)肿物CNB:乳腺浸润性导管癌,非特殊型。图6 (HE,×200)右乳腺改良根治标本(4周期新辅助化疗后):乳腺组织显著纤维化,未见明确肿瘤残余与治疗前比较,肿瘤化疗后组织分级为病理完全缓解(G5,pCR)。图7-9 女性,54岁,右乳癌NAC后肿瘤增大。术后病理,右乳化生性癌,化疗后组织学分级为高度有效(G4),属MHR组。图7-9 NAC前、NAC 2周期后、NAC 4周期后癌灶逐渐增大,内部信号不均匀。
R737.9
A
国家科技支撑计划项目(项目号:2013BAI07B01);深圳市科技计划项目(项目号:JCYJ20150403091443928)
10.3969/j.issn.1009-3257.2017.03.010
2017-05-23
石 桥,男,影像医学与核医学专业,博士,副主任医师,研究方向:乳腺影像诊断
单慧明
