小鼠骨折及不同治疗方式模型的研究进展
2017-07-06夏永宁于铁成吉林大学第一医院白求恩医学部吉林长春300
赵 毅,夏永宁,,于铁成(吉林大学:第一医院,白求恩医学部,吉林 长春 300)
小鼠骨折及不同治疗方式模型的研究进展
赵 毅1,夏永宁1,2,于铁成1(吉林大学:1第一医院,2白求恩医学部,吉林 长春 130012)
最近,小鼠骨折模型越来越引起研究者的兴趣.这是因为,科研人员可利用转基因技术和胚胎干细胞技术,将小鼠的基因序列利用转基因技术进行重构,研究具体的基因在骨折愈合过程中所起的作用.在当前的小鼠骨折模型中,小鼠的股骨骨折模型是最常用的.在研究普通骨折的愈合时,通过新的三点弯曲的工具造成小鼠的股骨或胫骨骨折,然后再用髓内钉、锁钉或髓内加压螺钉固定骨折的股骨或胫骨.另外,在研究骨折延迟愈合和骨不连时,经常会将小鼠的股骨切断并切开,然后用别针技术、带锁髓内针、锁定钢板或外固定架固定.评估骨折愈合的方法有多种,从传统的放射学、组织学和生物力学发展到了MRI、显微CT、放射性核素显像和特殊分子和基因的检测层面上.小鼠的步态分析是另一种有效的研究方法.总的来说,当今的小鼠骨折模型与时俱进,为我们研究正常和病理性骨折愈合过程中的生理学、生物力学、组织学、分子生物学和遗传学等各方面变化提供一大批可信的、标准化的方案.
动物模型;小鼠骨折模型;骨骼修复;实验鼠;骨折稳定
0 引言
动物骨折模型一般用于骨折愈合过程的研究[1-7].过去,学者们偏爱大型的动物模型,如狗、兔子、山羊、绵羊等[2-3,5,8-9].利用大型动物的骨骼重建可以更逼真地模仿人类的骨骼重建过程,主要是因为二者都具有哈弗斯系统[10-12].相对于大型动物,小鼠的骨骼重塑是通过骨吸收完成的[13-14].尽管大型动物的骨骼可以被稳定的植入[2-3,8,11],但是其主要弊端是在骨骼愈合过程中需要较长时间的圈养,并且消耗大量的科研经费.
因此,较小体型的动物模型越来越被认同和广泛应用[13-16].在骨科应用领域,大批小鼠被作为具有实用价值的模型工具,而这些小鼠模型也完全可以应用于研究其他物种.
应用小鼠制作一个标准模型具有很大的挑战性.这个模型必须是可重复的标准骨折类型,位置以及骨折移位的程度,这其中还包括软组织的损伤;对于外科手术治疗中的复位和固定在不同的标本之间也必须是可重复的;对于骨折移位和软组织损伤的特征的重建,可以通过应用一种标准的可弯曲或其他可以替代的制作骨折的机械工具而达到重建目的.由于小鼠的骨骼尺寸过于细小,这就使得重建一系列相同的骨骼模型成为一个极具挑战性的任务,例如应用长骨(诸如股骨和胫骨)来研究包括固定和生物力学评估在内的骨折愈合过程[17-18].
1 简介
在小鼠的骨折模型中应用了各式各样的内植物[4,13-15,19-25].而不同的内植物和手术技术会使骨折在不同的生物力学环境中愈合,这会直接影响到骨骼的愈合过程和结果[10,13-15,19-22,26-34].
1.1 小鼠骨折模型的优点 相较于大型的动物模型,小鼠模型具有显著的优势.从基因角度来讲,实验室中饲养的小鼠基因是已知的[35-39].转基因鼠给我们研究骨折愈合过程中所表达的不同分子机制提供了可能[35-36].并且,尚有大量的商业化生产的小鼠单克隆抗体,为研究在整个愈合过程中机体所表达的具体生物分子提供了大量的标记机会和工具.研究者可以利用各种各样的抗体去定位在骨折重建过程中所表达的不同目的生物大分子[35].而同样类型的上述实验在应用于大型动物模型时并不能进行实施,这是由于大型动物缺乏标准的转基因群体以及很少有针对该种大型动物的商业化生产的标准单克隆抗体[35].相对大型动物,小鼠的饲养成本更低,这也是研究人员逐渐青睐小鼠模型的又一个原因.例如,一只体质量为20 g的小鼠明显要比50 kg的绵羊无论是在购买、饲养,抑或是在处置方面都要经济实惠.数量众多的小鼠可以同时饲养在一个狭小空间中,相比之下大型动物往往会被饲养在实验中心之外,然后每次实验操作时再将它们运送回实验中心.另外,拥有特定基因的小鼠由于繁殖周期短,研究人员可以在短时间内获得足够数量的实验体.
1.2 小鼠的选择 小鼠的年龄、性别及种群的不同都会影响骨折的生物愈合机制[40].例如,与DBA/2和C3H两个近亲繁殖种群的小鼠相比,C57BL/6小鼠种群的愈合速度会更快[40],说明该种群小鼠体内突变的基因明显有助于骨骼的重塑和愈合[41].另外,相比较而言,雌鼠的股骨和胫骨的骨髓所拥有的间叶干细胞相对更少[42].
小鼠的年龄也会影响骨折的愈合.高龄小鼠的成骨细胞会表现为成骨细胞对生长刺激物质反应的下降,从而软骨分化和成熟也会延迟,进而导致软骨内成骨的延迟.高龄还会使调节血管再生的因子表达减少,从而影响骨折愈合过程中血管的再生过程[43].高龄鼠的间叶干细胞同样显示相对年轻鼠较低的组织修复和重建率[44].因此,在研究骨折愈合过程时,需要考虑年龄这一与骨折愈合密切相关的因素.小鼠在6~8周龄时性成熟,同时骨垢闭合,由于它们的体型不再增长,研究人员经常会选择这个年龄段的小鼠进行骨折的研究.相对恒定的骨骼形态是研究骨折愈合的一个必需条件,因为骨骼体积的变化同样会影响骨骼的愈合过程;另外,这也避免了在每个实验体身上的外科固定物品的一致性.在研究中应用到的所有小鼠的体质量超过20 g是最理想的,因为这个体质量级别的小鼠的股骨直径会在2~2.5 mm之间.对于骨折固定的的动物研究而言,实验小鼠同时具备的年龄匹配和体质量匹配是非常重要的.
2 几种小鼠的骨折愈合模型
2.1 肋骨骨折模型 肋骨的骨折模型是研究骨折愈合的有力工具,因为它并不需要固定和生物力学的试验[45].在吸入麻醉状态下,研究人员可以暴露小鼠的右侧第八肋间,然后用剪刀沿肋骨长轴垂直切断该肋骨[45].这个模型已经成功应用在检测骨折愈合过程中的基因表达方面的研究[46-49].
2.2 胫骨骨折模型 闭合的胫骨骨折模型简单易行,是研究骨折髓内固定的一种好的方法[50](图1).在一项研究中,使用一种直径为0.2 mm的不锈钢钢针固定了用3点弯曲工具制造的骨折[51].当应用胫骨骨折模型时一定要考虑到腓骨.比如,由于腓骨的存在与否会直接影响到胫骨固定的整体稳定性与生理愈合的环境[52],所以研究人员在应用这种模型时需要注意把腓骨是否存在作为一个变量.这种胫骨骨折模型改良自大鼠的闭合股骨骨折模型[51].应用胫骨骨折模型可以进行生理机能性的测试,而且这个骨折模型也早已应用于检测骨折愈合中的基因表达过程[53-56].
胫骨骨折的技术优势在于它减少了手术的损伤,减轻了固定物的重量以及减少了经费应用.其劣势在于,应用一根钢针髓内固定缺乏纵向与轴向的固定,这就导致纵向与轴向的不稳,同时手术入路通过膝关节,这很可能会导致膝关节脱位和髓腔损坏.当应用小鼠的胫骨骨折模型时,植入物钢针的形状需要与小鼠胫骨长轴方向弯曲的髓腔相匹配,这样才能更好地固定.
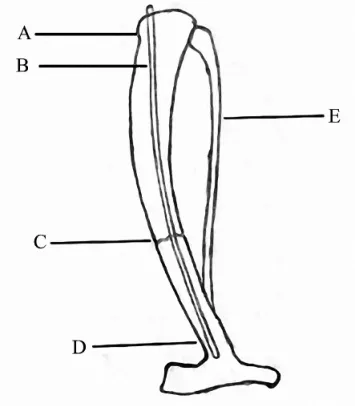
图1 胫骨骨折模型
2.3 小鼠的股骨骨折模型 小鼠的胫骨骨折模型在髓内固定通路更容易,但是胫骨弯曲的长轴使得生物力学分析变得更加复杂;胫骨周围仅有少量的软组织,会导致胫骨骨折不易愈合[20-22,57].另外,如果相邻的腓骨发生骨折,也会影响到胫骨骨折的愈合率,而在这个过程中,大鼠腓骨骨折的概率高达30%[57].与之相比,股骨是一种长管状的骨头,而且周围有大量的肌肉等软组织包裹,相对胫骨而言,股骨的直径自上而下大体一致且体积也足够大,这就使得股骨骨折模型可以应用于钉板等较大型的内固定或外固定装置.
2.3.1 髓内针 在小鼠的闭合股骨骨折中应用髓内针固定是以已经完全成熟的家兔/大鼠的股骨闭合骨折模型为基础的[51](图2).在用三点弯曲工具制作股骨骨折之前,研究人员会把一根直径约0.2 mm的不锈钢针事先插入股骨的髓腔内[51],目的是为了保持股骨的轴线稳定和防止大的移位.相较于它在胫骨上的应用,这种髓内针在股骨上的应用显示其不能抵抗轴向分离和旋转.这种固定方式有利于控制骨折点不移位,而且还会营造一种标准的骨折愈合环境.
这个模型可以帮助我们建立一种标准的骨折,而且这种髓内针可以在后续研究骨折愈合过程中的其他类型和作用的影响因素时取出.
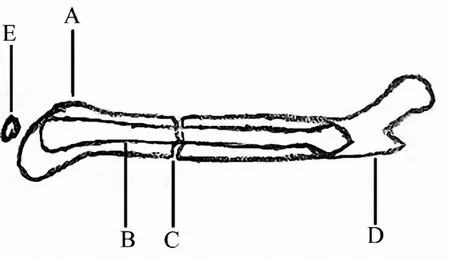
图2 股骨骨折模型(锁定髓内钉)
2.3.2 锁定髓内钉 在Holstein所描述的锁定髓内钉系统中(图2),以直径为0.1 mm的钨丝作为导针,将1 mL注射器的针头作为主钉植入髓腔[58].在手术过程中,首先将一根直径为0.1 mm直径的钨金属导丝经事先用0.5 mm环钻在股骨髁间切迹上打出的孔进入股骨骨髓腔.然后应用三点弯曲工具制作一个闭合的股骨干骨折,使用1 mL注射器的针头在该导丝的引导下固定股骨干[58].
导针移除后,主钉的末端与近端的钉头处呈水平,然后从近端向髁间方向加压.给主钉的近端和远端水平加压可以保证股骨骨折的抗旋稳定性.虽然这项技术在小鼠股骨骨折模型固定过程中的稳定性比单纯的髓内针固定的稳定性好,但是锁定钉系统也绝非是一种十分稳固的固定方式,它只应用于相对稳定的骨折模型.与简单髓内针系统具有相同优点的是,这项技术损伤小、术式简单、内植物重量小及成本低.主要的缺点是存在潜在的髓腔损伤的可能.
这个锁定髓内钉模型是现在临床中治疗管状骨骨折时经常用到的一种固定方式,具有微创及防旋等优点.这项技术适用于研究骨折的愈合过程.
2.3.3 交锁髓内钉 为了使小鼠的股骨骨折得到更加稳固的固定,Garcia使用微CT数据设计出了一种新型的髓内固定装置[31].这种装置可以借用一种特殊设计的瞄准装置用两枚直径为0.3 mm的锁钉将主钉的近端和远端牢牢地锁定住,同时,这个装置在临床中也应用到了治疗人类骨折领域[57](图3).这个系统包括一根直径为0.8 mm的髓内钉,同样需要一个开放稳定的骨折.在这个模型中,小鼠的股骨干骨折的固定会在一种切开固定的手术技术下进行.因为在这个手术中骨折端的间隙可以被手术者在直视下看到,因此这个模型被广泛应用于研究正常的骨折愈合过程、延迟的骨折愈合过程和骨不连的形成过程中.但是,这套装置的成本较高,而且切开复位内固定技术时切开软组织会造成对软组织的破坏,这往往都是研究人员不希望发生的损伤.这项技术的最大优势就是它能使骨折的复位达到较高的抗旋稳定性.而最大的缺点则是对组织进行的一系列侵入性操作,包括对髓腔的破坏性操作.
交锁髓内钉技术可以给骨折的固定带来高度的抗旋稳定性及轴向稳定作用,可以广泛应用于小鼠骨折愈合的研究过程中.
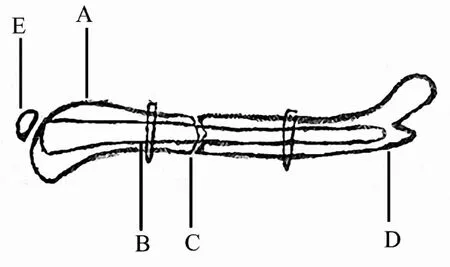
图3 股骨骨折模型(交锁髓内钉)
2.3.4 髓内加压螺钉 为了使小鼠股骨干骨折的闭合复位内固定后具有抗旋稳定性,研究人员可以使用一枚长为18 mm、直径为0.5 mm的髓内加压螺钉固定骨折,从而在不需要进行破坏性侵入性操作的前提下,就能建立一个闭合稳定的骨折固定[21,59](图4).同前所述,在制作一个股骨干骨折模型时首先需要在股骨踝部打孔,然后插入一根导丝,最后骨折模型制作成功后再用一枚具有螺纹的加压螺钉固定.这枚螺钉可以防止固定后的骨折断端旋转和轴向加压.这种螺钉的固定被认为是一种较为牢固的内固定方式.并且这种固定方式具有较低的组织损伤、简单的手术操作和较轻的内置物重量等优点.其缺陷为较高的内植物成本以及对骨髓腔潜在的破坏.这个模型比较适用于研究正常骨折愈合过程中的分子机制,但对于研究骨不连无任何作用.
在这个骨折模型的固定过程中,应用了一种牢固的固定技术.因此,这种固定方式可以用来研究术后锻炼时的影响因素,以及研究有效的术后康复疗法.
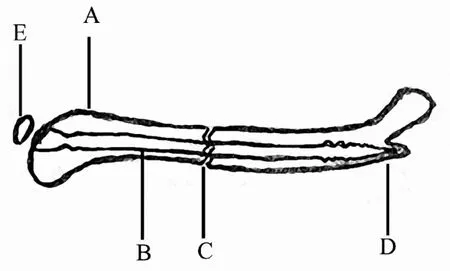
图4 股骨骨折模型(髓内加压螺钉)
2.3.5 “别针”装置 为了制作一个可靠的小鼠股骨骨折骨不连模型,用一枚髓内针制作而成的“别针”装置的应用可以同时兼顾轴向稳定与抗旋能力[60](图5).“别针”装置对小鼠股骨干骨折的固定过程需要手术暴露股骨干.这种方式可以制作不同大小间隙的骨折,适用于研究普通骨折的愈合过程、骨折延迟愈合的过程以及骨不连的形成过程.这个模型的优点包括高的轴向和抗旋稳定性、重量较轻的内植物以及较低的成本.最主要的缺点是需要开放性手术进行固定,并且还会对髓腔造成一定的损伤.
该装置能够提供轴向的稳定性,能够制作一种标准的骨病模型,从而为研究骨折的畸形愈合和不愈合提供工具.因此,该装置可以作为外固定技术的一种替代装置.
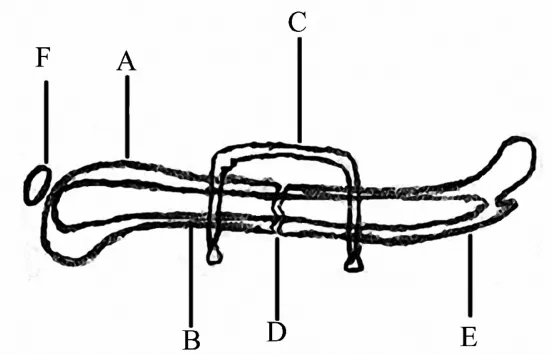
图5 股骨骨折模型(“别针”装置)
2.3.6 锁定钢板 虽然髓内钉等髓内固定系统已经成为现在小鼠的长管骨闭合骨折内固定模型的主流,但是锁定钢板和外固定架系统(髓外固定系统)将用于固定小鼠骨干和干骺端开放骨折模型的种髓外固定系统[20-22](图6).该系统致力于通过减少内置钢板与骨表面的接触面来减少骨膜的损伤.这块锁定钢板通过外科手术采用4枚锁定螺钉固定以达到稳定、坚固的骨折内固定.应用钢板固定骨折的方式适于研究普通骨折愈合过程、延迟愈合的骨折愈合过程和骨不连的形成过程,其中在研究骨不连的愈合过程中,钢板内固定的方式可以在不损伤髓腔及其内在的血管系统的情况下稳固的控制固定后的骨折间隙.
钢板锁定的方式使得在特定机制和标准条件下研究小鼠干骺端的骨折愈合过程成为可能.
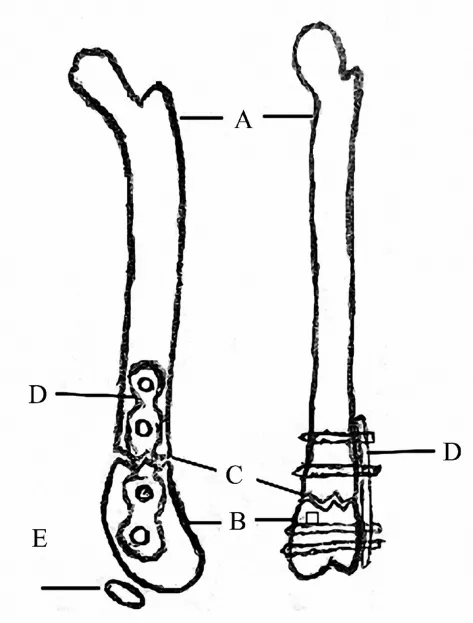
图6 股骨骨折模型(锁定钢板)
2.3.7 外固定装置 应用于小鼠骨折外固定的外固定架技术与临床应用于人本身的外固定架技术是相类似的(图7).这套外固定装置包括一块外在支撑物作为支撑及四根迷你的Schanz螺钉(AO Development Institute)[15,21],四根螺钉分别打入骨折近端和远端的骨质中,他们将外在的支撑物和碎裂的骨块连接在一起,有外在支撑物起支撑作用,螺钉作为传导支撑力的作用.这种外固定系统没有影响到骨折区域,但是由于应用到螺钉,这些打入骨质的螺钉会对周围的软组织造成损伤.当这种固定装置与具有完整骨质的股骨接触后,用手工去掰弯股骨使其骨折.外固定装置主要应用于研究正常的骨折愈合过程、骨折的延迟愈合过程和骨不连的形成过程,其中在研究骨不连的愈合过程中,外固定的方式可以坚固的控制固定后的骨折间隙[61].这种外固定装置最主要的缺点在于过于沉重的的固定装置、植入物过高的成本,以及由于过于笨重的外固定装置限制了实验动物的生理活动和步态,就会增加动物自我损伤的风险;另外,外固定装置可能还会导致后续的感染.这套外固定架对小鼠股骨骨折固定的模型就好似临床上用到的方式,而且同样的适用于开放性的股骨骨折.
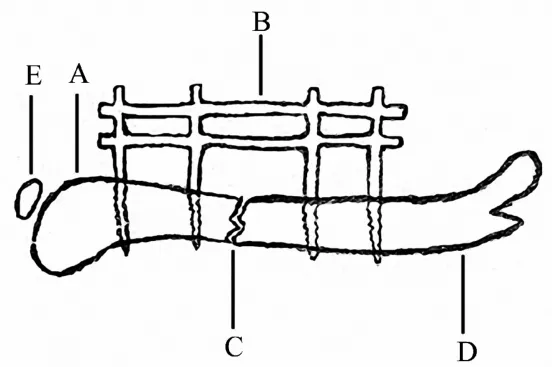
图7 股骨骨折模型(外固定装置)
2.4 利用三点弯曲工具制作小鼠的闭合骨折模型
三点弯曲重力驱动装置[21]是广泛应用于小鼠骨折模型制作领域的工具,最早由Bonnarens等[51]应用于制作兔子的胫骨骨折.简单的三点弯曲装置的设计易于研究人员制作、操作及掌握.然而,存在以下缺点:第一,由于小鼠股骨尺寸过小,所以该装置在股骨上固定的点不容易定位;第二,该装置的复位弹簧可能在频繁应用过程中产生金属疲劳,因此可能导致在整个实验过程中非一致的骨折模型;第三,转基因小鼠的骨骼相对较小,用该种工具制作一致性骨折极具挑战[22].
最新一代的重力驱动骨折装置通过提供改善的股骨位点、持续的碰撞速度及可调节的动能输入来解决上述问题[62].这一装置更适应小鼠大腿的解剖结构,新的复位弹簧提供更加持续的冲击速度和优化的设备性能.能够调节动能输入使得通过调节冲击时的质量和速度制作重复的横行骨折成为可能.正是由于以上进步,在制作一个闭合的骨折模型时小鼠的体质量反而成为了一个可有可无的决定因素,这也成为了这个模型的一项附加优势.
2.5 骨折愈合模型中的麻醉 小鼠的腹腔内注射麻醉是最早应用于手术过程中的麻醉方法,主要在研究小鼠的胫骨或腓骨骨折时应用,但是不能应用于肋骨骨折的研究过程[22].由于研究人员需要在实验过程中对实验动物进行操控,而且在整个制作和修复骨折的过程中需要实验小鼠不同的体位,所以整个过程需要在腹腔内注射麻醉下进行.吸入性麻醉最常应用于小鼠肋骨骨折模型的研究中,需要使用适用于小鼠的锥形面罩.最常用到的注射类麻醉药为甲苯噻嗪(2 mg/kg)和氯苯甲氨环己酮(氯胺酮 75 mg/kg),优点为成本低、易于管理及对研究者无健康损伤[19-22,57].
3 骨折愈合过程的评估
3.1 影像分析 在大多数的案例中,研究小鼠骨折愈合过程的影像学变化时,所用的小鼠标本必须在制作成骨折模型后的各个研究时间点上分别被处以安乐死[19].高分辨率成像和二维或三维X线断层扫描技术(微CT)通常会被用来评估小鼠骨折的愈合进程[22].传统的X⁃线摄片技术大致能够区分骨折后形成的骨的大小尺寸及影像学密度[57].而微CT扫描则可以反映出骨痂的具体信息,诸如骨痂组织的矿质密度、总的骨痂容量以及骨痂占骨折骨的体积分数[57].
非侵入性的实时成像技术在过去的几年间被引进用来评估活生物体内骨修复进程中的基因表达、蛋白质降解、细胞移位以及细胞死亡.新技术诸如生物荧光技术、近红外光成像技术及核磁共振技术在研究中都崭露头角[19-22,57].尽管微CT技术可以应用于体内,但是体外微CT则拥有更高的影像分辨率[66].成像还能够可视和定量地评估出愈合组织内的血管系统.此外,与造影剂联合应用的体外3D微CT成像能够单独使愈合组织内的脉管系统成像.
3.2 骨折愈合过程中的组织形态学分析 组织形态学技术应用于骨折愈合、组织愈合进程的评估和分析中,这项技术已经足够区分组织内的成骨细胞、破骨细胞以及这些细胞的合成代谢和分解代谢率[57].
总之,在这些骨折愈合进程中的标本被从实验动物体上切除及移除内植物后,一般都会遵循ASBMR的指导纲领对其进行固定、染色和分析对比度[67].在给出骨痂的三维结构之后,可将骨痂的大小和组织构成进行重复计算,这对定义一项具有代表性、标准化的参数十分重要[19-22,57].包括:①骨折间隙的骨痂大小与骨的直径比值;②骨痂的大小与全部愈合组织大小的比值;③软骨性骨痂面积与全部愈合组织大小的比值;④修复区域大小与全部愈合组织大小的比值.
3.3 生物力学分析 无损伤性的三点弯曲、损伤性的4点弯曲,以及扭曲、轴向测试等概念早已经被应用于研究小鼠的胫骨和股骨骨折修复的生物力学特性中[22].作为对比,由于肋骨的生理解剖结构不规则,所以肋骨骨折模型并不适用于进行生物力学研究.一项没有损伤性的三点弯曲测试可以测量小鼠股骨骨折模型在不同固定方式下愈合组织的刚度[20].在这项没有损伤的测试中,荷载⁃位移曲线线性曲度>1%,增加负重就会停止.无损加载协议的构造会在宏观和组织学上表现出来[20].损伤性四点弯曲测试已经被用来进行小鼠的胫骨和股骨骨折模型极限抗弯刚度(N/mm)和弯曲荷载(N/mm)的测量[68].极限弯曲载荷被定义为失败的最大荷载,在荷载⁃变形曲线中被确定.扭曲与轴向测试已经被应用于研究小鼠股骨骨折模型的髓内固定,主要用来决定固定是否有效[22,58].
总之,小鼠骨的尺寸过小,给生物力学测试带来了很大的挑战,所以需要更加精密的测量仪器.骨愈合过程中的任何生物力学分析结果的研究被表示为作为健侧骨结果的百分比考虑动物的个体差异.
3.4 免疫组织化学研究 除了进行形态学研究,研究人员可以应用免疫组织化学分析技术对骨折时细胞内的不同蛋白质进行原位空间检测,诸如细胞因子和细胞标记物等[50,68-69].免疫组织化学技术的评估结果能够被Western blotting(蛋白印迹法)及酶联免疫吸附试验技术等蛋白半定量分析方法所支持[70].而原位杂交技术为我们了解不同类型细胞中相应信使RNA的表达提供了进一步信息[68].另外,原位信使RNA表达的评估可以被半定量的技术诸如Northern blotting(North⁃ern印迹杂交)和RT⁃PCR(逆转录聚合酶链式反应)所支持[68].而且,骨折愈合组中的细胞可以被作为培养细胞,从而进行后续的细胞学领域的研究.
3.5 步态的活跃度分析 步态分析是一项十分有用的技术,它可以帮助研究人员评估术后动物的运动模式[71-72].步态分析已经被引进用来研究利用髓内针固定的小鼠股骨骨折模型中,去测试在骨折和固定后小鼠活动模式的改变[74].动态的步态分析通过胫股角数字成像技术为研究提供持续的数据.在本项技术的研究中,胫股角的范围和最大值是关键参数[72].骨折的固定会导致胫股角活动范围和峰值改变.通过对小鼠的步态分析,可以比较不同骨折固定技术对小鼠胫股角的活动范围和峰值的影响.
4 结论
在研究骨折愈合的细胞和细胞分子机制时有大量不同的骨折模型可以应用.而针对开放或闭合的骨折模型,研究人员可以在应用或不应用各种不同的固定方式的情况下去研究骨折的正常愈合过程、骨折延迟愈合的过程以及骨不连的形成过程.所有的对比分析必须在最大化减小或消除变量的基础条件下进行,比如实验中所应用到的小鼠必须在年龄、重量、性别、种系上一致.为了成功的制作一个小鼠的闭合股骨骨折模型,使用新型的三点弯曲装置可以制作可重复的股骨横行骨折模型[73-74].这样,小鼠的瘦小骨骼并不是一项影响动物实验的重要因素.时下流行的小鼠股骨骨折模型为研究人员在分子生物和基因层面研究正常骨折愈合过程、骨折延迟愈合过程以及骨不连的形成过程提供了标准模型.
[1]Ibrahim N,Mohamad S,Mohamed N,et al.Experimental fracture protocols in assessments of potential agents for osteoporotic fracture healing using rodent models[J].Curr Drug Targets,2013,14(14):1642-1650.
[2]Reifenrath J,Angrisani N,Lalk M,et al.Replacement,refinement,and reduction:necessity of standardization and computational models for long bone fracture repair in animals[J].J Biomed Mater Res A,2014,102(8):2884-2900.
[3]Sabalic S,Kodvanj J,Pavic A.Comparative study of three models of extra⁃articular distal humerusfracture osteosynthesis using the finite element method on an osteoporoticcomputational model[J].Injury,2013,44(Suppl 3):S56-S61.
[4]Mullis BH,Copland ST,Weinhold PS,et al.Effect of COX⁃2 in⁃hibitors and non⁃steroidal anti⁃inflammatory drugs on a mouse frac⁃ture model[J].Injury,2006,37(9):827-837.
[5]Kanthan SR,Kavitha G,Addi S,et al.Platelet⁃rich plasma(PRP)enhances bone healing innon⁃united critical⁃sized defects:a prelimi⁃nary study involving rabbit models[J].Injury,2011,42(8):782-789.
[6]de Vries RB,Buma P,Leenaars M,et al.Reducing the number of laboratory animals used in tissue engineering research by restricting the variety of animal models.Articular cartilage tissue engineering as a case study[J].Tissue Eng Part B Rev,2012,18(6):427-435.
[7]Dedania J,Borzio R,Paglia D,et al.Role of local insulin augmen⁃tation upon allograft incorporation in a rat femoral defect model[J].J Orthop Res,2011,29(1):92-99.
[8]Bullens PH,Hannink G,Verdonschot N,et al.No effect of dynamic loading on bone graft healing in femoral segmental defect reconstruc⁃tions in the goat[J].Injury,2010,41(12):1284-1291.
[9]Bullens PH,Schreuder HW,de Waal Malefijt M,et al.The pres⁃ence of periosteum is essential for the healing of large diaphyseal seg⁃ mental bone defects reconstructed with trabecular metal:a study in the femur of goats[J].J Biomed Mater Res B Appl Biomater,2010,92(1):24-31.
[10]刘建波,樊 磊,郑建英,等.钉棒系统内固定治疗胸腰椎不稳定骨折伴不全瘫的疗效分析[J].转化医学电子杂志,2015,2(4):26-27.
[11]Walschot LH,Aquarius R,Schreurs BW,et al.Osteoconduction of impacted porous titanium particles with a calcium⁃phosphate coating is comparable to osteoconduction of impacted allograft bone particles:in vivo study in a nonloaded goat model[J].J Biomed Mater Res B Appl Biomater,2012,100(6):1483-1489.
[12]Timperley AJ,Nusem I,Wilson K,et al.A modified cementing technique using BoneSource to augment fixation of the acetabulum in a sheep model[J].Acta Orthop,2010,81(4):503-507.
[13]唐开武,唐开礼.动力髋螺钉治疗老年骨质疏松性股骨粗隆间骨折的临床疗效探讨[J].转化医学电子杂志,2014,1(4):115-116.
[14]Holstein JH,Matthys R,Histing T,et al.Development of a stable closed femoral fracture model in mice[J].J Surg Res,2009,153(1):71-75.
[15]Cheung KM,Kaluarachi K,Andrew G,et al.An externally fixed fem⁃oral fracture model for mice[J].J Orthop Res,2003,21(4):685-690.
[16]Blokhuis TJ,Buma P,Verdonschot N,et al.BMP⁃7 stimulates early diaphyseal fracture healing in estrogen deficient rats[J].J Orthop Res,2012,30(5):720-725.
[17]Guo TZ,Wei T,Shi X,et al.Neuropeptide deficient mice have at⁃tenuated nociceptive,vascular,and inflammatory changes in a tibia fracture model of complex regional pain syndrome[J].Mol Pain,2012,8:85.
[18]Zhao X,Wang JX,Feng YF,et al.Systemic treatment with telmisar⁃tan improves femurfracture healing in mice[J].PLoS One,2014,9(3):e92085.
[19]Garcia P,Holstein JH,Maier S,et al.Development of a reliable non⁃union model in mice[J].J Surg Res,2008,147(1):84-91.
[20]Histing T,Garcia P,Matthys R,et al.An internal locking plate to study intramembranous bone healing in a mouse femur fracture model[J].J Orthop Res,2010,28(3):397-402.
[21]刘 建,李 强,王金山.螺钉联合后路抗滑钢板固定治疗股骨髁冠状面骨折的临床效果研究[J].转化医学电子杂志,2015,2(3):131-133.
[22]Histing T,Klein M,Stieger A,et al.A new model to analyze metaph⁃yseal bone healing in mice[J].J Surg Res,2012,178(2):715-721.
[23]McCormick JJ,Li X,Weiss DR,et al.Biomechanical investigation of a novel ratcheting arthrodesis nail[J].J Orthop Surg Res,2010,5:74.
[24]Walschot LH,Aquarius R,Verdonschot N,et al.Porous titanium particles for acetabular reconstruction in total hip replacement show extensive bony armoring after 15 weeks.A loaded in vivo study in 10 goats[J].Acta Orthop,2014,85(6):600-608.
[25]Pai S,Gunja NJ,Dupak EL,et al.A mechanical study of rigid plate configurations for sternal fixation[J].Ann Biomed Eng,2007,35(5):808-816.
[26]Thormann U,El Khawassna T,Ray S,et al.Differences of bone healing in metaphyseal defect fractures between osteoporotic and physiological bone in rats[J].Injury,2014,45(3):487-493.
[27]Zimmermann G,Schmeckenbecher KH,Boeuf S,et al.Differential gene expression analysis in fracture callus of patients with regular and failed bone healing[J].Injury,2012,43(3):347-356.
[28]Jungbluth P,Hakimi AR,Grassmann JP,et al.The early phase in⁃fluence of bone marrow concentrate on metaphyseal bone healing[J].Injury,2013,44(10):1285-1294.
[29]Garnavos C,Mouzopoulos G,Morakis E.Fixed intramedullary nail⁃ing and percutaneous autologous concentrated bone⁃marrow grafting can promote bone healing in humeral⁃shaft fractures with delayed u⁃nion[J].Injury,2010,41(6):563-567.
[30]Roderer G,Gebhard F,Duerselen L,et al.Delayed bone healing following high tibial osteotomy related to increased implant stiffness in locked plating[J].Injury,2014,45(10):1648-1652.
[31]Holstein JH,Becker SC,Fiedler M,et al.Intravital microscopic studies of angiogenesis during bone defect healing in mice calvaria[J].Injury,2011,42(8):765-771.
[32]Sun D,Junger WG,Yuan C,et al.Shockwaves induce osteogenic differ⁃entiation of human mesenchymal stem cells through ATP release and activation of P2X7 receptors[J].Stem Cells,2013,31(6):1170-1180.
[33]Yu T,Junger WG,Yuan C,et al.Shockwaves increase T⁃cell prolif⁃eration and IL⁃2 expression through ATP release,P2X7 receptors,and FAK activation[J].Am J Physiol Cell Physiol,2010,298(3):C457-464.
[34]Yu TC,Liu Y,Tan Y,et al.Shock waves increase T⁃cell prolifera⁃tion or IL⁃2 expression by activating p38 MAP kinase[J].Acta Bio⁃chimBiophys Sin(Shanghai),2004,36(11):741-748.
[35]Barthelmes D,Zhu L,Shen W,et al.Differential gene expression in Lin⁃/VEGF⁃R2+bone marrow⁃derived endothelial progenitor cells isolated from diabetic mice[J].Cardiovasc Diabetol,2014,13:42.
[36]Liu Y,Cao L,Ray S,et al.Osteoporosis influences osteogenic but not angiogenic response during bone defect healing in a rat model[J].Injury,2013,44(7):923-929.
[37]Jin W,Kong J,Wang H,et al.Protective effect of tert⁃butylhydro⁃quinone on cerebral inflammatory response following traumatic brain injury in mice[J].Injury,2011,42(7):714-718.
[38]Zhang X,Huang H,Yang T,et al.Chlorogenic acid protects mice againstlipopolysaccharide⁃induced acute lung injury[J].Injury,2010,41(7):746-752.
[39]Park AG,Paglia DN,Al⁃Zube L,et al.Local insulin therapy affects fracture healing in a ratmodel[J].J Orthop Res,2013,31(5):776-782.
[40]Manigrasso MB,O’Connor JP.Comparison of fracture healing among different inbred mouse strains[J].Calcif Tissue Int,2008,82(6):465-474.
[41]McCann RM,Colleary G,Geddis C,et al.Effect of osteoporosis on bone mineral density and fracture repair in a rat femoral fracture model[J].J Orthop Res,2008,26(3):384-393.
[42]Kasper G,Mao L,Geissler S,et al.Insights into mesenchymal stem cell aging:involvement of antioxidant defense and actin cytoskeleton[J].Stem Cells,2009,27(6):1288-1297.
[43]Mehta M,Strube P,Peters A,et al.Influences of age and mechani⁃cal stability on volume,microstructure,and mineralization of the fracture callus during bone healing:is osteoclast activity the key to age⁃related impaired healing[J].Bone,2010,47(2):219-228.
[44]Meyer RA Jr,Tsahakis PJ,Martin DF,et al.Age and ovariectomy impair both the normalization of mechanical properties and the accre⁃tion of mineral by the fracture callus in rats[J].J Orthop Res,2001,19(3):428-435.
[45]Nakase T,Nomura S,Yoshikawa H,et al.Transient and localized expression of bone morphogenetic protein 4 messenger RNA during fracture healing[J].J Bone Miner Res,1994,9(5):651-659.
[46]Murata K,Kitaori T,Oishi S,et al.Stromal cell⁃derived factor 1 regulates the actin organization of chondrocytes and chondrocyte hy⁃pertrophy[J].PLoS One,2012,7(5):e37163.
[47]Reumann MK,Nair T,Strachna O,et al.Production of VEGF re⁃ceptor 1 and 2 mRNA and protein during endochondral bone repair is differential and healing phase specific[J].J Appl Physiol(1985),2010,109(6):1930-1938.
[48]St⁃Arnaud R.CYP24A1⁃deficient mice as a tool to uncover a biologi⁃cal activity for vitamin D metabolites hydroxylated at position 24[J].J Steroid Biochem Mol Biol,2010,121(1-2):254-256.
[49]Ito T,Tokunaga K,Maruyama H,et al.Coxsa⁃ckievirus and adeno⁃virus receptor(CAR)⁃positive immature osteoblasts as targets of ade⁃novirus⁃mediated gene transfer for fracture healing[J].Gene Ther,2003,10(18):1623-1628.
[50]Hiltunen A,Vuorio E,Aro HT.A standardized experimental fracture in the mouse tibia[J].J Orthop Res,1993,11(2):305-312.
[51]Bonnarens F,Einhorn TA.Production of a standard closed fracture in laboratory animal bone[J].J Orthop Res,1984,2(1):97-101.
[52]Shefelbine SJ,Augat P,Claes L,et al.Intact fibula improves frac⁃ture healing in a rat tibia osteotomy model[J].J Orthop Res,2005,23(2):489-493.
[53]Obermeyer TS,Yonick D,Lauing K,et al.Mesenchymal stem cells facilitate fracture repair in an alcohol⁃induced impaired healing model[J].J Orthop Trauma,2012,26(12):712-718.
[54]Alford AI,Reddy AB,Goldstein SA,et al.Two molecular weight species of thrombospondin⁃2 are present in bone and differentially modulated in fractured and nonfractured tibiae in a murine model of bone healing[J].Calcif Tissue Int,2012,90(5):420-428.
[55]Nam D,Mau E,Wang Y,et al.T⁃lym⁃phocytes enable osteoblast maturation via IL⁃17F during the early phase of fracture repair[J].PLoS One,2012,7(6):e40044.
[56]Lauing KL,Roper PM,Nauer RK,et al.Acute alcohol exposure im⁃pairs fracture healing and deregulates beta⁃catenin signaling in the fracture callus[J].Alcohol Clin Exp Res,2012,36(12):2095-2103.
[57]Garcia P,Herwerth S,Matthys R,et al.The LockingMouseNail--a new implant for standardized stable osteosynthesis in mice[J].J Surg Res,2011,169(2):220-226.
[58]Holstein JH,Menger MD,Culemann U,et al.Development of a loc⁃king femur nail for mice[J].J Biomech,2007,40(1):215-219.
[59]Holstein JH,Becker SC,Fiedler M,et al.Increased exercise after sta⁃ble closed fracture fixation does not affect fracture healing in mice[J].J Biomech,2012,45(7):1299-1304.
[60]Garcia P,Holstein JH,Histing T,et al.A new technique for inter⁃nal fixation of femoral fractures in mice:impact of stability on frac⁃ture healing[J].J Biomech,2008,41(8):1689-1696.
[61]张 成,张 雁.外固定架与钢板内固定治疗桡骨远端不稳定性骨折对比[J].转化医学电子杂志,2015,2(2):97-98.
[62]Marturano JE,Cleveland BC,Byrne MA,et al.An improved murine femur fracture device for bone healing studies[J].J Biomech,2008,41(6):1222-1228.
[63]Mayer⁃Kuckuk P,Boskey AL.Molecular imaging promotes progress in orthopedic research[J].Bone,2006,39(5):965-977.
[64]Nakanishi T,Kokubun K,Oda H,et al.Bioluminescence imaging of bone formation using hairless osteocalcin⁃luciferase transgenic mice[J].Bone,2012,51(3):369-375.
[65]Zachos TA,Bertone AL,Wassenaar PA,et al.Rodent models for the study of articular fracture healing[J].J Invest Surg,2007,20(2):87-95.
[66]Duvall CL,Taylor WR,Weiss D,et al.Impaired angiogenesis,early callus formation,and latestage remodeling in fracture healing of os⁃teopontin⁃deficient mice[J].J Bone Miner Res,2007,22(2):286-297.
[67]Parfitt AM.Bone histomorphometry:proposed system for standardiza⁃tion of nomenclature,symbols,and units[J].Calcif Tissue Int,1988,42(5):284-286.
[68] Lin HN,O'Connor JP.Immunohistochemical localization of key arachidonic acid metaolism enzymes during fracture healing in mice[J].PLoS One,2014,9(2):e88423.
[69]Yamagiwa H,Tokunaga K,Hayami T,et al.Expression of metallo⁃proteinase⁃13(Collagenase⁃3)is induced during fracture healing in mice[J].Bone,1999,25(2):197-203.
[70]Holstein JH,Karabin⁃Kehl B,Scheuer C,et al.Endostatin inhibits Callus remodeling duringfracture healing in mice[J].J Orthop Res,2013,31(10):1579-1584.
[71]Becker A,Palissa A,Grimm M.Gait analysis⁃⁃an useful method for quantitatively measuring ataxia in mice[J].Z Versuchstierkd,1988,31(2):89-94.
[72]Histing T,Kristen A,Roth C,et al.In vivo gait analysis in a mouse femur fracture model[J].J Biomech,2010,43(16):3240-3243.
[73]高宏广,黄 鸿,赵肖川.AO锁骨钩钢板在锁骨远端骨折及肩锁关节脱位治疗中的应用效果[J].转化医学电子杂志,2014,1(4):53-54.
[74]未东兴.肱骨近端锁定接骨板在肱骨近端骨折临床疗效[J].转化医学电子杂志,2014,1(4):49-50.
Research progresson bonefractureand different treatments in mouse models
ZHAO Yi1,XIA Yong⁃Ning1,2,YU Tie⁃Cheng11Department of Orthopedics,First Hospital,2Norman Bethune Health Science Center,Jilin Univeisity,Changchun 130021,China
Recently,mouse fracture models have increasingly attracted interests among researchers,for mouse genes can be inactivated,mutated or specifically expressed using transgenic and embryonic stem cell technology,which provides opportunities to observe the effect of an individual gene in the fracture healing process.Among current mouse fracture models,the mouse femur fracture models were mostly selected.To investigate the mecha⁃nism of normal fracture healing,the mouse femur or tibia is frac⁃tured using the new 3⁃point bending device(closed models)and is fixed with intramedullary pin,locking nail or intramedullary compression screw.In contrast,to investigate the mechanism of delayed healing and non⁃union formation,the mouse femur is osteotomized using an open surgical approach(open models)and is fixed with pin⁃clip device,interlocking nail,locking plate or external fixator.To evaluate the process of fracture healing,a lot of analytical methods are selectable,ranging from traditional meth⁃ods such as radiological,histological and biomechanical analyses to MRI,microscopic CT,radionuclide imaging,and detection of specific molecules and genes.Gait analysis is another useful study method.In summary,current mouse femur fracture models provide standardized methods for us to analyze physiology,biomechanics,histology,molecular biology,and genetics aspects of normal frac⁃ture healing,delayed healing or non-union formation.The opin⁃ions given in this review might help researchers to perform in vivo bone healing experiments.
animal model;mouse fracture model;bone repair;mice;fracture stabilization
2095⁃6894(2017)06⁃83⁃07
R247.1
A
2017-04-29;接受日期:2017-05-13
国家自然科学基金(81172183,31470932)
赵 毅.副教授.E⁃mail:tiechengyu@163.com
于铁成.博士,教授,主任医师.E⁃mail:tiechengyu@163.com
